 , 梁钰贞, 卢桂宁, 石振清
, 梁钰贞, 卢桂宁, 石振清

华南理工大学环境与能源学院, 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
收稿日期: 2020-04-28; 修回日期: 2020-05-16; 录用日期: 2020-05-16
基金项目: 中央高校基础科学研究基金(No.2018PY10)
作者简介: 卢阳(1990-), 男, 博士研究生, E-mail:superloo@163.com
通讯作者(责任作者): 石振清, E-mail:zqshi@scut.edu.cn
摘要:在受重金属污染的土壤中,天然有机质(NOM)和重金属通常会同时参与铁氧化物的转化.但关于这一重要的环境反应过程中重金属释放动力学的研究目前还比较少.为阐明NOM对铁氧化物转化过程中Cu释放行为的影响,本研究使用两种代表性NOM:富里酸(FA)和胡敏酸(HA),开展了二者存在下的"铁氧化物-重金属-NOM"转化研究,并对转化不同时间点的铁氧化物进行了Cu释放动力学实验.动力学实验中采用了一个流动搅拌装置模拟pH=5.5环境条件下Cu的释放过程.结果表明,Cu的释放量随着铁氧化物的转化而降低,NOM的存在增加了Cu在流动搅拌实验中的释放量.球差校正扫描透射电子显微镜(Cs-STEM)结果显示,铜可以掺入铁氧化物纳米颗粒中,可以有效固定Cu,而FA和HA处理均产生了具有疏松结构的椭球形颗粒,为Cu的吸附提供了丰富的位点.这种疏松的结构导致了更多吸附态Cu的存在,阻碍了铜的掺入,与Cu释放结果一致.因此,Cu释放能力的差异性主要是铁氧化物老化的结果,与Cu和NOM的络合关系不大.这项研究的结果将有助于更好地理解在NOM存在下铁氧化物转化过程中Cu的环境行为,同时在纳米尺度上阐明Cu和C与赤铁矿相互作用的机理.
关键词:铁氧化物转化水铁矿赤铁矿铜天然有机质扫描透射电镜
Copper release kinetics during the iron oxide transformation in the presence of fulvic acid and humic acid
LU Yang
 , LIANG Yuzhen, LU Guining, SHI Zhenqing
, LIANG Yuzhen, LU Guining, SHI Zhenqing

The Key Lab of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, School of Environment and Energy, South China University of Technology, Guangzhou 510006
Received 28 April 2020; received in revised from 16 May 2020; accepted 16 May 2020
Abstract: Natural organic matter (NOM) and heavy metals (HMs) can both participate in the iron oxide transformation process in HM contaminated soils. However, there is still a lack of knowledge concerning the HM release kinetics during the iron oxide transformation especially under the influence of NOM. In this study, iron oxide transformation was conducted in the presence of Cu and two types of representative NOM, fulvic acid and humic acid (FA and HA). Release kinetic experiments were conducted for the iron oxides at various aging times to elucidate the influence of NOM on the Cu release during the iron oxide transformation process. A stirred-flow (SF) system and a pH of 5.5 were set to imitate the natural dynamic solid-liquid reaction process. Results showed that the leachability of Cu decreased during the iron oxide transformation, while NOM increased Cu leachability compared with the non-NOM treatment. The spherical aberration corrected scanning transmission electron microscopy (Cs-STEM) showed that Cu could be incorporated into the iron oxide nano particles to sequester Cu in iron oxides, while both FA and HA resulted in the ellipsoidal particles with a loose structure, which provided abundant sites for Cu adsorption. Overall, the different leachability of Cu was mainly due to the aging of Fe oxides, not to the aging of Cu-NOM complexes. Results in this study would help to get a better understanding of the environmental behaviors of Cu during the iron oxide transformation process in the presence of NOM, and also, shed lights on the nano scale mechanism of Cu and C interaction with iron oxides.
Keywords: iron oxide transformationferrihydritehematiteCunatural organic matterSTEM
1 引言(Introduction)近年来, 工矿业的发展导致一些地区的土壤产生了严重的Cu污染问题(Shi et al., 2013; 张金莲等, 2015; 程龙等, 2018; 陈洁宜等, 2019).Cu对大多数生物而言是必不可少的微量元素, 因为它对执行基本生物学功能的各种蛋白质和酶的活性至关重要(Rubino et al., 2012).但铜浓度过高对大多数细菌和植物都是有害的(Fulda et al., 2013; 李锦芬等, 2018), 游离的铜离子可以催化形成活性氧, 从而导致氧化性细胞损伤(Gaetke et al., 2003).因此, 正确评估Cu在土壤环境中的行为对于农业生产和人体健康具有重要意义.铁(Fe)氧化物和天然有机质(Natural Organic Matter, NOM)具有丰富的表面络合点位及较高的比表面积, 容易富集自然环境中的重金属离子(Lalonde et al., 2012; Xiong et al., 2018).在自然条件下, 铁元素的循环一般遵循如下过程:沉积物或者土壤厌氧层的铁氧化物溶解出Fe(Ⅱ), 然后Fe(Ⅱ)到达好氧层被氧化成Fe(Ⅲ), 之后Fe(Ⅲ)再形成弱结晶的水铁矿.研究表明, 水铁矿一般在土壤、水体沉积物中广泛存在, 并且, 水铁矿会朝着其他铁氧化物转化, 是环境中众多晶型较好的铁氧化物的前体矿物(王小明等, 2011).在自然条件下的水铁矿形成和转化过程中, 通常还伴随着NOM及重金属离子的引入, 因此, 该过程会对NOM、重金属的行为产生影响.反之, NOM及重金属也会影响铁氧化物的转化, 从而影响铁元素的地球化学循环(Riedel et al., 2013).
国内外研究人员发现, 虽然NOM中有很多官能团, 但铜元素更倾向于和羧基等官能团形成稳定的双齿内圈络合物(Strawn et al., 2008; 易层等, 2018; 徐晋玲, 2019).Cu与NOM的成键方式是不规则的八面体配位结构, 就平均值而言, Cu周围原子的第一壳层为6个O原子, 第二壳层为4个C原子(Xia et al., 1997).同时, NOM的大分子特质使得Cu在NOM吸附体系中不容易沉淀(Manceau et al, 2010), 增加了Cu在环境中的移动性.水铁矿和Cu的吸附作用可以在几分钟内完成(Scheinost et al., 2001), Cu也可以与铁氧化物形成共边型内圈络合物(Scheinost et al., 2001; Moon et al., 2012; 邓迎璇等, 2018).水铁矿和Cu的共沉淀中Cu的释放能力介于Cu自身沉淀与水铁矿吸附Cu之间(Martinez et al., 1998).相对于以上这些二元体系(“铁氧化物-Cu”或“NOM-Cu”), Cu在三元体系(“铁氧化物-Cu-NOM”)上的吸附量多于二元体系中Cu的吸附量(Saito et al., 2005).总之, 先前的研究多为Cu在二元体系的研究或者非铁氧化物转化过程的三元体系研究.涉及“铁氧化物-Cu-NOM”三者的动态耦合作用过程中Cu的释放动力学行为的研究, 特别是在不同类型的NOM影响下Cu在铁氧化物转化过程中的释放动力学过程及其微观机理的研究目前还不多.
基于此, 本研究采用两种有代表性的土壤有机质:富里酸(Fulvic Acid, FA)和胡敏酸(Humic Acid, HA), 开展在FA和HA的影响下铁氧化物转化过程中Cu释放动力学实验.实验主要采用一个流动搅拌(Stirred-Flow, SF)装置来阐释Cu在铁氧化物不同转化时间点的释放动力学过程.同时, 通过球差校正扫描透射电子显微镜(Spherical Aberration Corrected Transmission Electron Microscopy, Cs-STEM)研究“铁氧化物-Cu-NOM(FA/HA)”相互作用的微观机理.本研究旨在:①阐释不同NOM对Cu在铁氧化物转化过程中行为的影响;②揭示不同NOM对Cu的解吸附动力学产生差异的纳米级别微观机理.以期增进人们对“铁氧化物-Cu-NOM(FA/HA)”之间相互作用的机制层面的理解, 并为实际环境条件下修复和治理重金属污染提供理论支撑.
2 材料与方法(Materials and methods)2.1 实验材料实验过程首先制备0.1 mol · L-1 Fe(NO3)3和Cu(NO3)2的金属储备溶液, 两种试剂均为分析纯, 购自Alfa Aesar公司, 溶剂为去离子水(DIW, 电导率≥18 MΩ · cm-1).然后制备HA与FA的储备溶液, 二者浓度均为5 g · L-1, 其中, HA的溶剂为0.1 mol · L-1 NaOH溶液, FA的溶剂为DIW.实验所用HA购自Sigma-Aldrich公司(CAS:1415-93-6), 并按照前人的方法进行纯化(Vermeer et al., 1998).FA购自国际腐殖质学会(International Humic Substances Society, IHSS, Pahokee Peat, #2S103F).随后将FA与HA的储备溶液置于冰箱(4 ℃)避光保存, 一周内使用.
2.2 富里酸和胡敏酸影响下的铁氧化物转化过程本研究共设置3个“水铁矿-Cu-NOM”的共沉淀转化组:①水铁矿与铜的共沉淀转化组(Fh-Cu处理);②水铁矿、Cu和FA的共沉淀转化组(Fh-Cu-FA处理);③水铁矿、Cu和HA的共沉淀转化组(Fh-Cu-HA处理).实验容器采用带盖聚四氟乙烯(PTFE)瓶子, 反应全程用铝箔包裹以防止光对实验过程产生干扰.
“水铁矿-Cu-NOM”共沉淀过程是通过在敞口条件下加入NaOH溶液使Fe3+、Cu2+和NOM水解的方法合成的(Schwertmann et al., 2007).具体来讲, 对于Fh-Cu-FA体系, 将20 mL Fe (NO3)3储备溶液、2 mL Cu(NO3)2储备溶液、4 mL FA储备溶液混合均匀, 向混合溶液中用移液枪滴加1 mol · L-1的NaOH溶液至pH=7.5, 形成Fh-Cu-FA共沉淀, 滴加过程中逐滴加入并持续搅拌以防止实验体系局部区域过碱形成Cu沉淀, 记录NaOH体积并用移液枪精确补加去离子水到最终体积200 mL.Fh-Cu-HA共沉淀合成方法与Fh-Cu-FA相同.对于Fh-Cu处理, 水铁矿共沉淀过程与前文一致, 只是没有进行FA或者HA的添加.将水铁矿共沉淀放置于摇床, 振荡16~24 h, 然后用1 mol · L-1 NaOH溶液将共沉淀悬浊液调节至pH=10.0.随后, 将悬浊液转移到水浴摇床中于70 ℃振荡以进行铁氧化物的转化, 将此时记为铁氧化物转化0 h, 整个转化时间设置为168 h.转化实验中pH=10.0的设定主要是考虑到该pH可以加速水铁矿朝着赤铁矿的转化(Das et al., 2011; Marshall et al., 2014; Das et al., 2016), 并且在较高的pH条件下HA更容易处于溶解态而非颗粒态.转化进行中使用pH计每天检查一遍反应体系pH, 并通过逐滴添加0.1 mol · L-1 NaOH溶液或0.1 mol · L-1 HNO3溶液的方法使反应体系保持在pH=10.0.之前的研究已经表明在该实验条件下, 水铁矿主要转化为赤铁矿(Hematite)(Lu et al., 2020), 因此, 另设置一个赤铁矿吸附Cu的样品作为对照, 命名为“Cu Adsorbed Hematite”.制备过程是将最终浓度为2 mmol · L-1的Cu2+和0.89 g · L-1的赤铁矿悬浊液在pH=5.0条件下振荡4 h, 然后收集吸附Cu之后的赤铁矿颗粒待测Cs-STEM.
2.3 动力学释放实验该实验主要用以评估3种处理中Cu在流动背景溶液中的稳定性, 具体实验在一套流动搅拌(SF)装置上开展, 该装置具体介绍见文献(Tian et al., 2017).SF反应器的优点是可以精确控制实验变量, 避免反应产物随时间积累, 还可以在实验中持续充分搅拌悬浊液以减少矿物颗粒的团聚, 从而使反应过程中体系内部保持均一(Shi et al., 2005; Tian et al., 2017).具体实验过程是分别将3个处理在不同转化时间点(0、8、24、72、168 h)的铁氧化物共沉淀悬浊液各取0.5 mL加入到SF反应池(V=7.5 mL)中.然后将蠕动泵流速设置为1 mL · min-1, 持续通入背景溶液到SF反应池, 同时开启其中的搅拌子搅拌.背景溶液为0.01 mol · L-1 Ca(NO3)2溶液并用0.01 mol · L-1 MES缓冲液控制pH=5.5, 用来模拟实际土壤的pH与Ca2+背景.流动搅拌装置中设有0.22 μm的滤膜, 用以过滤通向馏分收集器的滤液, 从而收集溶解态的Cu(Cu2+及NOM络合态的Cu).馏分收集器(Spectrum CF-2, 美国)每隔5 min收集流动反应器中的流出溶液.单次实验解吸时间设定为300 min.所收集的样品用HNO3酸化保存到4 ℃冰箱, 初始高浓度样品用2%(体积分数)HNO3稀释, 用于后续ICP-MS分析测定样品的溶液相Cu浓度.先前的研究已表明铁氧化物转化过程中溶液相的Cu浓度较低可忽略, 绝大部分的Cu都在铁氧化物转化过程中被富集到固相(Lu et al., 2020), 因此, Cu累计释放百分比结果可通过SF实验中释放的累计质量相对于固相总共加入Cu的质量的比例来计算.
2.4 扫描透射电子显微镜分析本研究使用装有X射线能谱仪(Energy Dispersive X-Ray Spectroscopy, EDS, super-X, Bruker, 德国)和电子能量损失谱仪(Electron Energy Loss Spectroscopy, EELS, Quantum Gatan, 美国)的透射电子显微镜(Titan Themis 200, FEI, 美国)分析铁氧化物纳米颗粒的微观形貌与元素组成.该透射电子显微镜的工作电压为200 kV, 配备有STEM模式下的球差校正装置.测试过程在STEM模式下收集数据, 样品的微观形貌主要通过收集到的明场(Bright Field, BF)图像来获得, 样品纳米颗粒的元素分布主要通过EDS及EELS分析来获得.EDS主要用于分析Cu在铁氧化物上的微观分布, EELS主要用于分析C在铁氧化物上的微观分布.仪器具体测试参数设置及样品制备过程参照之前的研究(Lu et al., 2020).本研究中具体测试的样品为转化0、8、24和168 h的样品.
3 结果与讨论(Results and discussion)3.1 FA/HA对铁氧化物不同转化时间点Cu释放动力学的影响对于每一个铁氧化物共沉淀转化时间点而言, SF实验结果显示, Cu的溶液相释放浓度随着搅拌时间的增加而降低然后逐渐趋于零(图 1).具体而言, 在没有NOM的纯矿物处理(Fh-Cu)中, Cu释放浓度曲线下降速率较快, 而两个NOM处理在SF实验中的Cu释放浓度下降速率较慢.以3个处理转化时间0 h为例, SF实验中搅拌30 min时, Fh-Cu处理的Cu溶液相释放浓度为164.6 μg · L-1(图 1a);在Fh-Cu-FA处理中Cu的释放浓度增加到358.0 μg · L-1, Fh-Cu-HA处理中该数值为223.1 μg · L-1(图 1c和图 1e).纯矿物处理和NOM处理中Cu释放浓度随着搅拌时间增加而趋于零的速率也不同.以3个处理转化末尾时间点168 h样品的SF实验为例, Fh-Cu处理在搅拌大约50 min时, Cu释放浓度趋于零;而对于两个NOM处理, Cu释放浓度趋于零的反应时间点大约在反应100 min后.这些Cu释放浓度的结果表明NOM增加了铁氧化物共沉淀在SF实验中Cu的释放浓度即Cu的可移动性.但3个处理随着铁氧化物转化时间的增加, 无论NOM存在与否, 均显示释放出来Cu浓度逐渐降低.基于本课题组以前的研究结果, 在本研究实验条件下, Cu主要是与铁氧化物结合(吸附态和晶格取代), 与胡敏酸和富里酸结合的量只占总量的20%以下(Lu et al., 2020);同时, 铜与胡敏酸和富里酸主要是形成表面络合物, 其络合反应基本在24 h内完成, 进一步增加反应时间一般不会显著改变表面络合物形态.因此, 在本实验中Cu与FA或者HA的络合老化不会造成实验中观测到的Cu的释放的差异性(大于60%的Cu的释放).结合本课题组以前的研究, 老化过程中Cu在复合体系中形态的改变主要是Cu进入铁矿物晶格内部程度不同, 造成了Cu释放能力的差异.
图 1(Fig. 1)
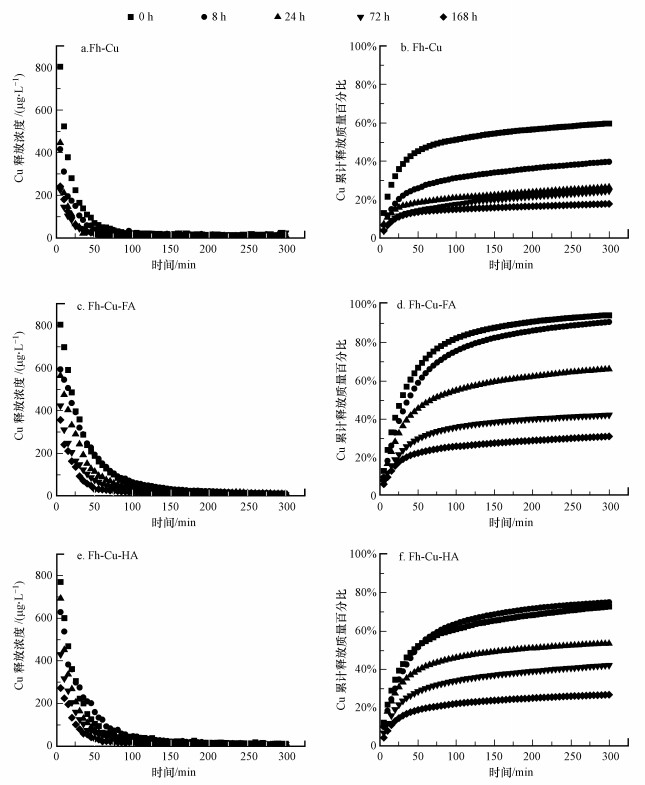 |
| 图 1 流动搅拌实验中铁氧化物转化不同时间点Cu释放浓度及累积Cu释放百分比动力学曲线 (a, c, e:Cu释放浓度;b, d, f:Cu累计释放质量百分比) Fig. 1Temporal changes of the concentration and accumulated mass percentage of released Cu from the iron oxides at different aging times of the stirred-flow experiments (a, c, and e, concentration of released Cu; b, d, and f, accumulated mass percentage of released Cu) |
累计释放出的Cu质量百分比随着搅拌时间的增加而逐渐增加然后趋于稳定(图 1).Cu累计释放质量百分比结果显示, Fh-Cu处理中各个时间点铁氧化物上Cu的累计释放量均小于NOM处理组(Fh-Cu-FA和Fh-Cu-HA)(图 1b), 与Cu释放浓度曲线中NOM增加Cu可移动特性的结论一致.同时, 结果还显示3个处理组随着铁氧化物转化时间的增加, 其各自处理中Cu累计释放质量百分比都是降低的, 说明Cu的可释放量随着铁氧化物转化时间的增加而降低.具体到两种有机质而言, FA和HA对于Cu的累计释放动力学影响略有不同.在0、8和24 h的时间点SF实验结束时, FA处理的Cu累计释放量比HA处理增加了23.1%~29.1%.当转化时间到了72 h, FA处理和HA处理中Cu累计释放量基本持平, 分别为42.0%和41.6%.在转化时间为168 h时, FA处理的释放量略高于HA处理, 二者累计释放Cu的量分别为30.5%和26.6%(图 1d和图 1f).这些结果表明, FA与HA对Cu在铁氧化物共沉淀中的释放动力学的差异在转化开始时最大, 然后这种差异随着转化时间的增加而减小.先前的研究已经表明, 铁氧化物在本研究实验条件(pH和温度)下主要生成赤铁矿(Lu et al., 2020), Cu已经被证明可以掺入到赤铁矿的晶体结构并同晶替代其中的铁元素从而在赤铁矿内部稳定存在(Frierdich et al., 2012; Lu et al., 2020).因此, NOM处理(Fh-Cu-FA和Fh-Cu-HA)相对于纯矿物处理而言, Cu在SF实验中释放量的增加有可能是NOM的加入阻碍了Cu掺入到赤铁矿晶体结构的过程所导致的.在铁氧化物转化初期, FA处理中Cu的释放量大于HA处理中Cu释放量的现象可能还与FA/HA结合的铜稳定性有关.通常来讲, FA结合的铜稳定常数小于HA结合的Cu, 因此, FA处理中铁氧化物上结合的Cu更容易被背景溶液中的Ca2+交换.
对于每一个铁氧化物共沉淀转化时间点而言, SF实验结果显示Fe的溶液相释放浓度很稳定, 都在零点附近, 说明3个处理在各个转化时间点的SF实验中基本没有Fe溶出(图 2).这个结果也说明金属离子在形成矿物后很难在SF实验体系中释放出来, 因此, Cu离子在SF实验中的不断释放是由于铁氧化物、NOM对Cu离子的结合作用而非Cu自身的沉淀作用.
图 2(Fig. 2)
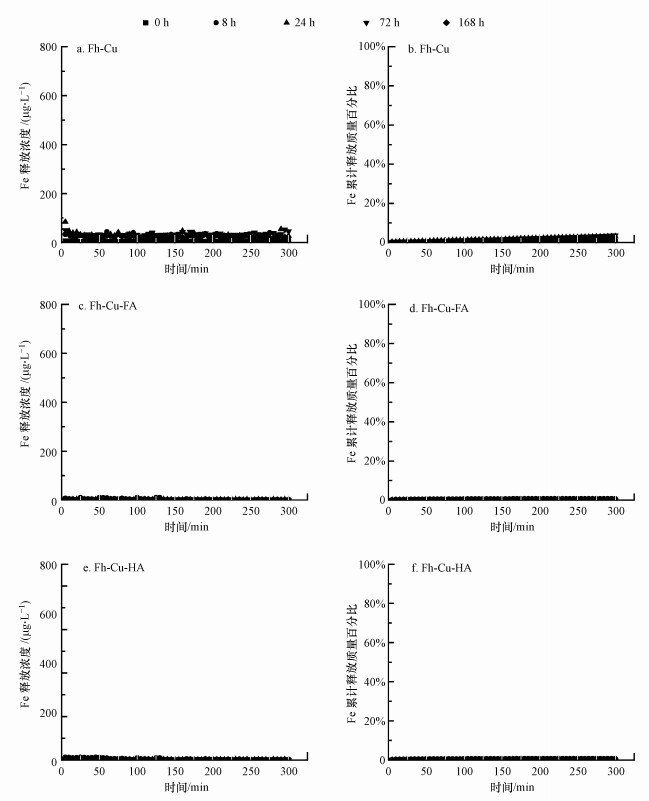 |
| 图 2 流动搅拌实验中铁氧化物转化不同时间点Fe释放浓度及累积Fe释放百分比动力学曲线 (a, c, e:Fe释放浓度;b, d, f:Fe累计释放质量百分比) Fig. 2Temporal changes of the concentration and accumulated mass percentage of released Fe from the iron oxides at different aging times of the stirred-flow experiments (a, c, and e, concentration of released Fe; b, d, and f, accumulated mass percentage of released Fe) |
3.2 FA/HA对铁氧化物转化微观形貌的影响及Cu的微观分布特性本课题组之前的研究已经表明, 铁氧化物在本实验体系下为水铁矿转化为赤铁矿的过程, 而Cu可以逐步进入赤铁矿的晶格内部(Lu et al., 2020).本研究中, 对SF实验的平行铁氧化物样品上Cu的微观分布进行了针对性的分析, 期望能建立Cu微观分布与释放动力学之间的关系.根据BF的成像原理, BF图像中的深色区域代表样品纳米颗粒的微观二维形貌, 而浅色区域则为无样品颗粒的电子束透过的区域.BF-STEM图像显示, 纯矿物体系(Fh-Cu)中的铁氧化物在开始转化时为无定形态的水铁矿团聚体, 转化8 h后变成立方体形状的赤铁矿.随着转化时间的进一步增加, 立方体形状的赤铁矿变得更加密实, 周围无定形态的水铁矿也越来越少(图 3a).对于两个NOM处理(Fh-Cu-FA和Fh-Cu-HA)而言, 微观形貌显示无定形的水铁矿逐渐变成了椭球形的赤铁矿纳米颗粒.两个处理中的铁氧化物在转化8 h后已经出现了椭球形的赤铁矿纳米颗粒, 但此时的椭球形颗粒周围还有很多无定形的矿物, 据其形貌推测为水铁矿或者水铁矿与FA/HA的络合物.随着转化时间的进一步增加, 无定形的矿物越来越少, 取而代之的是单个的椭球形赤铁矿颗粒, 并且两个NOM处理中的赤铁矿颗粒边缘相对于纯矿物体系更加疏松多孔(图 3b~3c).以上观测与本课题组先前的结果一致(Lu et al., 2020), 这种疏松多孔的结构减缓了Cu进入到铁氧化物晶格中的过程, 同时也使得更多的Cu处于吸附态, 使得FA/HA处理中的Cu在SF实验中的释放量多于纯矿物体系(图 1).
图 3(Fig. 3)
 |
| 图 3 不同处理中铁氧化物不同转化时间的扫描透射电镜明场像 Fig. 3BF-STEM images of iron oxides during the ferrihydrite transformation process for the three treatments |
STEM-EDS面扫描(STEM-EDS mapping)结果显示, 3个处理的初始和末尾时间点Cu均在铁氧化物颗粒上均匀分布(图 4), 说明在铁氧化物转化过程中Cu和水铁矿及赤铁矿紧密结合在一起.根据HAADF成像原理, 样品纳米颗粒存在的区域会显示有亮度, 而无样品纳米颗粒的电子束透过区域则构成图像的黑色背景.HAADF图像也显示了与BF图像类似的结果, 即转化使得水铁矿转化成立方体或者椭球形的赤铁矿纳米颗粒.3个处理中单个赤铁矿颗粒的EDS面扫描结果表明, 水铁矿转化成赤铁矿后, Cu在赤铁矿颗粒主体部分有很高的信号强度, 这种特征与先前研究中提到的一些元素(Pb、U和C)在纳米颗粒外围吸附的EDS面扫描特征明显不同(Ling et al., 2015; Lu et al., 2019).这些结果表明Cu随着铁氧化物的转化被固存到赤铁矿颗粒内部, 而这种Cu在赤铁矿颗粒内部的存在形态相对于表面吸附态的Cu更加稳定, 只有铁氧化物自身溶解才会得以释放.随着水铁矿转化时间的增加, 赤铁矿越来越多, 赤铁矿固存的Cu也越来越多, 因此, 导致Cu的可释放量越来越少.这与动力学实验中随着老化时间的增加, 释放出来的Cu浓度越来越小及累计释放Cu质量百分比越来越小的结果一致(图 1).
图 4(Fig. 4)
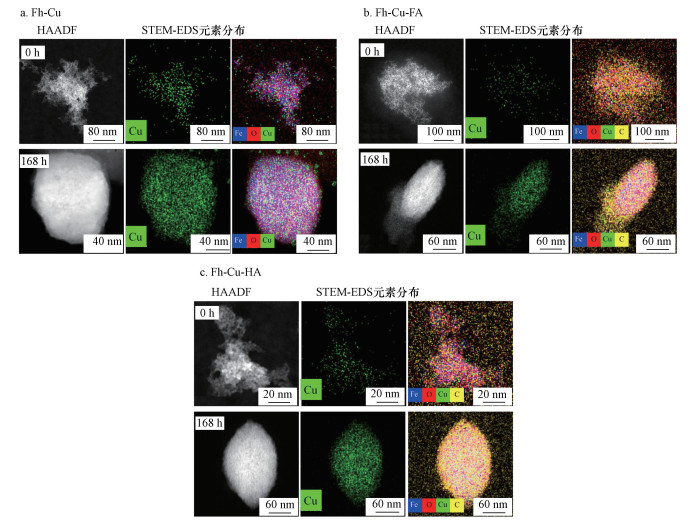 |
| 图 4 STEM-EDS面扫描:不同转化时间点铁氧化物的HAADF图像、Cu分布及Fe、O、Cu、C分布叠加图 Fig. 4STEM-EDS mapping:HAADF images, Cu distribution, and the color overlays of Fe, O, Cu, C distribution at various aging times |
Cs-STEM展示的实验体系矿物微观形貌及STEM-EDS面扫描结果均未发现Cu在某个区域富集的现象.之前的研究中在同等实验条件下固相XRD结果只存在明显的铁氧化物特征峰, 未检测到Cu氧化物的XRD特征峰(Lu et al., 2020).这些结果说明Cu沉淀在本实验体系中不是Cu的主要存在形式.因此, 在本实验体系中随着铁氧化物转化时间的增加Cu释放浓度和累计释放百分比的降低主要是因为铁氧化物的转化过程而非Cu自身的沉淀.由于反应体系中主要是铁氧化物、NOM及络合态的Cu, 因此, 随着转化时间的增加, 铁氧化物固定的Cu起到了越来越重要的作用, 从而导致在铁氧化物转化后期, FA与HA处理中Cu释放累计百分比结果逐渐趋于接近(图 1).
3.3 FA/HA在铁氧化物纳米颗粒上的分布特性FA/HA处理SF实验中Cu的累计释放质量百分比产生的差异有可能和FA/HA与铁氧化物的微观结合方式有关.因此, 本研究还采用对轻元素更加敏感的EELS技术对转化末尾时间点样品进行C在赤铁矿纳米颗粒边缘分布特征的分析(图 5).结果显示, C信号在椭球形赤铁矿颗粒外围达到峰值, 而Fe和O信号在赤铁矿颗粒主体区域达到峰值并且与赤铁矿颗粒形状保持一致, 说明FA和HA在铁氧化物转化末尾时间点均存在于赤铁矿颗粒的外围.但二者在赤铁矿外围的结合方式有一些差异.对于Fh-Cu-FA处理, EELS C信号有一个清晰的峰值, 位于颗粒的边缘.当EELS线扫描的位置进入到赤铁矿颗粒内部, C信号很快衰减, 取而代之的是Fe和O信号处于平稳状态(图 5a), 这种现象说明FA主要富集在赤铁矿纳米颗粒外围, 主体区域内部分布较少.而对于Fh-Cu-HA处理, EELS C信号的峰值在颗粒外围则并不唯一, 并且当EELS线扫描的位置进入到赤铁矿颗粒内部后依然有较强的C信号强度(图 5b).这表明HA分子可能渗透到了赤铁矿边缘区域的纳米孔洞中, 从而导致赤铁矿外围和边缘疏松多孔区域C信号差异较小.FA分子则在赤铁矿外围吸附, 较少进入边缘的孔洞, 因为其外围的C信号和边缘孔洞结构中的C信号差异较大.以上C的微观分布也与以前的结果吻合(Lu et al., 2020), 因此, 相对于FA处理而言, HA处理中会有较多的HA络合的Cu存在于赤铁矿边缘的疏松多孔结构中, 这种赤铁矿边缘纳米级别疏松多孔的物理隔挡在一定程度上阻碍了pH=5.5的条件下Cu的释放过程, 从而导致Fh-Cu-FA与Fh-Cu-HA处理在SF实验中产生了不同的Cu释放动力学结果(图 1).
图 5(Fig. 5)
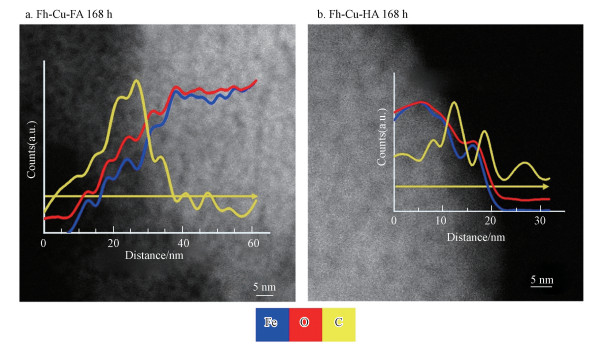 |
| 图 5 EELS线扫描:铁氧化物转化168 h赤铁矿颗粒边缘Fe、O、C的分布 (带有箭头的黄色线条代表EELS线扫描的位置) Fig. 5EELS line scans of elemental distribution for the hematite particle edges at 168 h aging time (The yellow line with arrow denotes the EELS line position) |
4 结论(Conclusions)1) Fh-Cu、Fh-Cu-FA、Fh-Cu-HA 3种处理均表明Cu的累计释放量随着水铁矿转化时间的增加逐渐降低, 铁氧化物转化减缓了Cu的可移动性;NOM(FA/HA)的加入增加了铁氧化物共沉淀在SF实验中Cu的释放量, 导致Cu在铁氧化物上更加不稳定.
2) NOM(FA/HA)的加入使得立方体形状的赤铁矿变为椭球形的赤铁矿;在铁氧化物转化过程中, Cu可以进入到赤铁矿的颗粒内部, 这是SF实验中随着铁氧化物转化Cu释放量不断降低的微观机理;相对于纯矿物体系中的密实赤铁矿颗粒, NOM加入后赤铁矿边缘变得疏松多孔, 这种疏松多孔的结构减缓了Cu进入到铁氧化物晶格中的过程, 同时也使得更多的Cu处于吸附态, 最终导致NOM处理中的Cu在SF实验中的释放量多于纯矿物体系.
3) FA主要吸附在赤铁矿外围, 较少分布在赤铁矿边缘疏松的孔隙中;而HA则分布在赤铁矿外围及边缘的疏松多孔的区域内, 两种NOM不同的微观分布方式导致了FA和HA处理在SF实验中产生不同的Cu释放动力学行为.
参考文献
| 陈洁宜, 刘广波, 崔金立, 等. 2019. 广东大宝山矿区土壤植物体系重金属迁移过程及风险评价[J]. 环境科学, 40(12): 5629-5639. |
| 程龙, 杨可明, 王晓峰, 等. 2018. 作物重金属铜污染的HHT边际谱特征与污染预测模型[J]. 中国环境科学, 38(1): 340-347. DOI:10.3969/j.issn.1000-6923.2018.01.038 |
| 邓迎璇, 李永涛, 李晓晶, 等. 2018. 土壤样品中重金属化学形态模型的发展与应用[J]. 农业环境科学学报, 37(7): 1350-1361. |
| Das S, Essilfie-Dughan J, Hendry M J. 2016. Sequestration of molybdate during transformation of 2-line ferrihydrite under alkaline conditions[J]. Applied Geochemistry, 73: 70-80. DOI:10.1016/j.apgeochem.2016.08.003 |
| Das S, Hendry M J, Essilfie-Dughan J. 2011. Transformation of two-line ferrihydrite to goethite and hematite as a function of pH and temperature[J]. Environmental Science and Technology, 45: 268-275. DOI:10.1021/es101903y |
| Frierdich A J, Catalano J G. 2012. Fe (Ⅱ)-mediated reduction and repartitioning of structurally incorporated Cu, Co, and Mn in iron oxides[J]. Environmental Science & Technology, 46: 11070-11077. |
| Fulda B, Voegelin A, Maurer F, et al. 2013. Copper redox transformation and complexation by reduced and oxidized soil humic acid.1.X-ray Absorption Spectroscopy Study[J]. Environmental Science & Technology, 47: 10903-10911. |
| Gaetke L M, Chow C K. 2003. Copper toxicity, oxidative stress, and antioxidant nutrients[J]. Toxicology, 189: 147-163. DOI:10.1016/S0300-483X(03)00159-8 |
| Lalonde K, Mucci A, Ouellet A, et al. 2012. Preservation of organic matter in sediments promoted by iron[J]. Nature, 483: 198-200. DOI:10.1038/nature10855 |
| 李锦芬, 瞿明凯, 刘刚, 等. 2018. 县域尺度土壤铜的有效性及相关影响因素评估[J]. 环境科学, 39(1): 363-370. |
| Ling L, Zhang W X. 2015. Enrichment and encapsulation of uranium with iron nanoparticle[J]. Journal of the American Chemical Society, 137: 2788-2791. DOI:10.1021/ja510488r |
| Lu Y, Hu S, Wang Z, et al. 2019. Ferrihydrite transformation under the impact of humic acid and Pb:kinetics, nanoscale mechanisms, and implications for C and Pb dynamics[J]. Environmental Science:Nano, 6: 747-762. DOI:10.1039/C8EN01327F |
| Lu Y, Hu S W, Liu F, et al. 2020. Effects of humic acid and fulvic acid on the sequestration of copper and carbon during the iron oxide transformation[J]. Chemical Engineering Journal, 383: 123194. DOI:10.1016/j.cej.2019.123194 |
| Manceau A, Matynia A. 2010. The nature of Cu bonding to natural organic matter[J]. Geochimica et Cosmochimica Acta, 74: 2556-2580. DOI:10.1016/j.gca.2010.01.027 |
| Marshall T A, Morris K, Law G T, et al. 2014. Incorporation of Uranium into Hematite during crystallization from ferrihydrite[J]. Environmental Science and Technology, 48: 3724-3731. DOI:10.1021/es500212a |
| Martinez C E, McBride M B. 1998. Solubility of Cd2+, Cu2+, Pb2+, and Zn2+ in aged coprecipitates with amorphous iron hydroxides[J]. Environmental Science & Technology, 32: 743-748. |
| Moon E M, Peacock C L. 2012. Adsorption of Cu(Ⅱ) to ferrihydrite and ferrihydrite-bacteria composites:Importance of the carboxyl group for Cu mobility in natural environments[J]. Geochimica et Cosmochimica Acta, 92: 203-219. DOI:10.1016/j.gca.2012.06.012 |
| Riedel T, Zak D, Biester H, et al. 2013. Iron traps terrestrially derived dissolved organic matter at redox interfaces[J]. Proceedings of the National Academy of Sciences of the United States of America, 110: 10101-10105. DOI:10.1073/pnas.1221487110 |
| Rubino J T, Franz K J. 2012. Coordination chemistry of copper proteins:how nature handles a toxic cargo for essential function[J]. Journal of Inorganic Biochemistry, 107: 129-143. DOI:10.1016/j.jinorgbio.2011.11.024 |
| Saito T, Koopal L K, Nagasaki S, et al. 2005. Analysis of copper binding in the ternary system Cu2+/humic acid/goethite at neutral to acidic pH[J]. Environmental Science & Technology, 39: 4886-4893. |
| Scheinost A C, Abend S, Pandya K I, et al. 2001. Kinetic controls on Cu and Pb sorption by ferrihydrite[J]. Environmental Science and Technology, 35: 1090-1096. DOI:10.1021/es000107m |
| Schwertmann U, Cornell R M. 2007. Ferrihydrite, Iron Oxides in the Laboratory[M]. Wiley-VCH Verlag GmbH, 103-112. |
| Shi G L, Lou L Q, Zhang S, et al. 2013. Arsenic, copper, and zinc contamination in soil and wheat during coal mining, with assessment of health risks for the inhabitants of Huaibei, China[J]. Environmental Science and Pollution Research, 20: 8435-8445. DOI:10.1007/s11356-013-1842-3 |
| Shi Z Q, Di Toro D M, Allen H E, et al. 2005. Modeling kinetics of Cu and Zn release from soils[J]. Environmental Science and Technology, 39: 4562-4568. DOI:10.1021/es048554f |
| Strawn D G, Baker L L. 2008. Speciation of Cu in a Contaminated Agricultural Soil Measured by XAFS, μ-XAFS, and μ-XRF[J]. Environmental Science & Technology, 42: 37-42. |
| Tian L, Shi Z Q, Lu Y, et al. 2017. Kinetics of cation and oxyanion adsorption and desorption on ferrihydrite:roles of ferrihydrite binding sites and a unified model[J]. Environmental Science and Technology, 51: 10605-10614. DOI:10.1021/acs.est.7b03249 |
| Vermeer A W P, van Riemsdijk W H, Koopal L K. 1998. Adsorption of humic acid to mineral particles.1.Specific and electrostatic interactions[J]. Langmuir, 14: 2810-2819. DOI:10.1021/la970624r |
| 王小明, 杨凯光, 孙世发, 等. 2011. 水铁矿的结构、组成及环境地球化学行为[J]. 地学前缘, 18(2): 339-347. |
| Xia K, Bleam W, Helmke P A. 1997. Studies of the nature of Cu2+ and Pb2+ binding sites in soil humic substances using X-ray absorption spectroscopy[J]. Geochimica et Cosmochimica Acta, 61: 2211-2221. DOI:10.1016/S0016-7037(97)00079-3 |
| Xiong J, Weng L, Koopal L K, et al. 2018. Effect of soil fulvic and humic acids on Pb binding to the goethite/solution interface:Ligand charge distribution modeling and speciation distribution of Pb[J]. Environmental Science and Technology, 52: 1348-1356. DOI:10.1021/acs.est.7b05412 |
| 徐晋玲.2019.土壤有机活性组分对Cu2+、磷酸盐形态转化的影响机制[D].杨凌: 中国科学院教育部水土保持与生态环境研究中心 |
| 易层, 严玉鹏, 王小明, 等. 2018. 天然有机质和金属离子在矿物表面的共吸附[J]. 农业环境科学学报, 37(8): 1574-1583. |
| 张金莲, 丁疆峰, 卢桂宁, 等. 2015. 广东清远电子垃圾拆解区农田土壤重金属污染评价[J]. 环境科学, 36(7): 2633-2640. |
