
 , 肖榕3, 吴思展1, 石维1, 佘远斌2
, 肖榕3, 吴思展1, 石维1, 佘远斌21. 铜仁学院材料与化学工程学院, 铜仁 554300;
2. 浙江工业大学化工学院, 杭州 310014;
3. 铜仁职业技术学院, 铜仁 554300
收稿日期: 2020-05-21; 修回日期: 2020-06-11; 录用日期: 2020-06-11
基金项目: 贵州省科技计划项目(No.黔科合LH字[2015]7231号)
作者简介: 秦航道(1988-), 男, 教授(博士), E-mail:qinhangdao@126.com
通讯作者(责任作者): 秦航道
摘要:采用水热合成法成功制备出MnFe2O4磁性纳米棒(s-MnFe2O4),并考察了商品化的Fe3O4、MnFe2O4和合成的s-MnFe2O4纳米棒这3种磁性纳米颗粒作为非均相Fenton催化剂降解水中四环素抗生素的性能.同时,采用X射线衍射(XRD)、透射电镜(TEM)、N2吸附-脱附、振动样品磁强计(VSM)及X射线光电子能谱(XPS)等技术对催化剂的理化性质进行了表征.非均相Fenton催化降解四环素的结果表明,s-MnFe2O4具有最高的催化活性,反应180 min,四环素的去除率可以达到87.6%,TOC的去除率达到47.5%.自由基捕获试验证实了羟基自由基(·OH)是非均相Fenton氧化过程中的主要活性物种.s-MnFe2O4磁性纳米棒的高催化活性归因于其表面拥有较高含量的Mn3+和Fe2+物种,它们的存在能加速界面电子的转移效率,从而促进·OH的生成.合成的s-MnFe2O4催化剂具有良好的稳定性,循环使用6次,四环素的去除率仅从87.6%降低到80.2%,且氧化过程中活性组分的流失很少.
关键词:非均相Fenton反应MnFe2O4四环素纳米棒磁性催化剂
Heterogeneous Fenton degradation of tetracycline in water catalyzed by magnetic MnFe2O4 nanorods
QIN Hangdao1,2

 , XIAO Rong3, WU Sizhan1, SHI Wei1, SHE Yuanbin2
, XIAO Rong3, WU Sizhan1, SHI Wei1, SHE Yuanbin21. School of Material and Chemical Engineering, Tongren University, Tongren 554300;
2. College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014;
3. Tongren Polytechnic College, Tongren 554300
Received 21 May 2020; received in revised from 11 June 2020; accepted 11 June 2020
Abstract: Magnetic MnFe2O4 nanorods (s-MnFe2O4) were successfully prepared by the hydrothermal synthesis. The commercial Fe3O4,MnFe2O4 and the synthesized s-MnFe2O4 were tested as heterogeneous Fenton catalysts in the degradation of tetracycline antibiotic in water. The physical and chemical properties of these catalysts were characterized by X-ray diffraction (XRD),transmission electron microscopy (TEM),N2 adsorption-desorption,vibrating sample magnetometer (VSM) and X-ray photoelectron spectroscopy (XPS). The results showed that s-MnFe2O4 exhibited the highest catalytic activity in the degradation of tetracycline. After the reaction of 180 min,the removal rate of tetracycline and TOC were 87.6% and 47.5%,respectively. Based on the quenching experiments,hydroxyl radicals (·OH) were confirmed to be the main active species during the heterogeneous Fenton reaction. The enhanced catalytic activity of s-MnFe2O4 was ascribed to the higher content of Mn3+ and Fe2+,which enhanced the interfacial electron transfer and promoted the generation of ·OH radicals. The stability of s-MnFe2O4 catalyst was confirmed to be fairly good and a slight leaching of active component was observed.
Keywords: heterogeneous Fenton reactionMnFe2O4tetracyclinenanorodsmagnetic catalyst
1 引言(Introduction)抗生素被广泛应用于人类医疗和畜牧养殖等行业, 但抗生素的滥用也使得其普遍存在于地表水、地下水和饮用水中(Rivera-Utrilla et al., 2013).四环素(TC)是世界上使用量第二大的抗生素, 具有很强的生物毒性, 水中残留的四环素对人体健康和生态环境都造成了很大的影响(Gómez-Pacheco et al., 2012).因此, 开发有效的去除水中四环素的方法具有重要的现实意义和实用价值.
非均相Fenton催化技术作为一种常见的高级氧化技术, 是降解水中抗生素的有效方法之一(王超等, 2018;陈俊毅等, 2019).为了提高非均相Fenton催化剂的催化活性, 研究人员进行了大量的尝试和努力, 如改变催化剂载体的表面性质(Messele et al., 2014;Qin et al., 2018a), 将合适的过渡金属氧化物与Fe3O4复合(Fe3O4-Mn3O4、Fe3O4/CeO2和Fe3O4@CeO2)(Xu et al., 2012; Wan et al., 2017;Qin et al., 2018b)等.本课题组在前期的研究中(Qin et al., 2018a), 以氮-硫共改性活性炭为载体制备出Fe/ACNS非均相Fenton催化剂, 氮-硫共改性活性炭由于含氮官能团和含硫官能团的引入不仅能提高催化剂表面Fe2+的含量, 还能抑制活性组分Fe的流失, 因而活性炭载体表面性质的改变使得其催化活性得到了提高.在另一研究中(Qin et al., 2018b), 制备出的磁性核壳Fe3O4@CeO2非均相Fenton催化剂在降解苯甲酸中体现出优异的催化性能, 而且利用Fe3O4核的磁性, 通过外加磁场能实现催化剂的快速回收.
此外, 将合适的金属引入到Fe3O4结构中(NiFe2O4、CuFe2O4和MnFe2O4)(Valdes-Solis et al., 2007; Chen et al., 2014; Tan et al., 2017)也是提高非均相Fenton催化剂活性的有效方法.其中, 具有软磁性的MnFe2O4作为尖晶石铁氧体的一员, 在催化臭氧氧化、非均相Fenton氧化和催化活化过硫酸盐氧化等高级氧化技术中体现出了优异的催化性能和结构稳定性(Valdes-Solis et al., 2007; Wang et al., 2014;Zhang et al., 2017).Valdes-Solis等(2007)在Fe3O4晶体结构中引入Mn, 既提高了Fe3+/Fe2+的循环速率, 又能利用MnFe2O4自身的磁性实现催化剂的快速回收, 作为非均相Fenton催化剂, MnFe2O4能促进H2O2分解为羟基自由基(·OH), 但该研究未考察有机物的降解效果, 且H2O2的分解机制也未阐明.
鉴于此, 本研究采用水热合成法成功制备出磁性MnFe2O4纳米催化剂, 并与商业购买的Fe3O4纳米颗粒和MnFe2O4纳米颗粒作为对比, 考查这3种磁性纳米颗粒作为非均相Fenton催化剂降解水中四环素的性能, 以四环素的去除率和TOC的去除率表征其催化活性, 并对催化机理和稳定性进行考查, 以期为制备高活性和稳定性的非均相Fenton催化剂提供理论基础, 并为处理抗生素废水提供新途径.
2 材料与方法(Materials and methods)2.1 MnFe2O4纳米棒的制备采用水热合成法制备MnFe2O4纳米棒, 具体操作如下:将10 mmol FeCl3·6H2O和5 mmol MnCl2·4H2O溶于40 mL去离子水中, 逐滴加入3 mol·L-1 NaOH溶液至pH为12;然后将上述悬浊液注入到50 mL的高压反应釜中, 将高压反应釜置于烘箱中, 于250 ℃下反应12 h;反应结束, 待高压反应釜冷却至室温后, 将样品取出, 用去离子水和乙醇洗涤数次至洗涤液pH不再变化;最后在60 ℃下干燥12 h, 得到的样品记为s-MnFe2O4.用于对比的Fe3O4纳米颗粒和MnFe2O4纳米颗粒购自南京宏德纳米材料有限公司.
商业购买的Fe3O4纳米颗粒采用溶剂热法制得, 具体过程如下:将1.35 g FeCl3·6H2O溶于40 mL乙二醇中, 超声条件下搅拌15 min至溶液呈橙红色澄清状;之后加入2.0 g聚乙二醇, 超声使之完全溶解后, 向上述溶液中加入3.60 g无水NaAC, 将所得均匀橙红色悬浊液转移至反应釜中, 于200 ℃下反应8 h, 自然冷却至室温后, 通过外加磁场分离出黑色固体产物;然后用乙醇和去离子水多次洗涤, 于60 ℃下干燥12 h, 即得Fe3O4磁性纳米颗粒.商业购买的MnFe2O4纳米颗粒采用共沉淀法制得, 具体过程如下:将10 mmol FeCl3·6H2O和5 mmol MnCl2·4H2O溶于100 mL去离子水中, 逐滴加入3 mol·L-1 NaOH溶液至pH为12, 将上述悬浊液在80 ℃水浴加热下反应60 min, 冷却之后过滤、洗涤, 于60 ℃下干燥12 h后, 置于管式炉中, 在Ar气氛中300 ℃下煅烧3 h, 即得MnFe2O4磁性纳米颗粒.
2.2 样品表征采用荷兰Philips X′Pert MPD型X射线衍射仪对样品进行结构、晶型表征, 扫描范围2θ为10°~80°;采用美国Micromeritics公司的ASAP-2460型全自动表面分析仪测定样品的比表面积和孔体积, 样品测试前在250 ℃下脱气处理5 h;采用日本JEOL JEM-2010HR型透射电子显微镜进行样品的形貌和微观结构观察;采用Digital Measurement System JDM-13型振动样品磁强计对样品的磁性进行测定;采用Kratos XSAM800型X-射线光电子能谱(XPS)仪对样品的表面组成进行表征, C1s校准结合能为284.8 eV.
2.3 试验方法非均相Fenton催化降解四环素试验在250 mL的锥形瓶中进行, 每次实验采用的四环素溶液体积为100 mL, 初始浓度为30 mg·L-1, pH值采用盐酸调至3.0.将锥形瓶至于恒温水浴振荡器中, 当溶液温度达到30 ℃时, 加入100 mg固体催化剂, 然后加入0.3 mL质量分数为30%的H2O2溶液开始反应, 振荡速度调节为150 r·min-1, 于不同时间取样, 并加入2 mL叔丁醇终止反应, 样品经膜过滤后进行分析.吸附试验中, 采用等量的去离子水代替H2O2溶液.每次试验重复3次, 最终结果为3次试验的平均值.
2.4 分析方法水中四环素的浓度采用高效液相色谱(HPLC, LC-20A, 日本岛津公司)进行测定, 色谱柱为C18反相色谱柱(4.6 mm × 250 mm, 5 μm), 流动相由体积比为15:85的乙腈和超纯水组成, 并采用1%的磷酸酸化, 紫外检测器波长为355 nm, 流速为0.5 mL·min-1, 进样体积为20 μL, 柱温为室温.溶液的pH值采用PHC-3C型pH计进行测定.氧化过程中从催化剂中流失到溶液中的Mn、Fe采用原子吸收光谱仪(AA-7000, 日本岛津公司)进行测定.总有机碳(TOC)表示水体中有机物总的碳含量, 采用TOC分析仪(TOC-2000, 美国热电公司)进行测定.水中H2O2的浓度采用比色滴定法进行测定(Eisenberg, 1943), H2O2与硫酸钛生成过氧化物-钛复合物黄色沉淀, 将沉淀溶解于硫酸中, 并在415 nm下测定其吸光度, 将吸光度代入标准曲线中求得H2O2的浓度.
3 结果分析与讨论(Results analysis and discussion)3.1 催化剂表征图 1为合成的s-MnFe2O4磁性纳米催化剂的XRD谱图及尖晶石结构MnFe2O4的标准谱图.从图可知, s-MnFe2O4在2θ=18.07°、30.62°、36.05°、43.72°、54.12°、57.72°和63.32°处均出现了MnFe2O4尖晶石结构的(111)、(220)、(311)、(400)、(422)、(511)和(440)晶面特征衍射峰, 特征峰位与标准卡片(JCPDS 10-0319)吻合.此外, 图谱中未出现其它杂峰, 表明合成的s-MnFe2O4样品为尖晶石结构的纯净晶体.
图 1(Fig. 1)
 |
| 图 1 s-MnFe2O4的XRD谱图 Fig. 1XRD pattern of s-MnFe2O4 |
图 2为商业购买的Fe3O4磁性纳米颗粒、MnFe2O4磁性纳米颗粒和合成的s-MnFe2O4磁性纳米催化剂的TEM谱图和HRTEM谱图.从图 2a可以看出, 商业购买的Fe3O4纳米颗粒呈不规则形状, HRTEM图(图 2d)中的晶格条纹间距约为0.25 nm, 为(311)晶面之间的间距(Qin et al., 2018b).从图 2b可以看出, 商业购买的MnFe2O4纳米颗粒呈球形, 直径约为40 nm, 其对应的HRTEM图(图 2e)中的晶格条纹间距为0.25 nm左右, 为尖晶石结构MnFe2O4 (311)的晶面间距(Jiang et al., 2015).从图 2c可以看出, 合成的s-MnFe2O4纳米催化剂呈棒状, 长度为50~150 nm, 其对应的HRTEM图(图 2f)中的晶格条纹间距为0.49 nm左右, 为XRD谱图中18.07°处衍射峰对应的(111)晶面之间的间距, 这表明s-MnFe2O4纳米棒沿着(110)晶面生长(Zhang et al., 2013).
图 2(Fig. 2)
 |
| 图 2 不同催化剂的TEM谱图(a.Fe3O4, b.MnFe2O4, c.s-MnFe2O4)和HRTEM谱图(d.Fe3O4, e.MnFe2O4, f.s-MnFe2O4) Fig. 2TEM images and HRTEM images of Fe3O4, MnFe2O4 and s-MnFe2O4 catalysts |
Fe3O4、MnFe2O4和s-MnFe2O4 3种磁性纳米催化剂的孔结构性质如表 1所示.由表 1可知, 商业购买的MnFe2O4的比表面积(SBET)和孔体积(Vt)分别为28 m2·g-1和0.088 cm3·g-1, 而合成的s-MnFe2O4纳米棒比表面积和孔体积较大, 分别为37 m2·g-1和0.11 cm3·g-1.
表 1(Table 1)
| 表 1 Fe3O4、MnFe2O4和s-MnFe2O4催化剂的理化性质 Table 1 Physical and chemical properties of Fe3O4, MnFe2O4 and s-MnFe2O4 catalysts | ||||||||||||||||
表 1 Fe3O4、MnFe2O4和s-MnFe2O4催化剂的理化性质 Table 1 Physical and chemical properties of Fe3O4, MnFe2O4 and s-MnFe2O4 catalysts
| ||||||||||||||||
图 3为Fe3O4、MnFe2O4和s-MnFe2O4纳米棒室温下的磁滞回归线, 其饱和磁化强度(Ms)如表 1所示.从图中可以看出, 3种催化剂均具有超顺磁性, Fe3O4的饱和磁化强度最大, 为69.1 emu·g-1.与购买的MnFe2O4相比, 合成的s-MnFe2O4纳米棒具有更高的饱和磁化强度, 因此, 在外加磁场的条件下, 能快速实现催化剂的回收.
图 3(Fig. 3)
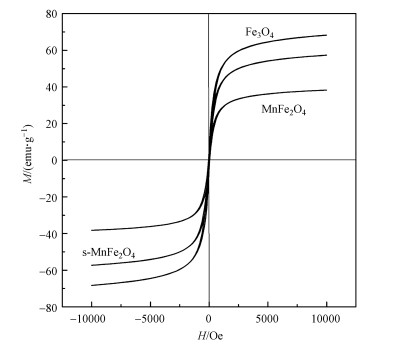 |
| 图 3 室温下Fe3O4、MnFe2O4和s-MnFe2O4的磁滞回归线 Fig. 3Magnetic hysteresis loops of Fe3O4, MnFe2O4 and s-MnFe2O4 measured at room temperature |
采用XPS分析可以获得催化剂表面Mn元素和Fe元素的化学状态信息.MnFe2O4纳米颗粒和s-MnFe2O4纳米棒表面的Mn 2p和Fe 2p的XPS谱图如图 4所示.从图 4a可以看出, Mn 2p1/2和Mn 2p3/2峰分别位于653.6 eV和642.4 eV.根据文献报道(Tan et al., 2017; Fu et al., 2019), Mn 2p3/2区域可以分解为两个结合能峰, 其中, 642.5 eV的特征峰对应Mn2+, 654.4 eV的特征峰对应Mn3+.由此可见, Mn2+和Mn3+同时存在于MnFe2O4和s-MnFe2O4催化剂表面.在MnFe2O4催化剂表面, Mn2+的相对含量为67.5%, Mn3+的相对含量为32.5%.在s-MnFe2O4催化剂表面, Mn2+的相对含量为63.2%, Mn3+的相对含量为36.8%.
图 4(Fig. 4)
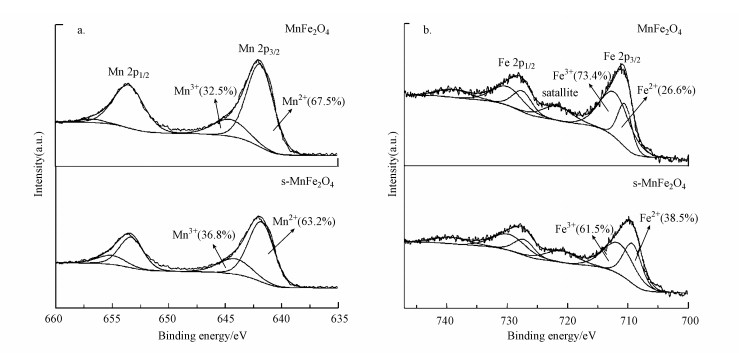 |
| 图 4 MnFe2O4和s-MnFe2O4的Mn 2p(a)和Fe 2p(b)的XPS谱图 Fig. 4XPS spectra of Mn 2p(a) and Fe 2p(b) for MnFe2O4 and s-MnFe2O4 |
从图 4b可以看出, Fe 2p1/2和Fe 2p3/2峰分别位于724.6 eV和711.3 eV.此外, 720.0 eV处存在一个卫星峰, 卫星峰的存在表明Fe3+物种的存在(Gu et al., 2008;Liang et al., 2012).根据文献报道(Wang et al., 2014; Fu et al., 2019), Fe 2p3/2区域可以分解为两个结合能峰, 其中, 709.0 eV的特征峰对应Fe2+, 711.0 eV的特征峰对应Fe3+.由此可见, Fe2+和Fe3+物种同时存在于MnFe2O4和s-MnFe2O4催化剂表面.在MnFe2O4催化剂表面, Fe2+的相对含量为26.6%, Fe3+的相对含量为73.4%.在s-MnFe2O4催化剂表面, Fe2+的相对含量为38.5%, Fe3+的相对含量为61.5%.与MnFe2O4催化剂相比较, s-MnFe2O4催化剂表面的Mn3+含量和Fe2+含量更高.
3.2 非均相Fenton催化降解四环素为了研究Fe3O4、MnFe2O4和s-MnFe2O4的催化活性, 考查了单独H2O2氧化、吸附及非均相Fenton氧化对水中四环素的去除效果, 结果如图 5所示.从图 5可以看出, 单独H2O2氧化很难降解水中的四环素, 反应180 min后, 四环素的去除率仅为2.2%.吸附过程对四环素的去除率为0.33%~0.63%, 其中, Fe3O4的吸附性能最强, 这可能与其拥有最大的比表面积有关(表 1).与单独H2O2氧化相比, 催化剂的加入大幅度提高了四环素的去除率, 合成的s-MnFe2O4纳米棒的催化活性最高, 它的加入使得四环素的去除率达到了87.6%.此外, 上述结果还表明四环素的去除主要是非均相Fenton氧化的结果而不是吸附造成的, 因为吸附性能最好的Fe3O4在180 min的反应时间内只能去除0.63%的四环素.
图 5(Fig. 5)
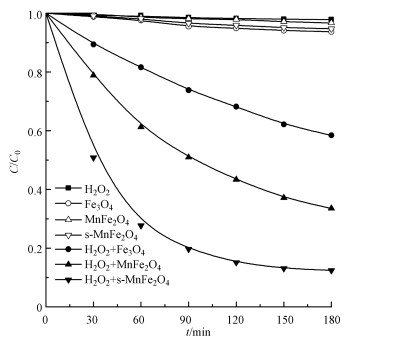 |
| 图 5 单独氧化、吸附及非均相Fenton氧化对四环素的去除效果 Fig. 5The removal of tetracycline during the single H2O2 oxidation, adsorption and heterogeneous Fenton reaction |
图 6是单独H2O2氧化和非均相Fenton氧化反应结束后体系TOC的去除率.从图中可以看出, 单独H2O2氧化很难将四环素彻底矿化, 反应结束后, TOC的去除率只有1.5%.3种催化剂的加入均提高了TOC的去除率, 这是由于催化剂的加入使得H2O2分解产生氧化能力更强且无选择性的活性物种, 能快速对四环素及生成的中间产物进行氧化(Wang et al., 2016).s-MnFe2O4纳米棒的加入使TOC的去除率达到了47.5%左右.由此可见, 3种催化剂中, 合成的s-MnFe2O4纳米棒催化活性最高, MnFe2O4次之, Fe3O4催化活性最低.
图 6(Fig. 6)
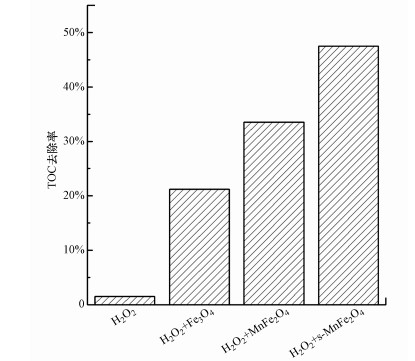 |
| 图 6 单独H2O2氧化和非均相Fenton氧化降解四环素过程中TOC的去除率 Fig. 6TOC removal in the degradation of tetracycline by single H2O2 oxidation and heterogeneous Fenton reaction |
由于传统的均相Fenton反应适用的pH范围较窄, 只适用于pH在2.5~4.0范围内(Ensing et al., 2003; Zhang et al., 2010), 因此, 研究非均相Fenton反应的一个重要目的是拓宽Fenton反应适用的pH范围.为探究四环素降解的最佳初始pH, 研究了溶液pH(1.0~9.0)对MnFe2O4纳米颗粒和s-MnFe2O4纳米棒催化活性的影响, 结果如图 7所示.从图中可以看出, 溶液pH对MnFe2O4和s-MnFe2O4非均相Fenton催化降解四环素的影响很大, 且二者的变化趋势一致, 均是随着pH的增加, 四环素的去除率先增加后降低, 在pH为3.0时达到最大值.对于s-MnFe2O4催化剂, 当溶液的pH从3.0提高到9.0时, 四环素的去除率由87.6%降低到41.9%(图 7b).这是由于H2O2在碱性条件下会迅速分解为O2而非·OH, 而分解产生的O2在该试验条件下很难氧化降解水中的有机物(Guo et al., 2003;Xia et al., 2011);另一方面, pH为6~7时, Fe3+的水解会形成FeOOH沉淀, ·OH产生的速率会受到抑制(Zha et al., 2014).当溶液的pH从3.0降低到1.0时, 四环素的去除率降低到32.2%, 这是由于强酸性条件下形成的H3O2+会增加H2O2的稳定性, 抑制了·OH的产生(Herney-Ramirez et al., 2010).
图 7(Fig. 7)
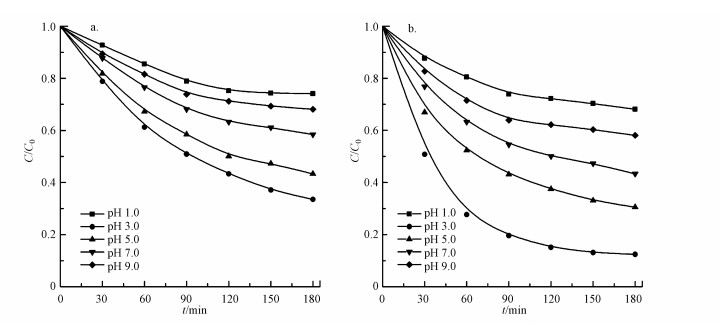 |
| 图 7 pH对MnFe2O4(a)和s-MnFe2O4(b)非均相Fenton催化降解四环素的影响 Fig. 7Effect of pH on the heterogeneous Fenton degradation of tetracycline catalyzed by MnFe2O4(a) and s-MnFe2O4(b) |
3.3 催化机理研究为了确定s-MnFe2O4非均相Fenton催化过程中产生的活性物种, 采用叔丁醇(TBA)和对苯醌(p-benzoquinone)两种常用的自由基抑制剂捕获氧化过程中产生的羟基自由基(·OH)和过氧化物自由基(·O2-), 结果如图 8所示.由图可知, 叔丁醇的加入大幅度抑制了四环素的降解, 当叔丁醇用量达到30 mmol·L-1时, 四环素的去除率由87.6%下降到27.8%;而对苯醌的加入对四环素的降解影响很小.此外, 叔丁醇的用量能显著地影响四环素的去除率, 而对苯醌的用量对四环素去除率的影响很小.以上结果表明非均相Fenton催化过程中产生的活性物种主要是·OH, 而非过氧化物自由基(Jin et al., 2017).
图 8(Fig. 8)
 |
| 图 8 自由基抑制剂对s-MnFe2O4非均相Fenton催化降解四环素的影响 Fig. 8Effect of radical scavengers on the heterogeneous Fenton degradation of tetracycline catalyzed by s-MnFe2O4 |
基于以上结论, 本文提出在MnFe2O4表面产生·OH的机理.如方程式(1)和(2)所示, MnFe2O4表面的≡Mn2+和≡Fe2+能分解H2O2产生·OH, 同时≡Mn2+和≡Fe2+被氧化成≡Mn3+和≡Fe3+(Wan et al., 2017; Costa et al., 2006).
 | (1) |
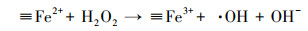 | (2) |
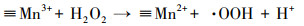 | (3) |
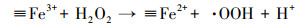 | (4) |
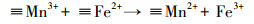 | (5) |
3.4 催化剂的稳定性稳定性和重复使用性是催化剂的一个重要指标.为了考查s-MnFe2O4纳米棒催化剂的稳定性, 将其重复使用6次, 每次反应结束后, 通过磁性分离回收溶液中的固体催化剂, 并测定溶液中Mn、Fe的含量.采用去离子水对回收的固体催化剂反复洗涤后, 置于110 ℃下干燥24 h, 冷却至室温后投入下一个循环使用, 稳定性试验的结果如图 9所示.从图 9a可以看出, 6次循环使用后, 四环素的去除率从87.6%降低到了80.2%, 仅下降了7.4%.四环素去除率的降低一方面由于催化剂表面吸附的有机物会影响其催化活性(Zazo et al., 2006), 另一方面由于回收过程难免会造成固体催化剂质量的减少(Qin et al., 2018b).此外, 如图 9b所示, 循环使用6次后, 流失的Mn、Fe浓度分别仅为0.036和0.049 mg·L-1, 这归因于其尖晶石结构的稳定性.上述结论均表明合成的s-MnFe2O4纳米棒催化剂具有良好的稳定性和重复使用性, 在非均相Fenton催化降解水中抗生素方面具有良好的应用前景.
图 9(Fig. 9)
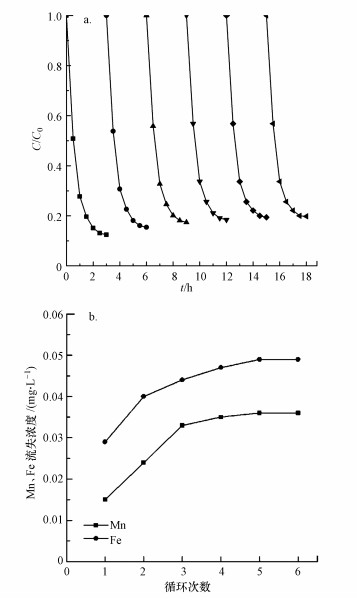 |
| 图 9 s-MnFe2O4催化剂的稳定性试验(a)及稳定性试验中Mn、Fe的流失(b) Fig. 9The stability test of s-MnFe2O4 catalyst(a) and the leaching of Mn and Fe during the stability test(b) |
4 结论(Conclusions)1) 采用水热合成法制备的s-MnFe2O4磁性纳米催化剂呈棒状, 与购买的MnFe2O4纳米颗粒相比, 其比表面积更大, 饱和磁化强度更高.
2) 对比Fe3O4纳米颗粒、MnFe2O4纳米颗粒和s-MnFe2O4纳米棒, 发现s-MnFe2O4纳米棒的催化活性比最高, 四环素的去除率高达87.6%, TOC去除率达到47.5%.
3) 自由基捕获试验证实, s-MnFe2O4非均相Fenton氧化过程中的活性物种主要是·OH, s-MnFe2O4纳米棒具有最高的催化活性归因于其表面拥有较高含量的Mn3+和Fe2+物种, 它们的存在能加速体系电子的转移效率, 从而促进·OH的生成.
4) 合成的s-MnFe2O4磁性纳米棒催化剂具有良好的稳定性, 循环使用6次仍具有较高的活性, 且活性组分的流失较少.
参考文献
| Chen J, Wen W J, Kong L J, et al. 2014. Magnetically separable and durable MnFe2O4 for efficient catalytic ozonation of organic pollutants[J]. Industrial & Engineering Chemistry Research, 53(15): 6297-6306. |
| 陈俊毅, 易云强, 方战强, 等. 2019. 4种常用铁基材料非均相芬顿降解四环素的研究[J]. 华南师范大学学报(自然科学版), 51(1): 49-55. |
| Costa R C C, Lelis M F F, Oliveira L C A, et al. 2006. Novel active heterogeneous Fenton system based on Fe3-xMxO4 (Fe, Co, Mn, Ni):The role of M2+ species on the reactivity towards H2O2 reactions[J]. Journal of Hazardous Materials, 129(1/3): 171-178. |
| Eisenberg G M. 1943. Colorimetric determination of hydrogen peroxide[J]. Industrial & Engineering Chemistry Analytical Edition, 15(5): 327-328. |
| Ensing B, Buda F, Baerends E J. 2003. Fenton-like chemistry in water:oxidation catalysis by Fe(III) and H2O2[J]. Journal of Physical Chemistry A, 107(30): 5722-5731. DOI:10.1021/jp0267149 |
| Fu H C, Ma S L, Zhao P, et al. 2019. Activation of peroxymonosulfate by graphitized hierarchical porous biochar and MnFe2O4 magnetic nanoarchitecture for organic pollutants degradation:Structure dependence and mechanism[J]. Chemical Engineering Journal, 360(3): 157-170. |
| Gómez-Pacheco C V, Sánchez-Polo M, Rivera-Utrilla J, et al. 2012. Tetracycline degradation in aqueous phase by ultraviolet radiation[J]. Chemical Engineering Journal, 187(4): 89-95. |
| Gu Z J, Xiang X, Fan G L, et al. 2008. Facile synthesis and characterization of cobalt ferrite nanocrystals via a simple reduction-oxidation route[J]. Journal of Physical Chemistry C, 112(47): 18459-18466. DOI:10.1021/jp806682q |
| Guo J, Al-Dahhan M. 2003. Catalytic wet oxidation of phenol by hydrogen peroxide over pillared clay catalyst[J]. Industrial & Engineering Chemistry Research, 42(12): 2450-2460. |
| Herney-Ramirez J, Vicente M A, Madeira L M. 2010. Heterogeneous photo-Fenton oxidation with pillared clay-based catalysts for wastewater treatment:A review[J]. Applied Catalysis B:Environmental, 98(1/2): 10-26. |
| Jiang F, Du X M, Zhao S H, et al. 2015. Preparation of carbon-coated MnFe2O4 nanospheres as high-performance anode materials for lithium-ion batteries[J]. Journal of Nanoparticle Research, 17(4): 173-181. |
| Jin H, Tian X K, Nie Y L, et al. 2017. Oxygen vacancy promoted heterogeneous Fenton-like degradation of ofloxacin at pH 3.2~9.0 by Cu substituted magnetic Fe3O4@FeOOH nanocomposite[J]. Environmental Science & Technology, 51(21): 12699-12706. |
| Liang X L, Zhong Y H, He H P, et al. 2012. The application of chromium substituted magnetite as heterogeneous Fenton catalyst for the degradation of aqueous cationic and anionic dyes[J]. Chemical Engineering Journal, 191(5): 177-184. |
| Messele S A, Soares O S G P, Orfao J J M, et al. 2014. Zero-valent iron supported on nitrogen-containing activated carbon for catalytic wet peroxide oxidation of phenol[J]. Applied Catalysis B:Environmental, 154-155(11/12): 329-338. |
| Qin H D, Xiao R, Chen J. 2018a. Catalytic wet peroxide oxidation of benzoic acid over Fe/AC catalysts:Effect of nitrogen and sulfur co-doped activated carbon[J]. Science of the Total Environment, 626: 1414-1420. |
| Qin H D, Xiao R, Shi W, et al. 2018b. Magnetic core-shell-structured Fe3O4@CeO2 as an efficient catalyst for catalytic wet peroxide oxidation of benzoic acid[J]. RSC Advances, 8(59): 33972-33979. DOI:10.1039/C8RA07144F |
| Rivera-Utrilla J, Gómez-Pacheco C V, Sánchez-Polo M, et al. 2013. Tetracycline removal from water by adsorption/bioadsorption on activated carbons and sludge-derived adsorbents[J]. Journal of Environmental Management, 131(12): 16-24. |
| Tan C, Gao N, Fu D, et al. 2017. Efficient degradation of paracetamol with nanoscaled magnetic CoFe2O4 and MnFe2O4 as a heterogeneous catalyst of peroxymonosulfate[J]. Separation and Purification Technology, 175(3): 47-57. |
| Valdes-Solis T, Valle-Vigon P, Alvarez S, et al. 2007. Manganese ferrite nanoparticles synthesized through a nanocasting route as a highly active Fenton catalyst[J]. Catalysis Communication, 8(12): 2037-2042. DOI:10.1016/j.catcom.2007.03.030 |
| Wan Z, Wang J L. 2017. Degradation of sulfamethazine antibiotics using Fe3O4-Mn3O4 nanocomposite as a Fenton-like catalyst[J]. Journal of Chemical Technology & Biotechnology, 92(4): 874-883. |
| 王超, 姚淑美, 彭叶平, 等. 2018. 高级氧化法处理抗生素废水研究进展[J]. 化工环保, 38(2): 135-140. |
| Wang N N, Zheng T, Zhang G S, et al. 2016. A review on Fenton-like processes for organic wastewater treatment[J]. Journal of Environmental Chemical Engineering, 4(1): 762-787. DOI:10.1016/j.jece.2015.12.016 |
| Wang Y B, Zhao H Y, Li M F, et al. 2014. Magnetic ordered mesoporous copper ferrite as a heterogeneous Fenton catalyst for the degradation of imidacloprid[J]. Applied Catalysis B:Environmental, 147(8): 534-545. |
| Xia M, Long M C, Yang Y D, et al. 2011. A highly active bimetallic oxides catalyst supported on Al-containing MCM-41 for Fenton oxidation of phenol solution[J]. Applied Catalysis B:Environmental, 110(11): 118-125. |
| Xu L, Wang J. 2012. Magnetic nanoscaled Fe3O4/CeO2 composite as an efficient Fenton-like heterogeneous catalyst for degradation of 4-chlorophenol[J]. Environmental Science & Technology, 46(18): 10145-10153. |
| Zazo J A, Casas J A, Mohedano A F, et al. 2006. Catalytic wet peroxide oxidation of phenol with a Fe/active carbon catalyst[J]. Applied Catalysis B:Environmental, 65(3/4): 261-268. |
| Zhang H, Liu J G, Ou C J, et al. 2017. Reuse of Fenton sludge as an iron source for NiFe2O4 synthesis and its application in the Fenton-based process[J]. Journal of Environmental Science, 53(3): 1-8. |
| Zha S X, Cheng Y, Gao Y, et al. 2014. Nanoscale zero-valent iron as a catalyst for heterogeneous Fenton oxidation of amoxicillin[J]. Chemical Engineering Journal, 255(11): 141-148. |
| Zhang G K, Gao Y Y, Zhang A L, et al. 2010. Fe2O3-pillared rectorite as an efficient and stable Fenton-Like heterogeneous catalyst for photodegradation of organic contaminants[J]. Environmental Science & Technology, 44(16): 6384-6389. |
| Zhang Z, Wang Y, Tan Q, et al. 2013. Facile solvothermal synthesis of mesoporous manganese ferrite (MnFe2O4) microspheres as anode materials for lithium-ion batteries[J]. Journal of Colloid and Interface Science, 398(5): 185-192. |
| Zhao H, Dong Y M, Wang G L, et al. 2013. Novel magnetically separable nanomaterials for heterogeneous catalytic ozonation of phenol pollutant:NiFe2O4 and their performances[J]. Chemical Engineering Journal, 219(3): 295-302. |
