 , 郑荣波3, 郭雪莲1,2
, 郑荣波3, 郭雪莲1,2
 , 方昕1,2, 付倩1,2, 刘爽1,2
, 方昕1,2, 付倩1,2, 刘爽1,21. 西南林业大学湿地学院, 昆明 650224;
2. 国家高原湿地研究中心, 昆明 650224;
3. 西南林业大学化学工程学院, 昆明 650224
收稿日期: 2019-11-25; 修回日期: 2020-01-10; 录用日期: 2020-01-10
基金项目: 国家自然科学基金项目(41563008);云南省高原湿地科学创新团队(2012HC007)
作者简介: 范峰华(1996-), 男, E-mail:fanfenghua216@163.com
通讯作者(责任作者): 郭雪莲, E-mail:guoxuelian2009@hotmail.com
摘要:二氧化钛纳米颗粒(TiO2NPs)的广泛应用使其环境释放量不断增加,从而影响到土壤氮的转化过程.然而,目前关于TiO2NPs对湖滨沼泽土壤氮矿化的影响机制尚不明确.因此,本研究以典型沼泽土壤为研究对象,通过室内培养实验研究不同剂量TiO2NPs处理(0 mg·kg-1(CK)、10 mg·kg-1(A10)、100 mg·kg-1(A100)、250 mg·kg-1(A250)、1000 mg·kg-1(A1000))对土壤理化性质、酶活性和氮矿化过程的影响,探讨TiO2NPs输入对土壤氮矿化过程影响的内在机制.结果表明:①不同剂量TiO2NPs处理显著降低了土壤pH和总有机碳(TOC)含量(p < 0.05),A100、A250和A1000处理显著降低了硝态氮(NO3--N)含量(p < 0.05).②A250和A1000处理显著抑制了过氧化氢酶活性(p < 0.05);培养7 d,不同剂量TiO2NPs处理均显著促进了脲酶活性(p < 0.05),抑制了脱氢酶活性(p < 0.05);随着培养时间延长,TiO2NPs处理对脲酶和脱氢酶活性的抑制作用逐渐减弱,表明TiO2NPs的负面作用会随时间减弱.③不同剂量TiO2NPs处理对氨化速率没有显著影响(p>0.05),A250、A1000处理对硝化和矿化速率有显著抑制作用(p < 0.01).④土壤氮矿化速率与土壤pH、总磷(TP)、NO3--N含量呈显著正相关,与脲酶、过氧化氢酶活性呈显著负相关.TiO2NPs主要通过改变沼泽土壤NO3--N含量影响氮矿化过程.本研究可为湖滨湿地保护和TiO2NPs环境风险评估提供理论依据.
关键词:二氧化钛沼泽氮矿化酶活性
Effects of TiO2 nanoparticles on the mineralization of soil nitrogen in a lakeshore marsh
FAN Fenghua1,2
 , ZHENG Rongbo3, GUO Xuelian1,2
, ZHENG Rongbo3, GUO Xuelian1,2
 , FANG Xin1,2, FU Qian1,2, LIU Shuang1,2
, FANG Xin1,2, FU Qian1,2, LIU Shuang1,21. Wetland College of Southwest Forestry University, Kunming 650224;
2. National Plateau Wetland Research Center, Kunming 650224;
3. College of Chemical Engineering, Southwest Forestry University, Kunming 650224
Received 25 November 2019; received in revised from 10 January 2020; accepted 10 January 2020
Abstract: The wide spread use of TiO2 nanoparticles (TiO2NPs) is increasing their environmental release, which could change the process of soil nitrogen transformation. However, the mechanism of the effect of TiO2NPs input on the mineralization of soil nitrogen in lakeshore marshes is still unclear. In order to explore the effects and the mechanism of TiO2NPs input on soil nitrogen mineralization, the soil was collected from a lakeshore marsh field and an indoor cultivated experiment with different addition of TiO2NPs was conducted. The amount of TiO2NPs was added with 0 mg·kg-1(CK), 10 mg·kg-1(A10), 100 mg·kg-1(A100), 250 mg·kg-1(A250) and 1000 mg·kg-1 (A1000), respectively. The soil physiochemical properties, enzyme activities and nitrogen mineralization rate of marsh soil were tested for each treatment. The results showed that ① all TiO2NPs addition significantly reduced soil pH and total organic carbon (TOC) (p < 0.05). The treatments of A100, A250 and A1000 significantly reduced the content of soil nitrate (NO3--N) (p < 0.05). ② The treatments of A250 and A1000 significantly reduced the activity of catalase (p < 0.05). All TiO2NPs addition significantly promoted the activity of urease, but reduced the activity of dehydrogenase after seven days cultivation. With the prolonged period of cultivation, the inhibition of TiO2NPs on the activity of urease and dehydrogenase decreased gradually, which means that the negative effect of TiO2NPs on enzyme activity would fade with time. ③ Treatments with TiO2NPs addition did not significantly affect soil ammonization rate (p>0.05), while the treatments of A250 and A1000 significantly reduced soil nitrification rate and mineralization rate (p < 0.01). ④ Soil nitrogen mineralization rate positively correlated with soil pH, total phosphorus (TP) and NO3--N contents, but negatively correlated with the activity of catalase and urease. TiO2NPs addition changed the mineralization process of soil nitrogen by regulating the content of NO3--N in lakeshore marshes. This study provides a theoretical basis for the protection of lakeshore marshes and the assessment of TiO2NPs environmental risks.
Keywords: TiO2 nanoparticlesmarsh soilnitrogen mineralizationenzyme activity
1 引言(Introduction)氮素是湿地生态系统最重要的养分之一(Gao et al., 2008), 其传输过程会显著影响湿地生态系统的结构和功能(Yin et al., 2019).土壤中的氮素大部分以有机氮形式存在, 无机氮(主要为NH4+-N和NO3--N)仅占土壤全氮的1%左右(Li et al., 2013).而有机氮必须通过矿化作用转化为无机氮, 才能被植物吸收和利用(Fu et al., 2019).氮矿化速率可以反映土壤的供氮能力高低(单玉梅等, 2019).氮矿化过程不仅可以将植物难以利用的有机氮转化为易吸收的无机氮并调节植物生长, 而且土壤氮的硝化作用会进一步产生温室气体N2O, 进而影响全球气候(Mou et al., 2015).
二氧化钛纳米颗粒(TiO2NPs)因具有光催化和抗菌的特性, 在光催化剂、个人护理、废水处理和环境修复等领域有着广泛的应用(Du et al., 2018).TiO2NPs是产量世界排名前五的纳米材料(Gottschalk et al., 2015), 其中, 2015年中国TiO2产量为232.3万吨.土壤中的纳米颗粒浓度高于水和空气, 是纳米颗粒释放到环境中主要的汇(Gottschalk et al., 2015).中国长江、黄河和鸭绿江沉积物中TiO2的含量为3.1~5.9 mg · g-1, 而珠江三角洲沉积物中TiO2含量高达11.61 mg · g-1(Zhou et al., 2004).研究表明, TiO2含量达到0.05 mg · g-1就会影响土壤理化性质(Ye et al., 2018), 并通过影响土壤有机体进而影响不同营养水平的生态系统功能(Gardea-torresdey et al., 2014).2006年, TiO2NPs被国际癌症组织列为2B类致癌物质(IARC, 2006).随着TiO2NPs产量和应用的增加, 其环境释放量也会不断增加, 由此引起人们对TiO2NPs环境风险的广泛关注(Du et al., 2018).
湿地由于所处地势较低, 不可避免的成为TiO2NPs在自然环境中的一个汇, 并成为其在自然环境中迁移和转化的中转站之一(Nowack et al., 2007).TiO2NPs一旦进入湿地生态系统, 就会在湿地土壤中累积, 进而对土壤微生物产生毒性作用, 并抑制土壤酶活性.研究发现, TiO2NPs会抑制土壤微生物活性, 且浓度增大, 抑制作用越显著(Liu et al., 2014).TiO2NPs不仅能减少土壤微生物数量和多样性, 而且也会改变土壤细菌群落的组成(Yuan et al., 2011).同时, TiO2NPs会对土壤中脲酶、脱氢酶活性产生抑制作用(李琳慧, 2015).Du等(2011)研究发现, 0.09 mg · g-1 TiO2NPs能显著降低小麦土壤过氧化氢酶活性.湿地土壤氮转化过程是在土壤微生物和土壤酶驱动下进行的, TiO2NPs对参与土壤氮转化的微生物和酶活性均产生影响, 必然会影响湿地土壤氮的转化过程, 进而对湿地生态系统本身乃至全球环境产生深远影响.有研究报道, TiO2NPs会使土壤中铵态氮、硝态氮、微生物生物量氮含量降低(李琳慧, 2015), 高浓度暴露的TiO2NPs可显著抑制氨氧化作用和氨态氮消耗(刘美婷等, 2015).目前, 大部分研究主要关注TiO2NPs输入对水稻土壤、河流沉积物和人工湿地土壤的影响, 而鲜有对沼泽土壤影响的研究报道.
随着湿地科学的发展, 湖滨带研究成为当前国内外研究的重要内容(杨永兴, 2002).湖滨带是连接湖泊水域生态系统与陆地生态系统的一个功能过渡区, 也是湖泊的最后一道保护屏障, 驱动着湖泊生态系统的物质循环与能量流动, 具有削减氮磷、净化水质等重要的生态功能(吴昊平, 2018).TiO2NPs进入湖泊湿地前, 首先在湖滨带沼泽土壤中累积, 这会对土壤生物产生毒性效应, 影响土壤理化性质, 进而影响沼泽土壤氮转化过程.目前, 关于TiO2NPs对湖滨沼泽氮转化的影响及机制尚未不清楚.因此, 本研究选取云南高原湖滨带典型沼泽土壤为对象, 研究TiO2NPs对湖滨沼泽土壤理化性质、酶活性、氮矿化作用的影响, 探讨TiO2NPs对湖滨沼泽土壤氮矿化的影响及内在机制, 以期为湖滨湿地生态保护与修复提供理论基础.
2 材料与方法(Materials and methods)2.1 实验材料2.1.1 TiO2NPs本研究选取的TiO2NPs为锐钛矿(Anatase), 纯度为99.8%, 粒径为10~25 nm, 亲水, 购于阿拉丁试剂公司.为防止聚集, 将配好的溶液于超声波(200 V, 50 kHz)下超声30 min.
2.1.2 土壤2017年7月, 在纳帕海国际重要湿地(99°37′10.6″~99°40′20.0″E, 27°48′55.6″~27°54′28.0″N)内选择典型湖滨沼泽土.用直径5 cm的土壤钻取表层0~10 cm的土壤, 剔除土壤中可见的石块和动植物残体后, 土样用自封袋保存, 带回实验室经风干、均质化、研磨后过2 mm目筛, 用于室内培养实验.沼泽土中TiO2含量为7.02 mg · g-1.
2.2 实验室模拟实验称取100 g干土于500 mL灭菌瓶中, 在加入TiO2NPs溶液之前, 先用灭菌超纯水调节土壤含水量至田间持水量的40%, 盖上橡皮塞, 共45份, 随机分为3组, 每组15份, 并单独设置3个平行样, 然后放入恒温培养箱于25 ℃下黑暗、避光活化5 d, 结束后测定土壤的初始理化性质.为了防止TiO2NPs溶液聚集, 用磁力搅拌器将不同浓度的TiO2NPs溶液均匀加入瓶中, 使含水量至田间持水量的70%.将处理好的样品继续放入25 ℃恒温培养箱中黑暗、避光培养.用差重法定期补充水分.考虑到TiO2NPs的慢性毒性, 分别在培养第7、14、35 d进行取样, 一部分留存于2~4 ℃冰箱, 用于测定铵态氮(NH4+-N)、NO3--N含量及土壤脲酶、过氧化氢酶活性;另一部分风干存于自封袋中, 用于测定土壤pH值、总氮(TN)、总磷(TP)、TOC含量和脱氢酶活性.
2.3 指标测定2.3.1 含水率测定采用差重法计算含水率, 具体见公式(1).
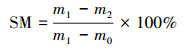 | (1) |
2.3.2 土壤pH值测定设置土水比为1 : 5, 采用土壤pH计(STARTER 300)测定土壤pH值.
2.3.3 TOC测定风干的土壤样品过2 mm筛后, 用盐酸溶液浸没, 烘干后的土壤样品进行包样, 采用总有机碳分析仪测定(德国元素Vario仪).
2.3.4 TN、TP测定称取0.1 g干土, 采用浓硫酸消煮, 之后用100 mL容量瓶定容, 慢性滤纸过滤取上清液, 使用连续流动分析仪(SKALAR San++, Sklar Co, Netherlands)测定.
2.3.5 NH4+-N、NO3--N测定称取5 g鲜土, 用1 mol · L-1的KCl溶液振荡浸提, 慢性滤纸过滤取上清液, 使用连续流动分析仪测定.
2.3.6 酶活性测定土壤脲酶测定:采用靛酚蓝比色法, 称取5 g鲜土, 加入实验试剂处理后, 在37 ℃恒温箱中培养24 h, 滤液用分光光度计于波长578 nm处比色.
土壤过氧化氢酶测定:采用高锰酸钾滴定法, 称取5 g鲜土, 加入实验试剂处理后, 放入0~4 ℃恒温培养箱, 然后加入到0.3%过氧化氢和0.5 mol · L-1 H2SO4中, 慢性滤纸过滤取上清液1 mL, 加入4 mL 0.5 mol · L-1 H2SO4, 用0.02 mol · L-1高锰酸钾溶液滴定至微红色.
土壤脱氢酶测定:采用TTC还原法测定, 称取5 g干土, 加入实验试剂处理后, 在30 ℃恒温箱中培养6 h, 滤液用分光光度计于波长485 nm处比色.
2.3.7 TiO2浓度测定使用ICP(电感耦合等离子体)发射光谱仪测定TiO2浓度.
2.4 指标计算氨化速率(Ra)、硝化速率(Rx)和矿化速率(Rk)的计算公式如下所示(解成杰等, 2013):
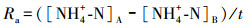 | (2) |
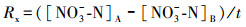 | (3) |
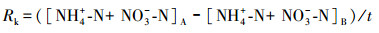 | (4) |
2.5 数据统计实验数据统计分析运用SPSS25软件, 时间、剂量对沼泽土壤酶活性及氨化速率、硝化速率、矿化速率的影响进行双因素方差分析(p < 0.05);不同处理间差异采用单因素方差分析检验(p < 0.05).运用Canoco5软件, 采用冗余分析法分析TiO2NPs处理下土壤环境因子与氮矿化的关系.图件制作采用Origin 8软件.
3 结果与分析(Results and analysis)3.1 沼泽土壤理化性质的变化TiO2NPs对沼泽土壤理化性质的影响见表 1.由表可知, 培养7 d, 土壤pH和TN含量均随TiO2NPs剂量的升高而降低(p < 0.05), 不同剂量TiO2NPs处理可显著降低土壤TOC含量(p < 0.01)和NO3--N含量(p < 0.05);培养14 d, 不同剂量TiO2NPs处理可显著降低土壤pH(p < 0.05);培养35 d, 土壤pH、NO3--N含量随TiO2NPs剂量的升高而降低(p < 0.05), 不同剂量TiO2NPs处理可显著降低土壤TOC含量(p < 0.01).
表 1(Table 1)
| 表 1 TiO2NPs处理对沼泽土壤理化性质的影响 Table 1 The effect of TiO2NPs addition on physical and chemical properties of marsh soil | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 TiO2NPs处理对沼泽土壤理化性质的影响 Table 1 The effect of TiO2NPs addition on physical and chemical properties of marsh soil
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
随着培养时间的延长, 与CK相比, A10、A100和A250处理显著降低了土壤pH(p < 0.01);A10、A100和A250处理显著降低了土壤TOC含量(p < 0.01);TN含量波动下降, 在A1000处理下受到显著影响(p < 0.01);TP含量除A1000处理外均呈先下降后上升的趋势, 在A250处理下受到显著影响(p < 0.05);NO3--N含量呈先下降后上升的趋势(p < 0.05), NH4+-N含量呈先下降后上升的趋势(p < 0.01).
3.2 沼泽土壤酶活性的变化培养7 d, 不同剂量TiO2NPs处理下脲酶活性显著高于CK(p < 0.05)(图 1b), A100、A250和A1000处理下脱氢酶活性显著低于CK(p < 0.05)(图 1c);培养14 d, A10和A100处理下过氧化氢酶活性显著高于CK(p < 0.05), 而A250和A1000处理下则显著低于CK(p < 0.05)(图 1a);培养35 d, A100、A250和A1000处理下过氧化氢酶活性显著低于CK(p < 0.01).
图 1(Fig. 1)
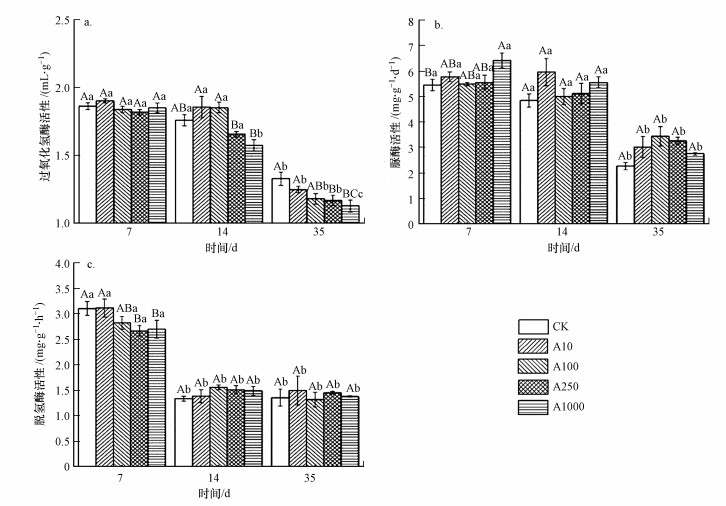 |
| 图 1 TiO2NPs处理对沼泽土壤过氧化氢酶活性(a)、脲酶活性(b)和脱氢酶活性(c)的影响 Fig. 1The effect of TiO2NPs addition on catalase activity(a), urease activity(b) and dehydrogenase activity(c) of marsh soil |
随着培养时间延长, 培养35 d时, 不同剂量TiO2NPs处理下过氧化氢酶、脲酶和脱氢酶活性都明显低于培养7 d和14 d时(p < 0.01);与CK相比, A250和A1000处理显著影响了过氧化氢酶活性(p < 0.01), A250和A1000处理在培养7 d时显著影响了脱氢酶和脲酶活性(p < 0.05).
双因素方差分析表明, TiO2NPs处理显著影响了过氧化氢酶活性(p < 0.05);随着培养时间延长会显著影响过氧化氢酶、脲酶和脱氢酶活性(p < 0.01);培养时间和TiO2NPs处理的交互作用则显著影响了脱氢酶活性(p < 0.01)(表 2).
表 2(Table 2)
| 表 2 培养时间和TiO2NPs剂量对沼泽土壤过氧化氢酶、脲酶和脱氢酶活性影响的双因素方差分析 Table 2 Two-factor variance analysis of the effect of incubation time and TiO2NPs concentration on dehydrogenase activity, urease activity and catalase activity of marsh soil | ||||||||||||||||||||||||||||||||||||||||
表 2 培养时间和TiO2NPs剂量对沼泽土壤过氧化氢酶、脲酶和脱氢酶活性影响的双因素方差分析 Table 2 Two-factor variance analysis of the effect of incubation time and TiO2NPs concentration on dehydrogenase activity, urease activity and catalase activity of marsh soil
| ||||||||||||||||||||||||||||||||||||||||
3.3 沼泽土壤氮矿化的变化不同剂量TiO2NPs处理对氨化速率没有显著影响.随着培养时间延长, 氨化速率呈先下降后上升的趋势(图 2a).
图 2(Fig. 2)
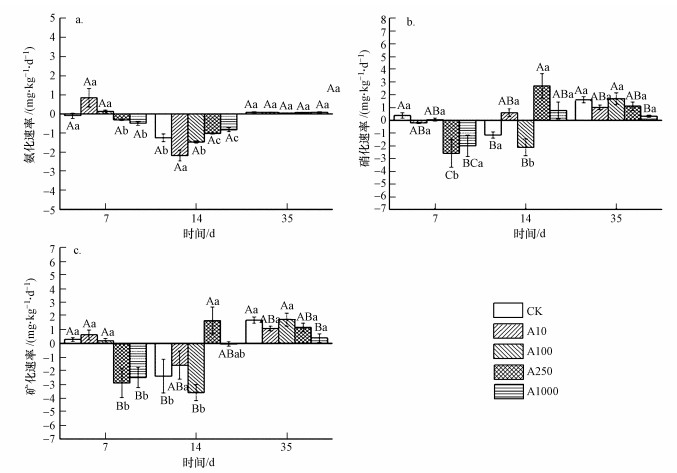 |
| 图 2 TiO2NPs处理对沼泽土壤氨化速率(a)、硝化速率(b)和矿化速率(c)的影响 Fig. 2The effect of TiO2NPs addition on ammoniation rate (a), nitrification rate (b) and mineralization rate (c) of marsh soil |
培养7 d, 随着TiO2NPs剂量的升高硝化速率显著下降(p < 0.05);培养14 d, A10、A250和A1000处理下的硝化速率均高于CK, 并达到显著性水平(p < 0.05);培养35 d, A10、A250和A1000处理下的硝化速率显著低于CK(p < 0.05).随着培养时间的延长, A10处理下的硝化速率上升, A100处理下的硝化速率先下降后上升, A250、A1000处理下的硝化速率先上升后下降(图 2b).
培养7 d, 与CK相比, 不同剂量TiO2NPs处理均显著降低了矿化速率(p < 0.05);培养14 d, A10、A250和A1000处理下的矿化速率高于CK(p < 0.05);培养35 d, A10、A250和A1000处理下的矿化速率显著低于CK(p < 0.05).随着培养时间延长, A10处理下的矿化速率先下降后上升, A250和A1000处理下的矿化速率先上升后下降, 除A100处理外, 其它处理均低于CK(图 2c).
双因素方差分析表明, TiO2NPs处理剂量显著影响了硝化速率和矿化速率(p < 0.05);随着培养时间延长, 显著影响了氨化速率和硝化速率(p < 0.01);培养时间和TiO2NPs处理的交互作用则显著影响了硝化速率和矿化速率(p < 0.01)(表 3).
表 3(Table 3)
| 表 3 培养时间和TiO2NPs处理对沼泽土壤氨化速率、硝化速率、矿化速率影响的双因素方差分析 Table 3 Two-factor variance analysis of the effect of incubation time and TiO2NPs concentration on ammoniation rate, nitrification rate and mineralization rate of marsh soil | ||||||||||||||||||||||||||||||||||||||||
表 3 培养时间和TiO2NPs处理对沼泽土壤氨化速率、硝化速率、矿化速率影响的双因素方差分析 Table 3 Two-factor variance analysis of the effect of incubation time and TiO2NPs concentration on ammoniation rate, nitrification rate and mineralization rate of marsh soil
| ||||||||||||||||||||||||||||||||||||||||
3.4 沼泽土壤环境与氮矿化关系分析环境因子与氮矿化相关关系见表 4, 硝化速率与pH、NO3--N呈显著正相关(p < 0.01), 与脱氢酶、脲酶、过氧化氢酶活性呈显著负相关(p < 0.01);氨化速率与TP、脱氢酶活性呈显著正相关(p < 0.05), 与NH4+-N呈显著正相关(p < 0.01), 与脲酶活性呈显著负相关(p < 0.05);矿化速率与pH呈显著正相关(p < 0.05), 与NO3--N呈显著正相关(p < 0.01), 与TP呈显著正相关(p < 0.05), 与脲酶、过氧化氢酶活性呈显著负相关(p < 0.01).
表 4(Table 4)
| 表 4 不同剂量TiO2NPs处理环境因子与沼泽土壤氮矿化的相关性分析 Table 4 Correlation analysis between environmental factors and nitrogen mineralization of marsh soil with TiO2NPs addition | ||||||||||||||||||||||||||||||||||||||||||||
表 4 不同剂量TiO2NPs处理环境因子与沼泽土壤氮矿化的相关性分析 Table 4 Correlation analysis between environmental factors and nitrogen mineralization of marsh soil with TiO2NPs addition
| ||||||||||||||||||||||||||||||||||||||||||||
同时通过冗余分析得出NO3--N对于矿化速率的贡献率最高, 为64.8%, 说明NO3--N显著影响了氮矿化(p < 0.01), 沼泽土壤氮矿化主要为硝化作用.此外, TP、pH、过氧化氢酶也显著影响了土壤氮矿化过程(p < 0.05)(图 3).
图 3(Fig. 3)
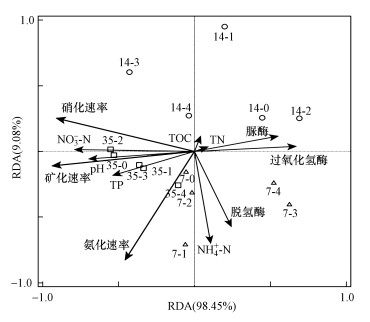 |
| 图 3 不同剂量TiO2NPs处理下环境因子与沼泽土壤氮矿化关系冗余分析 (图中数字7、14、35代表培养时间(d), 0、1、2、3、4代表不同剂量(0、10、100、250、1000 mg · kg-1)TiO2NPs处理) Fig. 3Redundancy analysis between environmental factors and nitrogen mineralization of marsh soil with TiO2NPs addition |
4 讨论(Discussion)4.1 TiO2NPs对沼泽土壤理化性质的影响机制本研究发现随着TiO2NPs剂量增加, pH值显著降低, 可能是由于TiO2NPs进入土壤后, 经过化学反应, 使土壤失去许多碱性物质, 从而显著降低土壤pH, 并且随剂量提高, 降低效果越明显.而Liu等(2014)研究发现, TiO2NPs处理引起土壤pH的增加, 可能是因为土壤呈弱酸性, TiO2NPs进入土壤后溶出金属离子Ti4+从而消耗土壤中的H+, 导致土壤pH值增大.而从培养时间上来看, pH值先降低后上升, 这可能是因为培养14 d后在脲酶作用下尿素水解过程中产生的NH4+会吸收土壤中的H+, 造成土壤pH值出现短暂的升高.同时, 回升后pH仍明显低于初始值, 这说明TiO2NPs对碱性土壤pH具有良好的调节作用.NO3--N不易被土壤颗粒吸附, 主要以溶质的形式存在于土壤溶液中, 极易被淋溶(Ma et al., 2010).本研究得出A100、A250、A1000处理显著抑制了NO3--N含量, 原因可能是相关微生物的活性受到了TiO2NPs抑制, 这与李琳慧(2015)研究TiO2NPs对土壤氮转化相关微生物和酶的影响所得出的结果一致.尿素先在脲酶作用下分解成NH4+-N, NH4+-N在硝化细菌作用下才会生成NO3--N, 这也很好地解释了NO3--N含量随培养时间的变化趋势.在其他研究中也提到了TiO2NPs处理会降低NH4+-N含量(李琳慧, 2015), 但在本研究中没有发现TiO2NPs处理会显著降低NH4+-N含量, 原因有二:一是经尿素产生的NH4+-N在微生物作用下很快地转化为NO3--N(李琳慧, 2015);二是NH4+具有酸性, 会与碱性土壤中和造成氮元素挥发(Ma et al., 2010).本研究中随着时间延长, NH4+-N含量先降低后上升, 可能是因为TiO2NPs在前期抑制氨化细菌的作用, 而后, TiO2NPs对脲酶活性和硝化细菌的抑制作用又减弱(李琳慧, 2015).TOC作为氮循环过程重要的底物来源, 在氮循环过程中具有重要的调控作用(Sosa et al., 2018).研究表明, 纳米材料可以产生具有很强化学活性的氧自由基和氢氧自由基, 这些自由基能与有机物反应, 使其降解成二氧化碳和水(尹勇, 2019).本研究中TOC含量随TiO2NPs剂量的升高而降低, 这是由于矿化的进行和自由基的产生消耗了TOC, 使得TOC含量下降, 这与尹勇(2019)的研究结果一致.
4.2 TiO2NPs对沼泽土壤酶活性影响机制土壤酶活性被认为是最能够反映土壤活力的指标之一(杨文彬等, 2015).金属氧化物纳米材料可以通过向土壤释放金属离子、改变土壤酶或其底物的空间结构和损伤生物体细胞的方式影响土壤酶活性(Asadishad et al., 2018).本研究中发现培养14 d, A250和A1000处理显著抑制了过氧化氢酶活性.研究发现, 盐碱土中高剂量(0.5 mg · g-1)的TiO2NPs会抑制过氧化氢酶活性(由婷婷, 2017), 0.09 mg · g-1的TiO2NPs能显著降低小麦土壤中过氧化氢酶活性(Du et al., 2011).原因可能是重金属与巯基发生反应, 形成金属硫化物等价物, 从而灭活或抑制酶的活性(Zhang et al., 2014).而尹勇(2019)研究发现TiO2NPs处理可显著增强土壤过氧化氢酶活性, 一方面可能是由于后期TiO2NPs处理激发了耐受微生物活性;另一方面, 一定的毒性可造成不耐受的菌种死亡, 这些死亡的细胞物质间接为其他菌种提供了营养, 从而出现过氧化氢酶活性增强的现象(胡谦, 2018).
脲酶作为胞外酶, 对于TiO2NPs处理敏感性很弱(Huang et al., 2005).本研究发现, 不同剂量TiO2NPs处理促进了土壤脲酶活性.这是因为土壤组分的吸附(如粘土和天然有机质)可以保护脲酶不与TiO2NPs发生更多的接触, 从而降低TiO2NPs的负面作用(Chen et al., 2015);也可能是因为土壤中TiO2NPs处理激发了土壤微生物活性, 导致土壤脲酶活性升高.然而, Du等(2011)发现壤质粘土中TiO2NPs处理对脲酶活性没有显著影响, Chai等(2015)提出1 mg · g-1 TiO2NPs处理能显著降低农业土壤脲酶的活性, 这可能与土壤类型和理化性质有关(Jo?ko et al., 2014).
本研究发现, 培养7 d脱氢酶活性随TiO2NPs剂量的增加显著降低, 而后没有显著性变化.这可能是因为短期内TiO2NPs处理会对土壤中微生物的活性及氧化能力造成影响, 减少有机质脱氢氧化反应, 从而抑制土壤脱氢酶活性(李琳慧, 2015), 而后抑制作用逐渐消失.随着培养时间的延长, TiO2NPs处理对脲酶和脱氢酶活性的抑制作用均表现为逐渐减弱, 说明TiO2NPs对沼泽土壤环境的负面效应会随着接触时间的延长而逐渐减弱, 这与前人研究结果相反(Zhang et al., 2014), 可能与沼泽土壤微生物代谢活性及土壤本身耐受能力、自我保护机制能够较快适应环境变化有关(Polacco et al., 2013).
4.3 TiO2NPs对沼泽土壤氮矿化影响机制本研究中不同剂量TiO2NPs处理对沼泽土壤氨化速率没有显著影响, 但对硝化和矿化速率的影响显著.从整个培养周期来看, TiO2NPs添加会抑制硝化速率和矿化速率, 尤其A250、A1000处理的抑制作用更明显.说明在本研究中TiO2NPs添加主要影响了硝化过程, 这可能是由于TiO2NPs对微生物的影响具有选择性, 只对部分微生物造成影响(李琳慧, 2015).尽管之前有研究提到TiO2NPs添加会影响氨化细菌, 降低氨化速率(孙影等, 2016), 但这与纳米材料的形状、大小以及在环境体系中的浓度都有关系(Asadishad et al., 2018), 具体还需要进一步研究.培养14 d, A250、A1000处理沼泽土壤的硝化速率和矿化速率高于CK, 可能是因为沼泽土壤微生物和相关酶在短期内适应了TiO2NPs添加的影响, 从而降低了TiO2NPs的负面作用, 这与之前的研究结论一致(Simonin et al., 2015).
湿地土壤矿化过程需要诸多因素参与, 而相关环境因子会直接或间接影响氮矿化过程.本研究发现TiO2NPs处理会降低土壤pH值, 抑制硝化作用和矿化作用的进行.这是因为自养硝化菌更适宜在碱性pH值范围内生长, 而有机质的溶性会随着土壤pH值的升高而提高, 从而提供大量富含碳和氮基质的物质以供微生物生长, 进而促进氮的硝化速率和矿化速率(Bai et al., 2010).Wang等(2018)的研究也证明土壤氮矿化速率和硝化速率均与土壤pH呈显著正相关.矿质氮含量是影响土壤氮矿化过程的重要因素, 土壤氮矿化过程能够产生大量的NH4+和OH-, 从而加速氮的氨化作用过程(Liu et al., 2004).本研究发现, 氨化速率与NH4+-N含量呈显著正相关, 而TiO2NPs处理对NH4+-N没有显著影响, 说明NH4+-N直接影响土壤的氨化速率.本研究还发现, 硝化速率、矿化速率与NO3--N呈显著正相关, 说明TiO2NPs添加会影响NO3--N含量进而影响硝化速率和矿化速率.有研究指出, NO3--N含量增加的程度越明显, 表明氮沉降对该区土壤硝化有促进作用(张树兰等, 2002), 而Bai等(2011)也提到NO3--N含量增加对氮矿化有显著的促进作用, 这与本研究一致.本研究中氨化速率和矿化速率与TP含量呈显著正相关, 这是因为磷作为营养元素, 可通过影响微生物量碳氮的活性、土壤酶的活性(Yang et al., 2013)及无机氮含量的变化, 从而影响土壤氨化速率和矿化速率(马红亮等, 2014);也可能由于磷输入为土壤微生物提供了一定的能源, 导致土壤微生物活性增强, 从而加速了土壤矿化过程(李辉信等, 2001).
土壤酶活性对土壤氮矿化的影响与土壤理化性质和微生物有关(张书亭, 2017).研究发现, 酶活性对土壤氮矿化的影响与微生物有关(Gao et al., 2017);另外, 也可能受到土壤理化性质的影响, 高盐、偏碱及电导率过高的土壤会抑制微生物活性, 从而影响土壤中的物质循环过程(张书亭, 2017).本研究中土壤氮矿化速率与土壤酶活性之间呈显著负相关, 但也有研究提到脲酶活性与氮矿化速率呈显著正相关(王学霞等, 2018), 这可能是由于土壤环境差异所致.本文没有对微生物进行分析, 具体还需要进一步探讨.
5 结论(Conclusions)1) 不同剂量TiO2NPs处理会直接或间接地对沼泽土壤氮矿化产生影响.研究发现, 不同剂量TiO2NPs处理会显著降低土壤pH和TOC含量(p < 0.05), A100、A250、A1000处理会显著降低NO3--N含量(p < 0.05).A250、A1000处理会显著抑制过氧化氢酶活性(p < 0.05), 培养7 d, 不同剂量TiO2NPs处理会显著促进脲酶活性而抑制脱氢酶活性(p < 0.05);随培养时间延长, TiO2NPs处理对脲酶和脱氢酶活性的抑制作用逐渐减弱, TiO2NPs对沼泽土壤环境的负面效应会随时间的延长而逐渐减弱, 培养时间和TiO2NPs处理的交互作用则显著影响了脱氢酶活性(p < 0.05).
2) 不同剂量TiO2NPs处理对氨化速率没有显著影响(p>0.05), A250、A1000处理显著抑制了土壤硝化速率和矿化速率(p < 0.05);培养时间和TiO2NPs处理的交互作用则显著影响了硝化速率和矿化速率(p < 0.01).
3) 土壤氮矿化与土壤pH、TP、NO3--N含量呈显著正相关, 与脲酶、过氧化氢酶活性呈显著负相关.NO3--N是影响氮矿化的主要因子, 硝化作用是氮矿化的主要过程.环境因子的变化在调控沼泽生态系统功能中具有重要的作用, 随着越来越多TiO2NPs的使用, 沼泽土壤理化性质和酶活性会受到显著影响, 从而改变土壤氮的矿化过程和沼泽土壤的生产力, 进而影响沼泽生态系统的结构和功能.
参考文献
| Asadishad B, Chahal S, Akbari A, et al. 2018. Amendment of agricultural soil with metal nanoparticles:effects on soil enzyme activity and microbial community composition[J]. Environmental Science & Technology, 52(4): 1908-1918. |
| Bai J B, Xu X L, Fu G, et al. 2011. Effects of temperature and nitrogen input on nitrogen mineralization in alpine soils on Tibetan Plateau[J]. Journal of Anhui Agricultural Sciences, 12(12): 1909-1912. |
| Bai J H, Gao H F, Wei D, et al. 2010. Nitrification potential of marsh soils from two natural saline-alkaline wetlands[J]. Biology & Fertility of Soils, 46(5): 525-529. |
| Chai H K, Yao J, Sun J J, et al. 2015. The effect of metal oxide nanoparticles on functional bacteria and metabolic profiles in agricultural soil[J]. Bulletin of Environmental Contamination & Toxicology, 94(4): 490-495. |
| Chen X, Cheng P, Sun L J, et al. 2015. Distinctive effects of TiO2 and CuO nanoparticles on soil microbes and their community structures in flooded paddy soil[J]. Soil Biology & Biochemistry, 86: 24-33. |
| Du J J, Zhang Y Y, Guo W, et al. 2018. Chronic impacts of TiO2 nanoparticles on populus nigra L.leaf decomposition in freshwater ecosystem[J]. Journal of Hazardous Materials, 350: 121-127. |
| Du W C, Sun Y Y, Ji R, et al. 2011. TiO2 and ZnO nanoparticles negatively affect wheat growth and soil enzyme activities in agricultural soil[J]. J Environ Monit, 13(4): 822-828. |
| Fu Q, Yan J W, Li H, et al. 2019. Effects of biochar amendment on nitrogen mineralization in black soil with different moisture contents under freeze-thaw cycles[J]. Geoderma, 353: 459-467. |
| Gao H F, Bai J H, Deng X Y, et al. 2017. Short-term effects of tidal flooding on soil nitrogen mineralization in a Chinese tidal salt marsh[J]. Physics & Chemistry of the Earth, 103: 3-10. |
| Gao J Q, Ouyang H, Zhang F, et al. 2008. The response of soil nitrogen mineralization to soil temperature and soil moisture in Zoige Alpine wetland[J]. Wetland Science, 6(2): 229-234. |
| Gardea-torresdey J L, Rico C M, White J C. 2014. Trophic transfer, transformation, and impact of engineered nanomaterials in terrestrial environments[J]. Environmental Science & Technology, 48(5): 2526-2540. |
| Gottschalk F, Lassen C, Kjoelholt J, et al. 2015. Modeling flows and concentrations of nine engineered nanomaterials in the Danish environment[J]. Int J Environ Res Public Health, 12(5): 5581-5602. |
| 胡谦.2018.三种典型纳米颗粒对土壤微生物及酶活性的对比研究[D].南京: 东南大学 http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=1019821434.nh |
| Huang P M, Wang M K, Chiu C Y. 2005. Soil mineral-organic matter-microbe interactions:impacts on biogeochemical processes and biodiversity in soils[J]. Pedobiologia, 49(6): 609-635. |
| Jo?ko I, Oleszczuk P, Futa B. 2014. The effect of inorganic nanoparticles (ZnO, Cr2O3, CuO and Ni) and their bulk counterparts on enzyme activities in different soils[J]. Geoderma, 232. |
| 李辉信, 胡锋, 郭和生, 等. 2001. 添加碳源、磷和石灰对红壤氮素矿化和硝化作用的影响[J]. 土壤, 33(3): 135-137. |
| 李琳慧.2015.纳米TiO2对土壤氮转化相关微生物和酶的影响[D].长春: 吉林大学 |
| Li Y L, Chen J, Cui D, et al.2013.Effects of warming on soil nitrogen mineralization under different soil moisture Conditions in the horqin sandy grassland[J].33(6): 1775-1781 |
| 刘美婷, 余冉, 陈良辉, 等. 2015. 典型纳米金属氧化物对氨氧化菌Nitrosomonas Europaea的生物胁迫影响[J]. 中国环境科学, 35(1): 190-195. |
| Liu Q M, Wu E Z, Zhu Y Z, et al. 2014. Effect of nano-TiO2 on red soil microbial activity[J]. Ecology and Environmental Sciences, 5: 859-863. |
| Liu Z K, Ping W S, Guo H J, et al. 2004. Nitrogen turnover from grazing livestock excreta:A review[J]. Acta Ecologica Sinica, 24(4): 775-783. |
| Ma B L, Wu T Y, Tremblay N, et al. 2010. Nitrous oxide fluxes from corn fields:on-farm assessment of the amount and timing of nitrogen fertilizer[J]. Global Change Biology, 16(1): 156-170. |
| 马红亮, 高人, 王杰, 等. 2014. 添加硝态氮对红壤净氨化和净矿化速率的影响[J]. 土壤通报, 45(4): 913-918. |
| Mou X J, Sun Z G, Liu X T. 2015. Net nitrogen mineralization and nitrification in the tidal marsh soils of the Yellow River Estuary[J]. China Environmental Science, 35(5): 1466-1473. |
| Nowack B, Bucheli T D. 2007. Occurrence, behavior and effects of nanoparticles in the environment[J]. Environmental Pollution, 150: 5-22. |
| Polacco J C, Mazzafera P, Tezotto T. 2013. Opinion-Nickel and urease in plants:still many knowledge gaps[J]. Plant Science, 199-200: 79-90. |
| 单玉梅, 温超, 常虹, 等. 2019. 不同放牧强度下荒漠草原土壤氮矿化季节性动态研究[J]. 生态环境学报, 28(4): 85-93. |
| Simonin M, Richaume A. 2015. Impact of engineered nanoparticles on the activity, abundance, and diversity of soil microbial communities:a review[J]. Environmental Science & Pollution Research, 22(18): 13710-13723. |
| Sosa L L D, Glanville H C, Marshall M R, et al. 2018. Spatial zoning of microbial functions and plant-soil nitrogen dynamics across a riparian area in an extensively grazed livestock system[J]. Soil Biology & Biochemistry, 120: 153-164. |
| 孙影, 李琳慧, 郭平. 2016. 纳米TiO2对土壤中氮转化相关细菌活性的影响[J]. 科学技术与工程, 16(20): 295-300. |
| Wang X, Guo X L, Zheng R B, et al. 2018. Effects of grazing on nitrogen transformation in swamp meadow wetland soils in Napahai of Northwest Yunnan[J]. Acta Ecologica Sinica, 38(7): 2308-2314. |
| 王学霞, 董世魁, 高清竹, 等. 2018. 青藏高原退化高寒草地土壤氮矿化特征以及影响因素研究[J]. 草业学报, 27(6): 1-9. |
| 吴昊平.2018.湖滨带修复对反硝化脱氮的影响机理及强化技术研究[D].武汉: 中国科学院大学(中国科学院武汉植物园) http://cdmd.cnki.com.cn/Article/CDMD-80108-1019023926.htm |
| 解成杰, 郭雪莲, 余磊朝, 等. 2013. 滇西北高原纳帕海湿地土壤氮矿化特征[J]. 生态学报, 33(24): 7782-7787. |
| Yang M F, Zhu L Q, Han X Z, et al. 2013. Effects of tillage and crop residues incorporation on soil nutrient, microbial biomass and enzyme activity under rice-wheat rotation[J]. Journal of Soil and Water Conservation, 45(3): 461-464. |
| 杨文彬, 耿玉清, 王冬梅. 2015. 漓江水陆交错带不同植被类型的土壤酶活性[J]. 生态学报, 35(14): 4604-4612. |
| 杨永兴. 2002. 国际湿地科学研究进展和中国湿地科学研究优先领域与展望[J]. 地球科学进展, 17(4): 508-514. |
| Ye X Y, Zhang W, Long J H, et al. 2018. Impact of engineered nanoperticles on Cd chemical speciation and bioavailability in paddy soil[J]. Chinese Journal of Environmental Engineering, 12(12): 3426-3432. |
| Yin S, Bai J H, Wen X J, et al. 2019. Effects of polycyclic aromatic hydrocarbon(phenanthrene)addition on soil nitrogen mineralization processes in rural and urban river wetlands of the Pearl River Estuary, China[J]. Journal of Agro-Environment Science, 38(3): 600-608. |
| 尹勇.2019.三种金属氧化物纳米材料对水稻幼苗生长及根际微生物群落结构的影响[D].桂林: 广西师范大学 |
| 由婷婷.2017.四种金属氧化物纳米材料对两种土壤酶活和细菌群落的影响[D].长春: 东北师范大学 http://cdmd.cnki.com.cn/Article/CDMD-10200-1017138574.htm |
| Yuan G, Schimel J P, Holden P A. 2011. Evidence for negative effects of TiO2 and ZnO nanoparticles on soil bacterial communities[J]. Environmental Science & Technology, 45(4): 1659-1664. |
| Zhang H M, Cao J, Tang B P, et al. 2014. Effect of TiO2 nanoparticles on the structure and activity of catalase[J]. Chem Biol Interact, 219(1): 168-174. |
| 张树兰, 杨学云, 吕殿青, 等. 2002. 温度、水分及不同氮源对土壤硝化作用的影响[J]. 生态学报, 22(12): 2147-2153. |
| 张书亭.2017.柽柳肥岛效应对土壤氮矿化及硝化速率的影响[D].兰州: 兰州大学 http://cdmd.cnki.com.cn/Article/CDMD-10730-1017715454.htm |
| Zhou H Y, Peng X T, Pan J M. 2004. Distribution, source and enrichment of some chemical elements in sediments of the Pearl River Estuary, China[J]. Continental Shelf Research, 24(16): 1857-1875. |
