 , 黄红林2
, 黄红林2
 , 吕丽丽2,3, 郭彬2,3, 温蓓2,3, 可欣1
, 吕丽丽2,3, 郭彬2,3, 温蓓2,3, 可欣1

1. 沈阳航空航天大学能源与环境学院, 沈阳 110136;
2. 中国科学院生态环境研究中心, 环境化学与生态毒理学国家重点实验室, 北京 100085;
3. 中国科学院大学, 北京 100049
收稿日期: 2019-11-15; 修回日期: 2019-12-14; 录用日期: 2019-12-14
基金项目: 国家自然科学基金(No.21876187,21577155,21537005,41877479)
作者简介: 李浩楠(1995-), 男, E-mail:lhn950216@163.com
通讯作者(责任作者): 黄红林, E-mail:hlhuang@rcees.ac.cn
可欣, E-mail:kex@iae.ac.cn
摘要:采用温室土培实验,研究了土壤中新型溴代阻燃剂十溴二苯乙烷(DBDPE)在不同种属植物中的吸收和传输特征,以及植物脂的影响作用;进一步应用计算模拟的手段解析了植物载脂蛋白与DBDPE的分子间相互作用,以阐明DBDPE的植物吸收传输的微观机制.结果表明,在玉米、小麦和黄瓜3种植物的根和地上部均检测到了DBDPE,根中DBDPE的含量高出地上部1~2个数量级.植物中累积的DBDPE量随时间的变化存在明显的生长稀释效应(p < 0.05).DBDPE的根吸收和茎向传输表现出植物种属间的显著差异(p < 0.05),根富集因子(RCF)顺序为黄瓜(0.30~0.57)>小麦(0.10~0.39)>玉米(0.03~0.26),而传输系数(TF)为小麦(0.17~0.20)>玉米(0.16~0.19)>黄瓜(0.04~0.07).DBDPE的根吸收量及RCF值与植物根脂含量成显著正相关关系(r=0.94,p < 0.01;r=0.98,p < 0.01);其地上部累积量及TF值与植物地上部脂含量显著正相关(r=0.77,p < 0.05;r=0.94,p < 0.05),但与植物根脂含量呈显著负相关关系(r=-0.74,p < 0.05;r=-0.76,p < 0.05),说明脂是控制植物吸收和传输DBDPE的重要组分.分子对接的结果显示,DBDPE能键合进入3种植物载脂蛋白的活性区域并与载脂蛋白特异性的活性位点作用,且DBDPE与载脂蛋白的结合方式及结合能力存在植物种属的显著差异,两者的结合强弱与根吸收DBDPE能力的顺序一致,印证了实验结果.本研究有助于理解植物中DBDPE的吸收传输特征及机制,可为深入认识DBDPE的陆生生态环境行为提供重要依据.
关键词:十溴二苯乙烷(DBDPE)植物吸收传输机制
Plant uptake and translocation of DBDPE in soil and the micro-mechanisms
LI Haonan1
 , HUANG Honglin2
, HUANG Honglin2
 , Lü Lili2,3, GUO Bin2,3, WEN Bei2,3, KE Xin1
, Lü Lili2,3, GUO Bin2,3, WEN Bei2,3, KE Xin1

1. College of Energy and Environment, Shenyang Aerospace University, Shenyang 110136;
2. State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085;
3. University of Chinese Academy of Sciences, Beijing 100049
Received 15 November 2019; received in revised from 14 December 2019; accepted 14 December 2019
Abstract: Plant uptake and translocation of decabromodiphenyl ethane (DBDPE), one of the novel brominated flame retardants, in the soil were investigated in a greenhouse study. Effects of lipids on DBDPE accumulation in plants were evaluated. In order to clarify the micro-mechanisms, molecular interactions of DBDPE with plant lipid transfer proteins (LTPs) were further characterized by the method of computer simulation. The results showed that accumulation of DBDPE were observed in both the roots and the aboveground parts of all the three plant species examined, namely maize, wheat and cucumber. Concentrations of DBDPE in roots were 1~2 orders of magnitude higher than those in the aboveground parts of plants. Plant growth dilution had a significant effect (p < 0.05) on the time-dependent accumulation of DBDPE in plant tissues. Root concentration factors (RCFs) for DBDPE were followed the order of cucumber (0.30~0.57) > wheat (0.10~0.39) > maize (0.03~0.26); whereas the translocation factors (TFs) were wheat (0.17~0.20) > maize (0.16~0.19) > cucumber (0.04~0.07). Root uptake of DBDPE and its RCFs were positively correlated with root lipid content (r=0.94, p < 0.01;r=0.98, p < 0.01). Concentrations of DBDPE in the aboveground parts of plants and its TFs were positively correlated with the lipid contents in the aboveground parts(r=0.77, p < 0.05;r=0.94, p < 0.05), but were inversely related to root lipid contents(r=-0.74, p < 0.05;r=-0.76, p < 0.05). Lipid was thus evidenced to be an essential component that controlled the uptake and translocation of DBDPE in plants. Molecular docking results showed that DBDPE could be docked into the active cavities of three plant LTPs and bound to their specific residues in the active sites. In addition, binding modes and binding affinities of LTPs to DBDPE were significantly difference among three plant species, and the binding abilities of LTPs were consistent with the root uptake of DBDPE in plants, which confirmed the experimental results. This study is beneficial to understand the characteristics and mechanisms of DBDPE uptaken and translocated by plants, and will provide vital basis on the in-depth exploration of the behaviors of DBDPE in the terrestrial eco-environment.
Keywords: DBDPEplantuptaketranslocationmechanisms
1 引言(Introduction)十溴二苯乙烷(Decabromodiphenyl ethane, DBDPE)为添加型新型溴代阻燃剂, 因其优良的热稳定性而被广泛应用于高聚物合成材料、纺织、电器、电线电缆等领域(Kierkegaard et al., 2009;Hardy et al., 2012;Li et al., 2017).随着多溴联苯醚(PBDEs)、六溴环十二烷(HBCD)等传统溴代阻燃剂的禁止生产和限制使用, 人们对DBDPE等新型溴代阻燃剂的需求日益剧增(Hoh et al., 2005;张长等, 2011;Li et al., 2017).目前, DBDPE已在大气(Hoh et al., 2005)、土壤(Li et al., 2016)、沉积物(Zhang et al., 2019)、水体(Ricklund et al., 2010)、生物体(何明靖等, 2017;余乐洹等, 2018;Jia et al., 2019)及灰尘(Newton et al., 2015)中被广泛检出.研究表明, DBDPE具有与传统溴代阻燃剂相似的生物蓄积性和毒性特征(韩倩等, 2016;Wang et al., 2019), 其对环境和人类健康造成的影响和危害越来越引起科学界的关注(Zhang et al., 2019).
土壤是有机污染物在陆生环境中主要的汇.近年来, 研究人员围绕农田、森林、化工厂周围及电子垃圾处置地土壤中DBDPE的污染状况和分布特征展开了详尽的调查(McGrath et al., 2018;Dreyer et al., 2019), 发现世界各地土壤均有DBDPE检出, 且其污染程度日趋严重.例如, 印尼苏腊巴亚地区的乡村和农田土壤DBDPE含量分别为3.4和0.16 ng·g-1干重(Ilyas et al., 2011);墨尔本电子垃圾处理厂土壤中DBDPE的含量高达37000 ng·g-1干重(McGrath et al., 2018).我国是商品化DBDPE的主要生产国, 2006—2012年产量约占全球总产量一半之多, 随之我国土壤DBDPE的污染问题也尤为突出.在山东、京津地区土壤中的DBDPE含量分别达到0.06~1612、0.03~173 ng·g-1干重(Covaci et al., 2011;Lin et al, 2015), 而珠江三角洲区域部分土壤中DBDPE的含量水平为22.4~362 ng·g-1, 甚至高于它所取代的BDE-209含量(1.35~161 ng·g-1)(Chen et al., 2013).
植物吸收是土壤有机污染物进入食物网的首要步骤(Limmer et al., 2014).有机污染物的植物吸收和传输过程与多种因素有关.研究表明, 土壤中有机污染的物植物吸收传输不仅存在显著的种间差异(White, 2002;Mattina et al., 2003), 而且还受到植物组成的影响(White et al., 2003).植物体的脂肪、碳水化合物、蛋白质、纤维素等成分与有机污染物的亲和力不同, 导致具有不同组成的植物体对有机污染物的吸收传输行为不同.有机污染物因其疏水性更易于富集到植物脂肪中, 植物脂对植物吸收疏水性有机污染物起关键作用.例如, 有关土壤中六氯苯(White et al., 2003)、菲(Gao et al., 2003)、PCDD/Fs(Zhang et al., 2009)等持久性有机污染物的植物吸收研究均得到了根富集因子与根脂含量显著正相关的结论.除脂含量外, 载脂蛋白为植物中广泛存在的蛋白家族, 具有多种生物学功能, 能够提供脂质结合的关键位点, 对疏水性有机污染物运送起到重要的载体的角色(Kader, 1996).高等植物中载脂蛋白含有多种基因型, 这对参与运输亲脂性分子的载脂蛋白的纯化和表征造成了障碍, 并对植物载脂蛋白参与外源有机化合物传输的实验研究带来很高的技术挑战(Sánchez et al., 2003).近年来, 计算模拟研究生物大分子与有机小分子相互作用的方法越来越流行, 利用同源建模结合分子对接研究载脂蛋白与有机污染物的分子间相互作用, 可以很好地解释有机污染物的植物吸收传输的微观机制(Wan et al., 2017)
已有很多研究证实土壤中的传统溴代阻燃剂(如PBDEs)能够被植物吸收, 并有****对其吸收传输机制进行了探究(Wang et al., 2011; Xu et al., 2016).目前, 已有植物通过大气吸收累积新型溴代阻燃剂DBDPE的研究报道(Salamova et al., 2013), 但对土壤中DBDPE在植物体内的吸收传输过程还缺乏了解, 且有关植物富集的种间差异的机理也不清楚.玉米、黄瓜、小麦常用作持久性有机污染物植物吸收的模式植物(Huang et al., 2010;Navarro et al., 2017), 三者组成各异.基于以上背景, 本文以这3种植物为对象, 研究不同种属的植物对土壤中DBDPE的吸收传输特征及植物脂的影响作用, 进一步采用计算模拟的手段研究植物载脂蛋白与DBDPE的分子间相互作用, 以阐明DBDPE的植物吸收传输的微观机制.本研究对于认识DBDPE在陆生生态环境的行为, 评价其生态风险及对食物链的潜在暴露风险都具有重要的意义.
2 材料与方法(Materials and methods)2.1 实验试剂DBDPE、BDE-209和BDE-77等标准溶液购自Wellington Laboratories (Canada);商品化DBDPE购自Tokyo Chemical Industry(TCI公司, 日本).样品的提取和净化使用优级纯的正己烷、三氯甲烷、二氯甲烷和丙酮.无水Na2SO4和硅胶(100~200目)用正己烷淋洗后在马弗炉中150 ℃活化12 h, 于干燥器中密闭保存.
2.2 盆栽实验实验所用土壤采自北京市东升八家郊野公园实验田表层的棕壤, 将土壤自然风干后磨碎, 过2 mm尼龙筛.土壤基本性质如下:pH=7.75, 土壤有机质4.27%, 阳离子交换容量24 cmol·kg-1.先向土壤中施入N、P、K基肥及其它微量元素, 然后依据野外调查实际污染土壤中DBDPE的含量范围人为添加商品化的DBDPE到土壤中.即用体积比为5:3:2的甲苯、四氢呋喃和丙酮混合溶液溶解一定量的DBDPE, 加入到1/4的实验所需土壤中, 污染土壤置于通风橱内3 d风干至有机溶剂完全挥发, 再逐级将其拌入全部实验土壤, 充分搅匀, 平衡2周后进行盆栽实验.种植植物前测定土壤中DBDPE的初始含量为(4982.4±60.6) ng·g-1, 每盆装入450 g土壤, 表面覆盖高度为0.5~1.0 cm的灭菌空白土壤, 以减少DBDPE的光降解和挥发.
以玉米(Zea mays L. cv., 郑单958)、黄瓜(Cucumis sativus L., 翠玉)和小麦(Triticum aestivum L., 郑麦366)为实验植物.种子购自中国农业科学院, 用3%双氧水表面灭菌处理15 min后, 去离子水彻底清洗, 浸泡于超纯水中并置于暗处12 h;然后转移到湿润的滤纸上, 放在恒温培养箱中, 黑暗条件下催芽.挑选萌发一致的植物种子播种, 出苗3 d后间苗:玉米2株·盆-1、黄瓜3株·盆-1、小麦15株·盆-1.实验在控制环境的生长室中进行, 植物种植条件参照文献(Huang et al., 2010).同时设置未添加DBDPE的土壤种植植物作为空白处理.种植15、30和45 d后分别收获植物的地上部分和根, 并将土壤过筛后得到的根段合并到根样中.先用自来水仔细冲洗根样, 除去附着的土壤颗粒, 再用去离子水淋洗根样和地上部分, 拭干水份, 称其鲜重.植物样品经冷冻干燥48 h, 再称其干重, 并于冰箱中-20 ℃保存.
2.3 DBDPE的提取和净化及仪器分析植物样品中DBDPE的提取依据Zhang等(2019)的方法并稍作改进.以BDE-77作为回收率指示物, 13C-BDE-209作为内标加入到定量后的样品中.称取粉粹的植物样品2 g左右, 加入30 ng回收率指示物BDE-77, 与等质量的无水Na2SO4混匀后置于滤纸筒中, 用100 mL体积比为1:1的正己烷和丙酮混合溶液索氏提取24 h.冷却后取出, 用15 mL混合溶液分4次冲洗提取器并将其合并入提取液中, 再于37 ℃下旋转蒸发至约5 mL.采用内径为10 mm的自制复合硅胶柱净化(Li et al., 2016).净化柱用50 mL正己烷预淋洗, 洗脱液为体积比为1:1的正己烷和二氯甲烷混合溶液, 按30、20、20 mL分3次洗脱.37 ℃旋蒸至5 mL后氮吹至干, 正己烷精确定容至300 μL, 过0.22 μm有机相滤膜, 于-20 ℃下储存待测.
DBDPE的分离与检测采用气相色谱质谱联用仪(GC-MS, GC 7890 A, MS 5975 MSD, Agilent), 配备DB-5HT毛细管柱(15 m×0.25 mm×0.10 μm). GC进样口温度为290 ℃, 脉冲不分流进样, 进样量为2 μL. MS离子源温度为230 ℃, 气相色谱与质谱间的连接温度为280 ℃.柱温箱升温程序:初始温度115 ℃, 保持2 min;然后以18 ℃·min-1的速率升到315 ℃, 保持10 min.载气为高纯氦气, 流速为1.5 mL·min-1.质谱采用电子电离方式(EI源), 70 eV, 选择离子检测模式(SIM). DBDPE的定性离子m/z=971.2、809.4、484.6, 定量离子为m/z=484.6, BDE-77的定性离子选择m/z=485.8、378.9、325.9, 13C-BDE-209的定性离子选择m/z=969.5、811.7、733.7.
实验过程中质量保证包括回收率指示物的添加、方法空白、基质加标、每天空白溶剂和标准溶液的随机进样.样品的最低检出限LOD以3倍信噪比计算(n=6), 植物样品中DBDPE的检出限为0.2~2.7 μg·g-1.加标回收实验的结果表明, 在5 μg·L-1添加水平下, 植物样品中DBDPE的回收率为71.4%~96.2%.BDE-77和13C-BDE-209的回收率分别为76.3%~102.4%和87.6%~105.4%.空白植物中未检测到DBDPE, 所有样品均进行平行分析, 样品中化合物的含量通过回收率进行校正.
2.4 植物脂含量的测定植物脂含量的测定参照Zhu等(2001)的方法.称取约0.5 g植物干样, 加入100 mL体积比为2:1的氯仿和甲醇混合液, 索氏提取6 h.提取液旋转蒸发浓缩至5 mL左右, 氮气吹干, 脂类物质用20 mL氯仿连续萃取2次移出, 经No.5 Whatman滤纸除去沉淀物过滤到一个预先恒重的玻璃管中, 再冷干至恒重.两次质量的差值与样品质量的比值即为植物脂含量.植物地上部的提取液需用不对称氨丙基硅胶柱去除叶绿素, 其余步骤与上述相同.所有的脂分析都设有3个平行.
2.5 植物载脂蛋白与DBDPE的分子对接为进一步探索DBDPE植物吸收传输的机制, 采用同源建模和分子对接表征DBDPE与植物载脂蛋白的分子间相互作用.玉米和小麦的载脂蛋白的3-D结构(图 1a和1b)在Protein Data Bank(PDB)数据库中直接获得, 其编号分别为1MZL及1BWO;而黄瓜的载脂蛋白的3-D结构(图 1c)则需通过同源建模得到.从National Center for Biotechnology Information数据库(NCBI, http://www.ncbi.nlm.nih.gov)获取黄瓜非特异性载脂蛋白的基因序列(csnsLTP), 以蛋白Pru p3(PDB编号2ALG)为模板进行同源建模.构建的黄瓜非特异性载脂蛋白残基位于Ramachandran构象图核心位置, 且模板蛋白与目标蛋白的同源相似性为58.2%, 大于30%, 说明同源建模的结果合理, 可以用作理论计算(Nayeem et al., 2006).
图 1(Fig. 1)
 |
| 图 1 植物载脂蛋白的3-D结构图 (a.玉米, b.小麦, c.黄瓜) Fig. 13-D structures of plant lipid transfer protein (a.maize, b.wheat, c.cucumber) |
ChemDraw 11.0得到的DBDPE分子结构如图 2所示, 保存为mo12格式, 并用Autodock 4.2进行处理.计算模拟参考Li等(2013)的方法, 通过Autodock对DBDPE与植物组织大分子进行分子对接, 具体运算过程如下:利用Autogrid对蛋白进行点电荷计算、加氢、非极性氢合并, 以蛋白的活性位点为中心, 划分一个4 nm×4 nm×4 nm的方格区域, 每个格点之间的距离设为0.0375 nm, 进行多次运算并通过拉马克遗传算法(LGA)来计算蛋白与DBDPE分子结合的可能构象.蛋白质与配体分别设置为刚性结构和柔性可扭转结构.在对接过程中, 最多选取10个构象进行计算, 构象结合能的评估使用MOLDOCK权值算法, 最终筛选超出自由能最低的构象用作后续分析.
图 2(Fig. 2)
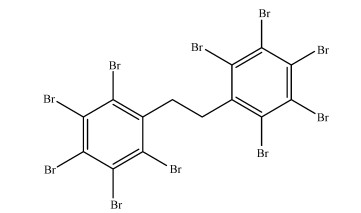 |
| 图 2 DBDPE的分子结构图 Fig. 2Structure of DBDPE |
2.6 数据分析数据采用Origin 8.0作图, 通过SPSS软件包(版本16.0)进行双因素方差分析(显著水平p < 0.05)来判定不同处理间植物中DBDPE含量、植物生物量、脂含量的差异显著性.
3 结果与讨论(Results and discussion)3.1 土壤中DBDPE的植物根系吸收根系吸收是植物累积土壤中持久性有机污染物的主要途径.由于DBDPE具有很高的辛醇-水分配系数(lgKow=11.1)(Covaci et al., 2011), 可能在土壤中具有较低的生物有效性, 而土壤中DBDPE是否可以被植物根吸收目前还不是很清楚.本研究中, 在黄瓜、玉米和小麦3种植物根中均检测到较高含量的DBDPE, 分别为1513.4~2841.6、161.0~1282.8、494.6~1971.7 ng·g-1, 说明植物可以从土壤中富集高疏水性的DBDPE, 这与Sun等(2019)的研究结果相似.植物根吸收DBDPE的量见图 3, 由图可知, 根中富集DBDPE的含量存在植物种属间的显著差异(p < 0.05).以植物种植45 d为例, 黄瓜、玉米和小麦根中DBDPE的含量分别为(1503.4 ± 94.5)、(161.0 ± 31.6)、(494.6 ± 24.7) ng·g-1, 即黄瓜根中DBDPE含量最高, 高出小麦根系中DBDPE含量2.04倍, 是玉米根中DBDPE含量的9.33倍.同时, 观测到3种植物根中累积的DBDPE含量随暴露时间的增加均明显减少.分析其原因可能是由于植物生长, 植物根系的生物量不断增加(表 1), 根富集DBDPE的含量存在植物生长稀释效应所致.其中, 由于玉米根系生物量增加的倍数最大(4.1倍), 故其根中富集的DPDPE的时间稀释效应最为显著.Trapp等(2007)和Jia等(2019)的研究也证实了生长稀释效应会影响有机污染物(如多环芳烃等)在植物中的累积含量.
图 3(Fig. 3)
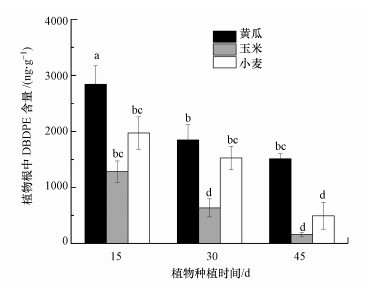 |
| 图 3 种植15、30、45 d后植物根中DBDPE的含量 (不同小写字母代表具有显著性差异, p < 0.05, 下同) Fig. 3Concentrations of DBDPE in roots after plant cultured for 15, 30 and 45 days (Different letters represent significant differences p < 0.05, the same below) |
表 1(Table 1)
| 表 1 3种植物地上部和根的干重 Table 1 Dry weight of aboveground parts and root of three species plants | |||||||||||||||||||||||||||||||||||||||||||||||||
表 1 3种植物地上部和根的干重 Table 1 Dry weight of aboveground parts and root of three species plants
| |||||||||||||||||||||||||||||||||||||||||||||||||
为了深入评估植物根对DBDPE的生物富集特性, 计算了DBDPE的根富集因子(RCF, Croot/Csoil)(表 2).如表 2所示, 黄瓜、玉米、小麦中DBDPE的RCF值分别为0.30~0.57、0.03~0.26、0.10~0.39.总体来说, 3种植物对DBDPE的根富集因子均小于1.类似地, 也有研究发现, 土壤中PBDEs等疏水性有机污染物的RCFs值也都小于1(Gonzailez et al., 2003).但与其他较低lgKow的有机污染物相比, 土壤中DPDPE的RCF值明显偏低, 如马铃薯对土壤中DDT的根富集因子为2.6(Gonzailez et al., 2003);苜蓿对土壤全氟化合物PFOA的RCF高达10.2(Wen et al., 2012).DBDPE的强疏水性导致其与土壤有机质存在强的吸附固定作用(Zhang et al., 2015), 因而难于从土壤中解析并为植物根吸收.再者DBDPE的分子量为971.2, 分子相对较大, 空间位阻相应较大(Yang et al., 2007), 从而限制了其在细胞膜的渗透, 其植物累积能力也低.3种植物中DBDPE的RCF值顺序为黄瓜>小麦>玉米, 再次说明不同植物根对DBDPE的富集能力有很大差异, 黄瓜对DBDPE的根吸收能力最强.目前许多研究表明有机污染物在植物体内富集存在种间差异, 但相关机理还很不清楚.根富集因子随暴露时间的增加而呈下降的趋势, 其可能受植物的生长稀释效应的影响;也有研究指出植物不同生长时间, 由于生命代谢活动强度不同导致吸收污染物的能力也不同(Wang et al., 2011). DBDPE的植物累积可能受稀释效应与污染物代谢的共同作用.
表 2(Table 2)
| 表 2 3种植物中DBDPE根富集因子(RCFs) Table 2 Root concentration factors (RCFs) of DBDPE in three species plants | |||||||||||||||||||
表 2 3种植物中DBDPE根富集因子(RCFs) Table 2 Root concentration factors (RCFs) of DBDPE in three species plants
| |||||||||||||||||||
3.2 DBDPE在植物体内的茎向传输植物地上部对有机污染物的富集包括污染物由根向地上部分的传输, 以及污染物的植物叶片的气态吸收两种途径(Schroll et al., 1994;Chiou et al., 2001).本研究中, 种植在无DBDPE污染土壤中的空白植物的地上部没有检测到DBDPE, 说明气态吸收途径对DBDPE在植物地上部分累积几乎无贡献.不同种植时间, 暴露在污染物土壤中的植物地上部累积的DBDPE含量见图 4.植物地上部均检测到了DBDPE, 说明存在DPDPE从植物根向地上部的传输, 并在植物地上部累积.在种植期间, 黄瓜、玉米、小麦地上部分DBDPE含量分别为62.5~201.1、106.5~236.6、102.0~350.2 ng·g-1, 均显著低于同一时间各自根系吸收的DBDPE含量.同时, 地上部DBDPE含量在3种植物间存在显著性差异(p < 0.05).
图 4(Fig. 4)
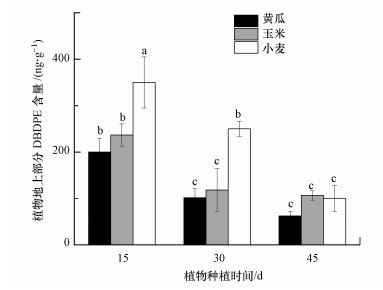 |
| 图 4 植物地上部分DBDPE含量 Fig. 4Concentrations of DBDPE in aboveground parts of plants |
为更准确地描述DBDPE在植物体内的传输能力, 计算DBDPE从植物根向地上部分的传输因子(TF), 即植物地上部DBDPE含量除以根中DBDPE含量(表 3).由表 3可知, 黄瓜、玉米和小麦中DBDPE的TF值分别为0.04~0.07、0.18~0.19、0.16~0.20, 相对一些全氟化合物、PBDEs同系物中的中等lgKow的单体来说, DBDPE的TF值偏小.例如, 在菠菜体内, 全氟化合物PFOS、PFPeA、PFOA从根部到茎叶部的TF值分别为3.82、1.08、1.63(Navarro et al., 2017);PBDEs(BDE-17、49、99、100、153、154、158)在玉米中的TF值为0.37~3.08(Wang et al., 2011).由此说明, DBDPE作为强疏水性的有机污染物, 其在植物体内的传输能力较弱.Sun等(2019)的研究结果也认为由于强疏水性、低水溶性, 植物中DBDPE传输所需时间更长, 污染物很难从植物根转运到地上部分.比较3种植物的传输系数(TF), 小麦和玉米分别为0.16~0.20和0.16~0.19, 均大于黄瓜(0.04~0.07), 即黄瓜中DBDPE的茎向传输最弱.此外, 种植30~45 d, 植物地上部生物量较前期(15 d)迅速增加(表 1), 植物生长稀释效应对植物地上部累积DBDPE含量和DBDPE的TF值的影响尤为显著.同时也不排除DBDPE可能在植物体内发生了转化, 导致母体化合物在植物体内累积减少.植物体中DBDPE的降解转化及代谢产物的鉴定需要进一步研究.
表 3(Table 3)
| 表 3 3种植物中DBDPE的传输因子(TF) Table 3 Translocation factors (TF) of DBDPE in three species of plants | |||||||||||||||||||
表 3 3种植物中DBDPE的传输因子(TF) Table 3 Translocation factors (TF) of DBDPE in three species of plants
| |||||||||||||||||||
3.3 植物脂对DBDPE生物累积的影响植物吸收累积疏水性有机污染物的能力与植物中脂含量密切相关(Schroll et al., 1994;Gao et al., 2003;Zhang et al., 2009).本研究测定了3种植物根和地上部分的脂肪含量(表 4), 结果表明, 植物根中脂含量为0.54%~12.3%, 地上部分脂含量为0.78%~11.3%.比较3种植物, 根中脂含量顺序为黄瓜(5.90%~12.3%)>小麦(2.74%~8.33%)>玉米(0.54%~4.53%), 地上部分脂含量则为小麦(2.90%~11.6%)>黄瓜(4.19%~7.16%)>玉米(0.74%~5.79%).脂含量越高越有利于疏水性有机污染物的跨膜吸收和转运.根中脂含量最高的黄瓜的根吸收DBDPE的含量高于小麦高于玉米, 而地上部脂含量高的小麦对DBDPE的茎向传输能力也较强.继而, 分析不同种植时间植物脂含量与植物累积DBDPE含量的相关关系发现, 植物根吸收DBDPE的含量(图 5a)及根富集因子(图 5b)与植物根脂含量成显著正相关关系(r=0.94, p < 0.01;r=0.98, p < 0.01);地上部DBDPE的含量(图 6a)及DBDPE的传输因子(图 6b)与植物地上部的脂含量也同样存在正相关性(r=0.77, p < 0.05;r=0.94, p < 0.05), 说明脂在植物累积土壤DBDPE中的重要作用.但DBDPE的传输因子与植物根脂含量成负相关关系(r=-0.76, p < 0.05)(图 6c).与高疏水性BDE-209相似(Huang et al., 2009), DBDPE具有很强的分配到根脂中的能力, 很难通过植物体内水分的蒸腾作用向上迁移, 根脂限制了其从根向地上部的传输.研究发现化合物的lgKow越大, 脂类物质在其吸收过程中所起的分配作用越强(Chiou et al., 2001).有关六氯苯(Schroll et al., 1994)、菲(Gao et al., 2003)、PCDD/Fs(Zhang et al., 2009)及PBDEs(Huang et al., 2010)的植物吸收研究也都得到了生物累积因子与脂含量显著正相关的结论.
表 4(Table 4)
| 表 4 黄瓜、玉米和小麦的根和地上部脂含量 Table 4 Lipid contents in the roots and aboveground parts of cucumber, maize and wheat | |||||||||||||||||||||||||||||||||||
表 4 黄瓜、玉米和小麦的根和地上部脂含量 Table 4 Lipid contents in the roots and aboveground parts of cucumber, maize and wheat
| |||||||||||||||||||||||||||||||||||
图 5(Fig. 5)
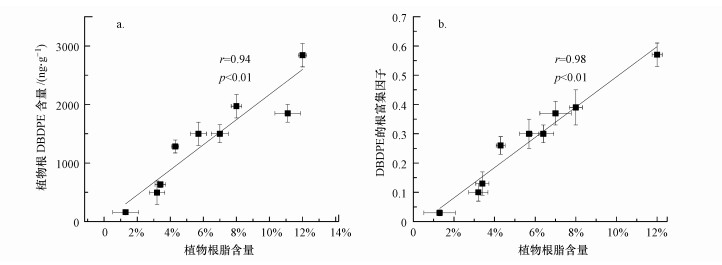 |
| 图 5 植物根富集DBDPE含量(a)及根富集因子(b)与植物根脂含量的相关性 Fig. 5Correlation between concentrations of DBDPE in plant roots (a), root concentration factors (b) and root lipid contents |
图 6(Fig. 6)
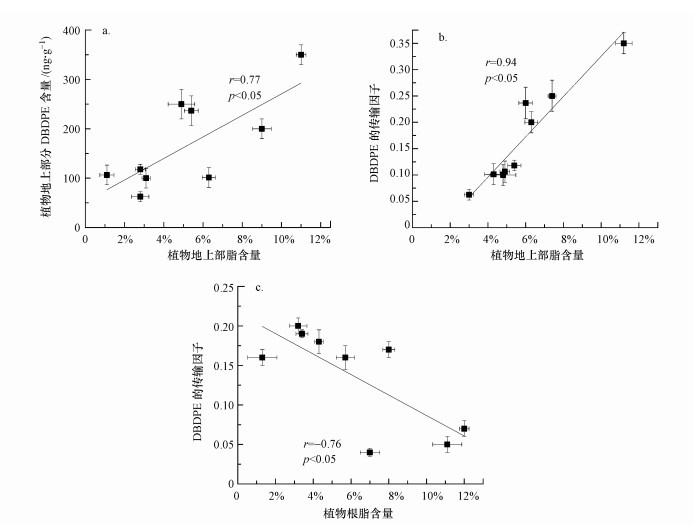 |
| 图 6 地上部富集DBDPE含量与植物地上部脂含量的相关性(a)及DBDPE的传输因子与地上部脂(b)和根脂(c)含量的相关性 Fig. 6Correlation between concentrations of DBDPE in plant aboveground parts and their lipid contents (a), and correlation between translocation factors of DBDPE and lipid contents in the aboveground parts (b) and roots (c) |
3.4 DBDPE与植物载脂蛋白的分子间相互作用载脂蛋白是有机污染物与植物结合的主要生物大分子之一, 其对有机污染物的植物吸收和传输的贡献也不容忽视.为进一步探索DBDPE植物吸收的分子机制, 本研究采用计算模拟表征了DBDPE与植物载脂蛋白的相互作用, 从分子间作用的角度解析植物吸收DBDPE的机制.分子对接的结果显示, DBDPE能键合进入3种植物载脂蛋白的活性区域并与载脂蛋白特异性的活性位点作用(图 7).由图可知, DBDPE与3种植物载脂蛋白结合的位置和形成的构型各不相同.分析DBDPE与植物载脂蛋白键合方式和特异性作用位点, 发现DBDPE均以静电疏水性作用和范德华力与植物载脂蛋白结合;黄瓜载脂蛋白与DBDPE相互作用的主要氨基酸残基为HIS35、ARG44、CYS48、LEU51、LYS52、ALA55;与玉米载脂蛋白作用的主要氨基酸残基为ILE11、CYS14、ILE15、ALA18、VAL33、ALA57;与小麦载脂蛋白作用的主要氨基酸残基为VAL39、CYS42、ILE43、LEU46、CYS78、LEU81.Wan等(2019)通过分子对接研究小麦载脂蛋白与几种OPEs的分子间相互作用, 发现不同的OPEs单体与载脂蛋白的作用位点各不相同, 且高疏水性的OPEs更易通过静电疏水性和范德华力的复合方式与植物载脂蛋白结合(Wan et al., 2017).本研究中DBDPE主要通过范德华力与植物载脂蛋白结合, 其中, 不同植物结合位点的差异和结合能力的强弱存在显著不同, 这也解释了DBDPE累积在植物种属间的差异.黄瓜、玉米、小麦3种植物载脂蛋白与DBDPE的结合能分别为-12.6、-4.84、-11.02 kcal·mol-1(表 5), 即DBDPE与植物载脂蛋白的结合强弱程度为黄瓜最强, 小麦次之, 玉米最弱, 两者的结合强弱与根吸收DBDPE能力的顺序一致, 印证了实验结果.目前, 利用各种理论模拟计算进行分子间相互作用的表征已经逐渐成为研究热点, 同源建模能够提供载脂蛋白等生物大分子的三维结构, 在此基础上利用分子对接方法可以预测外源性化合物与蛋白的相互作用位点并探究其作用机制, 本研究结果可为认识DBDPE植物累积行为的分子机制提供理论依据.
图 7(Fig. 7)
 |
| 图 7 DBDPE与植物载脂蛋白的分子对接(a)及相互作用位点(b) Fig. 7Molecular docking between DBDPE and plant lipid transfer proteins (LTPs) and binding active sites in plant LTPs interacted with DBDPE |
表 5(Table 5)
| 表 5 DBDPE与植物载脂蛋白的结合能及主要的作用氨基酸残基 Table 5 Binding affinities of plant LTPs to DBDPE and the main active amino acid residues of plant LTPs | ||||||||||||||||
表 5 DBDPE与植物载脂蛋白的结合能及主要的作用氨基酸残基 Table 5 Binding affinities of plant LTPs to DBDPE and the main active amino acid residues of plant LTPs
| ||||||||||||||||
4 结论(Conclusions)1) 黄瓜、玉米和小麦3种植物的根可以从土壤中吸收高疏水性的有机污染物DBDPE, 并存在DPDPE从植物根向地上部的传输;植物地上部分累积的DBDPE量均显著低于同一时间各自根系吸收的DBDPE量;生长稀释效应会影响植物吸收和传输DBDPE的量, 其中以对玉米累积DBDPE的影响最为明显;植物种属对DBDPE的吸收转运能力各不相同, 黄瓜根的吸收能力最大, 而传输能力则以小麦最强.
2) 植物脂对DBDPE的植物吸收与传输起着重要作用:植物根吸收DBDPE的含量及根富集因子与植物根脂含量成显著正相关关系;地上部累积含量及传输因子与植物地上部脂之间也显著正相关, 但DBDPE的传输因子与植物根脂含量成负相关关系.
3) DBDPE与3种植物载脂蛋白间结合部位和结合方式存在显著不同, 在一定程度上证明了DBDPE累积的植物种属的差异;载脂蛋白与DBDPE的结合为黄瓜最强, 小麦次之, 玉米最弱, 与植物根吸收DBDPE能力的顺序一致, 理论计算印证了实验结果, 从分子水平揭示了DBDPE的植物吸收和传输机制.
参考文献
| Chen S J, Feng A H, He M J, et al. 2013. Current levels and composition profiles of PBDEs and alternative flame retardants in surface sediments from the Pearl River Delta, southern China:Comparison with historical data[J]. Science of the Total Environment, 444: 205-211. |
| Chiou C, Sheng G Y, Manes M. 2001. A partition-limited model for the plant uptake of organic contaminants from soil and water[J]. Environmental Science & Technology, 35(7): 1437-1444. |
| Covaci A, Harrad S, Abdallah M A, et al. 2011. Novel brominated flame retardants:A review of their analysis, environmental fate and behaviour[J]. Environment International, 37(2): 532-556. |
| Dreyer A, Neugebauer F, Lohmann N, et al. 2019. Recent findings of halogenated flame retardants (HFR) in the German and Polar environment[J]. Environmental Pollution, 253: 850-863. |
| Gao Y Z, Zhu L Z. 2003. Phytoremediation and its models for organic contaminated soils[J]. Journal of Environmental Sciences, 15(3): 302-310. |
| Gonzailez M, Miglioranza B K S, Aizpún de Moreno J E, et al. 2003. Occurrence and distribution of organochlorine pesticides (OCPs) in tomato (Lycopersicon esculentum) crops from organic production[J]. Journal of Agricultural and Food Chemistry, 51: 1353-1359. |
| 韩倩, 张丽娟, 胡国成, 等. 2016. 十溴二苯乙烷对草鱼幼鱼肝脏和肌肉组织氧化应激效应的影响[J]. 生态毒理学报, 11(2): 680-686. |
| Hardy M, Krueger H, Blankinship A, et al. 2012. Studies and evaluation of the potential toxicity of decabromodiphenyl ethane to five aquatic and sediment organisms[J]. Ecotoxicology and Environmental Safety, 75: 73-79. |
| 何明靖, 杨婷, 李琦, 等. 2017. 卤系阻燃剂在东江鱼体中的生物富集[J]. 环境科学, 38(1): 383-388. |
| Hoh E, Zhu L H, Hites R A. 2005. Novel flame retardants, 1, 2-bis(2, 4, 6-tribromophenoxy)ethane and 2, 3, 4, 5, 6-pentabromoethylbenzene, in United States' environmental samples[J]. Environmental Science & Technology, 39: 2472-2477. |
| Huang H L, Zhang S Z, Christie P, et al. 2010. Behavior of decabromodiphenyl ether (BDE-209) in the soil-plant system:uptake, translocation, and metabolism in plants and dissipation in soil[J]. Environmental Science & Technology, 44(2): 663-667. |
| Ilyas M, Sudaryanto A, Setiawan I E, et al. 2011. Characterization of polychlorinated biphenyls and brominated flame retardants in sediments from riverine and coastal waters of Surabaya, Indonesia[J]. Marine Pollution Bulletin, 62: 89-98. |
| Jia H H, Wang X T, Cheng H X, et al. 2019. Pine needles as biomonitors of polybrominated diphenyl ethers and emerging flame retardants in the atmosphere of Shanghai, China:Occurrence, spatial distributions, and possible sources[J]. Environmental Science and Pollution Research, 26(12): 12171-12180. |
| Jia J P, Bi C J, Zhang J F, et al. 2019. Atmospheric deposition and vegetable uptake of polycyclic aromatic hydrocarbons (PAHs) based on experimental and computational simulations[J]. Atmospheric Environment, 204: 135-141. |
| Kader J C. 1996. Lipid-transfer proteins in plants[J]. Annual Review of Plant Physiology & Plant Molecular Biology, 47(1): 627-654. |
| Kierkegaard A, Sellstrom U, McLachlan M S. 2009. Environmental analysis of higher brominated diphenyl ethers and decabromodiphenyl ethane[J]. Journal of Chromatography A, 1216: 364-375. |
| Limmer M, Burken J. 2014. Plant translocation of organic compounds:molecular and physicochemical predictors[J]. Environmental Science & Technology Letters, 1(2): 156-161. |
| Lin Y, Ma J, Qiu X H, et al. 2015. Levels, spatial distribution, and exposure risks of decabromodiphenylethane in soils of North China[J]. Environmental Science and Pollution Research, 22(17): 13319-13327. |
| Li Q F, Fang Y P, Li X X, et al. 2013. Mechanism of the plant cytochrome P450 for herbicide resistance:A modelling study[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 28(6): 1182-1191. |
| Li J H, Chen Y, Xiao W J. 2017. Polybrominated diphenyl ethers in articles:A review of its applications and legislation[J]. Environmental Science and Pollution Research, 24: 4312-4321. |
| Li W L, Liu L Y, Zhang Z F, et al. 2016. Brominated flame retardants in the surrounding soil of two manufacturing plants in China:Occurrence, composition profiles and spatial distribution[J]. Environmental Pollution, 213: 1-7. |
| Mattina M, Lannucci-Berger W, Musante C, et al. 2003. Concurrent plant uptake of heavy metals and persistent organic pollutants from soil[J]. Environmental Pollution, 124(3): 375-378. |
| McGrath T J, Morrison P D, Ball A S, et al. 2018. Spatial distribution of novel and legacy brominated flame retardants in soils surrounding two australian electronic waste recycling facilities[J]. Environmental Science & Technology, 52(15): 8194-8204. |
| Navarro I, Torre A D L, Sanz P, et al. 2017. Uptake of perfluoroalkyl substances and halogenated flame retardants by crop plants grown in biosolids-amended soils[J]. Environmental Research, 152: 1199-1206. |
| Nayeem A, Sitkoff D, Krystek J R S. 2006. A comparative study of available software for high-accuracy homology modeling:From sequence alignments to structural models[J]. Protein Science, 15(4): 808-824. |
| Newton S, Sellstrom U, de Wit C. 2015. Emerging flame retardants, PBDEs, and HBCDDs in indoor and outdoor media in Stockholm, Sweden[J]. Environmental Science & Technology, 49(5): 2912-2920. |
| Ricklund N, Kierkegaard A, Mclachlan M S. 2010. Levels and potential sources of decabromodiphenyl ethane (DBDPE) and decabromodiphenyl ether (DecaBDE) in lake and marine sediments in Sweden[J]. Environmental Science & Technology, 44(6): 1987-1991. |
| Salamova A, Hites R A. 2013. Brominated and chlorinated flame retardants in tree bark from around the globe[J]. Environmental Science & Technology, 47(1): 349-354. |
| Sánchez D, Ganfornina M D, Gutiérrez G, et al. 2003. Exonintron structure and evolution of the lipocalin gene family[J]. Molecular Biology Evolution, 20(5): 775-783. |
| Schroll R, Bierling B, Cao G, et al. 1994. Uptake pathways of organic-chemicals from soils by agricultural plants[J]. Chemosphere, 28: 297-303. |
| Sun J Q, Wu Y H, Jiang P, et al. 2019. Concentration, uptake and human dietary intake of novel brominated flame retardants in greenhouse and conventional vegetables[J]. Environment International, 123: 436-443. |
| Trapp S, Cammarano A, Capri E, et al. 2007. Diffusion of PAH in potato and carrot slices and application for a potato model[J]. Environmental Science & Technology, 41(9): 3103-3108. |
| Wang S, Zhang S Z, Huang H L, et al. 2011. Uptake, translocation and metabolism of polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls (PCBs) in maize (Zea mays L.)[J]. Chemosphere, 85(3): 379-385. |
| Wang Y W, Chen T, Sun Y M, et al. 2019. A comparison of the thyroid disruption induced by decabrominated diphenyl ethers (BDE-209) and decabromodiphenyl ethane (DBDPE) in rats[J]. Ecotoxicology and Environmental Safety, 174: 224-235. |
| Wan W N, Huang H L, Lv J T, et al. 2017. Uptake, translocation, and biotransformation of organophosphorus esters in wheat (Triticum aestivum L.)[J]. Environmental Science & Technology, 51(23): 13649-13658. |
| White J. 2002. Differential bioavailability of field-weathered p, p'-DDE to plants of the cucurbita and cucumis genera[J]. Chemosphere, 49: 143-152. |
| White J, Wang X, Gent M. 2003. Subspecies-level variation in the phytoextraction of weathered p, p'-DDE by cucurbita pepo[J]. Environmental Science & Technology, 37: 4368-4373. |
| Wen B, Liu Y, Wang P, et al. 2012. Toxic effects of chlortetracycline on maize growth, reactive oxygen species generation and the antioxidant response[J]. Journal of Environmental Sciences, 24(6): 1099-1105. |
| Wen B, Wu Y L, Zhang H N, et al. 2016. The roles of protein and lipid in the accumulation and distribution of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in plants grown in biosolids-amended soils[J]. Environmental Pollution, 216: 682-688. |
| Xu X H, Wen B, Huang H L, et al. 2016. Uptake, translocation and biotransformation kinetics of BDE-47, 6-OH-BDE-47 and 6-MeO-BDE-47 in maize (Zea mays L.)[J]. Environmental Pollution, 208(Pt B): 714-722. |
| Yang Z Y, Greenstein D, Zeng E Y, et al. 2007. Determination of poly (dimethyl) siloxane-water partition coefficients for selected hydrophobic organic chemicals using 14C-labeled analogs[J]. Journal of Chromatography A, 1148(1): 23-30. |
| 余乐洹, 蔡梓华, 余旭儿, 等. 2018. 红隼体内典型卤代有机污染物的含量及组织分配[J]. 环境化学, 37(4): 645-651. |
| 张长, 胡浪平, 曾光明, 等. 2011. 一种新型环境污染物-羟基化多溴联苯醚(OH-PBDEs)[J]. 环境科学, 32(7): 2170-2175. |
| Zhang H J, Chen J P, Ni Y W, et al. 2009. Uptake by roots and translocation to shoots of polychlorinated dibenzo-p-dioxins and dibenzofurans in typical crop plants[J]. Chemosphere, 76(6): 740-746. |
| Zhang W W, Wang P, Zhu Y, et al. 2019. Brominated flame retardants in atmospheric fine particles in the Beijing-Tianjin-Hebei region, China:spatial and temporal distribution and human exposure assessment[J]. Ecotoxicology and Environmental Safety, 171: 181-189. |
| Zhang Z W, Pei N C, Sun Y X, et al. 2019. Halogenated organic pollutants in sediments and organisms from mangrove wetlands of the Jiulong river estuary, South China[J]. Environmental Research, 171: 145-152. |
| Zheng Q, Nizzetto L, Li J, et al. 2015. Spatial distribution of old and emerging flame retardants in chinese forest soils:sources, trends and processes[J]. Environmental Science & Technology, 49(5): 2904-2911. |
| Zhu Y H, Zhang S Z, Zhu Y G, et al. 2007. Improved approaches for modeling the sorption of phenanthrene by a range of plant species[J]. Environmental Science & Technology, 41: 7818-7823. |
