
 , 谢世伟1, 唐琳1, 张文强1,2, 张国琴1, 朱义年2, 单杨1,3
, 谢世伟1, 唐琳1, 张文强1,2, 张国琴1, 朱义年2, 单杨1,31. 桂林理工大学化学与生物工程学院, 桂林 541006;
2. 广西环境污染控制理论与技术重点实验室, 桂林 541006;
3. 湖南省农业科学院, 湖南农产品加工研究所, 长沙 410125
收稿日期: 2019-09-21; 修回日期: 2020-01-06; 录用日期: 2020-01-06
基金项目: 国家自然科学基金(No.21467006);广西壮族自治区特聘专家团队项目(厅发[2018]39);广西环境污染控制理论与技术重点实验室研究基金(No.1701K003)
作者简介: 刘红艳(1970—), 女, 副教授, E-mail:lhyglite@126.com
通讯作者(责任作者): 刘红艳
摘要:己烯雌酚(Diethylstilbestrol,DES)作为水环境中最具雌激素活性的合成化合物之一,其给生物体和环境带来的危害已经引起人们的关注.本研究首先通过分子对接与分子动力学模拟从理论上分析漆酶与DES的相互作用;其次通过实验分析其降解动力学模型及不同反应条件和介质对漆酶催化转化DES的影响;最后使用响应面分析方法优化漆酶-ABTS系统催化转化DES的最佳条件.计算结果表明,漆酶与DES的反应能够自发进行且它们之间主要存在氢键和疏水作用力.实验结果表明,反应6 h左右,50 mg·L-1的DES的降解率达到93%以上;根据Michaelis-Menten模型得到的动力学参数Km和Vmax分别为36.18 mg·L-1和45.98 mg·L-1·h-1,模型的R2为0.99.漆酶催化降解DES的最佳pH为6,最佳温度为55℃.几种介质中,ABTS对漆酶催化降解DES的作用最强.通过响应面分析发现,在pH=5.5、55.98℃、1.52 mmol·L-1 ABTS、31.52 mg·L-1 DES的条件下,反应0.5 h后ABTS-漆酶系统可将DES完全降解.本研究可为漆酶催化转化DES提供理论基础和实验方法.
关键词:己烯雌酚漆酶分子对接分子动力学模拟响应面分析法
Degradation of diethylstilbestrol by laccase based on computational simulation and response surface analysis
LIU Hongyan1

 , XIE Shiwei1, TANG Lin1, ZHANG Wenqiang1,2, ZHANG Guoqin1, ZHU Yinian2, SHAN Yang1,3
, XIE Shiwei1, TANG Lin1, ZHANG Wenqiang1,2, ZHANG Guoqin1, ZHU Yinian2, SHAN Yang1,31. College of Chemistry and Bioengineering, Guilin University of Technology, Guilin 541006;
2. Guangxi Key Laboratory of Environmental Pollution Control Theory and Technology, Guilin 541006;
3. Hunan Agricultural Product Processing Institute, Hunan Academy of Agricultural Sciences, Changsha 410125
Received 21 September 2019; received in revised from 6 January 2020; accepted 6 January 2020
Abstract: Diethylstilbestrol (DES) is one of the most estrogenic active compounds in aquatic environment, and its harmful to organisms and environment has attracted people's attention. In this study, we firstly, analyzed the interaction between laccase and DES by molecular docking and molecular dynamics simulation. Secondly, the degradation kinetics model and the effects of different reaction conditions and medium on the catalytic conversion of DES by laccase were analyzed.Finally, the response surface analysis method was used to optimize the optimal conditions for the catalytic conversion of DES by the laccase-ABTS system. The results of calculations showed that the reaction of laccase with DES can occur spontaneously and there were mainly hydrogen bonds and hydrophobic interactions between them. The experimental results showed that the degradation rate of 50 mg·L-1 DES can reach more than 93% in about 6 hours. According to the Michaelis-Menten model, the kinetic parameters Km and Vmax were 36.18 mg·L-1 and 45.98 mg·L-1·h-1, respectively, The coefficient of determination (R2) of the model was 0.99. The optimum pH for laccase-catalyzed degradation of DES was 6, and the optimum temperature was 55 ℃. In the study of several mediators, ABTS was found to have the strongest effect on catalyzed degradation of DES by laccase. Response surface analysis revealed that the ABTS-laccase system completely degraded DES after half an hour of reaction at pH=5.5, 55.98 ℃, 1.52 mmol·L-1 ABTS, and 31.52 mg·L-1 DES. This study provides a theoretical basis and experimental method for the catalytic conversion of DES by laccase.
Keywords: diethylstilbestrollaccasemolecular dockingmolecular dynamics simulationresponse surface analysis method
1 引言(Introduction)己烯雌酚(Diethylstilbestrol, DES)是一种合成的非甾体雌激素或异雌激素, 具有比雌二醇更强的雌激素活性(Korach et al., 1978;Shang et al., 2014).自1938年被英国化学家合成后, 最初用于治疗肠胃不适、头晕和皮肤红肿, 后来被作为预防流产的处方药而广泛应用于医学界, 还被用于治疗晚期前列腺癌、乳腺癌、卵巢功能不全、闭经、子宫发育不全、功能性子宫出血等疾病(Goyal et al., 2001;Grenader et al., 2014;Koong et al., 2014).在1971年己烯雌酚因被发现可诱发多种女性疾病而遭禁用(He et al., 2002;Tournaire et al., 2015;2018;Troisi et al., 2016).但己烯雌酚作为外敷、或是临床手术辅助药物及动物的生长促进剂依然被广泛应用于临床和畜禽生产中, 其中一部分DES或DES代谢产物随着动物的粪便、尿等进入环境.进入环境中的DES虽然一般浓度较低, 甚至是微量的, 但在生态系统中可以通过生物浓缩、生物积累和生物放大3种途径增大浓度, 然后进入食物链, 同样危害生物体和人类的健康.
Lin等(2009)利用臭氧氧化降解DES, 但效果却不显著.Xu等(2017)研究了己烯雌酚的紫外光转换及其在阳光下对地表水的持久性污染, 发现DES能够被光催化降解, 但也发现DES是一种光致变色化合物, 其紫外诱导的中间体可以在阳光下转化回DES, 这显然减缓了DES的光降解.作为一类脂溶性化合物DES在环境中不易被降解, 利用传统的处理方法来降解这类酚类有机污染物不仅费用昂贵且效果不佳(Snyder et al., 2003;Tay et al., 2009).漆酶是一种典型的生物催化剂, 是一种含铜的多酚氧化酶, 其催化有机底物的单电子后, 同时将其中的氧分子还原成水.已有研究表明, 漆酶由于其低氧化还原电位可以催化多种酚类化合物(Barrios-Estrada et al., 2018;Catherine et al., 2016;2019;Divya et al., 2018), 并且通过加入介质能够扩展其催化底物范围及提高氧化效率(Kurniawati et al., 2007;Ashe et al., 2016;Parra et al., 2019).分子对接使用算法能快速可靠地预测配体与受体之间的最佳结合方式, 这可能解释了实验结果(Tang et al., 2018;Wu et al., 2018).目前, 漆酶与双酚A、壬基酚、苯酚的分子对接结果为其环境处理提供了重要的理论依据(Zhang et al., 2012;Mo et al., 2018;Liu et al., 2019).
本研究采用分子计算模拟和实验相结合的方法研究彩绒革盖菌(Trametes versicolor)漆酶对DES的生物转化作用.首先, 利用分子对接和分子动力学模拟(Molecular Dynamics simulation, MD)研究漆酶与DES相互作用的结合位点及相互作用力;其次, 通过实验研究底物浓度、温度、pH值、介质类型等因素对漆酶催化转化DES效率的影响, 并根据Michaelis-Menten模型和Lineweaver-Burk模型分析漆酶催化降解DES的动力学模型;最后, 通过响应面分析方法(Response Surface analysis Method, RSM)对漆酶-ABTS系统催化降解DES的条件进行优化.基于理论研究与基础实验评估漆酶对己烯雌酚的生物转化能力.
2 材料和方法(Materials and methods)2.1 化学试剂漆酶(Laccase from Trametes versicolor, 0.94 U·mg-1), 己烯雌酚(DES)、2, 2′-连氮基-双(3-乙基苯并噻唑啉-6-磺酸)(ABTS)、1-羟基苯并三唑(HBT)、香草醛、丁香醛、乙酰丁香酮购自上海源叶生物有限公司.甲醇、乙腈为色谱纯试剂, 购自北京迪科马科技有限公司.其他试剂皆为分析纯以上.
2.2 漆酶与DES的分子对接和分子动力学模拟使用Autodock4.2进行分子对接.首先从蛋白质数据库(http://www.rcsb.org)中获取T. versicolor漆酶的晶体结构(ID:1GYC)(Piontek et al., 2002);然后利用ChemBioDraw Ultra软件绘制DES小分子结构, 并进行几何优化.
使用AutoDock4.2软件依次打开配体和漆酶, 根据实验的需求对它们进行处理并保存为pdbqt格式.对接的格子大小为100 ? × 100 ? × 100 ?, 用Autogrid计算格点能量, 对接运算采用拉马克遗传算法, 漆酶与DES的结合情况用半经验的自由能计算方法评价, 其他参数设置为默认值.最后使用VMD软件和LigPlus进行图形展示和相互作用力分析.
分子动力学模拟在Linux系统中的GROMACS 4.6软件上进行.利用其程序分别对漆酶和漆酶-DES复合物进行了20 ns的MD模拟.模拟系统:采用GROMOS96 43A1力场, 使用SPC水模型和立方体水盒子(newbox), 蛋白质与水盒子壁的最小距离为1 nm, 并且加入了Na+, 用以维持系统环境的性质为中性;用最陡下降法进行初始结构的能量最小化;采用正则系统(NVT)和等温等压系统(NPT)平衡体系.最后使用VMD软件和origin软件进行结果展示及分析.
2.3 降解实验建立10 mL反应体系, 体系包括:醋酸钠缓冲溶液(10 mmol·L-1, pH=5.5)9.5 mL、1 mg·mL-1的漆酶溶液0.5 mL和2.5 g·L-1 DES溶液.根据实验需求设定DES在反应体系中的浓度范围为10~50 mg·L-1.降解实验均在35 ℃和120 r·min-1下振荡反应进行, 并测试反应0.5、1、2、4、6 h时的DES降解率.使用等式计算降解程度:R=(C0-C)/C0×100%, 其中, R为DES的降解率, C0为DES的初始浓度, C为DES的最终浓度.
本实验在安捷伦A1260高效液相色谱仪检测下完成, 色谱柱为ZORBAX SB-C18 (150 mm× 4.6 mm× 5 μm);检测条件为:进样体积10 μL, 以等体积的乙腈和水为流动相等梯度洗脱10 min, 泵流速为1.0 mL·min-1, 柱温30 ℃, 紫外检测器检测240 nm波长处的出峰情况, 记录峰面积值.
2.4 温度、pH及介质类型对漆酶降解DES的影响研究了不同反应温度(25、35、45、55、65和75 ℃)、反应体系pH(3.0、4.0、4.5、5.0、5.5、6.0、7.0和8.0)和不同介质(包括2种合成介质:ABTS、HBT及3种天然介质:香草醛、丁香醛和乙酰丁香酮)对DES降解的影响.每项试验进行3次平行实验, 消耗0.5 mL 1 mg·mL-1的漆酶.
2.5 响应面优化设计漆酶-ABTS系统对DES的降解条件在单因素实验的基础上, 采用Box-Benkenshi试验设计研究漆酶-ABTS系统中DES的降解率随反应体系pH、反应温度、DES浓度、ABTS浓度的变化, 并对试验数据进行回归及响应面分析.试验因素与水平编码见表 1, 以漆酶对DES反应0.5 h后的降解率为响应值进行的29个试验的响应面结果见表 2.
表 1(Table 1)
| 表 1 试验因素与水平 Table 1 Experimental factors and levels | ||||||||||||||||||||||||
表 1 试验因素与水平 Table 1 Experimental factors and levels
| ||||||||||||||||||||||||
表 2(Table 2)
| 表 2 己烯雌酚响应面分析结果 Table 2 Results of diethylstilbestrol response surface | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 己烯雌酚响应面分析结果 Table 2 Results of diethylstilbestrol response surface
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
对响应面分析结果进行统计分析, 除非特别提及, 所有数据从3份平行实验中获得.所有标准偏差均低于所示平均值的5%, 实验结果表示为平均值±标准偏差.
3 结果与讨论(Results and discussion)3.1 漆酶与DES的分子对接基于AutoDock程序的分子对接研究提供了对小分子和生物大分子之间潜在相互作用的深入了解, 这可能是目标导向的实验结果(Tang et al., 2018;Wu et al., 2018).从多次对接中得到最大构象簇位于最低能量等级并计算得到其结合能为-5.99 kcal·mol-1, 理论预测漆酶与DES能够自发进行.图 1a为漆酶与DES的最佳结合构象示意图, 其中清楚地显示了DES在漆酶上的结合位置.从图 1a中的右下图可以发现DES并没有完全进入漆酶的肽链空腔, 而是依附在漆酶空腔的凹槽, 这可能是由于DES的空间位阻导致的.DES依附在漆酶的空腔处并且主要被残基Asp128、Lys40、Gln102、Ala103、Asn227、Gly225、Ile226、Ala309、Met311、Asp101、Leu308包围.在图 1b中不难发现DES与漆酶中的Ala309、Asp128残基结合形成氢键, 且均与DES的酚羟基相连.此外, DES与漆酶中的残基Lys40、Gln102、Ala103、Asn227、Gly225、Ile226、Met311、Asp101、Leu308形成“半包裹”的疏水界面.这些结果表明漆酶与DES能够自行发生反应, 且氢键和疏水相互作用是形成漆酶-DES复合物的重要作用力.
图 1(Fig. 1)
 |
| 图 1 漆酶-DES分子对接结合示意图(a)和疏水作用图(b) Fig. 1Schematic diagram of laccase-DES molecular docking binding(a) and hydrophobic interaction diagram(b) |
3.2 漆酶与DES的分子动力学模拟为了研究蛋白与小分子作用前后的构象变化及蛋白内氨基酸残基动力学行为, 本文采用MD模拟这一种非常可靠的方法(Soleymani et al., 2019).通过模拟能够更好地理解大分子与小分子形成复合物的微观特性变化, 这有利于分析其相互作用.均方根偏差(RMSD)值可以反映体系原子相对于平衡位置的波动情况, 其数值越小说明模拟系统越稳定(Sahu et al., 2019).从图 2a中可以看出, 约在10 ns后两体系的RMSD值基本水平且1gyc-DES复合物比游离更趋于稳定, 有利于复合物分子的形成.通过gromacs中存在的g-gyrate计算回旋半径(Rg)以检查在DES存在下漆酶(1gyc)的动态稳定性和紧密性(Wang et al., 2019).由图 2b可知, 在10 ns之后1gyc-DES体系的Rg值整体略小于蛋白1gyc的Rg值, 表明1gyc-DES二级结构在DES与1gyc结合后发生微小变化, 导致整个氨基酸结构收缩, 因而使得蛋白二级结构发生改变.均方根波动(RMSF)是计算每个氨基酸残基随时间的平均均方根波动进而来分析局部蛋白质的迁移率变化(Mohtashami et al., 2019).值得注意的是, 基于残基作图发现, 漆酶与漆酶-DES复合物的原子波动状况相似(图 2c).造成这一现象的原因很有可能是X射线结构分辨率较低, 无法准确地反映原子的热波动(Fujiwara et al., 2006).
图 2(Fig. 2)
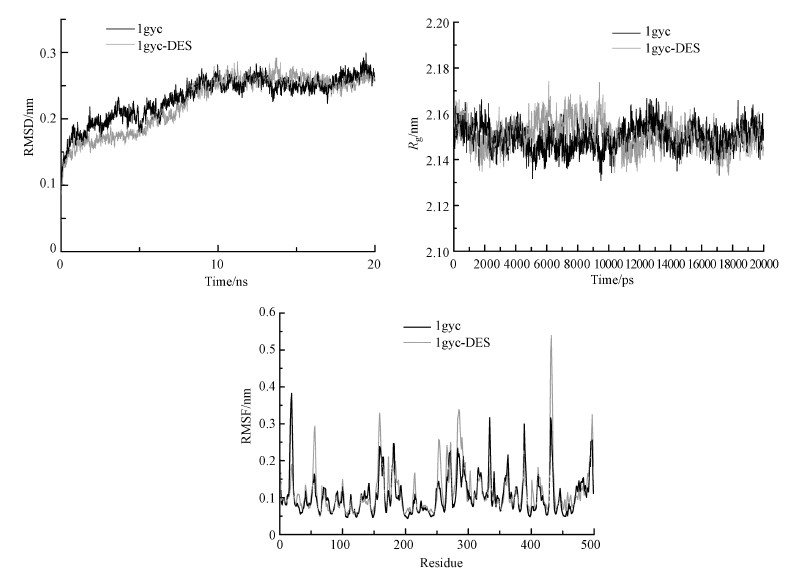 |
| 图 2 MD模拟的漆酶和漆酶-DES体系的RMSD、Rg、RMSF Fig. 2RMSD, Rg, RMSF of laccase and laccase-DES systems simulated by MD |
综合动力学模拟结果发现, DES与漆酶相结合后大约在10 ns趋于稳定, 同时对漆酶结构有一定的影响.同时也证明DES能够与漆酶发生相互作用, 有利于复合物的形成, 这与分子对接中结合能的结果是一致的.
3.3 降解实验及其动力学模型分析分子对接及MD模拟表明漆酶与DES是存在相互作用的, 因此, 为了研究漆酶对DES污染物的处理能力进行了一系列降解实验, 结果如图 3所示.从图 3a中可以观察到, 6 h后, 10~50 mg·L-1 DES的降解率均达到93%以上.随着DES初始浓度从10 mg·L-1增加到30 mg·L-1, 降解率在4 h以后就保持在92%以上.当DES浓度为40 mg·L-1时, 4 h后的降解率达到75%左右.当DES浓度达到50 mg·L-1时, DES浓度的增加导致降解率进一步降低, 但在4 h后仍然有70%的DES被降解.这表明漆酶可以在相对高浓度的DES下经历底物抑制.酶促反应过程通常遵循Michaelis-Menten动力学模型, 根据该动力学模型, 降解速率在非常低的底物浓度下是一级的.由于反应混合物中DES的浓度非常低(μmol·L-1水平), 因此, 这类化合物的降解可以通过一级反应速率方程来拟合(Eibes et al., 2011).假设降解50 mg·L-1 DES(约为1.86 μmol·L-1)的实验符合一级动力学规律, 通过拟合得到动力学常数K为0.32 h-1, R2为0.94.此外, Lineweaver-Burk模型被用于确定Michaelis-Menten参数, 即米氏常数Km和最大反应速率Vmax.通过计算得Km和Vmax分别为36.18 mg·L-1和45.98 mg·L-1·h-1, R2为0.99(图 3b).Lineweaver-Burk模型的结果与一阶模型结果并不一致, 因为计算得到的Vmax与Km的比率约为1.27 h -1.
图 3(Fig. 3)
 |
| 图 3 DES浓度对漆酶降解的影响及酶促动力学模型 Fig. 3Effect of DES concentration on laccase degradation and enzymatic kinetics model |
综上所述, 漆酶对DES有很好的降解效果, 但DES浓度在50 mg·L-1的范围内并不是简单的遵循一级动力学模型, 可能为混合级动力学模型(Navada et al., 2019).
3.4 pH和温度对漆酶降解DES的影响图 4显示了反应1 h时不同pH和温度对DES降解效率的影响.在35 ℃条件下, 不同pH对20 mg·L-1 DES降解率的影响见图 4a.显然, 在pH=3.0~8.0范围内, pH对DES的生物转化存在二次和线性的影响在pH=5.5~7.0的范围内, DES的降解率达到90%以上, 将pH增加至8.0时, 降解效率明显下降, 这一现象与漆酶在较高pH下的活性降低一致.在中性或者碱性条件下, 氢氧根离子的浓度增加, 这有助于氢氧根离子与漆酶的T2/T3铜簇内的质子化桥连配体结合, 从而阻止了电子从T1转移到T2/T3中心, 降低了酶活性(Peyratout et al., 1994).从图中还可以观察到在较低pH下DES的降解率并不理想, 这是由于在酸性条件下能够导致酶的完全失活.最佳pH取决于漆酶性质及基质性质, 因为pH可以改变化合物的电荷和酶的构型形状, 这是基质进入或结合活性位点的基础(Margot et al., 2013).酶-基质复合物主要通过弱相互作用稳定, 如范德华力和氢键, 而后者在很大程度上受中等pH的影响, 因此, 将pH值增加或降低到一定范围之外会降低酶的稳定性和活性(Bhattacharya et al., 2008).根据本文的研究结果, pH=6.0将是漆酶活性和稳定性之间平衡的值, 在这一条件下DES能够达到最大的转化.因此, 后续选择在pH=6.0条件下来评估催化体系中温度的影响.
图 4(Fig. 4)
 |
| 图 4 pH(a)和温度(b)对漆酶降解DES的影响 Fig. 4Effect of pH(a) and temperature(b) on laccase degradation of DES |
在25~75 ℃范围内温度对40 mg·L-1 DES降解率的影响见图 4b.由图可知, 温度会影响反应速率和酶稳定性, 在25 ℃和75 ℃下观察到DES的降解率分别为64.81%和54.66%.在较低温度(25 ℃)下降解效率降低是由于反应的活化能降低, 在较高温度下降解效率降低是由于漆酶的失活, 这是因为当温度超过一定值后, 增加的热失活率比反应速率更显著(Cantarella et al., 2003).从图 4b不难发现漆酶降解DES的最佳温度为55 ℃.Daassi等(2013)研究发现, 使用漆酶-HBT系统进行酸性橙51脱色的最佳温度为50 ℃.Maruyama等(2006)研究表明, 漆酶介质系统在70 ℃时能最有效地降解除草剂.真菌漆酶的最佳催化活性温度通常在50~70 ℃之间(Baldrian et al., 2006), 本实验结论与之一致.
3.5 介质类型对漆酶降解DES的影响氧化还原介体可以作为漆酶和底物之间的电子穿梭, 以克服漆酶的空间位阻和动力学限制(Bourbonnais et al., 1998).介体可以通过与酶活性位点或蛋白质结构上的其他合适区域进行结合, 从而产生比漆酶本身对底物具有更高氧化能力的自由基物质(Ashe et al., 2016).已有研究表明, 可以使用漆酶-介质系统来提高底物转化率(Zeng et al., 2017;Kobakhidze et al., 2018;Parra et al., 2019).本文将研究两种常见的合成介质(ABTS和HBT)和3种常见的天然介质(香草醛、丁香醛、乙酰丁香酮)对漆酶降解DES的影响, 从而找到一个合适的介质来强化漆酶催化转化DES的能力.
图 5为100 mg·L-1 DES降解0.5 h后的实验结果, 在ABTS存在下, 漆酶能更有效地催化转化DES.0.5 h后, 超过95%的DES被0.3 mmol·L-1 ABTS-漆酶系统降解.HBT在0.1 mmol·L-1的条件下对漆酶降解DES有一定的促进作用, 然而随着HBT浓度的增加, DES的降解率反而降低.这一结果表明ABTS是一种比HBT更好的用于降解DES的介体系统.然而也有研究表明, HBT是漆酶降解除草剂异丙隆最有效的介质, ABTS的效果略差(Zeng et al., 2017).这一现象说明降解有机污染物的最佳介质对每种底物都是有特异性的.香草醛、丁香醛和乙酰丁香酮是邻甲氧基取代的酚, 它们能够降低漆酶与DES间的氧化还原电位差, 使漆酶与DES能更好地发生反应, 这可以解释3种天然介质对漆酶降解DES都存在促进作用.虽然丁香醛和乙酰丁香酮对漆酶降解DES也有极大的助力, 但仍然比不上ABTS, 导致这一结果的原因可能是由于介质的催化机制不同.此外, 从图中还可以观察到介质浓度对DES的降解也有一定的影响, 除HBT外基本上是随着介质浓度升高而降解率升高.因此, 本研究对漆酶-ABTS系统降解DES进行优化设计.
图 5(Fig. 5)
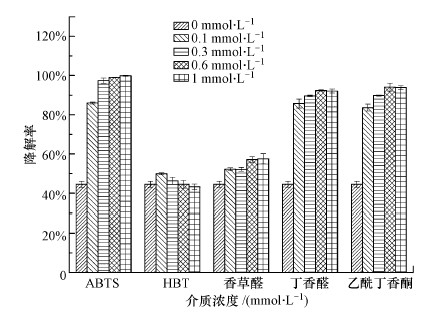 |
| 图 5 不同介质对降解率的影响 Fig. 5Effect of different media on degradation rate |
3.6 响应面优化研究表 2和表 3列出了完整的设计矩阵及实验结果、预测结果、统计分析结果.将实验值拟合为二阶多项式模型, 并得到降解率Y与反应体系pH(A)、反应温度(B)、介质浓度(C)、底物浓度(D)4个因素之间的二次方程:
 | (1) |
| 表 3 方差分析结果 Table 3 Results of variance analysis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 方差分析结果 Table 3 Results of variance analysis
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
由表 3的方差分析结果可知, 回归模型的p < 0.0001, 表明回归模型达到极显著水平;方程决定系数R2=0.98, 表明该方程具有较好的估计预测能力, 失拟项值F=5.90(p=0.0509>0.05)表明回归模型失拟不显著, 该模型可用于预测漆酶对己烯雌酚的降解率;此外, R计算2(0.97)与R预测2(0.91)结果相近.以上结果表明, 根据实验拟合的二阶多项式模型是有价值的(Sakkas et al., 2011).
实验值与预测值之间的相关性分析如图 6a所示, 均位于对角线附近, 显示了与对角线的低偏差.实验值和预测值之间的残差如图 6b所示, 残差的分布呈随机正态分布且分散无规律, 也表明模型具有很好的拟合能力.
图 6(Fig. 6)
 |
| 图 6 基于RSM模型的DES降解实验值与预测值对应关系(a)及残差图(b) Fig. 6Correspondence between experimental values and predicted values of DES degradation based on RSM model (a) and residual map (b) |
此外, 从表 3中的p值和F值可知, pH(A)、温度(B)、DES浓度(D)对模型的贡献极其重要, 其中, pH对模型的显著性影响最大.因此, 本研究还分析了pH与其他因素之间的交互作用.在一定条件下, 若某因素与其它因素存在相互作用, 则它们间的曲线存在交叉, 若无交互作用, 则曲线将大致平行并具有相同的趋势(Galedari et al., 2019).
如图 7所示, 在35 ℃和75 ℃条件下, pH对DES降解率的影响存在相同轨迹;在ABTS浓度为0.2 mmol·L-1和1.8 mmol·L-1情况下, DES的降解率曲线也出现类似的形状;此外, DES浓度对降解率的影响也表现出相同趋势.这些结果均表明参数之间不存在相互作用.
图 7(Fig. 7)
 |
| 图 7 pH与温度、ABTS、DES的相互作用 Fig. 7Interaction of pH with temperature, ABTS, DES |
3.7 ABTS-漆酶系统催化降解DES最佳条件确定由上述研究结果可知, ABTS-漆酶系统催化降解DES的最优条件为:pH=5.5, 温度为55.98 ℃, ABTS浓度为1.52 mmol·L-1, DES浓度为31.52 mg·L-1.在此条件下下计算得到的降解率为104.3%(本实验通过空白加标实验得到的回收率为95%~108%), 然后以最佳条件进行ABTS-漆酶系统催化降解DES的实验, 得到实验降解率为100%, 表明RSM模型足以预测和优化DES的催化降解, 且在最佳条件下, DES能被漆酶完全催化降解.基于ABTS-漆酶系统降解DES的最优响应曲面和等高线图如图 8所示.
图 8(Fig. 8)
 |
| 图 8 最优响应曲面及等高线图 Fig. 8Optimal response surface and contour map |
4 结论(Conclusions)本文通过理论计算和降解实验研究了漆酶与DES的相互作用及漆酶有效催化转化DES的条件.结果表明, 漆酶与DES相互作用的结合能是-5.99 kcal·mol-1, 它们之间的相互作用反应能够自发进行.通过降解实验研究发现, 漆酶催化降解DES的Michaelis-Menten方程的动力学参数Km和Vmax分别为36.18 mg·L-1和45.98 mg·L-1·h-1, 模型的R2为0.99, 并且发现DES浓度在50 mg·L-1范围内降解过程并不是简单的遵循一级动力学模型, 可能为混合级动力学模型.温度、pH、介质类型及DES浓度对DES降解效率存在很大影响.通过RSM优化确定ABTS-漆酶体系的最佳反应条件为:pH=5.5、温度55.98 ℃、ABTS浓度1.52 mmol·L-1、DES浓度31.52 mg·L-1, 在此条件下, 漆酶浓度为50 mg·L-1时, 反应0.5 h后DES的降解率达到100%, 与模型预测值104.3%相差不大, 表明根据实验拟合的二阶多项式模型是可靠的.
参考文献
| Ashe B, Nguyen L N, Hai F I, et al. 2016. Impacts of redox-mediator type on trace organic contaminants degradation by laccase:Degradation efficiency, laccase stability and effluent toxicity[J]. International Biodeterioration & Biodegradation, 113: 169-176. |
| Baldrian P. 2006. Fungal laccases-occurrence and properties[J]. FEMS Microbiology Reviews, 30(2): 215-242. DOI:10.1111/j.1574-4976.2005.00010.x |
| Barrios-Estrada C, De Jesús Rostro-Alanis M, Mu?oz-Gutiérrez B D, et al. 2018. Emergent contaminants:Endocrine disruptors and their laccase-assisted degradation-A review[J]. Science of the Total Environment, 612: 1516-1531. DOI:10.1016/j.scitotenv.2017.09.013 |
| Bhattacharya S S, Banerjee R. 2008. Laccase mediated biodegradation of 2, 4-dichlorophenol using response surface methodology[J]. Chemosphere, 73(1): 81-85. DOI:10.1016/j.chemosphere.2008.05.005 |
| Bourbonnais R, Leech D, Paice M G. 1998. Electrochemical analysis of the interactions of laccase mediators with lignin model compounds[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 1379(3): 381-390. DOI:10.1016/S0304-4165(97)00117-7 |
| Cantarella G, Galli C, Gentili P. 2003. Free radical versus electron-transfer routes of oxidation of hydrocarbons by laccase/mediator systems:Catalytic or stoichiometric procedures[J]. Journal of Molecular Catalysis B:Enzymatic, 22(3): 135-144. |
| Catherine H, Penninckx M, Frédéric D. 2016. Product formation from phenolic compounds removal by laccases:A review[J]. Environmental Technology & Innovation, 5: 250-266. |
| Choi J M, Han S S, Kim H S. 2015. Industrial applications of enzyme biocatalysis:Current status and future aspects[J]. Biotechnology Advances, 33(7): 1443-1454. DOI:10.1016/j.biotechadv.2015.02.014 |
| Daassi D, Zouari-Mechichi H, Frikha F, et al. 2013. Decolorization of the azo dye Acid Orange 51 by laccase produced in solid culture of a newly isolated Trametes trogii strain[J]. Biotech, 3(2): 115-125. |
| Divya L M, Prasanth G K, Arun K G, et al. 2018. Bisphenol-A carbonate dimer is a more preferred substrate for laccase mediated degradation than the Biphenol-A in its monomeric and dimeric forms[J]. International Biodeterioration & Biodegradation, 135: 19-23. |
| Eibes G, Debernardi G, Feijoo G, et al. 2011. Oxidation of pharmaceutically active compounds by a ligninolytic fungal peroxidase[J]. Biodegradation, 22(3): 539-550. DOI:10.1007/s10532-010-9426-0 |
| Fujiwara S I, Amisaki T. 2006. Molecular dynamics study of conformational changes in human serum albumin by binding of fatty acids[J]. Proteins:Structure, Function, and Bioinformatics, 64(3): 730-739. DOI:10.1002/prot.21053 |
| Galedari M, Mehdipour Ghazi M, Rashid Mirmasoomi S. 2019. Photocatalytic process for the tetracycline removal under visible light:Presenting a degradation model and optimization using response surface methodology (RSM)[J]. Chemical Engineering Research and Design, 145: 323-333. DOI:10.1016/j.cherd.2019.03.031 |
| Goyal H O, Braden T D, Mansour M, et al. 2001. Diethylstilbestrol-treated adult rats with altered epididymal sperm numbers and sperm motility parameters, but without alterations in sperm production and sperm morphology[J]. Biology of Reproduction, 64(3): 927-934. DOI:10.1095/biolreprod64.3.927 |
| Grenader T, Plotkin Y, Gips M, et al. 2014. Diethylstilbestrol for the treatment of patients with castration-resistant prostate cancer:retrospective analysis of a single institution experience[J]. Oncology Reports, 31(1): 428-434. DOI:10.3892/or.2013.2852 |
| He S H, Liang Z H, Zhan W. 2002. Establishment of the recombinant yeast assay system for environmental estrogens[J]. Environmental Health, 19(1): 57-59. |
| Kobakhidze A, Elisashvili V, Corvini P F X, et al. 2018. Biotransformation of ritalinic acid by laccase in the presence of mediator TEMPO[J]. New Biotechnology, 43: 44-52. DOI:10.1016/j.nbt.2017.08.008 |
| Koong L Y, Watson C S. 2014. Direct estradiol and diethylstilbestrol actions on early-versus late-stage prostate cancer cells[J]. Prostate, 74(16): 1589-1603. DOI:10.1002/pros.22875 |
| Korach K S, Metzler M, Mclachlan J A. 1978. Estrogenic activity in vivo and in vitro of some diethylstilbestrol metabolites and analogs[J]. Proceedings of the National Academy of Sciences, 75(1): 468. DOI:10.1073/pnas.75.1.468 |
| Kurniawati S, Nicell J A. 2007. Efficacy of mediators for enhancing the laccase-catalyzed oxidation of aqueous phenol[J]. Enzyme and Microbial Technology, 41(3): 353-361. DOI:10.1016/j.enzmictec.2007.03.003 |
| Li S, Yang X, Yang S, et al. 2012. Technology prospecting on enzymes:Applycation, marketing and engineering[J]. Computational and Structural Biotechnology Journal, 2(3): e201209017. DOI:10.5936/csbj.201209017 |
| Lin Y, Peng Z, Zhang X. 2009. Ozonation of estrone, estradiol, diethylstilbestrol in waters[J]. Desalination, 249(1): 235-240. DOI:10.1016/j.desal.2008.06.034 |
| Liu H Y, Zhang Z X, Xie S W, et al. 2019. Study on transformation and degradation of bisphenol A by Trametes versicolor laccase and simulation of molecular docking[J]. Chemosphere, 224: 743-750. DOI:10.1016/j.chemosphere.2019.02.143 |
| Margot J, Maillard J, Rossi L, et al. 2013. Influence of treatment conditions on the oxidation of micropollutants by Trametes versicolor laccase[J]. New Biotechnology, 30(6): 803-813. DOI:10.1016/j.nbt.2013.06.004 |
| Maruyama T, Komatsu C, Michizoe J, et al. 2006. Laccase-mediated oxidative degradation of the herbicide dymron[J]. Biotechnology Progress, 22(2): 426-430. DOI:10.1021/bp050251h |
| Mo D, Zeng G, Yuan X, et al. 2018. Molecular docking simulation on the interactions of laccase from Trametes versicolor with nonylphenol and octylphenol isomers[J]. Bioprocess and Biosystems Engineering, 41(3): 331-343. DOI:10.1007/s00449-017-1866-z |
| Mohtashami M, Fooladi J, Haddad-Mashadrizeh A, et al. 2019. Molecular mechanism of enzyme tolerance against organic solvents:Insights from molecular dynamics simulation[J]. International Journal of Biological Macromolecules, 122: 914-923. DOI:10.1016/j.ijbiomac.2018.10.172 |
| Navada K K, Kulal A. 2019. Enzymatic degradation of chloramphenicol by laccase from Trametes hirsuta and comparison among mediators[J]. International Biodeterioration & Biodegradation, 138: 63-69. |
| Parra Guardado A L, Belleville M P, Rostro Alanis M D J, et al. 2019. Effect of redox mediators in pharmaceuticals degradation by laccase:A comparative study[J]. Process Biochemistry, 78: 123-131. DOI:10.1016/j.procbio.2018.12.032 |
| Peyratout C S, Severns J C, Holm S R, et al. 1994. EPR studies of ligand binding to the Type 2/Type 3 cluster in tree laccase[J]. Archives of Biochemistry and Biophysics, 314(2): 405-411. DOI:10.1006/abbi.1994.1460 |
| Piontek K, Antorini M, Choinowski T. 2002. Crystal structure of a laccase from the fungustrametes versicolor at 1.90-? resolution containing a full complement of coppers[J]. Journal of Biological Chemistry, 277(40): 37663-37669. DOI:10.1074/jbc.M204571200 |
| Sahu S N, Pattanayak S K. 2019. Molecular docking and molecular dynamics simulation studies on PLCE1 encoded protein[J]. Journal of Molecular Structure, 1198: 126936. DOI:10.1016/j.molstruc.2019.126936 |
| Sakkas V A, Calza P, Vlachou A D, et al. 2011. Photocatalytic transformation of flufenacet over TiO2 aqueous suspensions:Identification of intermediates and the mechanism involved[J]. Applied Catalysis B:Environmental, 110: 238-250. DOI:10.1016/j.apcatb.2011.09.006 |
| Shang G, Xue J, Li M, et al. 2014. Estrogen receptor affinity chromatography:A new method for characterization of novel estrogenic disinfection by-products[J]. Chemosphere, 104: 251-257. DOI:10.1016/j.chemosphere.2014.01.027 |
| Snyder S A, Westerhoff P, Wert E, et al. 2003. Pharmaceuticals, personal care products, and endocrine disruptors in water:Implications for the water industry[J]. Environmental Engineering Science, 20(5): 449-469. DOI:10.1089/109287503768335931 |
| Soleymani H, Ghorbani M, Allahverdi A, et al. 2019. Activation of human insulin by vitamin E:A molecular dynamics simulation study[J]. Journal of Molecular Graphics and Modelling, 91: 194-203. DOI:10.1016/j.jmgm.2019.06.006 |
| Tang B, Tang P, He J, et al. 2018. Characterization of the binding of a novel antitumor drug ibrutinib with human serum albumin:Insights from spectroscopic, calorimetric and docking studies[J]. Journal of Photochemistry and Photobiology B:Biology, 184: 18-26. DOI:10.1016/j.jphotobiol.2018.05.008 |
| Tay K S, Rahman N A, Abas M R B. 2009. Degradation of DEET by ozonation in aqueous solution[J]. Chemosphere, 76(9): 1296-1302. DOI:10.1016/j.chemosphere.2009.06.007 |
| Tournaire M, Epelboin S, Devouche E, et al. 2015. A cancer risk in women exposed to diethylstilbestrol in utero[J]. Thérapie, 70(5): 433-441. |
| Tournaire M, Devouche E, Epelboin S, et al. 2018. Birth defects in children of men exposed in utero to diethylstilbestrol (DES)[J]. Thérapie, 73(5): 399-407. |
| Troisi R, Hatch E E, Palmer J R, et al. 2016. Prenatal diethylstilbestrol exposure and high-grade squamous cell neoplasia of the lower genital tract[J]. American Journal of Obstetrics and Gynecology, 215(3): 322e. |
| Wang W, Gan N, Sun Q, et al. 2019. Study on the interaction of ertugliflozin with human serum albumin in vitro by multispectroscopic methods, molecular docking, and molecular dynamics simulation[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 219: 83-90. DOI:10.1016/j.saa.2019.04.047 |
| Wu D, Liu D, Zhang Y, et al. 2018. Unravelling the binding mechanism of benproperine with human serum albumin:A docking, fluorometric, and thermodynamic approach[J]. European Journal of Medicinal Chemistry, 146: 245-250. DOI:10.1016/j.ejmech.2018.01.064 |
| Xu B, Li K, Qiao J, et al. 2017. UV photoconversion of environmental oestrogen diethylstilbestrol and its persistence in surface water under sunlight[J]. Water Research, 127: 77-85. DOI:10.1016/j.watres.2017.09.059 |
| Zeng S, Qin X, Xia L. 2017. Degradation of the herbicide isoproturon by laccase-mediator systems[J]. Biochemical Engineering Journal, 119: 92-100. DOI:10.1016/j.bej.2016.12.016 |
| Zhang Y, Zeng Z, Zeng G, et al. 2012. Effect of Triton X-100 on the removal of aqueous phenol by laccase analyzed with a combined approach of experiments and molecular docking[J]. Colloids and Surfaces B:Biointerfaces, 97: 7-12. DOI:10.1016/j.colsurfb.2012.04.001 |
