 , 孟庆康1, 金亮1,2, 杨溢琪1, 方婧1
, 孟庆康1, 金亮1,2, 杨溢琪1, 方婧1
 , 林道辉2
, 林道辉21. 浙江工商大学环境科学与工程学院, 杭州 310018;
2. 浙江大学环境与资源学院, 杭州 310058
收稿日期: 2019-10-28; 修回日期: 2019-11-22; 录用日期: 2019-11-22
基金项目: 国家自然科学基金(No.21976158, 21677129)
作者简介: 程磊磊(1989-), 男, E-mail:390470087@qq.com
通讯作者(责任作者): 方婧, E-mail:rceesfangjing@126.com
摘要:近年来环境中生物炭胶体形成受到广泛关注,它是生物炭在环境中物理分解作用的重要过程,对污染物迁移有着重要影响.然而,目前对生物炭胶体释放过程和影响因素的研究甚少,人们对生物炭胶体释放机理的认识还很有限.本研究以小麦秸秆和花生壳为生物质来源,系统地探讨了生物炭的裂解温度(300~700 ℃)和溶液离子强度(0.1~10 mmol·L-1)对生物炭胶体产率的影响.结果表明,随着裂解温度的升高,生物炭的耐磨性增强,且在较高的裂解温度下(≥500 ℃)花生壳生物炭的耐磨性显著强于小麦秸秆生物炭.生物炭的胶体产率受到生物质来源和裂解温度的显著影响,花生壳生物炭的胶体产率低于小麦秸秆生物炭,高温裂解(≥600 ℃)生物炭的胶体产率显著低于中低温裂解生物炭.在相同溶液离子强度下,生物炭胶体产率与其亚微米级碎片率呈显著正相关(p < 0.05),即生物炭中亚微米级碎片率越高,生物炭胶体产率越高.当溶液离子强度从1 mmol·L-1增加到10 mmol·L-1时,两种来源生物炭的胶体产率均显著降低,其降低的程度因生物炭裂解温度而异,其中低温裂解(300 ℃)生物炭的胶体产率降低了11.1%~11.2%,中高温裂解(≥ 500 ℃)生物炭的胶体产率降低了60.0%~97.2%.
关键词:生物炭胶体裂解温度生物质来源耐磨性离子强度
Influence of pyrolysis temperature and ionic strength on the release behavior of biochar colloid from different feedstocks
CHENG Leilei1,2
 , MENG Qingkang1, JIN Liang1,2, YANG Yiqi1, FANG Jing1
, MENG Qingkang1, JIN Liang1,2, YANG Yiqi1, FANG Jing1
 , LIN Daohui2
, LIN Daohui21. School of Environmental Science and Engineering, Zhejiang Gongshang University, Hangzhou 310018;
2. Department of Environmental Science, Zhejiang University, Hangzhou 310058
Received 28 October 2019; received in revised from 22 November 2019; accepted 22 November 2019
Abstract: In recent years, the formation of biochar colloids in the environment has attracted more and more attention, which is an important process of biochar physical decomposition and has an important impact on pollutant migration. However, fundamental studies on the release processes and the influencing factors of biochar colloids are scarce, and the current understanding of the mechanisms of biochar colloids release is rather limited. In this study, we systematically explored the effects of pyrolysis temperature (300~700 ℃) and solution ionic strength (0.1~10 mmol·L-1) on the yield of biochar colloids from bulk biochar prepared from wheat straw and peanut shell. Results showed that the abrasive resistance of biochar increased with the increase of pyrolysis temperature. At higher pyrolysis temperature (≥500 ℃), the abrasive resistance of peanut shell biochar was significantly better than that of wheat straw biochar. The yield of biochars colloid was significantly affected by both feedstock and pyrolysis temperature. The colloids from peanut shell biochar was lower than from wheat straw biochar. The yield of biochar colloids at high pyrolysis temperature (≥600 ℃) was significantly lower than the lower pyrolysis temperature, which was significantly positively correlated with the content of submicron fragments in biochar (p < 0.05). When solution ionic strength increased from 1 mmol·L-1 to 10 mmol·L-1, the yield of biochar colloids decreased, the inhibition of which varied with pyrolysis temperature. The yield of biochar colloids from higher pyrolysis temperatures (≥500℃) was greatly inhibited by ionic strength, which decreased by 60.0%~97.2%, but it slightly changed from biochar with a lower temperature (300 ℃), which decreased by 11.1%~11.2%.
Keywords: biochar colloidspyrolysis temperaturefeedstockabrasive resistanceionic strength
1 引言(Introduction)生物炭是生物质在无氧或缺氧条件下裂解产生的一种碳质材料(Lehmann, 2007).生物炭具有高度芳香结构、高比表面积、丰富的孔隙度和官能团等特点, 已被证明能有效地用作碳封存(Zimmerman et al., 2011), 修复污染土壤(Ahmad et al., 2014;李金文等, 2018)和保持土壤肥力(Novak et al., 2009;Jeffery et al., 2011).近年来, 生物炭在环境中的物理分解过程受到人们的广泛关注, 生物炭胶体的形成被认为是碳流失不可忽视的过程(Spokas et al., 2014;Liu et al., 2018;方婧等, 2019;Yang et al., 2019).
生物炭在土壤中将受到研磨作用、冻融作用和膨胀作用等发生物理性破碎(Spokas et al., 2014;Ravi et al., 2016;Liu et al., 2018), 这些破碎的生物炭小颗粒很可能形成具有高度迁移性的生物炭胶体.研究发现, 在水流冲击下生物炭将释放出微米及亚微米级的碎片, 从而形成生物炭胶体(Spokas et al., 2014;Liu et al., 2018;Yang et al., 2019).生物炭胶体具有较高的悬浮稳定性, 比如300 ℃和600 ℃制备的小麦秸秆生物炭胶体在NaCl溶液中的临界絮凝浓度(CCCNaCl)分别为274 mmol·L-1和183 mmol·L-1 (Yang et al., 2019), 高于常见的矿物胶体(如高岭石胶体的CCCNaCl为88 mmol·L-1)(Sotirelis et al., 2017)和碳纳米材料(如碳纳米管的CCCNaCl为25 mmol·L-1)(Saleh et al., 2008).多项研究表明, 生物炭胶体在多孔介质中具有很强的迁移能力, 可能会随地表径流或孔隙流迁移到深层土壤或地下水(Wang et al., 2013a; 2013b;韩旸等, 2017;Chen et al., 2017; 2018;Wang et al., 2019).此外, 生物炭对重金属和有机物均具有很强的吸附能力.例如, 水稻秸秆和牛粪制备的生物炭对铅离子的吸附容量可达65.3~132.8 mg·g-1(孙红文, 2013).Ma等(2019)指出, 玉米秸秆和稻壳生物炭胶体对邻苯二甲酸二乙酯的吸附量可达27.6~33.9 mg·g-1显著高于大颗粒生物炭(11.9~12.7 mg·g-1).因此, 具有高迁移活性的生物炭胶体很可能作为土壤污染物迁移的载体, 促进污染物在多孔介质中的迁移能力, 从而增加其环境风险(Lian et al., 2017).因此, 无论从生物炭胶体对生物炭物理性碳流失的重要贡献, 还是从生物炭胶体对环境中污染物的影响来看, 研究生物炭胶体的释放行为和机制都是非常必要的.
然而, 目前国内外关于生物炭胶体释放过程和影响因素的研究甚少, 尤其是对生物炭胶体释放机理的认识还很有限.Spokas等(2014)指出, 生物炭吸收水分和水流侵蚀冲刷破坏了生物炭的物理结构, 从而导致生物炭胶体的释放.Liu等(2018)的研究指出, 在研磨和超声作用下, 炭化程度较低的组分很容易物理破碎而形成生物炭胶体, 并且生物炭胶体产率与生物炭的O/C呈正相关.Song等(2019)认为, 植物源制备的生物炭胶体产率与其本体生物炭的灰分含量呈正相关.颗粒本体中亚微米级细颗粒(0.45~2 μm)是胶体释放的重要库源(Jiang et al., 2017).因此, 可以假设生物炭本体中亚微米级碎片是形成生物炭胶体的重要组分.生物炭的抗研磨特性是决定其亚微米级碎片率的主要因素, 抗研磨能力强, 不容易发生物理破碎(张家铭等, 2008).裂解温度和生物质来源决定了生物炭的硬度和韧性等物理特性, 从而影响了生物炭的耐磨性(Reza et al., 2012).裂解温度是影响生物炭颗粒最终力学性能的主要因素(Das et al., 2015).然而, 目前缺乏生物炭耐磨性与生物炭胶体释放之间关系的相关研究.此外, 从胶体化学的角度来看, 溶液离子强度是影响胶体释放、团聚和稳定性非常重要的因子(Borgnino et al., 2013;Sequaris et al., 2013).增加溶液离子强度将显著抑制土壤胶体的释放(Bradford et al., 2010).当溶液中NaCl浓度从10 mmol·L-1增加到800 mmol·L-1时, 牛粪生物炭和小麦秸秆生物炭胶体发生了显著的团聚, 其团聚体粒径迅速增大(Song et al., 2019).生物炭胶体的释放行为也将受到溶液离子强度的显著影响.
因此, 本研究以小麦秸秆和花生壳为制备生物炭的来源, 系统研究生物炭的裂解温度和溶液离子强度对生物炭胶体产率的影响, 分析生物炭胶体产率与生物炭性质(元素组成和耐磨特性)的相关关系, 研究结果有利于深入了解水土环境中生物炭的物理分解过程和归宿.
2 材料与方法(Materials and methods)2.1 生物炭的制备与性质表征生物炭制备原材料为小麦秸秆(WS)和花生壳(PS), 其中小麦秸秆采自江苏省连云港市, 花生壳采自山东省济宁市.将小麦秸秆和花生壳洗净, 在50 ℃烘箱中干燥24 h, 用粉碎机将秸秆和花生壳粉碎, 过50目筛, 装于密封袋中备用.将过50目筛的小麦秸秆和花生壳粉末装入250 mL陶瓷坩埚中, 压实盖上盖, 在马弗炉内热解炭化.马弗炉升温速率为5 ℃·min-1, 升温至目标温度(300、400、500、600、700 ℃), 保持目标温度6 h.将小麦秸秆和花生壳制得的生物炭分别标记为WS-BC-X和PS-BC-X, 其中X表示制备温度.
采用QM-3SP2行星式球磨机将生物炭研磨成细粉末.取10 g小麦秸秆和花生壳生物炭置于250 mL不锈钢罐中, 罐中加入150 g Ф =10 mm的不锈钢球进行研磨(Shan et al., 2016;王文祥等, 2017).球磨机转速为400 r·min-1, 单向运行, 球磨时间分别为50 min和6 h.所有制备好的生物炭样品均储存于干燥器中.生物炭pH(固液比1:50)采用pH计测定(METTLER TOLED0 S22O Seven Compact pH/离子计, Switzerland);可溶性有机碳(DOC)采用总有机碳分析仪测定(TOC-VCPH, SHIMADZU Co., Japan);生物炭的灰分含量用热重分析仪(TGA, STA-449-F3, Netzsch-Geratebau GmbH, Selb, Germany)测定.生物炭中C、H和N元素的含量采用元素分析仪测定(MicroCube, Elementar, Germany), O元素含量通过差减法得到.生物炭的表面官能团情况采用傅里叶变换红外光谱(FTIR, Tensor 27, Bruker Optics, Germany)分析.生物炭的亚微米级碎片率通过激光粒度仪测量(Microtrac S3500 particle size analyzer, American Mackie Co., USA).不同电解质溶液中生物炭胶体的Zeta电位和水动力学直径利用纳米粒度仪(Zetasizer Nano ZS 90, Malvern Instruments Ltd, English)测量.
2.2 生物炭胶体的提取在考察裂解温度对生物炭胶体产率的影响实验中, 将球磨50 min的生物炭(1 g)加入到含有电解质溶液(50 mL)的50 mL塑料离心管中, 然后在25 ℃、150 r·min-1的条件下振荡24 h, 将振荡后的悬浮液转移到50 mL的具塞比色管中.将比色管静置沉降24 h后, 根据Stokes定律得到有效粒径 < 2 μm的生物炭悬浮液(Qian et al., 2016).悬浮液使用0.45 μm醋酸纤维素膜进行过滤.滤膜上所收集的固体颗粒定义为生物炭胶体.生物炭胶体在烘箱(105 ℃)中干燥24 h, 称重来计算生物炭胶体的产率.滤液用来测定生物炭中可溶性有机碳含量.通常使用0.45 μm滤膜过滤溶液来区分天然水体中溶解和颗粒物质(Aiken et al., 2011).为了避免概念混淆, 本实验中生物炭胶体具体指粒径在0.45~2 μm之间的生物炭颗粒.为了尽可能消除粒径对生物炭胶体产率的影响, 在考察溶液离子强度(0.1、1.0和10 mmol·L-1 NaCl)对生物炭胶体产率的影响实验中, 本研究采用了球磨6 h的生物炭来提取生物炭胶体.所有实验均设置3组平行.
2.3 Derjaguin-Landau-Verwey-Overbeek(DLVO)理论DLVO理论描述胶体颗粒之间的相互作用力主要考虑了范德华力和静电力. DLVO理论将颗粒之间的总势能表示为(Derjaguin et al., 1941;Verwey et al., 1948;Liang et al., 2013):
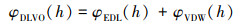 | (1) |
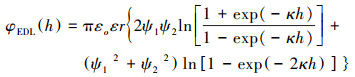 | (2) |
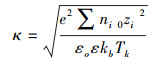 | (3) |
生物炭胶体的范德华力可用公式(4)表示:
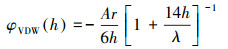 | (4) |
3 结果与讨论(Results and discussion)3.1 生物炭的理化性质两种生物炭的傅里叶变换红外光谱如图 1所示.吸收峰3419 cm-1和3425 cm-1是O—H伸缩振动峰, 1708 cm-1和1733 cm-1是羧基C=O伸缩振动吸收峰(Xiao et al., 2014), 1616 cm-1和1604 cm-1是芳香环中C=C的吸收峰(Chen et al., 2009).当裂解温度从300 ℃升高到700 ℃时, WS-BC在3419 cm-1(O—H)和1708 cm-1(C=O)处吸收峰强度逐渐减弱, 说明随着裂解温度增高, 生物炭中—OH和羧基官能团减少.类似地, PS-BC在3425 cm-1(O—H)和1733 cm-1(C=O)处吸收峰强度随着裂解温度增高也逐渐减弱.这与文献报道一致(Chen et al., 2009).WS-BC的芳香环中C=C和C=O吸收峰(1616 cm-1)强度在300~600 ℃之间逐渐增强, 在700 ℃时吸收峰强度明显减弱.类似地, PS-BC的芳香环中C=C和C=O吸收峰(1604 cm-1)强度在300~500 ℃之间逐渐增强, 在600 ℃时该吸收峰强度明显减弱, 裂解温度继续升高到700 ℃时该处吸收峰消失.这与文献报道一致(Chun et al., 2004;Chen et al., 2009), 说明在极高裂解温度下, 生物炭上芳香碳核普遍形成.1095 cm-1和462 cm-1是Si—O振动吸收峰(Xiao et al., 2014), WS-BC在1095 cm-1和462 cm-1均有明显的吸收峰, 且吸收峰强度随着裂解温度升高而增强, 说明生物炭中硅元素的累积, 这与小麦是典型的富硅植物相一致(Xiao et al., 2014;Qu et al., 2016).晶态硅(石英、方石英和鳞石英)是富硅植物制备的生物炭中灰分的重要成分(Xiao et al., 2014).生物炭灰分含量一般随着裂解温度增加而增加.在相同裂解温度下, 富硅植物制备的生物炭中灰分含量往往大于其他植物(Xiao et al., 2014).
图 1(Fig. 1)
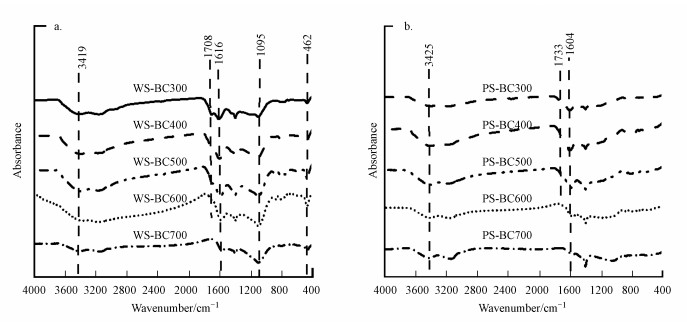 |
| 图 1 不同裂解温度下生物炭的傅里叶变换红外光谱(FTIR)图(a.WS-BC, b.PS-BC) Fig. 1FTIR spectra for biochar with different pyrolysis temperatures (a.WS-BC, b.PS-BC) |
不同生物炭的物理化学性质如表 1所示, 其结果与傅里叶变换红外光谱表征结果相一致.当裂解温度从300 ℃升高到700 ℃时, WS-BC和PS-BC的pH分别从5.7和6.2升高到9.7和9.8.高裂解温度会促进羧基、酚羟基等酸性官能团的分解和有机酸的挥发, 使得pH升高(李金文等, 2018).生物炭中的C和灰分含量随裂解温度增加而显著增加.例如, 当裂解温度从300 ℃升高到700 ℃时, WS-BC和PS-BC中C含量分别从58.2%和67.5%增加到67.3%和81.7%, 同时其灰分的含量分别从10.8%和4.5%分别增加到18.7%和6.4%.然而, WS-BC和PS-BC中的DOC、H、H/C、O/C和(O+N)/C则均随着裂解温度的升高而显著降低.例如, 当裂解温度从300 ℃升高到700 ℃时, WS-BC和PS-BC的DOC的含量分别从2.6 mg·g-1和2.2 mg·g-1降低到0.2 mg·g-1和0.04 mg·g-1.先前的研究指出生物炭中DOC的释放量与生物炭中酸性官能团的含量呈正相关(Lin et al., 2012a).H/C原子比是表征生物炭芳香性的重要指标, H/C越小则芳香性越高(马锋锋等, 2017).O/C和(O+N)/C原子比是表征生物炭极性的重要指标, O/C、(O+N)/C越大则亲水性和极性越大(马锋锋等, 2017;陈宝梁等, 2008).随着裂解温度的升高, 生物炭的芳香性逐渐增大, 而其表面极性逐渐减弱, 生物炭表面的含氧官能团逐渐消失.
表 1(Table 1)
| 表 1 生物炭的物理化学性质 Table 1 Physicochemical properties of biochars | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 生物炭的物理化学性质 Table 1 Physicochemical properties of biochars
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 生物炭的耐磨特性研磨是模拟自然条件下生物炭和矿物质物理风化的有效方法(Li et al., 2012;Spokas et al., 2014).为了考察生物炭颗粒的耐磨性(抗研磨能力), 我们测定了不同生物炭在同一球磨时间下得到的亚微米级(< 2 μm)碎片率.如图 2a所示, 不同生物炭球磨6 h后, PS-BC600和PS-BC700的亚微米级碎片率(均为91.8%)小于其他生物炭, 而其它生物炭的亚微米级碎片率基本相似(碎片率在97.2%~97.9%).这说明经过6 h的球磨可以使不同生物炭获得相似的粒径分布.如图 2b所示, 不同生物炭球磨50 min后, WS-BC和PS-BC中亚微米级碎片率(< 2 μm)的顺序均为:BC300≈ BC400 > BC500 > BC600 > BC700, 这表明在裂解温度400~700 ℃范围内, 随着裂解温度升高, 生物炭的耐磨性增强.在低温裂解制备的生物炭中, 物理破碎被认为是更显著的, 可归因于生物炭孔隙坍塌和骨架破裂(Spokas et al., 2014;Liu et al., 2018).随着裂解温度增加, 生物炭中无定型碳原子排列逐渐趋向有序性, 芳香炭逐渐共轭化, 生物炭的结构变得稳定且致密, 生物炭表现为刚性, 这使得较高裂解温度制备的生物炭具有较强的抗研磨能力.比较相同裂解温度下两种不同来源生物炭的亚微米级碎片率可知(图 2b), 在裂解温度≤ 400 ℃时, WS-BC和PS-BC的碎片率非常接近, 说明相似的耐磨性能.在裂解温度大于400 ℃时, PS-BC的碎片率明显低于WS-BC, 说明在较高的裂解温度下PS-BC的耐磨性要显著强于WS-BC.Das等(2015)对不同裂解温度和生物质原料制备的7种生物炭进行了结构-力学性能研究, 结果表明在较高裂解温度(500~900 ℃)制备的生物炭硬度较高, 且生物炭芳香越高, 其硬度和弹性系数均越高.Hu等(2016)研究了生物炭在不同裂解温度(250~650 ℃)下的硬度, 指出生物炭的亲水性官能团是影响生物炭抗压能力的主要因素, 生物炭之间以亲水性官能团为媒介形成氢键, 从而增强抗压能力.
图 2(Fig. 2)
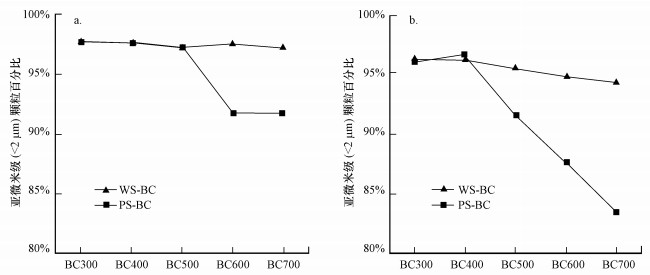 |
| 图 2 生物炭中亚微米级(< 2 μm)颗粒含量(a.球磨6 h, b.球磨50 min) Fig. 2Cumulative distribution of submicron fragments (< 2 μm) of biocahr (a. ball milling for 6 h, b. ball milling for 50 min) |
3.3 裂解温度对生物炭胶体产率的影响不同裂解温度制备的生物炭在溶液离子强度为1 mmol·L-1条件下的生物炭胶体产率如图 3所示.两种生物炭的胶体产率均受到裂解温度的显著影响.在裂解温度为300~500 ℃之间时, WS-BC和PS-BC的胶体产率均较高, 分别为369.1~401.7 mg·g-1和276.5~325.4 mg·g-1, 且受裂解温度变化的影响较小.当裂解温度大于500 ℃时, WS-BC和PS-BC的胶体产率均显著降低.WS-BC600和WS-BC700的胶体产率比WS-BC500的胶体产率分别下降了31%和95%;PS-BC600和PS-BC700的胶体产率比PS-BC500的胶体产率分别下降了83%和99%.这说明600 ℃以上高温裂解制备的生物炭胶体产率显著低于中低温制备的生物炭.Liu等(2018)研究指出, 当裂解温度从300 ℃升高到600 ℃时, 从本体生物炭中释放的纳米级生物炭产率降低, 这是因为中低温裂解生物炭中碳化程度较低的组分更易于被物理分解为纳米级生物炭.不仅如此, 高温裂解生物炭石墨微晶的结构和硬度也会降低其物理分解的可能性(Braadbaart et al., 2009;Naisse et al., 2015), 生物炭胶体更加容易从低温裂解制备的生物炭中释放出来.在相同的裂解温度下, 生物质来源对生物炭胶体产率有显著影响.PS-BC在溶液离子强度为1 mmol·L-1条件下的生物炭胶体产率均低于WS-BC的生物炭胶体产率.当裂解温度为300、400、500、600、700 ℃时, PS-BC比WS-BC的生物炭胶体产率分别低了25.4%、11.8%、28.1%、81.5%和96.4%.由此可见, 高裂解温度(≥ 600 ℃)时, PS-BC的胶体产率极显著低于WS-BC.
图 3(Fig. 3)
 |
| 图 3 不同裂解温度生物炭胶体产率(溶液离子强度为1 mmol·L-1) Fig. 3Yield of biochar colloids with different pyrolysis temperatures (IS= 1 mmol·L-1) |
如前文所述, 裂解温度决定了同一生物质来源生物炭的化学组成和耐磨特性.为了更好地探讨生物炭胶体产率与裂解温度的关系, 本研究作了两种生物炭胶体产率与其生物炭各项性质的相关性分析, 其结果如表 2所示.尽管以往有研究表明生物炭胶体产率与O/C和灰分呈显著相关性(Qu et al., 2016;Song et al., 2019), 但是本研究的结果显示, WS-BC和PS-BC的胶体产率与生物炭的化学组成, 如DOC、C、O、H/C、O/C、(O+N)/C和灰分均没有显著相关性.这可能是本实验的生物质来源与文献不同所致, 说明生物炭胶体产率与其化学性质的关系受到生物质来源的影响.Song等(2019)研究也发现动物粪便制备的生物炭胶体产率与其灰分没有显著相关性.Liu等(2019)指出木本生物炭释放的生物炭胶体产率低于草本和粪便生物炭, 这主要与木质素热稳定性高有关.然而, 值得注意的是WS-BC和PS-BC的胶体产率均与其亚微米级碎片率呈显著正相关(p < 0.05)(表 2), 这说明生物炭的胶体产率与其亚微米级碎片率有着密切关系, 即生物炭中亚微米级碎片率越高, 生物炭胶体产率越高.这也说明生物炭胶体的释放行为与其抗研磨能力密切相关, 即生物炭的耐磨性越强, 生物炭胶体的产率越低.因此, 增加裂解温度通过增强同一生物质来源生物炭的耐磨性, 从而降低相同研磨条件下生物炭中亚微米级碎片率, 最终导致生物炭胶体产率降低.此外, 生物炭胶体的释放与其抗研磨能力的关系也适用于不同来源生物炭之间的比较.在不考虑生物炭来源的情况下, 生物炭胶体产率与其亚微米级碎片率之间依然存在显著的正相关关系(p=0.009).这说明较高的PS-BC耐磨性可能是造成相同离子强度下PS-BC的胶体产率低于WS-BC的重要原因.
表 2(Table 2)
| 表 2 生物炭胶体产率(IS=1 mmol·L-1)与生物炭性质Pearson相关性分析结果(p值)(n=5) Table 2 Analysis of the Pearson correlation between the yield of biochar colloids (IS=1 mmol·L-1) and biochar properties (p value) (n=5) | ||||||||||||||||||||||||||||||||||||
表 2 生物炭胶体产率(IS=1 mmol·L-1)与生物炭性质Pearson相关性分析结果(p值)(n=5) Table 2 Analysis of the Pearson correlation between the yield of biochar colloids (IS=1 mmol·L-1) and biochar properties (p value) (n=5)
| ||||||||||||||||||||||||||||||||||||
3.4 溶液离子强度对生物炭胶体产率的影响不同溶液离子强度下生物炭胶体产率如图 4所示.生物炭的胶体产率受到溶液离子强度的显著影响.当溶液离子强度从0.1 mmol·L-1增加到1 mmol·L-1时, WS-BC和PS-BC的生物炭胶体产率变化很小;但离子强度进一步从1 mmol·L-1增加到10 mmol·L-1时, WS-BC和PS-BC的生物炭胶体产率均显著降低, 其降低的程度因裂解温度不同而不同.当溶液离子强度从1 mmol·L-1增加到10 mmol·L-1时, WS-BC300、WS-BC400、WS-BC500、WS-BC600和WS-BC700的生物炭胶体产率分别从290.4、328.6、339.2、162.9和51.1 mg·g-1下降到258.2、215.1、58.5、12.3和1.4 mg·g-1, 分别降低了11.1%、34.5%、82.8%、92.5%和97.2%.由此可见, 在裂解温度≥500 ℃时WS-BC胶体产率受溶液离子强度影响极大(抑制率超过80%), 而裂解温度低于500 ℃时, 生物炭胶体产率受溶液离子强度影响相对较小(抑制率小于35%).这说明在溶液离子强度为10 mmol·L-1时, 中低温(300~500 ℃)制备的小麦秸秆生物炭胶体形成过程对其碳流失贡献不可以忽视, 而高温制备(600~700 ℃)的小麦秸秆生物炭胶体形成过程对其碳流失贡献很小.类似地, 当溶液离子强度从1 mmol·L-1增加到10 mmol·L-1时, PS-BC300、PS-BC400、PS-BC500、PS-BC600和PS-BC700的生物炭胶体产率分别从233.6、212.6、317.8、78.7和1.0 mg·g-1下降到207.5、7.7、32.9、25.3和0.4 mg·g-1, 分别降低了11.2%、96.4%、89.6%、67.8%和60.0%.这说明PS-BC在裂解温度≥ 400 ℃时生物炭胶体产率受溶液离子强度影响极大, 而仅PS-BC300受溶液离子强度影响较小.这一结果也意味着, 在溶液离子强度为10 mmol·L-1时, 300 ℃制备的花生壳生物炭胶体形成过程对其碳流失贡献不可以忽视, 而中高温(400~700 ℃)制备的花生壳生物炭胶体形成过程对其碳流失贡献很小.
图 4(Fig. 4)
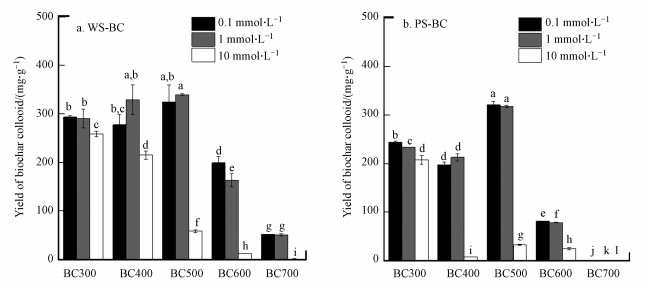 |
| 图 4 不同溶液离子强度条件下生物炭胶体产率(a.WS-BC, b.PS-BC, 对于同一来源生物炭而言, 图中不同的字母表示不同处理之间存在显著性差异, p < 0.05) Fig. 4Yield of biochar colloids in solutions with various ionic strengths (a.WS-BC, b. PS-BC, For a given biochar, the different letters indicate significant difference (p < 0.05) amongst different treatments) |
一般认为, 溶液离子强度能显著地影响胶体的团聚和沉降性能, 影响其在环境中的稳定性(Borgnino et al., 2013;Sequaris et al., 2013).先前的研究表明, 离子强度的增加抑制了胶体的释放, 因为阳离子浓度的增加压缩了胶体的双电层, 降低了胶体颗粒的斥力(Chowdhury et al., 2015).DLVO胶体稳定性理论认为, 胶体的形成和稳定在一定条件下取决于胶粒之间相互作用位能, 小颗粒需要克服团聚作用才能形成稳定的胶体.不同溶液离子强度下生物炭胶体颗粒间的DLVO能量计算如图 5所示.当溶液离子强度≤ 1 mmol·L-1时, 所有生物炭胶体间均存在较高的排斥作用能垒(384~919 kT), 且不存在负值的次级吸引势阱(第二极小值), 说明此时溶液条件不利于生物炭胶体的团聚.然而, 当离子强度从1 mmol·L-1增加到10 mmol·L-1时, 生物炭胶体排斥作用能垒依然大于200 kT, 但出现了负值的次级吸引势阱(-5.0~-9.4 kT), 表明此时吸引作用主要由次级吸引势阱控制.胶体颗粒会因为负值的次级吸引势阱的存在而发生团聚, 尽管这样的团聚作用是可逆的(Ma et al., 2015;杨雯等, 2017).离子强度增大使得生物炭胶体颗粒因为次级吸引势阱的存在而发生团聚, 从而减少了生物炭胶体的释放.此外, 由于表面电荷的异质性和空间位阻作用, DOC被认为是能够显著抑制纳米颗粒和生物炭胶体团聚的有效分散剂(Lin et al., 2012b;Lin et al., 2008;Yang et al., 2019).低温裂解生物炭胶体产率受离子强度影响较小可能与其较高的DOC有关.例如WS-BC300中DOC的含量为2.6 mg·g-1, 而WS-BC700中只有0.20 mg·g-1(表 1).DOC产生的空间位阻作用抵消了离子强度增加导致的团聚作用, 使得生物炭胶体稳定性增强.同样地, WS-BC400受离子强度的影响小于PS-BC400(图 4), 这可能与WS-BC400中的DOC含量(1.8 mg·g-1)显著高于PS-BC400(1.1 mg·g-1)有关.
图 5(Fig. 5)
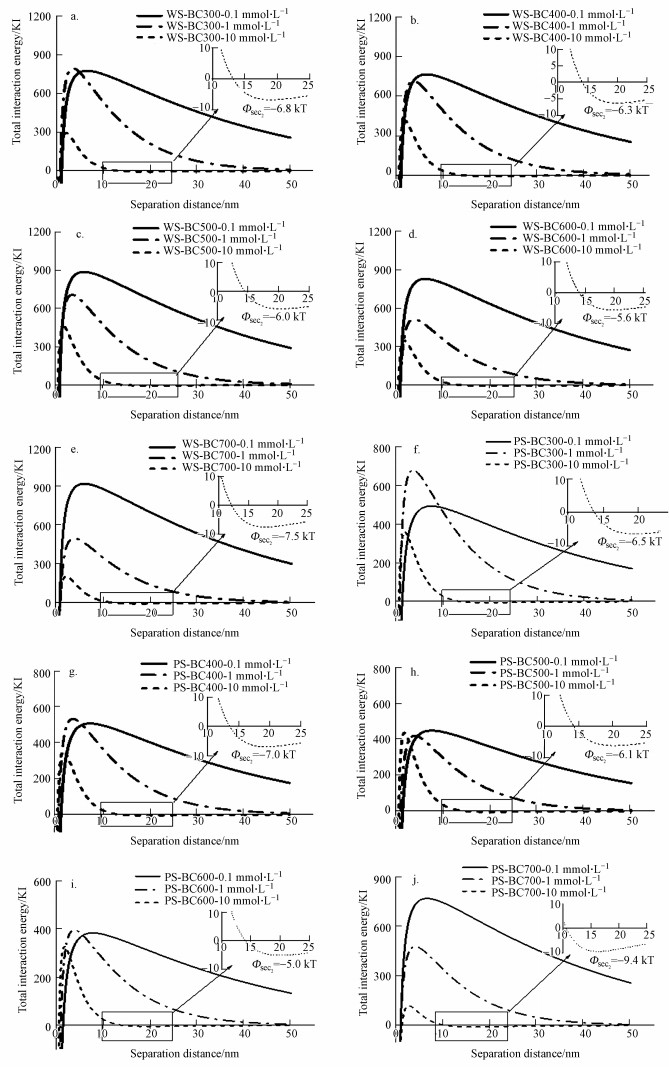 |
| 图 5 不同溶液离子强度下生物炭胶体颗粒间的DLVO能量分布(a~e.WS-BC, f~j.PS-BC) Fig. 5The calculation of DLVO energy between biochar colloids under different ionic strengths (a~e. WS-BC, f~j. PS-BC) |
4 结论(Conclusions)生物炭的裂解温度、来源和溶液离子强度对生物炭胶体产率有显著影响.生物炭的耐磨性随着裂解温度升高而增强.在裂解温度为300~500 ℃之间时, WS-BC和PS-BC的胶体产率均较高, 分别为369~401.7 mg·g-1和276.5~325.4 mg·g-1.当裂解温度≥600 ℃时, WS-BC和PS-BC的胶体产率均显著降低, 且PS-BC的胶体产率显著低于WS-BC.WS-BC和PS-BC的胶体产率均与其亚微米级碎片率呈显著正相关(p < 0.05), 这说明生物炭胶体的释放行为与其抗研磨能力密切相关, 即生物炭的耐磨性越强, 生物炭胶体的产率越低.溶液离子强度对生物炭胶体产率有重要影响, 其影响程度因裂解温度而异.当溶液离子强度从0.1 mmol·L-1增加到1 mmol·L-1时, WS-BC和PS-BC的生物炭胶体产率变化很小.但离子强度进一步从1 mmol·L-1增加到10 mmol·L-1时, 生物炭胶体产率明显降低:WS-BC300、WS-BC400、WS-BC500、WS-BC600和WS-BC700的生物炭胶体产率分别从290.4、328.6、339.2、162.9和51.1 mg·g-1下降到258.2、215.1、58.5、12.3和1.4 mg·g-1, PS-BC300、PS-BC400、PS-BC500、PS-BC600和PS-BC700的生物炭胶体产率分别从233.6、212.6、317.8、78.7和1.0 mg·g-1下降到207.5、7.7、32.9、25.3和0.4 mg·g-1.本研究结果进一步证明了环境中生物炭胶体造成的生物炭碳流失过程是不可忽视的, 尤其是中低温裂解的生物炭, 同时也为生物炭在环境中物理分解和归趋增加了新的认知.
参考文献
| Ahmad M, Rajapaksha A U, Lim J E, et al. 2014. Biochar as a sorbent for contaminant management in soil and water:A review[J]. Chemosphere, 99(3): 19-33. |
| Aiken G R, Hsu-Kim H, Ryan J N. 2011. Influence of dissolved organic matter on the environmental fate of metals, nanoparticles, and colloids[J]. Environmental Science & Technology, 45(8): 3196-3201. |
| Braadbaart F, Poole I, Brussel A A V. 2009. Preservation potential of charcoal in alkaline environments:an experimental approach and implications for the archaeological record[J]. Journal of Archaeological Science, 36(8): 1672-1679. |
| Bradford S A, Kim H. 2010. Implications of cation exchange on clay release and colloid-facilitated transport in porous media[J]. Journal of Environmental Quality, 39(6): 2040-2046. |
| Borgnino L. 2013. Experimental determination of the colloidal stability of Fe(Ⅲ)-montmorillonite:Effects of organic matter, ionic strength and pH conditions[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 423: 178-187. |
| 陈宝梁, 周丹丹, 朱利中, 等. 2008. 生物碳质吸附剂对水中有机污染物的吸附作用及机理[J]. 中国科学(B辑:化学), 38(6): 530-537. |
| Chen M, Wang D, Yang F, et al. 2017. Transport and retention of biochar nanoparticles in a paddy soil under environmentally-relevant solution chemistry conditions[J]. Environmental Pollution, 230: 540-549. |
| Chen M, Alim N, Zhang Y, et al. 2018. Contrasting effects of biochar nanoparticles on the retention and transport of phosphorus in acidic and alkaline soils[J]. Environmental Pollution, 239: 562-570. |
| Chen B, Chen Z. 2009. Sorption of naphthalene and 1-naphthol by biochars of orange peels with different pyrolytic temperatures[J]. Chemosphere, 76(1): 127-133. |
| Chowdhury I, Mansukhani N D, Guiney L M, et al. 2015. Aggregation and stability of reduced graphene oxide:complex roles of divalent cations, pH, and natural organic matter[J]. Environmental Science & Technology, 49(18): 10886-10893. |
| Chun Y, Sheng G, Chiou C T, et al. 2004. Compositions and sorptive properties of crop residue-derived chars[J]. Environmental Science & Technology, 38(17): 4649-4655. |
| Das O, Sarmah A K, Bhattacharyya D. 2015. Structure-mechanics property relationship of waste derived biochars[J]. Science of the Total Environment, 538: 611-620. |
| Deraguin B V, Landau L. 1941. Theory of the stability of strongly charged lyophobic sols and of the adhesion of strongly charged particles in solution of electrolytes[J]. Acta Physicochim:USSR, 14: 733-762. |
| 方婧, 金亮, 程磊磊, 等. 2019. 环境中生物质炭稳定性研究进展[J]. 土壤学报, (5): 1034-1047. |
| 韩旸, 多立安, 刘仲齐, 等. 2017. 生物炭颗粒的分级提取、表征及其对磺胺甲噁唑的吸附性能研究[J]. 环境科学学报, 37(6): 2181-2189. |
| Hu Q, Yang H, Yao D, et al. 2016. The densification of bio-char:Effect of pyrolysis temperature on the qualities of pellets[J]. Bioresource Technology, 200: 521-527. |
| Jeffery S, Verheijen F G A, Velde M V D, et al. 2011. A quantitative review of the effects of biochar application to soils on crop productivity using meta-analysis[J]. Agriculture Ecosystems & Environment, 144(1): 175-187. |
| Jiang C L, Sequaris J M, Vereecken H, et al. 2017. Effects of temperature and associated organic carbon on the fractionation of water-dispersible colloids from three silt loam topsoils under different land use[J]. Geoderma, 299: 43-53. |
| 李金文, 顾凯, 唐朝生, 等. 2018. 生物炭对土体物理化学性质影响的研究进展[J]. 浙江大学学报(工学版), 52(1): 192-206. |
| Li W, He Y, Wu J, et al. 2012. Extraction and characterization of natural soil nanoparticles from Chinese soils[J]. European Journal of Soil Science, 63(5): 754-761. |
| Lian F, Xing B S. 2017. Black carbon (biochar) in water/soil environments:molecular structure, sorption, stability, and potential risk[J]. Environmental Science & Technology, 51(23): 13517-13532. |
| Liang Y, Bradford S A, Simunek J, et al. 2013. Sensitivity of the transport and retention of stabilized silver nanoparticles to physicochemical factors[J]. Water Research, 47(7): 2572-2582. |
| Lehmann J. 2007. A handful of carbon[J]. Nature, 447(7141): 143-144. |
| Lin D H, Xing B S. 2008. Tannic acid adsorption and its role for stabilizing carbon nanotube suspensions[J]. Environmental Science & Technology, 42(16): 5917-5923. |
| Lin Y, Munroe P, Joseph S, et al. 2012a. Water extractable organic carbon in untreated and chemical treated biochars[J]. Chemosphere, 87(2): 151-157. |
| Lin D H, Li T T, Yang K, et al. 2012b. The relationship between humic acid (HA) adsorption on and stabilizing multiwalled carbon nanotubes (MWNTs) in water:Effects of HA, MWNT and solution properties[J]. Journal of Hazardous Materials, 241: 404-410. |
| Liu C H, Chu W, Li H, et al. 2019. Quantification and characterization of dissolved organic carbon from biochars[J]. Geoderma, 335: 161-169. |
| Liu G C, Zheng H, Jiang Z X, et al. 2018. Formation and physicochemical characteristics of nano biochar:Insight into chemical and colloidal stability[J]. Environmental Science & Technology, 52(18): 10369-10379. |
| 马锋锋, 赵保卫. 2017. 不同热解温度制备的玉米芯生物炭对对硝基苯酚的吸附作用[J]. 环境科学, 38(2): 837-844. |
| Ma S, Zhou K J, Yang K, et al. 2015. Heteroagglomeration of oxide nanoparticles with algal cells:effects of particle type, ionic strength and pH[J]. Environmental Science & Technology, 49(2): 932-939. |
| Ma S Q, Jing F Q, Sohi S P, et al. 2019. New insights into contrasting mechanisms for PAE adsorption on millimeter, micron- and nano-scale biochar[J]. Environmental Science and Pollution Research, 26(18): 18636-18650. |
| Naisse C, Girardin C, Lefevre R, et al. 2015. Effect of physical weathering on the carbon sequestration potential of biochars and hydrochars in soil[J]. GCB Bioenergy, 7(3): 488-496. |
| Novak J M, Busscher W J, Laird D L, et al. 2009. Impact of biochar amendment on fertility of a southeastern coastal plain soil[J]. Soil Science, 174(2): 105-112. |
| Qian L, Zhang W, Yan J, et al. 2016. Effective removal of heavy metal by biochar colloids under different pyrolysis temperatures[J]. Bioresource Technology, 206: 217-224. |
| Qu X L, Fu H Y, Mao J D, et al. 2016. Chemical and structural properties of dissolved black carbon released from biochars[J]. Carbon, 96: 759-767. |
| Ravi S, Sharratt B S, Li J, et al. 2016. Particulate matter emissions from biochar-amended soils as a potential trade off to the negative emission potential[J]. Scientific Reports, 6: 35984. |
| Reza M T, Lynam J G, Vasquez V R, et al. 2012. Pelletization of biochar from hydrothermally carbonized wood[J]. Environmental Progress & Sustainable Energy, 31(2): 225-234. |
| 孙红文. 2013. 生物炭与环境[M]. 北京: 化学工业出版社. |
| Saleh N B, Pfefferle L D, Elimelech M. 2008. Aggregation kinetics of multiwalled carbon nanotubes in aquatic systems:measurements and environmental implications[J]. Environmental Science & Technology, 42(21): 7963-7969. |
| Sequaris J M, Klumpp E, Vereecken H. 2013. Colloidal properties and potential release of water-dispersible colloids in an agricultural soil depth profile[J]. Geoderma, 193: 94-101. |
| Shan D, Deng S, Zhao T, et al. 2016. Preparation of ultrafine magnetic biochar and activated carbon for pharmaceutical adsorption and subsequent degradation by ball milling[J]. Journal of Hazardous Materials, 305: 156-163. |
| Song B Q, Chen M, Zhao L, et al. 2019. Physicochemical property and colloidal stability of micron- and nano-particle biochar derived from a variety of feedstock sources[J]. Science of the Total Environment, 661: 685-695. |
| Sotirelis N P, Chrysikopoulos C V. 2017. Heteroaggregation of graphene oxide nanoparticles and kaolinite colloids[J]. Science of the Total Environment, 579: 736-744. |
| Spokas K A, Novak J M, Masiello C A, et al. 2014. Physical disintegration of biochar:An overlooked process[J]. Environmental Science & Technology Letters, 1(8): 326-332. |
| 王文祥, 李宝花, 周海彪, 等. 2017. 水洗-球磨法降解飞灰中二噁英的研究[J]. 环境科学学报, 37(6): 2232-2237. |
| Verwey E J W, Overbeek J T G. 1948. Theory of the stability of lyophobic colloids[J]. The Journal of Physical Chemistry, 51(3): 631-636. |
| Wang D J, Zhang W, Hao X, et al. 2013a. Transport of biochar particles in saturated granular media:effects of pyrolysis temperature and particle size[J]. Environmental Science & Technology, 47(2): 821-828. |
| Wang D J, Zhang W, Zhou D, et al. 2013b. Antagonistic effects of humic acid and iron oxyhydroxide grain-coating on biochar nanoparticle transport in saturated sand[J]. Environmental Science & Technology, 47(10): 5154-5161. |
| Wang Y, Zhang W, Shang J, et al. 2019. Chemical aging changed aggregation kinetics and transport of biochar colloids[J]. Environmental Science & Technology, 53(14): 8136-8146. |
| Xiao X, Chen B, Zhu L. 2014. Transformation, morphology, and dissolution of silicon and carbon in rice straw-derived biochars under different pyrolytic temperatures[J]. Environmental Science & Technology, 48(6): 3411-3419. |
| Yang W, Shang J Y, Sharma P, et al. 2019. Colloidal stability and aggregation kinetics of biochar colloids:Effects of pyrolysis temperature, cation type, and humic acid concentrations[J]. Science of the Total Environment, 658: 1306-1315. |
| 杨雯, 郝丹丹, 徐东昊, 等. 2017. 生物炭颗粒在饱和多孔介质中的迁移与滞留[J]. 土壤通报, 48(2): 304-312. |
| Zimmerman A R, Gao B, Ahn M Y. 2011. Positive and negative carbon mineralization priming effects among a variety of biochar-amended soils[J]. Soil Biology & Biochemistry, 43(6): 1169-1179. |
| 张家铭, 张凌, 蒋国盛, 等. 2008. 剪切作用下钙质砂颗粒破碎试验研究[J]. 岩土力学, (10): 2789-2793. |
