 , 司杰, 钟转有, 黄璜
, 司杰, 钟转有, 黄璜

中山大学环境科学与工程学院, 广东省环境污染控制与修复技术重点实验室, 广州 510006
收稿日期: 2019-07-31; 修回日期: 2019-09-12; 录用日期: 2019-09-12
基金项目: 广州市科技计划项目(No.201904010125);国家自然科学基金青年科学基金项目(No.51408619)
作者简介: 程冬馨(1994-), 女, E-mail:chengdx3@mail2.sysu.edu.cn
通讯作者(责任作者): 黄璜, E-mail:huang46@mail.sysu.edu.cn
摘要:在饮用水输配系统中,来源于管壁生物膜的有机物可能耗氯并生成消毒副产物(DBPs),包括二氯乙腈(DCAN)与二氯乙酰胺(DCAcAm)等高毒性含氮DBPs(N-DBPs).研究考察管网常见的细菌与其胞外聚合物(EPS)以及模拟管壁生物膜氯化与氯胺化后DCAN与DCAcAm的生成,并与天然有机物(NOM)和水源水有机物进行比较.结果显示,铜绿假单胞菌、恶臭假单胞菌与藤黄微球菌与氯反应生成的DCAN、DCAcAm浓度分别为1.48~2.02、0.21~0.38 μg·mg-1(mg-1以TOC计),高于同反应条件下NOM的生成量;相比于氯化反应,3株细菌细胞氯胺化生成的DCAN与DCAcAm浓度明显更低.3株菌的EPS也是氯与氯胺化反应生成DCAN与DCAcAm的前体物,且其氯胺化反应生成的DCAcAm浓度高于氯化反应生成的.与NOM、水源水相比,模拟管壁生物膜氯化后生成的N-DBPs与三氯甲烷(TCM)浓度比更高,表明生物膜有机物比NOM与水源水有机物更倾向生成DCAN与DCAcAm类N-DBPs,且模拟管壁生物膜氯胺化的DCAcAm生成量高于氯化反应的,说明管壁生物膜有机物是供水管网系统中DCAN与DCAcAm类N-DBPs的重要前体物.
关键词:细菌胞外聚合物氯氯胺消毒副产物
Formation of dichloroacetonitrile and dichloroacetamide from biofilms in drinking water distribution systems
CHENG Dongxin
 , SI Jie, ZHONG Zhuanyou, HUANG Huang
, SI Jie, ZHONG Zhuanyou, HUANG Huang

School of Environmental Science and Engineering, Guangdong Provincial Key Laboratory of Environmental Pollution Control and Remediation Technology, Sun Yat-sen University, Guangzhou 510006
Received 31 July 2019; received in revised from 12 September 2019; accepted 12 September 2019
Abstract: Given the regulatory presence of residual chlorine or chloramines in water distribution systems, organic matter in pipeline biofilms may consume chlorine/chloramines and form disinfection byproducts (DBPs), such as dichloroacetonitrile (DCAN) and dichloroacetamide (DCAcAm), two highly toxic nitrogenous DBPs (N-DBPs) species. The objectives of this study are to investigate the formation of DCAN and DCAcAm during chlorination and chloramination of pipeline biofilms, model bacterial cells and the corresponding extracellular polymers (EPS). DBPs formation from natural organic matter (NOM) and source water was also evaluated for comparison. The results show that DCAN and DCAcAm formation from chlorination of Pseudomonas aeruginosa, Pseudomonas putida and Micrococcus luteus selected as model species in biofilms were 1.48~2.02 μg·mg-1 and 0.21~0.38 μg·mg-1(mg-1 is per mg TOC), respectively, which were higher than those from chlorination of NOM. During chloramination, the bacterial cells formed less DCAN and DCAcAm than during chlorination. The bacterial EPS also acted as DCAN and DCAcAm precursors during chlorination and chloramination, with higher DCAcAm formation during chloramination than during chlorination. To evaluate the speciation of DBPs formed from chlorination of pipeline biofilms, the ratios of DCAN and DCAcAm concentration to trichloromethane (TCM) concentration were calculated and found to be higher than the corresponding ones for NOM and source water, suggesting that biofilms are more prone to form DCAN and DCAcAm than NOM and source water organic matter during chlorination. The biofilms formed more DCAcAm during chloramination than during chlorination. These results suggest that biofilms acted as important precursors to form DCAN and DCAcAm in drinking water distribution systems.
Keywords: bacteriaextracellular polymerschlorinechloraminesdisinfection byproducts
1 引言(Introduction)氯与氯胺是国内外给水处理中广泛使用的消毒剂(Seidel et al., 2005; 张金松等, 2016), 可有效灭活多种病原微生物, 成本低廉、使用简便, 且具有较好的持久性, 可使管网水中保持一定浓度的余氯.但是, 氯或氯胺消毒剂会与水中有机物反应生成一些具有毒害作用的消毒副产物(Disinfection byproducts, DBPs), 包括三卤甲烷等已列入水质规范中的常规DBPs与毒性更高的卤乙腈、卤乙酰胺等含氮DBPs(Nitrogenous DBPs, N-DBPs).在饮用水管网输配过程中, 水厂出水中剩余的氯或氯胺会与管网系统中的有机物反应继续生成DBPs, 造成管网水中DBPs的浓度高于水厂出水(Toroz et al., 2005; Liew et al., 2016), 降低供水的化学安全性.因此, 供水管网输配过程中的DBPs生成问题开始受到广泛关注(Fisher et al., 2018).
Rossman等的研究发现, 水样在旧管道中氯化后的三卤甲烷生成量高于在同等条件下的烧杯中的生成量, 表明在管网输配系统中, 除了水厂出水中所包含的有机物, 来源于管壁的生物膜有机物也会耗氯并生成DBPs(Rossman et al., 2001).供水管网与水长期接触的管壁上普遍存在着生物膜, 它主要由微生物细胞及其胞外聚合物(Extracellular polymers, EPS)组成.细菌是管壁生物膜中的最大种群(池年平等, 2010), 假单胞菌、鞘氨醇单胞菌、微球菌、芽孢杆菌属较为常见(Momba et al., 2000; 孙慧芳等, 2011).这些细菌细胞及其EPS富含多糖以及蛋白质等高含氮量有机物, 可为DBPs、特别是高毒性N-DBPs的生成提供有机氮来源.铜绿假单胞菌等细菌细胞与其EPS已被报道在氯消毒过程中可生成三卤甲烷、卤乙腈等DBPs(Wang et al., 2012; 2013; 刘昕等, 2012), 且管壁生物膜氯化反应生成的三卤甲烷浓度与水源水生成的相近(Xu et al., 2018).但是, 现有研究主要关注生物膜有机物氯化后常规DBPs的生成, 生物膜的卤乙酰胺类新兴N-DBPs生成情况还不清楚, 且生物膜有机物氯胺化过程中的N-DBPs生成规律还未见报道.
本文以二氯乙腈(Dichloroacetonitrile, DCAN)与二氯乙酰胺(Dichloroacetamide, DCAcAm)这两种N-DBPs为重点, 并以三氯甲烷(Trichloromethane, TCM)为典型含碳DBPs(Carbonaceous DBPs, C-DBPs)作为对照, 研究生物膜模式细菌细胞及其EPS在与氯或氯胺反应过程中的N-DBPs生成, 并考察模拟管壁生物膜的N-DBPs生成潜能.研究结果将有助于我们更好的理解与控制供水管网系统中卤乙腈与卤乙酰胺类N-DBPs的生成与变化.
2 材料与方法(Materials and methods)2.1 模式细菌悬浮液的制备与EPS提取2.1.1 模式细菌的选择在供水管网管壁生物膜的常见菌种(孙慧芳等, 2011;Wang et al., 2012)中选取3株作为模式细菌:铜绿假单胞菌Pseudomonas aeruginosa(CGMCC1.2620)、恶臭假单胞菌Pseudomonas putida(CGMCC1.3136)与藤黄微球菌Micrococcus luteus(CGMCC1.1848), 其中前二者是假单胞菌属, 为革兰氏阴性菌;后者属于微球菌属, 为革兰氏阳性菌.试验所用3株菌均购自中国普通微生物菌种保藏管理中心.
2.1.2 细菌细胞悬浮液的制备将冻存的菌种接种于肉汤培养基, 37 ℃、150 r · min-1振荡培养16~18 h.5000 r · min-1离心10 min收集菌体, 弃掉上清液, 清洗沉淀, 离心与清洗过程重复3~4次以充分去除培养基.将收集的菌体溶于高纯水中得到细菌细胞悬浮液.取少量细菌细胞悬浮液稀释混匀后利用总有机碳(TOC)分析仪(TOC-VCPH, 日本岛津)测定其TOC浓度(Huang et al., 2013).TOC浓度采用总碳与无机碳的差减法获得, 总碳与无机碳浓度通过连续3次测样取均值获得.
2.1.3 细菌EPS的提取采用阳离子交换树脂法提取细菌胞外聚合物(Wang et al., 2012).在菌悬液中按1 : 1质量比加入钠型树脂(Dowex? MarathonTM C, 20~50 mesh), 4 ℃、900 r · min-1磁力搅拌混合1 h, 随后将混合液在14000 r · min-1、4 ℃条件下离心20 min.取上清液, 0.2 μm滤膜过滤得到EPS溶液.
2.2 模拟管壁生物膜的培养采用2台模拟管道的环形反应器(Annular reactors, ARs)以实验室自来水为进水并联运行2个月培养模拟管壁生物膜, 示意图如图 1所示(Xing et al., 2017).反应器有效容积2 L, 水力停留时间2 h, 即通过蠕动泵控制进水流速为16.7 mL · min-1.每台反应器装载20个载片, 载片挂膜面积为11.8 cm2.载片安装于反应器旋转内柱表面, 电机转速为110 r · min-1.2台反应器分别安装铜载片与PVC载片.使用前铜制载片用无菌去离子水冲洗, 高压灭菌锅中121 ℃、15 min灭菌;PVC载片用3 g · L-1的次氯酸钠溶液浸泡24 h后用无菌去离子水冲洗干净.生物膜形成后, 选取部分载片用于生物量测定, 用无菌水冲洗载片表面除去残留营养物质, 采用超声波振荡剥离(张晓健等, 2006)后获得细菌细胞悬浮液.用异养菌平板计数法(HPC)测定细菌总数, 并按照2.1.2节中方法测定该细菌细胞悬浮液TOC浓度, 结果均换算成单位面积表示, 分别用于表征生物膜的生物量与有机物含量.
图 1(Fig. 1)
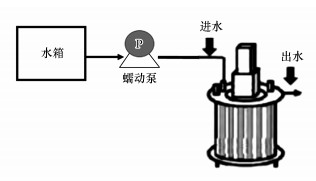 |
| 图 1 环形反应器示意图 Fig. 1Schematic diagram of the annular reactor |
2.3 天然有机物(NOM)溶液及水源水的获取将Suwannee river NOM粉末(Cat. No. 2R101N, 国际腐殖质协会)于超纯水中搅拌溶解, 通过0.45 μm滤膜过滤得到NOM储备液, 并通过稀释测定其TOC浓度.将储备液用超纯水稀释至TOC为2或5 mg · L-1的溶液用于氯化试验.水源水水样为地表水, 取自佛山某水厂进水, 经过0.45 μm滤膜过滤后用于氯化试验.
2.4 氯(胺)化试验反应在40 mL棕色玻璃瓶中、无顶空25 ℃条件下遮光进行.用20 mmol · L-1磷酸盐缓冲液将各溶液pH值维持在7.0.氯化反应投加次氯酸钠溶液, 氯胺化反应投加预制备的一氯胺.达到预定的反应时间, 以过量抗坏血酸去除余氯(胺)后测定DBPs.
为考察细菌的DBPs生成, 将3种细菌细胞悬浮液稀释至TOC为2 mg · L-1, 氯与一氯胺投量为5 mg · L-1, 反应24 h.为考察细菌EPS的DBPs生成, 配制TOC为5 mg · L-1的EPS溶液, 按DBPs生成潜能测试方法进行氯与氯胺化实验(Krasner et al., 2007), 即投加25 mg · L-1(3×TOC+8×NH3-N+10)的氯反应24 h或投加15 mg · L-1(3×TOC)的氯胺反应72 h.为考察生物膜的DBPs生成, 将生长有生物膜的铜管或PVC载片浸没在缓冲溶液中, 投加40~60 mg · L-1的氯或氯胺(管材载片耗氯, 高投量以保证余氯), 反应24 h.空白的铜管与PVC载片进行相同的反应, 未测出DBPs生成.为比较生物膜有机物与水中NOM的DBPs生成, 同时对NOM溶液与水源水水样进行氯化试验.
2.5 DBPs分析方法以甲基叔丁基醚为萃取液进行液液萃取后采用带电子捕获检测器的气相色谱仪(GC/ECD, GC7890A, 美国安捷伦)测定.DCAN与TCM测定利用DB-5色谱柱, 柱温程序:35 ℃保持9 min;以2 ℃ · min-1的速度升至40 ℃, 保持1 min;以20 ℃ · min-1的速度升至160 ℃, 保持5 min.DCAcAm测定利用DB-1701色谱柱, 柱温程序:35 ℃保持3 min;以20 ℃ · min-1的速度升至220 ℃保持1.5 min.检测器ECD温度为290 ℃, 吹扫平均流速为18.7 cm · s-1.
3 结果与讨论(Results and discussion)3.1 模式细菌的DBPs生成细菌细胞是管壁生物膜的主要组成.以管网生物膜中普遍存在的铜绿假单胞菌、恶臭假单胞菌与藤黄微球菌为模式细菌, 考察细菌细胞在氯化过程中DBPs的生成, 并与NOM的进行比较, 如图 2所示.在相同的氯化反应下, 3种细菌细胞生成的3种DBPs浓度相近, 与前人发现的细菌DBPs生成水平一致(Wang et al., 2012;刘昕等, 2012; Huang et al., 2013).TCM生成量为5.96~7.09 μg · mg-1(mg-1以TOC计, 全文同), 远低于NOM的生成量;但DCAN生成量为1.48~2.02 μg · mg-1, 高于NOM的生成量;DCAcAm生成量为0.21~0.38 μg · mg-1, 是NOM生成量的1.8~3.1倍.这表明模式细菌细胞及其胞外有机质在氯化过程中生成DCAN与DCAcAm类N-DBPs的能力可能比NOM的更高.前期研究发现大肠杆菌等细菌细胞中的有机氮含量达到0.26~0.34 mg · mg-1(Huang et al., 2013), 远高于NOM中0.004 mg · mg-1的有机氮含量(Huang et al., 2017), 因此细菌有机物的高DCAN、DCAcAm生成量可能与其高有机氮含量有关.
图 2(Fig. 2)
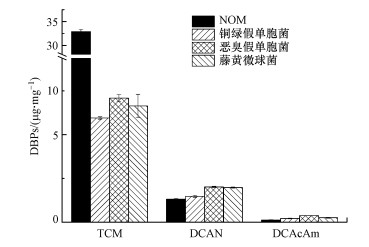 |
| 图 2 生物膜典型细菌与NOM氯化反应的DBPs生成(TOC: 2 mg · L-1, Cl2:5 mg · L-1, t :24 h, pH:7.0) Fig. 2DBPs formation from chlorination of model bacterial cells in biofilms and NOM |
进一步考察3株细菌细胞与氯胺反应的DCAN、DCAcAm生成特性, 并与氯化反应的进行比较, 如图 3所示.在消毒剂投加量与接触时间相同的条件下, 3株细菌细胞氯胺化生成的DCAN与DCAcAm浓度均明显小于氯化生成的.进一步考察恶臭假单胞菌在氯化与氯胺化反应不同时间点的DCAN与DCAcAm生成, 如图 4所示.随着时间增加, 恶臭假单胞菌细胞氯化的DCAN与DCAcAm生成量逐渐增加, 均远大于相同条件下氯胺化反应的生成量, 且差距随时间增加而增大.与氯化反应相比, NOM等水中溶解性有机物氯胺化生成的DCAN浓度更低, 却可生成更高浓度的DCAcAm(Huang et al., 2017).细菌细胞氯(胺)化的DCAN生成规律与溶解性有机物一致, 但其氯胺化的DCAcAm生成量小于氯化的, 可能与游离氯破坏细胞膜造成胞内物质释放并与其反应生成DBPs, 而氯胺对细胞损伤较小胞内物质释放较少有关(Huang et al., 2013).
图 3(Fig. 3)
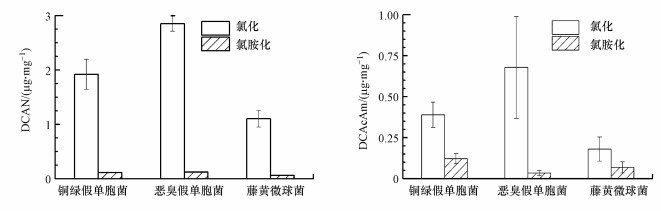 |
| 图 3 生物膜典型细菌细胞氯(胺)化反应的DCAN与DCAcAm生成比较(TOC: 2 mg · L-1, Cl2/NH2Cl: 5 mg · L-1, t: 72 h, pH: 7.0) Fig. 3Comparison of DCAN and DCAcAm formation between chlorination and chloramination of model bacterial cells |
图 4(Fig. 4)
 |
| 图 4 恶臭假单胞菌细胞氯(胺)化反应的DCAN与DCAcAm生成特性(TOC: 2 mg · L-1, Cl2/NH2Cl: 5 mg · L-1, pH: 7.0) Fig. 4DCAN and DCAcAm formation during chlorination and chloramination of Pseudomonas putida cells |
3.2 细菌EPS的DBPs生成EPS是生物膜中微生物分泌的包裹着细胞的多糖、蛋白质等组成的大分子聚合物, 占生物膜有机物总量的80%以上(Wang et al., 2013; Coburn et al., 2016), 可与水中扩散至生物膜的消毒剂反应从而对生物膜中微生物起保护作用, 同时耗氯并生成DBPs.因此, 提取3株细菌的EPS, 考察其与氯或氯胺反应的DCAN与DCAcAm生成潜能, 如图 5所示.3株细菌EPS与氯反应的DCAN生成潜能为0.15~0.55 μg · mg-1, 略低于文献中1 μg · mg-1左右的浓度水平(Wang et al., 2012; 2013), 这可能与菌株以及氯化条件的不同有关.细菌EPS氯化后生成0.02~0.11 μg · mg-1的DCAcAm, 显著低于DCAN的生成潜能.但3株细菌EPS氯胺化后的DCAcAm生成潜能与DCAN生成潜能相近, 且高于氯化反应的DCAcAm生成潜能.这表明细菌EPS是可与氯、氯胺反应生成卤乙腈与卤乙酰胺类N-DBPs的前体物.
图 5(Fig. 5)
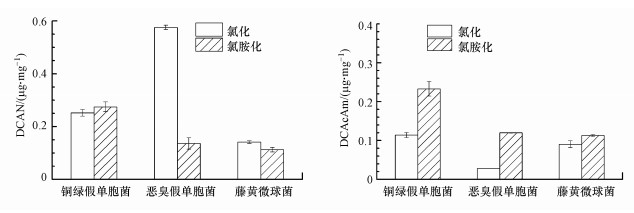 |
| 图 5 生物膜典型细菌EPS氯(胺)化的DCAN与DCAcAm生成潜能(TOC: 5 mg · L-1, pH: 7.0, Cl2: 25 mg · L-1, t: 24 h; NH2Cl: 15 mg · L-1, t: 72 h) Fig. 5Formation potential of DCAN and DCAcAm during chlorination and chloramination of EPS of model bacteria in biofilms |
由于DBPs生成潜能测试中, 氯化与氯胺化反应的消毒剂投量与反应时间均不相同, 进一步针对恶臭假单胞菌EPS, 比较其在氯化与氯胺化反应相同投氯量下不同时间点的DCAN与DCAcAm生成, 如图 6所示.恶臭假单胞菌EPS氯化过程中DCAN浓度随时间先升高, 12 h后迅速下降, 但氯胺化的DCAN浓度在48 h内随时间逐渐升高, 造成24 h内DCAN生成量在氯化过程中更高, 但后期则在氯胺化过程中更高;DCAcAm的生成量在氯化与氯胺化过程中则先升高后趋于平稳, 且12 h后氯胺化反应的生成量便明显高于氯化反应的.与细胞氯胺化的DCAcAm生成量明显小于氯化的不同, EPS氯胺化生成的DCAcAm浓度明显高于氯化的, 与NOM的规律相同(Huang et al., 2017).这可能由于提取的EPS与NOM均可直接与水中氯胺反应, 但细菌细胞需要被氯胺破坏释放出胞内有机物再作为前体物与氯胺反应.这表明在输送氯胺消毒出水的管网中, 生物膜EPS也可能是管网水中DCAN与DCAcAm类N-DBPs生成的重要前体物.
图 6(Fig. 6)
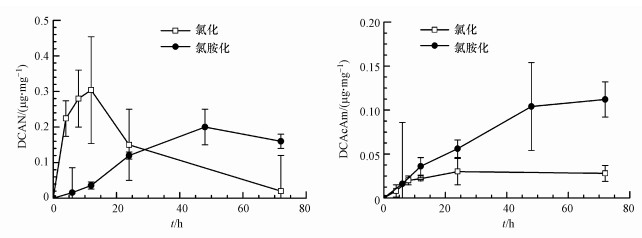 |
| 图 6 恶臭假单胞菌EPS氯(胺)化的DCAN与DCAcAm生成特性(TOC: 5 mg · L-1, Cl2/NH2Cl: 20 mg · L-1, pH: 7.0) Fig. 6Formation of DCAN and DCAcAm during chlorination and chloramination of Pseudomonas putida EPS |
3.3 模拟管壁生物膜的DBPs生成为了考察生物膜的N-DBPs生成, 利用AR反应器培养模拟管壁生物膜.获得的铜管载片生物膜与PVC管载片生物膜的细菌总数分别为310、730 CFU · cm-2, TOC含量分别为3.0、2.1 μg · cm-2.与PVC管材相比, 铜管对生物膜生长有一定的抑制作用, 但其生物膜TOC含量却相对较高, 可能与铜离子的胁迫作用促进菌群分泌更多的EPS有关, 有待进一步的研究.
将载片生物膜进行氯化与氯胺化反应, 考察24 h后DCAN与DCAcAm的生成量, 如图 7所示.生物膜氯化反应的DCAN、DCAcAm生成量分别为0.38~2.30 μg · mg-1、0.13~0.82 μg · mg-1;氯胺化反应的DCAN、DCAcAm生成量分别为0.32~1.64 μg · mg-1、0.42~1.37 μg · mg-1.随着氯或氯胺投加量的增大, 生物膜的DCAN与DCAcAm生成量逐渐增大.在氯化过程中, 铜管与PVC管载片生物膜的DCAN生成量均明显高于DCAcAm;在氯胺化过程中, PVC管载片生物膜的DCAcAm生成量可超过DCAN生成量.前文发现细菌细胞及其EPS在氯化、氯胺化后均可生成DCAN与DCAcAm, 因此由其组成的生物膜生成DCAN与DCAcAm并不意外, 生物膜中的微生物细胞与EPS可能都参与了DBPs的生成反应.但比较生物膜、细菌细胞及其EPS氯化与氯胺化反应中N-DBPs的生成, 发现生物膜氯胺化的DCAcAm生成量均高于氯化的, 与细菌EPS的DCAcAm生成规律类似, 与细菌细胞的DCAcAm生成规律相反.此外, 铜管生物膜氯胺化的DCAN生成量也高于氯化的, 与恶臭假单胞菌EPS长时间反应的DCAN生成规律类似.这可能与模拟管壁生物膜中EPS生成N-DBPs的作用有关, 后续将针对生物膜EPS进行深入研究.
图 7(Fig. 7)
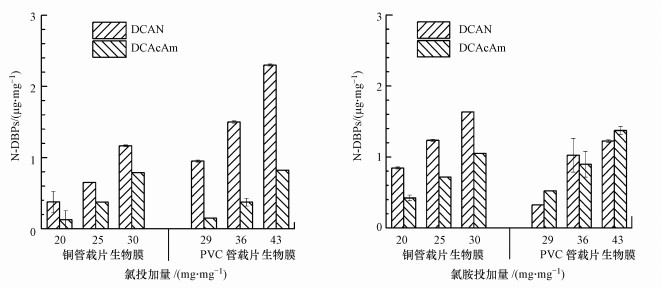 |
| 图 7 模拟管壁生物膜氯(胺)化反应的DCAN与DCAcAm生成 Fig. 7Formation of DCAN and DCAcAm during chlorination and chloramination of biofilms on copper and PVC surfaces |
以DCAN、DCAcAm与TCM的生成量比例表征生物膜氯化反应生成的N-DBPs与C-DBPs的分布, 并与NOM及水厂源水进行比较, 如表 1所示.生物膜的DCAN、DCAcAm与TCM的浓度比明显高于NOM及水厂源水的, 表明与水源水中有机物和NOM相比, 生物膜有机物氯化反应生成的DBP中DCAN、DCAcAm类N-DBPs的占比更高, 即生物膜有机物比NOM与水源水有机物更倾向生成DCAN与DCAcAm类N-DBPs, 与3.1节中发现的模式细菌有机物的规律一致.已有报道通过模型研究发现管网生物膜对管网水中三卤甲烷类C-DBPs生成的贡献可高达12%(Abokifa et al., 2016), 那么更倾向生成N-DBPs的生物膜对管网水中卤乙腈与卤乙酰胺类N-DBPs生成的贡献可能会更高, 生物膜有机物作为管网系统中卤乙腈与卤乙酰胺类N-DBPs的前体物是不容忽视的.
表 1(Table 1)
| 表 1 模拟管壁生物膜与NOM、水源水氯化生成的DBPs分布比较 Table 1 Comparison of DBPs speciation between biofilms, NOM and source water during chlorination | ||||||||||||||||
表 1 模拟管壁生物膜与NOM、水源水氯化生成的DBPs分布比较 Table 1 Comparison of DBPs speciation between biofilms, NOM and source water during chlorination
| ||||||||||||||||
4 结论(Conclusions)1) 铜绿假单胞菌、恶臭假单胞菌与藤黄微球菌与氯反应均生成DCAN、DCAcAm, 且其生成量高于同反应条件下NOM的生成量.3株细菌细胞氯胺化生成的DCAN与DCAcAm浓度均明显小于氯化反应生成的.
2) 铜绿假单胞菌、恶臭假单胞菌与藤黄微球菌EPS是氯与氯胺化反应生成DCAN与DCAcAm的前体物, 且其氯胺化反应生成的DCAcAm浓度显著高于氯化反应生成的.
3) 模拟管壁生物膜氯化反应生成0.38~2.30 μg · mg-1、0.13~0.82 μg · mg-1的DCAN与DCAcAm, 氯胺化反应生成的DCAcAm浓度更高.与NOM、水源水相比, 模拟管壁生物膜氯化生成的DCAN、DCAcAm浓度与TCM浓度比更高, 表明管壁生物膜有机物可能是管网系统中卤乙腈与卤乙酰胺类N-DBPs的重要前体物.
参考文献
| Abokifa A A, Yang Y J, Lo C S, et al. 2016. Investigating the role of biofilms in trihalomethane formation in water distribution systems with a multicomponent model[J]. Water Research, 104: 208-219. DOI:10.1016/j.watres.2016.08.006 |
| 池年平, 董秉直, 姚若虚. 2010. 给水管网中微生物研究进展[J]. 水处理技术, 36(2): 29-32. |
| Coburn KM, Wang Q, Rediske D, et al. 2016. Effects of extracellular polymeric substance composition on bacteria disinfectionby monochloramine:application of MALDI-TOF/TOF-MS and multivariate analysis[J]. Environmental Science & Technology, 50(17): 9197-9205. |
| Fisher I, Kastl G, Shang F, et al. 2018. Framework for optimizing chlorine and byproduct concentrations in drinking water distribution systems[J]. Journal-American Water Works Association, 110(11): 38-49. DOI:10.1002/awwa.1183 |
| Huang H, Wu Q Y, Tang X, et al. 2013. Formation of haloacetonitriles and haloacetamides during chlorination of pure culture bacteria[J]. Chemosphere, 92(4): 375-381. DOI:10.1016/j.chemosphere.2013.01.031 |
| Huang H, Chen B Y, Zhu Z R. 2017. Formation and speciation of haloacetamides and haloacetonitriles for chlorination, chloramination, and chlorination followed by chloramination[J]. Chemosphere, 166: 126-134. DOI:10.1016/j.chemosphere.2016.09.047 |
| Krasner S W, Sclimenti M J, Mitch W A, et al. 2007. Using formation potential tests to elucidate the reactivity of DBP precursors with chlorine versus with chloramines[C]. Proceedings of AWWA Water Quality Technology Conference, AWWA, Denver |
| Liew D, Linge K L, Joll C A. 2016. Formation of nitrogenous disinfection by-products in 10 chlorinated and chloraminated drinking water supply systems[J]. Environmental Monitoring and Assessment, 188(9): 518. DOI:10.1007/s10661-016-5529-3 |
| Liu S, Gunawan C, Barraud N, et al. 2016. Understanding, monitoring and controlling biofilm growth in drinking water distribution systems[J]. Environmental Science & Technology, 50(17): 8954-8976. |
| 刘昕, 周达诚, 王保强. 2012. 2种形态铜绿假单胞菌在氯消毒过程中消毒副产物研究[J]. 水处理技术, 38(10): 17-20. DOI:10.3969/j.issn.1000-3770.2012.10.005 |
| Momba M, Kfir R, Venter S N, et al. 2000. An overview of biofilm formation in distribution systems and its impact on the deterioration of water quality[J]. Water S A, 26(1): 59-66. |
| Rossman L A, Brown R A, Singer P C, et al. 2001. DBP formation kinetics in a simulated distribution system[J]. Water Research, 35(14): 3483-3489. DOI:10.1016/S0043-1354(01)00059-8 |
| Seidel C J, Mcguire M J, Summers H S, et al. 2005. Have utilities switched to chloramines?[J]. Journal American Water Works Association, 97(10): 87-97. DOI:10.1002/j.1551-8833.2005.tb07497.x |
| 孙慧芳, 石宝友, 王东升. 2011. 供水管网内壁生物膜的特征及其对水质的影响[J]. 中国给水排水, 27(21): 40-45. |
| Toroz I, Uyak V. 2005. Seasonal variations of trihalomethanes (THMs) in water distribution networks of Istanbul City[J]. Desalination, 176(1/3): 127-141. |
| Wang Z, Choi O, Seo Y. 2013. Relative contribution of biomolecules in bacterial extracellular polymeric substances to disinfection byproduct formation[J]. Environmental Science & Technology, 47(17): 9764-9773. |
| Wang Z, Kim J, Seo Y. 2012. Influence of bacterial extracellular polymeric substances on the formation of carbonaceous and nitrogenous disinfection byproducts[J]. Environmental Science & Technology, 46(20): 11361-11369. |
| Xu J, Huang C, Shi X, et al. 2018. Role of drinking water biofilms on residual chlorine decay and trihalomethane formation:An experimental and modeling study[J]. Science of the Total Environment, 642: 516-525. DOI:10.1016/j.scitotenv.2018.05.363 |
| Xing X C, Wang H B, Hu C, et al. 2018. Effects of phosphate-enhanced ozone/biofiltration on formation of disinfection byproducts and occurrence of opportunistic pathogens in drinking water distribution systems[J]. Water Research, 139: 168-176. DOI:10.1016/j.watres.2018.03.073 |
| 张金松, 卢小艳. 2016. 饮用水消毒工艺及副产物控制技术发展[J]. 给水排水, 42(9): 1-3. DOI:10.3969/j.issn.1002-8471.2016.09.001 |
| 张晓健, 唐峰, 王生辉, 等. 2006. 给水管网内生物膜影响化合氯消耗的研究[J]. 中国给水排水, 22(17): 1-4. DOI:10.3321/j.issn:1000-4602.2006.17.001 |
| 钟丹, 袁一星, 马文成, 等. 2017. 供水管网内生物膜与余氯衰减交互作用[J]. 哈尔滨工业大学学报, 49(8): 49-54. |
