 , 高珊1,2, 王伟全1,2, 徐应明2, 孙约兵2
, 高珊1,2, 王伟全1,2, 徐应明2, 孙约兵2

1. 东北农业大学资源与环境学院, 哈尔滨 150030;
2. 农业农村部环境保护科研监测所, 农业农村部产地环境污染防控重点实验室/天津市农业环境与农产品安全重点实验室, 天津 300191
收稿日期: 2019-06-17; 修回日期: 2019-08-21; 录用日期: 2019-08-21
基金项目: 天津市自然科学基金重点项目(No.17JCZDJC34200);中国农业科学院基本科研业务费专项院级统筹项目(No.Y2018PT12)
作者简介: 付宇童(1996-), 女, E-mail:2111516068@qq.com
通讯作者(责任作者): 孙约兵, E-mail:sunyuebing@aepi.org.cn
摘要:采用室内暗培养试验,研究了纳米富勒烯对土壤呼吸强度、酶活性及微生物结构群落多样性的影响.结果表明,添加纳米富勒烯抑制了土壤呼吸强度(p < 0.05),较对照处理CO2累积量降低了1.2%~11.3%.纳米富勒烯显著抑制了土壤脲酶活性(p < 0.05),与对照相比,降低了19.1%~33.7%,土壤脱氢酶活性整体上表现为随纳米富勒烯添加量增加先增加后降低的趋势.与之相反,添加不同剂量纳米富勒烯整体上提高了土壤碱性磷酸酶活性,但差异不明显(p>0.05).利用磷脂脂肪酸(Phospholipid Fatty Acids,PLFAs)分析发现,添加纳米富勒烯(10~500 mg·kg-1)后土壤总PLFAs含量较对照降低了3.6%~27.3%,在低剂量(≤ 50 mg·kg-1)纳米富勒烯处理下革兰氏阳性细菌、革兰氏阴性细菌、真菌、细菌含量均有所提升,而当纳米富勒烯剂量达到500 mg·kg-1时,土壤微生物数量在不同程度上受到抑制.土壤微生物生态学指数(Shannon、Simpson和Pielou指数)、聚类分析(Cluster analysis)、主成分分析(Principal component analysis)均显示纳米富勒烯对土壤中微生物群落多样性产生了负面影响.
关键词:纳米富勒烯土壤呼吸强度酶活性磷脂脂肪酸
Effects of nano-fullerene on soil enzyme activities and microbial community
FU Yutong1,2
 , GAO Shan1,2, WANG Weiquan1,2, XU Yingming2, SUN Yuebing2
, GAO Shan1,2, WANG Weiquan1,2, XU Yingming2, SUN Yuebing2

1. College of Resources and Environment, Northeast Agricultural University, Harbin 150030;
2. Key Laboratory of Original Agro-Environmental Pollution Prevention and Control, Ministry of Agriculture and Rural Affairs(MARA)/Tianjin Key Laboratory of Agro-Environment and Agro-Product Safety, Agro-Environmental Protection Institute, MARA, Tianjin 300191
Received 17 June 2019; received in revised from 21 August 2019; accepted 21 August 2019
Abstract: The effects of nano-fullerene (NF) on soil respiration, enzyme activity and microbial community diversity were studied by in-house dark culture experiments. The results show that the addition of NF inhibited the soil respiration intensity (p < 0.05), with a decrease of 1.2%~11.3%, and the Soil urease activity was significantly inhibited (p < 0.05), with 19.1%~33.7% reduction, when compared with control. With the increase of NF content, the activities of soil dehydrogenase initially increased slightly and then decreased, while the alkaline phosphatase activity increased, and both of them were not obviously significant (p>0.05). In contrast to the control, the mount of total phospholipid fatty acids (PLFAs) and actinomycetes in the soil decreased by 3.6%~27.3% with the addition of NF. Under lower NF content (≤ 50 mg·kg-1), the population of gram-positive bacteria, gram-negative bacteria, fungi and bacteria enhanced; but when NF was up to 500 mg·kg-1, all the above mentioned microbial communities were inhibited. Soil microbial ecological indices (Shannon, Simpson and Pielou index), cluster analysis, and principal component analysis results indicate that NF had a negative impact on soil microbial community diversity.
Keywords: nano-fullerenesoilrespiration intensityenzymes activityphospholipid fatty acids
1 引言(Introduction)纳米富勒烯(C60)因其特殊的理化性质而被广泛应用于新型材料、光电子学、生物制药(刘泽员, 2018)、环境保护等领域, 还用于润滑油、传感器及化妆品等日常生活用品的制造(Liu et al., 2015).在C60生产、运输及使用过程中将不可避免地进入到环境中, 因此, 其对环境造成的影响不容忽视.目前, 众多****相继探究了纳米富勒烯对水生动物(Boyle et al., 2017)、人类健康(Li et al., 2013)及生态环境等的影响(Navarro et al., 2013). Torre等(2018)研究发现, 200 mg·L-1 C60会引起斑马鱼胚胎的氧化应激和参与能量代谢的蛋白质下降. Ploeg等(2013)认为, 154 mg·L-1纳米富勒烯会使食土蚯蚓的HSP70基因表达降低66%并导致组织病变. Zhao等(2018)发现, 纳米富勒烯的悬浊液没有对活性污泥中的微生物种类造成显著性影响. Filley等(2016)在其研究中指出, 3.3 mg·L-1的纳米富勒烯处理组与空白组的聚类分析结果最不相似;Santos等(2013)研究发现, 200 mg·kg-1纳米富勒烯会使嗜热脂肪芽孢杆菌代谢下降15%. 刘文娟(2015)研究发现, 由于纳米富勒烯易于固定在土壤颗粒上, 因而对土壤微生物过程会有微弱影响.然而, 有关纳米富勒烯对土壤呼吸强度、微生物标识物磷脂脂肪酸(Phospholipid fatty acids, PLFAs)含量特征影响的研究报道较少.
土壤酶是植物根系分泌物、生物残体腐解及微生物生长代谢活动过程中所释放的酶, 不仅能够快速地反映出土壤中化学生物过程的方向和强度, 而且可以反映土壤中物质循环和能量流动的状态.因此, 土壤酶几乎成为所有土壤质量研究中必不可少的关键指标(卢冠男等, 2014).PLFA生物标记法具有快速、可定性和定量反映土壤微生物群落结构组成和多样性的特点(Orwin et al., 2018), 通常用作不同生境条件下土壤生物标记物(孙玉青等, 2015;Jiang et al., 2017).目前, PLFA生物标记法已被广泛应用于堆肥(陈耀宁, 2007)、活性污泥(赵志瑞等, 2013)及土壤中微生物群落结构(吴建军等, 2008)特征的研究.周莉娜等(2016)利用磷脂脂肪酸生物标记法, 研究了不同浓度的亚硝氮、硝氮和氨氮对厌氧细菌群落结构的影响, 发现高浓度下污泥表面的主要细菌为球状菌, 低浓度下污泥表面球状菌和杆菌并存. Xu等(2018)用澳洲坚果壳生物炭处理Cd和Pb超标土壤后, 借助PLFA生物标记法测定发现生物炭处理后的土壤微生物量有所提高. Anjos等(2018)利用PLFA分析了微生物群落对河岸周围不同土壤的响应.纳米富勒烯进入土壤环境后, 势必会在一定程度上改变土壤微生物群落结构, 对土壤生态系统造成一定影响.因此, 亟需开展纳米富勒烯对陆地生态系统中土壤酶活性、微生物群落功能多样性影响的研究.基于此,本文采用室内模拟培养试验, 研究纳米富勒烯对土壤酶活性、微生物呼吸强度及微生物群落结构多样性的影响, 以期为评估纳米富勒烯对土壤生态环境的风险提供科学依据.
2 材料与方法(Materials and methods)2.1 供试材料纳米富勒烯(C60)粉末购自浙江艾绿化工科技有限公司, 为黑色粉末, 纯度为99.9%, 直径为0.7 nm, 长度为1.1 nm, 其扫描电镜(JEM-2010)结果见图 1.
图 1(Fig. 1)
 |
| 图 1 纳米富勒烯表征 Fig. 1Nano-fullerene characterization |
土壤样品采自天津近郊废弃农田, 采样深度为0~20 cm.新鲜的土壤样品带回实验室, 用镊子剔除植物残体、较大的土壤动物残骸及石头等, 充分混合后备用.供试土壤的基本理化性质见表 1.
表 1(Table 1)
| 表 1 供试土壤的基本理化性质 Table 1 Basic physical and chemical properties of experimental soil | ||||||||||||||
表 1 供试土壤的基本理化性质 Table 1 Basic physical and chemical properties of experimental soil
| ||||||||||||||
2.2 试验设计将土壤样品置于25 ℃恒温恒湿培养箱中温育7 d, 以稳定土壤中的微生物活性, 培养期间用称重法调节土壤含水量, 使其保持一致(程东娟等, 2012).温育结束后, 称取400 g土壤样品装于已灭菌的1000 mL培养瓶中, 根据前人研究结果(Jensen et al., 2010;Hao et al., 2018), 将纳米富勒烯粉末施用的剂量设为10、50、100、200、500 mg·kg-1共5个梯度, 不添加纳米材料的土壤样品为对照处理, 每个处理重复3次.置于25 ℃恒温恒湿的培养箱中避光培养, 保持田间最大持水量的60%, 培养7 d后分别测定土壤呼吸强度、酶活性和微生物PLFA.
2.3 土壤呼吸强度测定土壤呼吸的测定采用GC法, 开启气相色谱仪至基线稳定, 连接标准气体, 吹扫进样系统10~15 min, 将标准物质注入仪器进行分析, 由色谱工作站记录色谱图, 待混合气体中各组分色谱峰分离良好、色谱峰形对称后, 通入待测气体(寇太记等, 2007).
2.4 土壤酶活性测定土壤脲酶活性采用苯酚-次氯酸钠比色法测定, 以24 h每千克土产生的NH3-N量表示;土壤碱性磷酸酶的测定采用磷酸苯二钠比色法, 其活性以每克土壤24 h释放的酚量来表示(李振高等, 2008);土壤脱氢酶的测定采用TTC还原法, 其活性以每克土24 h生成的TPF表示(戴濡伊等, 2013).
2.5 土壤微生物多样性测定取2 g干燥冷冻样品于特氟隆离心管中, 在离心管内加入浸提液和未酯化内标物后静止过夜, 采用氯仿-甲醇-柠檬酸提取总脂, 经SPE柱收集磷脂, 磷脂通过温和碱性甲酯化为磷脂脂肪酸甲酯, 静止后提取上层甲基酯化脂肪酸后并氮吹干.采用安捷伦GC-MC (6890-5973N)分析磷脂脂肪酸的组成. PLFAs的检测采用微生物自动鉴定系统, 以十九脂肪酸甲酯内标物进行定量计算.磷脂脂肪酸的命名采用方法命名, PLFA含量用nmol·g-1表示(颜慧等, 2006).可作为特征生物标记物的一些脂肪酸列于表 2.
表 2(Table 2)
| 表 2 主要表征微生物的特征磷脂脂肪酸(PLFA) Table 2 Main phospholipid fatty acids (PLFA) to characterize microbes | ||||||||||||
表 2 主要表征微生物的特征磷脂脂肪酸(PLFA) Table 2 Main phospholipid fatty acids (PLFA) to characterize microbes
| ||||||||||||
2.6 数据处理与分析利用Excel 2010处理试验数据.利用DPS采用单因素方差分析(One-way ANOVA)和最小显著差数法(LSD法)进行不同处理间均值的方差分析和差异显著性比较(p < 0.05), 统计数据以平均值和标准差表示.根据磷脂肪酸含量和种类计算丰富度指数Shannon(H)、多样性指数Simpson(D)和均匀度指数Pielou(J)(式(1)~(3)), 分析土壤微生物群落的多样性(颜慧等, 2006).利用主成分分析法(PCA)分析土壤微生物群落结构变化(李媛, 2014).采用Origin 8.0绘图.
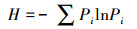 | (1) |
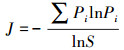 | (2) |
 | (3) |
3 结果与讨论(Results and discussion)3.1 纳米富勒烯对土壤呼吸强度的影响土壤呼吸速率和CO2累积量是土壤中微生物活性的重要指标(刘颖等, 2005;王秋双等, 2017), 通常用来评价土壤微生物有氧活动能力.如图 1所示, 添加纳米富勒烯后土壤CO2积累量受到不同程度的抑制, 与对照相比, 降低了1.2%~11.3%.当纳米富勒烯剂量达到200 mg·kg-1时, CO2积累量显著降低(p < 0.05).这可能是由于土壤中微生物受外源污染胁迫后, 抑制了自身的代谢活动, 导致CO2释放量减少, 这与Tong等(2007)的研究结果相似. Oyelami等(2015)研究了纳米富勒烯对葡萄糖矿化速率的影响, 发现葡萄糖的最大分解速率不受纳米富勒烯浓度的影响, 葡萄糖的最大矿化速率随时间不断降低, 但总体上没有统计学规律. 王秋双等(2017)研究表明, 添加纳米银后土壤CO2累积量与呼吸强度变化一致, 且随浓度增加而显著降低(p < 0.05), 但添加不同浓度石墨烯对土壤基础呼吸的影响没有产生明显差异(p>0.05).
图 2(Fig. 2)
 |
| 图 2 不同剂量纳米富勒烯处理下CO2累积量的变化 Fig. 2Cumulative amounts of CO2 under different treatments of nano-fullerene |
3.2 纳米富勒烯对土壤酶活性的影响在土壤氮素循环系统中, 脲酶可以专性水解有机氮源, 释放出铵调节土壤肥力(卢冠男等, 2014).土壤脲酶活性随纳米富勒烯添加剂量增加呈先降低再增加而后降低的趋势(图 3A), 但不同处理下脲酶活性均显著低于对照处理(p < 0.05), 降低了19.1%~29.5%, 显示出纳米富勒烯进入到土壤中对土壤氮素循环系统造成了一定的影响, 但各剂量纳米富勒烯处理组之间差异不显著. 胡谦(2018)研究表明, 纳米富勒烯在一定程度上降低了土壤脲酶活性, 但差异并不显著性(p>0.05). 张晶(2014)研究发现, 添加高浓度纳米炭粉短期内对土壤中脲酶的活性有抑制作用.这可能是由于一定剂量的碳纳米材料的毒性效应是由于产生氧化胁迫或自由基, 对脂质造成过氧化损伤或者破坏了脲酶结构, 使脲酶正常功能丧失甚至死亡.
图 3(Fig. 3)
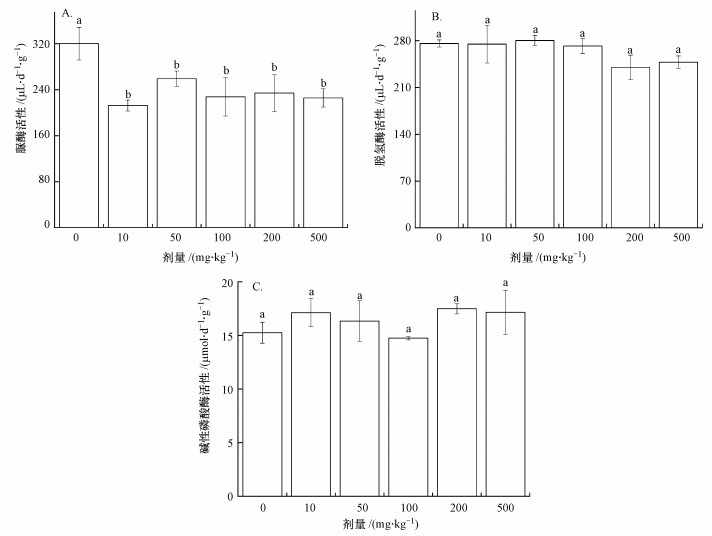 |
| 图 3 纳米富勒烯对土壤酶活性的影响(A.脲酶活性,B.脱氢酶活性,C.碱性磷酸酶活性) Fig. 3Effect of nano-fullerene on soil enzyme activities |
脱氢酶是土壤微生物活性及功能多样性的重要指标, 微生物呼吸作用和生物量都与脱氢酶活性有关, 因而可间接反映微生物的活动和生存能力(胡谦, 2018). 图 3B为不同剂量纳米富勒烯处理土壤脱氢酶活性的变化趋势, 中、低剂量的纳米富勒烯对土壤脱氢酶活性几乎没有影响, 当纳米富勒烯含量达到200和500 mg·kg-1时, 土壤脱氢酶活性分别较对照下降了12.9%和10.1%, 但不同处理间差异不显著(p>0.05).这与Tong等(2007)的研究结果相符, 土壤中高含量的黏粒和有机物会减轻纳米富勒烯的毒性, 也有可能是因为纳米富勒烯本身毒性较弱, 即使经过表面改性的富勒烯衍生物都不会对脱氢酶造成显著影响. 胡谦(2018)发现由于纳米富勒烯本身具有光敏性, 在光照条件下会激发产生ROS对细胞造成损害. Filley等(2016)研究显示, 在光照条件下纳米富勒烯引起土壤呼吸率的下降比未经过光照更明显, 说明光照可能对纳米富勒烯的毒性造成一定影响.本实验是在全程避光下完成的, 纳米富勒烯没有经过光照其毒性较弱, 所以可能产生的ROS不足以对土壤中脱氢酶的活性造成显著性影响.
土壤碱性磷酸酶在有机磷的矿化及其生物有效性上具有重要作用(白雪等, 2018), 其通过酶促反应可以使有机磷的脱磷速度加快, 提高土壤磷素的有效性.与对照相比, 添加纳米富勒烯后土壤碱性磷酸酶活性的差异均不显著(p>0.05)(图 3C), 但投加不同剂量纳米富勒烯后土壤碱性磷酸酶活性整体上受到了激活(100 mg·kg-1除外).与对照相比, 在10、50、200和500 mg·kg-1纳米富勒烯处理下, 土壤碱性磷酸酶分别增加了12.3%、7.1%、14.6%和12.4%. Liang等(2018)研究表明, 当暴露于1000 mg·kg-1纳米富勒烯时, 水稻穗中Cd的生物累积显着降低(p < 0.05). Anna(2018)发现低浓度的富勒烯可以改变河流系统中有机污染物的毒性.纳米富勒烯对碱性磷酸酶活性的刺激作用可能源于3个方面:①可能是由于微生物群落向产磷酸酶的微生物转变;②该试验土壤中的黏粒和有机物可能有效吸附了纳米颗粒并使之更容易聚集;③可能是由于本试验所采用的土壤中产磷酸酶的微生物对纳米富勒烯有着较高的耐受性(胡谦, 2018).
3.3 添加纳米富勒烯对土壤微生物多样性的影响磷脂脂肪酸(Phospholipid Fatty Acid, PLFAs)是微生物细胞膜的恒定组分, 存在于活体微生物中, 并且会随着细胞的死亡而迅速分解.磷脂脂肪酸技术可以准确地检测出微生物群落组成及多样性的变化(吴小虎, 2014), 是指示土壤生态系统稳定性的传感器.不同剂量的纳米富勒烯施入土壤后, 土壤微生物的变化情况可以根据单位质量土样中PLFAs来判断(表 3).虽然随着纳米富勒烯剂量的增加, 总PLFAs含量整体呈下降趋势, 但不同剂量富勒烯处理下土壤微生物总PLFAs含量与对照组差异显著性不明显(p>0.05).陈义轩等(2019)研究指出, 总PLFAs的变化是由于添加物对土壤微生物各组分的影响显著, 进而导致土壤微生物PLFAs总量和微生物组成结构的变化.
表 3(Table 3)
| 表 3 不同剂量纳米富勒烯处理下土壤特征磷脂脂肪酸含量 Table 3 Characteristics of PLFA biomarkers for the microbial transitional subcommunity after treatments of different dose of nano-fullerene | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 不同剂量纳米富勒烯处理下土壤特征磷脂脂肪酸含量 Table 3 Characteristics of PLFA biomarkers for the microbial transitional subcommunity after treatments of different dose of nano-fullerene
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
随着纳米富勒烯剂量的增加, 细菌PLFAs、放线菌PLFAs未出现显著性差异, 这个结果与Tong等(2007)的研究一致(表 3). 胡谦(2018)研究发现, 各浓度纳米富勒烯都未影响微生物群落组成和结构, 细菌菌属的相对丰度也只出现了轻微的变化.细菌一般是土壤微生物中的优势群落, 本试验中不同处理组细菌的PLFAs占总PLFAs含量的比值均在65.00%以上, 因此, 纳米富勒烯对微生物的影响会首先体现在细菌群落中.由表 3可以看出, 空白组的细菌PLFAs含量为(375.10±33.92) nmol·g-1, 除10、50 mg·kg-1纳米富勒烯处理组的细菌PLFAs上升了1.6%、3.6%, 其他剂量的纳米富勒烯分别使细菌PLFAs下降了7.0%、12.6%和17.3%, 这与土壤中脲酶活性的变化趋势类似.这可能是由于细菌偏好生存在营养丰富、有机物易于分解的土壤中, 脲酶可以特异性地促进尿素水解成氨和碳酸, 为细菌提供易于生长的环境.纳米富勒烯可能通过改变土壤有机物含量而影响土壤中的氮循环系统, 从而对土壤细菌的营养和能量来源造成影响, 降低土壤中的细菌含量(樊诗亮等, 2016).
革兰氏阳性细菌PLFAs、革兰氏阴性细菌PLFAs、真菌PLFAs整体呈现出先升高后降低的趋势(表 3), 未经过纳米富勒烯处理的土壤中革兰氏阳性细菌、革兰氏阴性细菌、真菌PLFAs含量分别为(138.27±3.50)、(119.46±10.70)和(9.75±1.99) nmol·g-1.在50 mg·kg-1的纳米富勒烯处理下, 革兰氏阳性细菌PLFAs、革兰氏阴性细菌PLFAs、真菌PLFAs显著高于其它处理组(p < 0.05), 与对照相比, 分别增加了40.5%、30.1%和38.1%.当纳米富勒烯剂量为500 mg·kg-1时, 会对革兰氏阳性菌、真菌产生抑制作用, 分别较对照降低了16.2%和26.4%.200 mg·kg-1纳米富勒烯处理下的土壤革兰氏阴性细菌PLFAs含量最低, 仅为(91.91±3.78) nmol·g-1.Jin等(2014)在研究中指出, 单壁碳纳米管能够引起与土壤营养物质循环相关真菌数量的减少.王秋双等(2017)的研究结果显示, 在100 mg·kg-1的纳米石墨烯处理下真菌数量会产生显著性升高.这可能是由于土壤微生物可以某种方式抵消纳米富勒烯的毒性, 也可能是由于土壤环境的复杂性影响了纳米富勒烯的毒性, 但这些都需要进一步的试验才能深入了解.
真菌和细菌对土壤有机物的分解途径不同, 真菌易生存于低营养、难分解及低氮含量有机物的环境中.微生物群落结构关乎生态系统的稳定和健康, 研究发现, 真菌/细菌生物量比值与农田生态系统稳定性相关, 一些研究也表明真菌/细菌生物量比值与微生物多样性存在相关性(曹志平等, 2011).本研究中真菌/细菌比值均与对照组无显著性差异(表 3), 说明不同剂量的纳米富勒烯处理没有对土壤真菌/细菌的比例结构造成显著影响, 没有对细菌和真菌的群落结构多样性造成显著影响(刘文娟, 2015).本研究中不同剂量富勒烯处理下G+/G-比值整体呈先增高后降低趋势, 无显著性差异(p>0.05), 说明纳米富勒烯对土壤微生物的胁迫程度无明显变化.Kumar等(2011)发现革兰氏阴性菌对纳米颗粒的敏感性低于革兰氏阳性菌.一般来说, 革兰氏阳性菌细胞壁较厚, 许多菌种还会产生内生孢子, 抵抗极端环境, 这可能是G+/G-比值升高的原因.但由于纳米富勒烯的毒性随着剂量的增加而增大, 在纳米富勒烯投加量达到500 mg·kg-1时, 使得土壤革兰氏阳性细菌PLFAs显著性降低, 从而导致G+/G-比值降低.
不同剂量纳米富勒烯处理下土壤生态学指数见表 4. Shannon指数可以表征微生物群落中物种组成的丰富性, Shannon指数越大, 说明微生物的丰富度越高.不同剂量纳米富勒烯处理下的Shannon指数不存在显著性差异(p < 0.05), 其中, 10 mg·kg-1纳米富勒烯处理下的Shannon指数值最大为1.38, 说明微生物群落的丰富度最高(陈义轩等, 2019). Simpson指数可用以评估土壤中微生物最常见物种的优势度, Simpson指数越高, 常见物种的优势度越高.不同剂量纳米富勒烯处理下的土壤微生物Simpson指数都有不同程度的降低, 各处理组与对照组相比分别降低了40%、74%、46%、34%和31%, 其中, 10 mg·kg-1纳米富勒烯处理下物种优势度显著降低(p < 0.05). Pielou指数反映了群落均匀度, 均匀度越大, 该环境中微生物物种数目、个体数目分布状况越相似.纳米富勒烯的添加使Pielou指数呈现波动, 其中, 500 mg·kg-1纳米富勒烯处理下的群落均匀度显著性降低(p < 0.05) (郭梨锦等, 2013).
表 4(Table 4)
| 表 4 不同纳米富勒烯处理下土壤生态学指数 Table 4 Soil ecological index under different treatments of nano-fullerene | ||||||||||||||||||||||||||||||||
表 4 不同纳米富勒烯处理下土壤生态学指数 Table 4 Soil ecological index under different treatments of nano-fullerene
| ||||||||||||||||||||||||||||||||
由不同剂量纳米富勒烯处理下微生物磷脂脂肪酸的聚类树图可知(图 4a), 不同处理的微生物群落结构差异明显, 可分为两大类, 未添加纳米富勒烯处理组为一类, 纳米富勒烯添加量为10、50、100、200和500 mg·kg-1的处理组为另外一大类.在所有处理中, 添加了50和100 mg·kg-1纳米富勒烯的土壤微生物群落组成最为相似, 此外, 100和200 mg·kg-1纳米富勒烯处理之间的相似性要大于10 mg·kg-1处理.以上3个处理的微生物群落组成的相似性要大于添加量为500 mg·kg-1的纳米富勒烯处理组.为进一步分析不同浓度纳米富勒烯对土壤微生物群落结构的影响, 对不同纳米富勒烯添加量下土壤中所提取的磷脂脂肪酸进行主成分分析(图 4b), 第一主成分轴和第二主成分轴对处理的差异贡献率分别为64.06%和27.51%, 其累计贡献率达到91.57%.其中, 对照组及10 mg·kg-1纳米富勒烯处理过的土壤样品位于第一象限, 50 mg·kg-1纳米富勒烯处理的土壤样品位于第四象限, 100、200 mg·kg-1处理下的土壤样品位于第三象限, 而500 mg·kg-1纳米富勒烯处理下的土壤样品位于第二象限, 这与聚类分析结果类似.这些结果进一步证明了纳米富勒烯确实对土壤中微生物群落造成了改变.
图 4(Fig. 4)
 |
| 图 4 不同处理下土壤微生物PLFAs聚类分析(a)和主成分分析(b) Fig. 4Cluster analysis (a) and principal component analysis (b) for PLFAs of microbial community under different nano-fullerene concentrations |
微生物是土壤能量流动及物质循环主要参与者.因此, 通过研究不同剂量纳米富勒烯对土壤微生物群落结构的影响, 对于了解纳米富勒烯对土壤生态系统结构和功能的影响具有十分重要的意义(Gu et al., 2014).但在纳米富勒烯在环境中排放量持续增加的背景下, 其对土壤生态系统的影响必然是一个长期的、复杂的过程.本研究初步阐释了不同剂量的纳米富勒烯短期内对土壤呼吸速率、土壤酶活及PLFAs的影响.另外, 虽然PLFA法可以准确、可靠地反映和比较微生物特征性磷脂, 用于外界不同环节条件下研究特点功能菌群结构的变化.但其应用受微生物特点PLFA定量和定性信息缺乏的影响, 不能全面评价土壤微生物在不同分类单元的变化, 需要通过其他更为先进的土壤微生物分析技术, 比如高通量测序技术进行更深入、更有针对性的研究.
4 结论(Conclusions)1) 不同剂量的纳米富勒烯使土壤呼吸速率及CO2积累量降低, 与对照组相比, 高剂量(≥200 mg·kg-1)纳米富勒烯会使土壤呼吸速率及CO2积累量显著降低(p < 0.05).
2) 添加纳米富勒烯后, 显著抑制了土壤脲酶活性(p < 0.05);中、低剂量纳米富勒烯提高了土壤脱氢酶活性, 当纳米富勒烯剂量≥200 mg·kg-1时, 脱氢酶活性受到抑制, 而投加50 mg·kg-1纳米富勒烯整体上提高了土壤碱性磷酸酶活性.
3) 投加纳米富勒烯对放线菌、总PLFAs含量均有所降低, 当纳米富勒烯剂量≤50 mg·kg-1时, 对G-和细菌数量有所促进, 当纳米富勒烯剂量>200 mg·kg-1时, G+和真菌数量受到抑制.微生物的生态学指数、聚类分析、PCA分析结果表明, 纳米富勒烯改变了土壤中微生物群落多样性.
参考文献
| Anjos D C, Hernandez F F F, Ba?uelos G S, et al. 2018. Microbial community and heavy metals content in soils along the Curu River in Ceará, Brazil[J]. Geoderma Regional, 14: e00173. DOI:10.1016/j.geodrs.2018.e00173 |
| Anna F. 2018. Fullerenes influence the toxicity of organic micro-contaminants to river biofilms[J]. Frontiers in Microbiology, 9: 1426. DOI:10.3389/fmicb.2018.01426 |
| 白雪, 周怀平, 解文艳, 等. 2018. 不同类型地膜覆盖对玉米农田土壤酶活性的影响[J]. 农业资源与环境学报, 170(4): 103-110. |
| Boyle D, Sutton P A, Handy R D, et al. 2018. Intravenous injection of unfunctionalized carbon-based nanomaterials confirms the minimal toxicity observed in aqueous and dietary exposures in juvenile rainbow trout (Oncorhynchus mykiss)[J]. Environmental Pollution, 232: 191-199. DOI:10.1016/j.envpol.2017.09.033 |
| 曹志平, 李德鹏, 韩雪梅. 2011. 土壤食物网中的真菌/细菌比率及测定方法[J]. 生态学报, 31(16): 4741-4748. |
| 陈耀宁.2007.堆肥化中协同降解木质纤维素的混合菌筛选及其培养[D].长沙: 湖南大学 http://cdmd.cnki.com.cn/Article/CDMD-10532-2007159592.htm |
| 陈义轩, 宋婷婷, 方明, 等. 2019. 四种生物炭对潮土土壤微生物群落结构的影响[J]. 农业环境科学学报, 38(2): 394-404. |
| 程东娟, 张亚丽. 2012. 土壤物理实验指导[M]. 北京: 中国水利水电出版社. |
| 戴濡伊, 吴季荣, 徐剑宏, 等. 2013. 小麦根际土壤脱氢酶活性测定方法的改进[J]. 江苏农业学报, 29(4): 772-776. DOI:10.3969/j.issn.1000-4440.2013.04.014 |
| Della T C, Maggioni D, Ghilardi A, et al. 2018. The interactions of fullerene C60 and Benzo(α) pyrene influence their bioavailability and toxicity to zebrafish embryos[J]. Environmental Pollution, 241: 999-1008. DOI:10.1016/j.envpol.2018.06.042 |
| 樊诗亮, 何丽芝, 秦华, 等. 2016. 生物质炭对邻苯二甲酸二丁酯污染土壤微生物群落结构多样性的影响[J]. 环境科学学报, 36(5): 1800-1809. |
| Filley T. 2016. Soil microbial response to photo-degraded C60 fullerenes[J]. Environmental Pollution, 211: 338-345. DOI:10.1016/j.envpol.2015.12.025 |
| Gu M, Zhang Z, Wang W, et al. 2014. The effects of radiation pollution on the population diversities and metabolic characteristics of soil microorganisms[J]. Water, Air, & Soil Pollution, 225: 2133. |
| 郭梨锦, 曹凑贵, 张枝盛, 等. 2013. 耕作方式和秸秆还田对稻田表层土壤微生物群落的短期影响[J]. 农业环境科学学报, 32(8): 1577-1584. |
| Hao Y, Ma C X, Zhang Z T, et al. 2018. Carbon nanomaterials alter plant physiology and soil bacterial community composition in a rice-soil-bacterial ecosystem[J]. Environmental Pollution, 232: 123-136. DOI:10.1016/j.envpol.2017.09.024 |
| 胡谦.2018.三种典型纳米颗粒对土壤微生物及酶活性的对比研究[D].南京: 东南大学 http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=1019821434.nh |
| Jensen K A. 2010. Effects of CFullerene nanoparticles on soil bacteria and protozoans[J]. Environmental Toxicology & Chemistry, 27: 1895-1903. |
| Jiang J S, Huang H, Huang Y M. 2017. Relationship between maturity and microbial communities during pig manure composting by phospholipid fatty acid (PLFA) and correlation analysis[J]. Journal of Environmental Management, 206: 532-539. |
| Jin L, Son Y, Deforest J L, et al. 2014. Single-walled carbon nanotubes alter soil microbial community composition[J]. Science of the Total Environment, 466-467: 533-538. DOI:10.1016/j.scitotenv.2013.07.035 |
| 寇太记, 朱建国, 谢祖彬. 2007. 测定方法和植物生长对土壤呼吸的影响[J]. 生态环境学报, 16(1): 205-209. DOI:10.3969/j.issn.1674-5906.2007.01.038 |
| Kumar N V, Walker V K. 2011. Perturbation of an arctic soil microbial community by metal nanoparticles[J]. Journal of Hazardous Materials, 190: 816-822. DOI:10.1016/j.jhazmat.2011.04.005 |
| 李媛.2014.厌氧氨氧化工艺启动和运行特性及其受抑机理研究[D].无锡: 江南大学 http://cdmd.cnki.com.cn/Article/CDMD-10295-1014370516.htm |
| Li Z, Zhang F, Wang Z, et al. 2013. Fullerene (C60) nanoparticles exert photocytotoxicity through modulation of reactive oxygen species and p38 mitogen-activated protein kinase activation in the MCF-7 cancer cell line[J]. Journal of Nanoparticle Research, 15: 2102. DOI:10.1007/s11051-013-2102-7 |
| 李振高, 骆永明, 滕应. 2008. 土壤与环境微生物研究法[M]. 北京: 科学出版社. |
| Liang C, Xiao H, Hu Z, et al. 2018. Uptake, transportation and accumulation of C 60, fullerene and heavy metal ions (Cd, Cu, and Pb) in rice plants grown in an agricultural soil[J]. Environmental Pollution, 235: 330-338. DOI:10.1016/j.envpol.2017.12.062 |
| Lin Z, Yi J, Peizhe S, et al. 2018. Effects of individual and complex ciprofloxacin fullerene C 60 and ZnO nanoparticles on sludge digestion:Methane production, metabolism, and microbial community[J]. Bioresource Technology, 267: 46-53. DOI:10.1016/j.biortech.2018.07.024 |
| Liu R, Cohen Y. 2015. Nanoinformatics for environmental health and biomedicine[J]. Beilstein Journal of Nanotechnology, 6: 2449-2451. DOI:10.3762/bjnano.6.253 |
| 刘文娟.2015.纳米胶囊型农药和碳纳米材料对土壤微生物的生物效应[D].北京: 北京科技大学 http://cdmd.cnki.com.cn/Article/CDMD-10008-1016044598.htm |
| 刘颖, 韩士杰, 胡艳玲, 等. 2005. 土壤温度和湿度对长白山土壤呼吸速率的影响[[J]. 应用生态学报, 16(9): 1581-1585. DOI:10.3321/j.issn:1001-9332.2005.09.001 |
| 刘泽员. 2018. 富勒烯及其衍生物在医药领域的应用研究进展[J]. 中国药科大学学报, 49(2): 136-146. |
| 卢冠男, 夏梦洁, 贾丹阳, 等. 2014. 我国14种典型土壤脲酶、脱氢酶活性对汞胁迫的响应[J]. 环境科学学报, 34(7): 1788-1793. |
| Navarro D A, Kookana R S, Kirby J K, et al. 2013. Behaviour of fullerenes (C60) in the terrestrial environment:Potential release from biosolids-amended soils[J]. Journal of Hazardous Materials, 262: 496-503. DOI:10.1016/j.jhazmat.2013.08.021 |
| Orwin K H, Dickie I A, Holdaway R, et al. 2018. A comparison of the ability of PLFA and 16S rRNA gene metabarcoding to resolve soil community change and predict ecosystem functions[J]. Soil Biology and Biochemistry, 117: 27-35. DOI:10.1016/j.soilbio.2017.10.036 |
| Oyelami A O, Semple K T. 2015. Impact of carbon nanomaterials on microbial activity in soil[J]. Soil Biology and Biochemistry, 86: 172-180. DOI:10.1016/j.soilbio.2015.03.029 |
| Ploeg M, Handy R D, Heckmann L H, et al. 2012. C60 exposure induced tissue damage and gene expression alterations in the earthworm Lumbricus rubellus[J]. Nanotoxicology, 7: 432-440. |
| Santos S M, Dinis A M, Rodrigues D M, et al. 2013. Studies on the toxicity of an aqueous suspension of C60 nanoparticles using a bacterium (gen.Bacillus) and an aquatic plant (Lemna gibba) as in vitro model systems[J]. Aquatic Toxicology, 142-143: 347-354. DOI:10.1016/j.aquatox.2013.09.001 |
| 孙玉青, 张莘, 吴照祥, 等. 2015. 雄黄矿区不同砷污染土壤中微生物群落结构及碳源利用特征[J]. 环境科学学报, 35(11): 3669-3678. |
| Tong Z, Bischoff M, Nies L, et al. 2007. Impact of fullerene (C60) on a soil microbial community[J]. Environmental Science & Technology, 41: 2985-2991. |
| 王秋双, 戚兴超, 申天琳, 等. 2017. 纳米银与石墨烯对土壤微生物及土壤酶的影响[J]. 环境科学学报, 37(8): 3149-3157. |
| 吴建军, 蒋艳梅, 吴愉萍, 等. 2008. 重金属复合污染对水稻土微生物生物量和群落结构的影响[J]. 土壤学报, 45(6): 1102-1109. DOI:10.3321/j.issn:0564-3929.2008.06.013 |
| 吴小虎.2014.氟磺胺草醚对土壤微生物多样性的影响[D].北京: 中国农业科学院 http://cdmd.cnki.com.cn/Article/CDMD-82101-1014327035.htm |
| Xu Y, Seshadri B, Sarkar B, et al. 2018. Biochar modulates heavy metal toxicity and improves microbial carbon use efficiency in soil[J]. Science of the Total Environment, 621: 148-159. DOI:10.1016/j.scitotenv.2017.11.214 |
| 张晶.2014.纳米炭粉对土壤酶的影响及其机理的研究[D].咸阳: 西北农林科技大学 http://cdmd.cnki.com.cn/Article/CDMD-10712-1014420478.htm |
| 赵志瑞, 马斌, 张树军, 等. 2013. 高氨氮废水与城市生活污水短程硝化系统菌群比较[J]. 环境科学, 34(4): 226-234. |
| 周莉娜, 苏润华, 马思佳, 等. 2016. 基于PLFA法分析亚硝氮、硝氮和氨氮对厌氧微生物细菌群落的影响[J]. 环境科学学报, 36(2): 499-505. |
