
 , 丰叶1, 王锦旗1, 营成曦1
, 丰叶1, 王锦旗1, 营成曦11. 南京信息工程大学应用气象学院, 江苏省农业气象重点实验室, 南京 210044;
2. 南京信息工程大学江苏省大气环境与装备技术协同创新中心, 南京 210044
收稿日期: 2018-06-08; 修回日期: 2018-08-26; 录用日期: 2018-08-26
基金项目: 国家自然科学基金(No.41471446);南京信息工程大学大学生实践创新训练计划项目(教发[2017])
作者简介: 宋玉芝(1970-), 女, 副教授, E-mail:syz70@nuist.edu.cn
通讯作者(责任作者): 宋玉芝
摘要: 为了探讨湖泊富营养化过程中沉积物及水体氮、磷浓度对附植藻类的影响,通过室内模拟实验,研究了水体及沉积物氮、磷升高对苦草(Vallisnerianatans(Lour.)Hara)上附植藻类生长、群落组成及其体内氮、磷含量的影响.结果表明,在实验条件下,随着水中氮、磷含量升高,附植藻类生物量及附植藻类氮、磷含量均呈极显著增加(p < 0.01).随着水体可获得的氮、磷浓度升高,附植藻类的相对丰度有所变化,舟形藻(Navicula)、小球藻(Chlorella)及微囊藻(Microcystis)相对丰度随着氮、磷水平的升高而下降,直链藻(Melosira)则相反,但舟形藻、直链藻、微囊藻、小环藻(Cyclotella)和小球藻均为群落的优势属种.沉积物氮、磷含量升高对附植藻类生物量、优势种丰度及群落氮、磷含量影响较小,均未达到显著水平(p < 0.05).在实验条件下,沉积物氮、磷含量对附植藻类影响不大,而水体氮、磷浓度升高显著地促进了附植藻类生长.研究结果也为解释富营养化湖泊沉水植物衰退及消亡提供了一定的科学依据.
关键词:水体沉积物氮磷附植藻类
Effects of nitrogen and phosphorus availability on epiphytic algae attaching to the macrophyte Vallisneria natans
SONG Yuzhi1,2

 , FENG Ye1, WANG Jinqi1, YING Chengxi1
, FENG Ye1, WANG Jinqi1, YING Chengxi1 1. Jiangsu Key Laboratory of Agricultural Meteorology, College of Applied Meteorology, Nanjing University of Information Science & Technology, Nanjing 210044;
2. Jiangsu Collaborative Innovation Center of Atmospheric Environment and Equipment Technology(AEET), Nanjing University of Information & Technology, Nanjing 210044
Received 8 June 2018; received in revised from 26 August 2018; accepted 26 August 2018
Supported by the National Natural Science Foundation of China(No.41471446) and the College Students Practice and Innovation Training Program, Nanjing University of Information Science and Technology([2017])
Biography: SONG Yuzhi(1970—), female, associate professor, E-mail:syz70@nuist.edu.cn
*Corresponding author: SONG Yuzhi
Abstract: To investigate the effect of nitrogen and phosphorus availability on epiphytic algae in the process of lake eutrophication, the epiphytic algal biomass, community composition and contents of nitrogen and phosphorus were measured under different levels of nitrogen and phosphorus both in sediment and water column by indoor simulation experiment. The results show that with increasing nutrient availability in the water column, the biomass and the nutrient contents of epiphytic algae increased (p < 0.01), and Navicula, Melosira, Microcystis, Cyclotella and Chlorella were the dominant population., while the relative population abundance of epiphytic algae changed with the increase of nitrogen and phosphorus levels, and the relative abundances of Navicula, Chlorella and Microcystis decreased but Melosira increased. The concentrations of nitrogen and phosphorushad little effect on the biomass, dominant species and nutrient contents of epiphytic algae in sediments (p < 0.05). This result could account for the decline of submerged macrophytes in eutrophic lakes.
Keywords: water bodysedimentnitrogen and phosphorusepiphytic algae
1 引言(Introduction)由于人类活动的影响, 大量的氮、磷等营养物质进入湖泊, 使得水体富营养化日趋严重, 进而也导致沉水植被衰退和消失的现象在世界范围内普遍出现.造成沉水植物衰退的影响因子有多种(Roberts et al., 2003;Qin et al., 2006;魏宏农等, 2013), 已有研究表明, 附植藻类的存在会对沉水植物产生不利的影响, 如附植藻类会显著降低沉水植物的光合作用, 最终导致其衰退甚至消亡(Sand-Jensen, 1977;Nelson, 2017).研究发现, 湖泊的富营养化过程中, 湖泊水体氮、磷浓度的升高在多数情况下不会直接对沉水植物的生长产生不利影响(Song et al., 2017), 而氮、磷浓度的升高却可以促进附植藻类及浮游藻类的迅速发展, 尤其是对附植藻类(Borum, 1985;Qin et al., 2006).Borum(1985)指出, 随着水体营养盐的增加, 附植藻类生物量的增加速度远远超过浮游藻类.因此, 研究环境营养盐对附植藻类的影响对水生生态系统修复和保护具有一定的指导意义.
目前认为, 附植藻类的生物量随水体营养盐浓度的升高而增加, 但不同的研究其结果存在一定的差异, 在氮、磷营养盐浓度较低的水体中, 有时可观察到附植藻类生物量较高的现象(McDougal et al., 1997;Dodds, 2003).如在贫营养及中营养湖泊中, 水体营养浓度相对较低, 但附植藻类异常丰富(Azim et al., 2005;卡尔夫, 2011).由于浅水湖泊其特殊的性质使得水生植物比较繁茂, 有80%以上的水生植物表面上覆盖着附植藻类(Azim et al., 2005;卡尔夫, 2011;Pettit et al., 2016), 且附植藻类种类也很多, 在一些湖泊中其种类数量占整个藻类种数的90%, 生物量远远超过浮游藻类的生物量(Br?nmark, 1989;Azim et al., 2005;卡尔夫, 2011).这种现象与根生沉水植物从沉积物泵吸氮、磷等营养盐密切相关.研究表明, 在有些情况下, 附植藻类所需营养盐有时高达80%来源于其宿主植物的释放(Moeller et al., 1988;Burkholder et al., 1990;Wetzel, 2001), 这说明沉积物营养盐浓度会对附植藻类生长产生影响.随着水体中氮、磷浓度的升高, 附植藻类生物量随之增加(Blumenshine et al., 1997;McDougal et al., 1997).Pizarro等(2002)对比分析了寡营养、中营养及富营养湖泊中的附植藻类, 结果发现, 湖泊营养盐水平越高, 附植藻类生物量越大, 附植藻类生物量与氮、磷等含量存在显著相关性.然而, 也有研究表明, 水体营养盐的增加, 有时并未对附植藻类生物量产生较大的影响, 但却能显著改变附植藻类群落的结构与多度(Balata et al., 2010;Song et al., 2016).目前, 在富营养化湖泊中, 关于氮、磷等营养盐添加对附植藻类影响的研究较少(宋玉芝等, 2016;Nelson, 2017), 而在水体氮、磷水平较高的情况下, 沉积物氮、磷等营养盐是否还能通过根生沉水植物从沉积物中摄取氮、磷等营养盐, 并释放到水体中供附植藻类生长?目前也不十分清楚.因此, 本文通过模拟实验, 探讨水体及沉积物中不同氮、磷水平对苦草上附植藻类生长及其体内氮、磷含量的影响, 以期为富营养化湖泊的生态修复及管理提供依据.
2 材料与方法(Material and methods)2.1 实验材料及设计从东太湖采集苦草, 从中选择长势相近的苦草, 将表面的附植藻类轻轻刷洗去除, 种植于盛有用薄膜包裹的干净湿沙子的塑料盆中, 每盆种植2~3株, 种好后再在表面覆盖约5 cm厚的干净湿沙子, 最后在整个塑料盆外面再用薄膜包裹(苦草叶片露在外面), 以阻止沉积物与水体交流.种植好的塑料盆放入事先盛有16 L营养液的玻璃缸(20 cm×30 cm×40 cm)中, 每个玻璃缸放置10盆, 并且在光线良好的室内培养2周后处理.根据目前的湖泊营养盐水平及已有的文献资料, 用NH4Cl和KH2PO4将水体氮(TN)、磷(TP)浓度设置为3个处理水平(NP1:1.0、0.10 mg·L-1;NP2:2.0、0.20 mg·L-1;NP3:3.5、0.35 mg·L-1).沉积物TN、TP设置2个水平, 分别为低氮、磷水平(NPs1:1.0、0.1 mg·g-1)和高氮、磷水平(NPs2:2、0.2 mg·g-1).为了保证各处理水体的氮、磷浓度相对稳定, 每3 d测定水体的TN、TP浓度并补充营养盐浓缩液.为了控制浮游藻类的暴发, 试验期间还定期将培养液以虹吸的方式更换, 实验第35 d采集苦草, 苦草样品表面的附植藻类用软毛刷刷洗, 刷洗液定容备用;用于分析附植藻类生物量、种群组成及氮、磷含量.
2.2 测定方法2.2.1 附植藻类生物量鉴于藻类都含有叶绿素a(Chl a), 因此, 通常用Chl a含量来快速估算藻类的生物量.本文采用Chl a含量来表征附植藻类的生物量, 具体操作为:取一定体积附植藻类备用液, 采用Whatman GF/F玻纤滤膜过滤, 将带有藻的滤膜用热乙醇萃取分光光度法测定(陈宇炜等, 2006)
2.2.2 附植藻类的鉴定与计数取附植藻类备用液50 mL, 加入1 mL鲁哥试剂固定浓缩, 用偏光显微镜进行藻类的鉴定, 用藻类计数框进行定量计数, 鉴定到属, 结果为每毫升溶液中藻类个体数量并转换为相对丰度, 相对丰度大于10%为优势属种(何剑锋等, 2005).
2.2.3 水体及藻类TN、TP的测定待测样经碱性过硫酸钾消解后用紫外分光光度法测定TN, 用钼酸铵分光光度法测定TP(黄祥飞等, 2000).
2.2.4 数据处理利用Excel 2003和SPSS19.0软件对数据进行统计分析.
3 结果与分析(Results and analysis)3.1 附植藻类生物量由图 1可知, 附植藻类生物量随水体氮、磷浓度的升高而增加, 在沉积物氮、磷水平较低(NPs1)的情况下, 与NP1相比, NP2与NP3处理中附植藻类生物量分别增加了22.05%、57.48%;在沉积物氮、磷水平较高(NPs2)的情况下, 与NP1相比, NP2、NP3处理中附植藻类生物量分别增加了27.07%、51.89%.由此可见, 两种氮、磷水平处理的沉积物中, 其水体氮、磷浓度升高对附植藻类生物量均有明显的影响.与水体氮、磷浓度相比, 沉积物氮、磷水平升高对附植藻类生物量的影响较小(图 1).当水体氮、磷水平处于NP2水平时, 沉积物氮、磷水平升高对附植藻类生物量的作用稍大, 但与低氮、磷水平(NPs1)的沉积物相比, 高氮、磷水平(NPs2)的沉积物中其附植藻类仅增加了9.03%.通过双因素方差分析可知, 水体氮、磷浓度对附植藻类生物量存在极显著作用(F=21.19, p < 0.01);而沉积物氮、磷含量对附植藻类生物量的作用未达到显著水平(p>0.05), 水体氮、磷水平与沉积氮、磷水平对附植藻类生物量影响的交互作用并不显著(p>0.05).
图 1(Fig. 1)
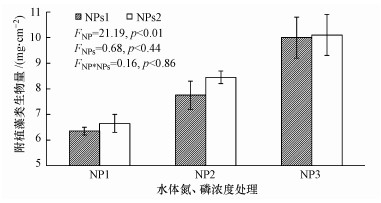 |
| 图 1 不同氮、磷水平下附植藻类生物量 Fig. 1Biomass of epiphytic algae at different N and P levels |
3.2 附植藻类群落组成图 2所示为不同氮、磷浓度下苦草上附植藻类群落中藻类相对丰度大于1%的种属.从图 2可以看出, 附植藻类主要由硅藻(Bacillariophyta)、蓝藻(Cyanobacteria)和绿藻(Chlorophyta)组成, 其中, 硅藻占绝对优势, 相对丰度在61.60%~71.88%之间变化;蓝藻及绿藻相对较少, 相对丰度分别为11.75%~18.82%、10.63%~18.41%.从图 2还可以看出, 硅藻门主要有脆杆藻(Fragilaria)、舟形藻(Navicula)、异极藻(Gomphonema)、小环藻(Cyclotella)和直链藻(Melosira), 其中, 舟形藻、小环藻和直链藻占绝对优势, 在几种处理中的相对丰度均大于10%;蓝藻门中的微囊藻(Microcystis)占绝对优势, 其相对丰度在11.73%~18.65%;绿藻门主要包括栅藻(Scenedesmus)和小球藻(Chlorella), 其中, 小球藻相对丰度较大, 在7.19%~13.7%之间变动.随着水体氮、磷浓度的升高, 苦草上藻类的优势藻类组成虽发生了变化, 但变化不大.随着水体可获得的氮、磷浓度升高, 舟形藻、直链藻、微囊藻、小环藻和小球藻均为优势属种, 但藻类的相对丰度有所变化.舟形藻、小球藻及微囊藻相对丰度随着水体氮、磷浓度的升高而下降;异极藻和直链藻则相反, 随着水体氮、磷浓度的升高, 其相对丰度增加;脆杆藻、小环藻及栅藻相对丰度随水体氮、磷浓度的增加呈波动变化.当水体氮、磷浓度分别达到3.5、0.35 mg·L-1时, 异极藻相对丰度超过10%, 成为优势种类.
图 2(Fig. 2)
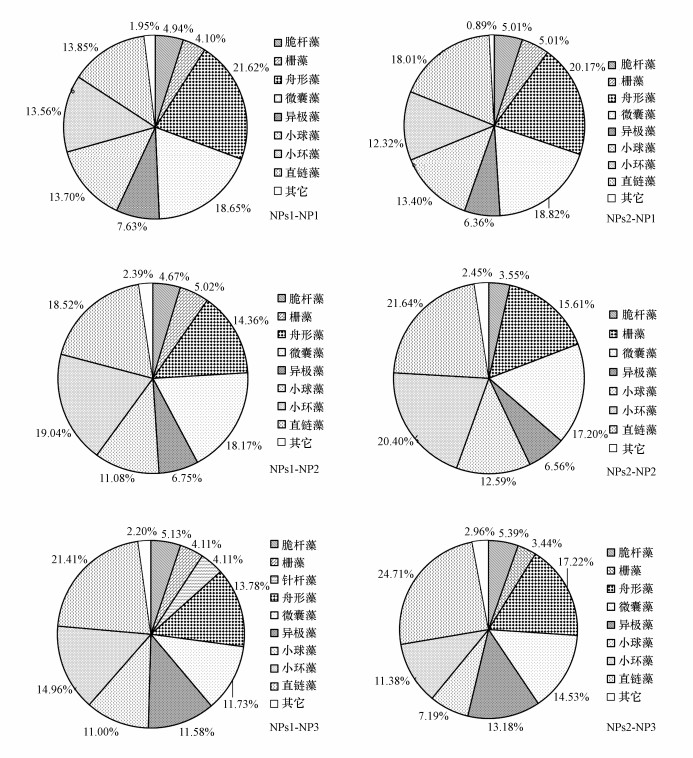 |
| 图 2 不同氮、磷水平下附植藻类群落组成 Fig. 2Community composition of epiphytic algae at different N and P levels |
由图 2可知, 沉积物氮、磷水平对附植藻类优势种影响较小.在相同水体氮、磷浓度条件下, 沉积物藻类优势种相同, 但对相对丰度小于10%的种类来说却存在变化.在水体氮、磷浓度较低(NP1)时, 沉积物氮、磷水平对苦草上附植藻类相对丰度小于10%的藻类影响不大.然而, 当水体氮、磷浓度较高(NP2)时, 氮、磷水平低的沉积物中, 附植藻类群落中栅藻的相对丰度约为5%;而氮、磷水平高的沉积物中, 其附植藻类群落中栅藻的相对丰度却小于1%.NP3处理下, 氮、磷含量较低的沉积物中, 附植藻类群落中针杆藻的相对丰度超过了1%, 均值达到4.11%;而氮、磷含量较高的沉积物中, 其附植藻类群落中针杆藻的相对丰度依然小于1%(图 2).具体原因有待于进一步探讨.
3.3 附植藻类氮、磷含量水体氮、磷浓度对附植藻类氮、磷含量存在着影响(图 3).从图 3可知, 随着水体氮、磷浓度升高, 附植藻类氮、磷含量随之升高.在NPs1情况下, 相对于NP1而言, NP2与NP3处理附植藻类的氮含量分别增加了7.25%、27.23%, 磷含量分别增加了12.95%、2.51%;在NPs2情况下, 附植藻类氮含量分别增加了5.19%、15.49%, 磷含量分别增加了16.62%、22.78%.由此可见, 两种氮、磷水平处理的沉积物, 其水体氮、磷浓度升高对附植藻类氮、磷含量均有明显的影响.与水体氮、磷浓度相比, 沉积物氮、磷含量升高对附植藻类氮、磷含量影响较小, 且随着水体氮、磷浓度的升高, 沉积物氮、磷含量对附植藻类氮含量的影响随之减弱(图 3).这说明在低氮、磷浓度的水体中, 沉积物氮对附植藻类氮的贡献较大;而对磷来说, 当水体氮、磷水平分别处于NP1、NP2及NP3时, 相对于低氮、磷水平的沉积物而言, 高氮、磷水平的沉积物中的附植藻类, 其磷含量分别增加了3.34%、6.70%、3.58%.这说明当水体氮、磷含量处于NP2时, 沉降物对附植藻类贡献较大.通过双因素方差分析可知, 水体氮、磷浓度对附植藻类氮、磷含量均存在显著作用(F=28.03, p < 0.01;F=6.94, p < 0.05);而沉积物氮、磷水平对附植藻类氮、磷含量的作用未达到显著水平(p>0.05), 水体氮、磷水平与沉积氮、磷水平对附植藻类氮、磷含量的交互作用并不显著(p>0.05).
图 3(Fig. 3)
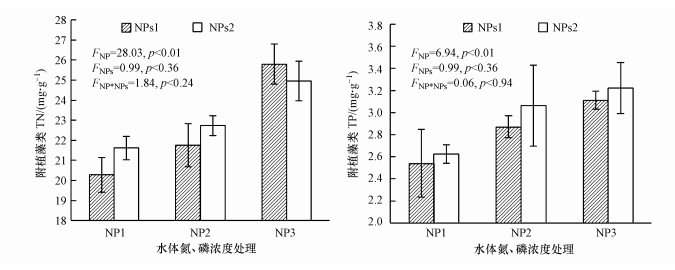 |
| 图 3 不同氮、磷水平下附植藻类氮、磷含量 Fig. 3Nitrogen and phosphorus contents in community of epiphytic algae at different N and P levels |
4 讨论(Discussion)附植藻类与沉水植物作为水体的初级生产者, 是浅水水域生态系统的重要组成部分.氮、磷是初级生产者的生源要素, 对附植藻类及其宿主植物无疑会产生影响.已有的研究表明, 附植在惰性基质上的着生藻类, 其生物量随着水体氮、磷含量的增加而迅速增加(Havens et al., 1999;Quinlan et al., 2008;Sutherland et al., 2017).李佩等(2012)的研究表明, 不同浓度的氮、磷等营养元素下的附植藻类生物量存在显著差异, 在中、高营养盐浓度下的附植藻类生物量最高.通过野外对寡营养、中营养及富营养湖泊中的附植藻类调查也发现, 湖泊氮、磷等营养盐水平越高, 附植藻类生物量越大, 附植藻类生物量与水体氮、磷等含量存在显著相关性(Pizarro et al., 2002).本实验结果与这些研究结果一致.研究表明, 当水体营养盐水平较低时, 沉水植物通过根部从底泥吸收氮、磷等营养元素不仅可用来满足自身生长的需求, 而且通过输送到叶片从而释放到周围环境中(Agnieszka, 2002).即便沉水植物只能释放非常少量的营养物质(从根系吸收的磷的1%~2%), 也能对附植藻类产生巨大的影响(Moeller et al., 1988; Agnieszka, 2002).附植藻类能够吸收15%~100%植物释放的磷(Moeller et al., 1988; Burkholder et al., 1990; Wetzel, 2001), 进而对附植藻类的生长产生影响(Agnieszka, 2002).附植藻类及其宿主植物也能从水体中吸收氮、磷等营养元素.有研究表明, 当水体氨氮浓度为0.1 mg·L-1时, 植物通过叶吸收的氮超过其通过根从沉积物中吸收的氮(Nichols et al., 1976), 这也意味着当水体氨氮浓度超过0.1 mg·L-1时, 附植藻类可从水体直接吸收氮、磷等营养盐来满足自身的生长需要.事实上, 本文实验设计中, 水体中氮的浓度远远高于0.1 mg·L-1, 实验结果也表明, 沉积物氮、磷水平对附植藻类生物量没有显著影响, 说明水体中氮、磷水平已满足附植藻类对氮、磷的需要.研究表明, 附植藻类从水体中吸收溶解性氮、磷的能力特别强(Wetzel, 2001; Dodds, 2003), 通过吸收作用将氮、磷滞留在生物体中.Wetzel(2001)的研究表明, 丝状藻类消耗了水体中95%的可利用氮源及85%的磷源.从附植藻类氮、磷含量也可以看出, 附植藻类氮、磷的含量受水体氮、磷影响较显著, 而沉积物氮、磷对附植藻类氮、磷含量没有显著影响(图 3).
不同湖泊中附着藻类群落以硅藻门、蓝藻门及绿藻门占优势, 但优势藻组成和优势藻丰度存在着差异.裴国凤等(2011)对湖北21个湖泊底栖藻类的调查结果表明, 极细微曲壳藻(Achnanthes Montana Krasske)在中营养、中-富营养湖泊底栖藻类群落中占绝对优势, 曲壳藻(Achnanthes spp.)是富营养湖泊东湖沿岸带夏季底栖藻类优势种, 小形异极藻(Gomphonema parvulum)在富营养化严重的南湖占绝对优势, 这说明附着藻类群落通过改变其优势种组成来适应新的环境.本文通过室内模拟也表明, 在各处理中, 苦草上附着藻类群落均以硅藻门、蓝藻门、绿藻门占优势, 其中, 硅藻门占绝对优势, 其相对丰度在61.60%~71.88%之间.各处理组中舟形藻、直链藻、微囊藻、小环藻和小球均是优势属种.随着水体氮、磷水平的升高, 舟形藻、小球藻及微囊藻的相对丰度随之降低, 而异极藻和直链藻的相对丰度随之升高.当水体氮、磷浓度分别达到3.5、0.35 mg·L-1时, 异极藻的相对丰度超过10%, 成为优势属种.由此可见, 本实验中随着水体氮、磷浓度的增加, 附植藻类通过改变其优势种的组成及丰度进而保持附植藻类的生长.这也是浅水湖泊在富营养过程中, 沉水植物表面的附着藻类因外源氮、磷等营养盐输入而过度生长繁殖(Qin et al., 2006), 进而对沉水植物生长产生不利影响导致沉水植物衰亡的主要原因.近年来的一些研究表明, 附植藻类大量覆盖减少了到达宿主植物表面的光合有效辐射, 进而降低水草叶片表面HCO3-的扩散速率, 使沉水植物光合速率降低(Sand-Jensen, 1977;Song et al., 2017;Nelson, 2017), 从而影响沉水植物的生长及生存(魏宏农等, 2013;Song et al., 2017).在水动力扰动比较大的水体中, 大量的附植藻类覆盖增加了水流的物理阻力, 也使植物叶片或植株易受伤害, 影响其生长(Nelson, 2017).但在寡营养湖中, 水体氮、磷等营养物质的浓度较低, 附着藻类主要通过宿主植物从沉积物中获得营养, 附植藻类的发展受到宿主植物的制约(Robets et al., 2003;卡尔夫, 2011).随着水体中氮、磷等营养物质的增加, 附植藻类可直接从水体中获得氮、磷等营养元素满足自身生长需要, 生物量急剧增加(Havens et al., 1999), 从而不利于沉水植物生长, 导致水草衰退甚至消失(由文辉, 1999;Frankovich et al., 2005; Song et al., 2017).
5 结论(Conclusions)1) 随着水体氮、磷浓度升高, 附植藻类生物量显著增加(p < 0.01), 底泥氮、磷含量对附植藻类生物量的影响随之减小.水体氮、磷浓度相同时, 附植藻类生物量随底泥氮、磷水平的升高未显著增加(p>0.05).
2) 随着环境中可获得的氮、磷增加, 附植藻类优势种变化不大, 各处理组中舟形藻、直链藻、微囊藻、小环藻和小球均为优势属种, 但藻类相对丰度发生了变化.舟形藻、小球藻及微囊藻的相对丰度随着水体氮、磷浓度的升高而下降, 异极藻和直链藻的相对丰度随着水体氮、磷浓度的升高而增加.
3) 随着水体氮、磷浓度升高, 附植藻类氮、磷含量显著增加(p < 0.01), 底泥氮、磷含量升高对附植藻类氮、磷含量的影响随之减弱;水体氮、磷浓度相同的情况下, 沉积物氮、磷含量增加对附植藻类氮、磷含量的影响不大.
参考文献
| Agnieszka P.2002.The indirect effect of sediment nutrient enrichment on the epiphytic algal community[D].Bowling: Bowling Green State University |
| Azim M E, Verdegem M C J, van Dam A A, et al. 2005. Periphyton:Ecology, Exploitation and Management[M]. Wallingford: CABI Publishing. |
| Balata D, Piazzi L, Nesti U, et al. 2010. Effects of enhanced loads of nutrients on epiphytes on leaves and rhizomes of Posidonia oceanica[J]. Journal of Sea Research, 63(3): 173–179. |
| Blumenshine S C, Vadeboncoeur Y, Lodge D M, et al. 1997. Benthic-pelagic links:responses of benthos to water-column nutrient enrichment[J]. Journal of the North American Benthological Society, 16(3): 466–479.DOI:10.2307/1468138 |
| Borum J. 1985. Development of epiphytic communities on eelgrass (Zostera marina) along a nutrient gradient in a Danish estuary[J]. Marine Biology, 87(2): 211–218.DOI:10.1007/BF00539431 |
| Br?nmark C. 1989. Interactions between epiphytes, macrophytes and freshwater snails:a review[J]. Journal of Molluscan Studies, 55(2): 299–311.DOI:10.1093/mollus/55.2.299 |
| Burkholder J M, Wetzel R Q. 1990. Epiphytic alkaline phosphatase on natural and artificial plants in an oligotrophic lake:reevaluation of the role of macrophytes as a phosphorus source for epiphytes[J]. Limnology and Oceanography, 35(3): 736–747.DOI:10.4319/lo.1990.35.3.0736 |
| 陈宇炜, 陈开宁, 胡耀辉. 2006. 浮游植物叶绿素a测定的"热乙醇法"及其测定误差的探讨[J]. 湖泊科学, 2006, 18(5): 550–552.DOI:10.3321/j.issn:1003-5427.2006.05.019 |
| Dodds W K. 2003. The role of periphyton in phosphorus retention in shallow freshwater aquatic systems[J]. Journal of Phycology, 39(5): 840–849.DOI:10.1046/j.1529-8817.2003.02081.x |
| Frankovich T A, Zieman J C. 2005. Periphyton light transmission relationships in Florida Bay and the Florida Keys, USA[J]. Aquatic Botany, 83(1): 14–30.DOI:10.1016/j.aquabot.2005.05.003 |
| Havens K E, East T L, Rodusky A J, et al. 1999. Littoral periphyton responses to nitrogen and phosphorus:an experimental study in a subtropical lake[J]. Aquatic Botany, 63(3/4): 267–290. |
| 何剑锋, 王桂忠, 李少菁, 等. 2005. 北极拉普捷夫海春季冰藻和浮游植物群落结构及生物量分析[J]. 极地研究, 2005, 17(1): 1–10. |
| 黄祥飞, 陈伟民, 蔡启铭. 2000. 湖泊生态调查观测与分析[M]. 北京: 中国标准出版社. |
| 卡尔夫. 2011. 湖沼学:内陆水生态系统[M]. 北京: 高等教育出版社. |
| 李佩, 谢从新, 何绪刚, 等. 2012. 水体营养水平及附着藻类对苦草生长的影响[J]. 现代渔业, 2012, 39(1): 11–17. |
| McDougal R L, Goldsborough L G, Hann B J. 1997. Responses of prairie wetland to press and pulse additions of inorganic nitrogen and phosphorus production by planktonic and benthic algae[J]. Archiv Fur Hydrobiologie, 140: 145–167.DOI:10.1127/archiv-hydrobiol/140/1997/145 |
| Moeller R E, Burkholder J M, Wetzel R G. 1988. Significance of sedimentary phosphorus to a rooted submersed macrophyte(Najasflexilis(Willd.) Rostk.and Schmidt) and its algal epiphytes[J]. Aquatic Botany, 32(3): 261–281.DOI:10.1016/0304-3770(88)90120-9 |
| Nelson W G. 2017. Development of an epiphyte indicator of nutrient enrichment:A critical evaluation of observational and experimental studies[J]. Ecological Indicators, 79: 207–227.DOI:10.1016/j.ecolind.2017.04.034 |
| Nichols D S, Keeney D R. 1976. Nitrogen nutrition of Myriophyllum spicatum:uptake and translocation of 15N by shoots and roots[J]. Freshwater Biology, 6(2): 145–154.DOI:10.1111/fwb.1976.6.issue-2 |
| 裴国凤, 刘国祥. 2011. 长江中游湖泊沿岸带的底栖藻类群落结构特征[J]. 湖泊科学, 2011, 23(2): 239–245. |
| Pettit N E, Ward D P, Adame M F, et al. 2016. Influence of aquatic plant architecture on epiphyte biomass on a tropical river floodplain[J]. Aquatic Botany, 129: 35–43.DOI:10.1016/j.aquabot.2015.12.001 |
| Pizarro H, Vinocur A, Tell G. 2002. Periphyton on artificial substrata from three lakes of different trophic status at Hope Bay(Antarctica)[J]. Polar Biology, 25(3): 169–179. |
| Qin B Q, Song Y Z, Gao G. 2006. The role of periphytes in the shift between macrophyte and phytoplankton dominated systems in a shallow, eutrophic lake(Lake Taihu, China)[J]. Sciencein China Series C, 49(6): 597–602.DOI:10.1007/s11427-006-2025-y |
| Quinlan E L, Phlips E J, Donnelly K A, et al. 2008. Primary producers and nutrient loading in Silver Springs, FL, USA[J]. Aquatic Botany, 88(3): 247–255.DOI:10.1016/j.aquabot.2007.11.003 |
| Roberts E, Kroker J, Krner S, et al. 2003. The role periphyton during the recolonization of a shallow lake with submerged macrophytes[J]. Hydrobiologia, 506(1/3): 525–530. |
| Sand-Jensen K. 1977. Effect of epiphytes on eelgrass photosynthesis[J]. Aquatic Botany, 3: 55–63.DOI:10.1016/0304-3770(77)90004-3 |
| 宋玉芝, 王宇佳, 王锦旗, 等. 2016. 水体氮磷浓度对两种沉水植物上附着藻类的影响[J]. 环境科学学报, 2016, 36(9): 3208–3212. |
| Song Y Z, Wang J Q, Gao Y X. 2017. Effects of epiphytic algae on biomass and physiology of Myriophyllum spicatum L.with the increase of nitrogen and phosphorus availability in the water body[J]. Environmental Science and Pollution Research, 24(10): 9548–9555.DOI:10.1007/s11356-017-8604-6 |
| Sutherland D L, Craggs R J. 2017. Utilisingperiphytic algae as nutrient removal systems for the treatment of diffuse nutrient pollution in waterways[J]. Algal Research, 25: 496–506.DOI:10.1016/j.algal.2017.05.023 |
| 魏宏农, 潘建林, 赵凯, 等. 2013. 菹草附着物对营养盐浓度的响应及其与菹草衰亡的关系[J]. 生态学报, 2013, 33(24): 7661–7666. |
| Wetzel R G. 2001. Limnology:Lake and River Ecosystems[M]. San Diego: Academic Press. |
| 由文辉. 1999. 淀山湖着生藻类群落结构与数量特征[J]. 环境科学, 1999, 20(5): 59–62.DOI:10.3321/j.issn:0250-3301.1999.05.002 |
