 , 孙志伟1,3, 宋佳伟1,2, 徐刚1
, 孙志伟1,3, 宋佳伟1,2, 徐刚1

1. 中国科学院烟台海岸带研究所, 烟台 264003;
2. 中国科学院大学, 北京 100049;
3. 鲁东大学, 烟台 264003
收稿日期: 2018-03-20; 修回日期: 2018-06-05; 录用日期: 2018-06-05
基金项目: 国家自然科学基金(No.41573120,41103073)
作者简介: 吕迎春(1979-), 女, E-mail:yclv@yic.ac.cn
通讯作者(责任作者): 徐刚, E-mail:gxu@yic.ac.cn
摘要: 磷酸酶催化水解有机磷是水体生物有效磷的重要补充途径.以天鹅湖富营养化水体为研究对象,研究了磷和金属对水体中碱性磷酸酶的活性(APA)和动力学性质的影响.结果表明:磷酸根(PO43-)、六偏磷酸根((PO3)66-)、焦磷酸根(P2O74-)、β-甘油磷酸根((C3H4O6P)2-)在0.01~1 mmol·L-1范围内对APA表现为抑制作用,并且抑制作用随浓度的升高而增强:浓度为1 mmol·L-1时,与对照相比,水体中APA分别降低50.8%、55.8%、52.4%和14.4%.金属Al3+、Co2+、Pb2+和Cr6+对APA的激活作用随浓度增大而增强,浓度为1 mmol·L-1时,水体APA分别是空白的2.8、3.1、2.3和2.7倍.重金属Cu2+、Zn2+、Ni2+对水体中碱性磷酸酶表现出抑制作用,3种重金属中Cu2+抑制作用最显著.当Cu2+浓度为1 mmol·L-1时,碱性磷酸酶相对活性仅为空白的62.3%.随着Cu2+、PO43-、(PO3)66-、P2O74-浓度增大,碱性磷酸酶的最大反应速率Vmax保持基本稳定,米氏常数Km增大,因此,它们对碱性磷酸酶的抑制为竞争性抑制类型.同时,Vmax/Km值随Cu2+、PO43-、(PO3)66-、P2O74-、(C3H4O6P)2-浓度的增大而降低,催化效率降低,说明Vmax/Km可作为水体磷酸酶催化能力的有效指标.总体而言,含磷基团和金属离子会显著影响富营养化水体APA,将间接影响水体有机磷的转化和供磷效率.
关键词:碱性磷酸酶动力学特征竞争性抑制天鹅湖
Effects of phosphate and metal ions on alkaline phosphatase activity and kinetic parameters in Swan Lake, Rongcheng
Lü Yingchun1
 , SUN Zhiwei1,3, SONG Jiawei1,2, XU Gang1
, SUN Zhiwei1,3, SONG Jiawei1,2, XU Gang1

1. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003;
2. University of Chinese Academy of Sciences, Beijing 100049;
3. Ludong University, Yantai 264003
Received 20 March 2018; received in revised from 5 June 2018; accepted 5 June 2018
Supported by the National Natural Science Foundation of China(No.41573120, 41103073)
Biography: LV Yingchun(1979—), female, E-mail:yclv@yic.ac.cn
*Corresponding author: XU Gang, E-mail:gxu@yic.ac.cn
Abstract: The catalytic hydrolysis of organic phosphorus by phosphatase represents an important source of available phosphorus in surface water. To assess the effects of phosphate and metal ions on alkaline phosphatase activity and kinetic parameters, surface water samples were taken from the coastal Swan Lake water in Rongcheng. Results show that phosphate (PO43-), hexametaphosphates (PO3)66-, pyrophosphate (P2O74-) and β-glycerophosphate (C3H4O6P)2- could inhibit the alkaline phosphatase activity (APA) when their concentrations were in the range of 0.01-1mmol·L-1. And this inhibition effect increased with the increase of the ion concentrations. In comparison, the APA decreased 50.8%, 55.8%, 52.4% and 14.4% as treated by 1 mmol·L-1 PO43-, (PO3)66-, P2O74-, (C3H4O6P)2-, respectively. The activation of APA by Al3+、Co2+、Pb2+ and Cr6+ increased when their concentration increased. After adding 1 mmol·L-1 Al3+, Co2+, Pb2+ and Cr6+ to the water, the APA increased by a factor of 2.8, 3.1, 2.3 and 2.7, respectively. The heavy metal Cu2+, Zn2+, Ni2+ were also found to have inhibition effects on APA, especially for Cu2+.The residual APA dramatically decreased to 62.3% at 1 mmol·L-1of Cu2+. The significant reduction of an apparent substrate affinity (Km) and the uniform pattern of maximum APA (Vmax) were both observed when the Cu2+, PO43-, (PO3)66-, P2O74- increased. This phenomenon indicates that Cu2+, PO43-, (PO3)66-, P2O74- behave in competitive inhibition effects. In addition, Vmax/Km ratio is a good indicator for the catalytic efficiency of alkaline phosphatases in eutrophic water. This research suggests that the phosphate and metal ions can significantly influence APA and has profound implication for the transform and supplement of the organic phosphorus in eutrophic water.
Keywords: alkaline phosphatasekinetic parameterscompetitive mechanismSwan Lake
1 引言(Introduction)水体富营养化是当今世界面临的主要水环境问题,我国大部分内陆湖泊水体和部分河口海湾已经出现富营养化甚至重度富营养化现象(秦伯强等,2013).磷是造成水体富营养化的关键因素之一,水体中磷主要以溶解态有机磷和悬浮态颗粒磷的形式存在,分别占总磷的12%~30%、62%~82%,而生物可直接利用的正磷酸盐仅占5%~8%(高光等,2005).显然,水体可溶性无机磷含量很难满足水体生物生长繁殖所需,而碱性磷酸酶(AP)能够通过催化反应将有机磷水解并释放出无机磷供生物直接利用(Grzyb et al., 2012).
碱性磷酸酶是一种非特异性磷酸单脂酶,它存在于除高等植物外几乎所有的生物体内,可直接参加磷的代谢过程,在磷的消化、吸收、分泌等过程中发挥着重要作用.碱性磷酸酶活性(APA)可指示水生生态系统磷的丰缺,对水体内源有机磷释放及其富营养化都有重要影响(杜虹等,2005).APA的高低是系统磷限制的重要指标.Perkins等(2000)在原位营养添加实验中表明,APA能很好地反映水体磷限制情况.曲博等(2015)研究也发现,添加外源磷酸酶可以促进稳定性有机磷向活性磷转化.水体中APA与磷形态及含量密切相关.Huang等(1999)在厦门湾水体的研究结果表明,水体APA同磷酸盐和一些低分子有机磷(甘油磷酸等)存在显著负相关关系,这说明水体AP产生受这些离子的抑制.
此外,环境中的重金属也会影响APA,一些土壤、沉积物和污泥中重金属的积累显著降低了它们的APA,进而影响磷的转化和生物有效性(冯丹等,2015).谢春生(2012)研究了市政污泥中重金属离子对APA的影响,结果表明,Zn2+、Cu2+、Ag+对污泥中的碱性磷酸酶有较强的抑制作用,Mg2+、Co2+、Pb2+、Cr6+对碱性磷酸酶有不同程度的激活作用.近年来由于人类活动加剧,水体和沉积物中重金属离子等不断累积,已经对当地生态环境构成了威胁(秦延文等,2012).这些重金属和含磷基团可能会影响水体磷酸酶活性和动力学转化,进而影响水体有机磷的分解和生物有效性,这对掌握水体富营养化进程和治理具有重要意义.目前有关磷和重金属离子对水体APA影响的报道十分有限.基于此,本文对富营养化水体中各种阴阳离子对APA及动力学性质的影响进行研究,旨在为水环境监测提供酶学指标,也为水体富营养化治理提供理论依据.
2 材料与方法(Materials and methods)2.1 采样点概况山东荣成天鹅湖,又名月湖,位于东经122°33′0"~122°34′30",北纬37°19′31"~37°22′30".由于港湾泥沙淤积逐渐变成椭圆形半封闭的泻湖,面积约6 km2,平均水深1~2 m.由于沉积物在入口处堆积使潮流通道变短,水体交换不畅,水质加速恶化.另外,受人类活动影响,大量污染物汇入天鹅湖,湖区刚毛藻和大叶藻等藻类大量繁殖.天鹅湖水质已经呈富营养化状态,水体总磷为0.1 mg·L-1,活性磷为0.011 mg·L-1,叶绿素含量为1.9 mg·L-1(张友,2017).
2.2 样品采集与分析在天鹅湖均匀选取15个采样点(图 1),于2016年5月在上述采样点用有机玻璃采样器采集表层(0~50 cm)水样5 L,每个采样点使用GPS定位仪精确定位.15个采样点各采集1 L水样后混合成一个样品,带回实验室冷藏保存,测定各项指标.
图 1(Fig. 1)
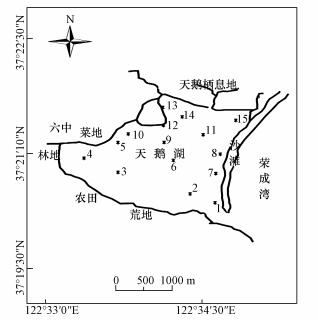 |
| 图 1 水样采样点示意图 Fig. 1The sampling site in this study |
实验中考虑到正常海水中各阴阳离子的种类与浓度,结合富营养化水体天鹅湖的实际人为排放量,选取不同浓度(0.01~1 mmol·L-1)含磷阴离子(磷酸根(PO43-)、六偏磷酸根((PO3)66-)、焦磷酸根(P2O74-)、β-甘油磷酸根((C3H4O6P)2-))和金属离子(Ca2+、Mg2+、Al3+、Cu2+、Zn2+、Ni2+、Mn2+、Co2+、Pb2+和Cr6+),测定离子添加平衡后碱性磷酸酶的相对活力.为了扣除相反离子的贡献,实验中还考察了Cl-、NO2-、NO3-、SO42-和K+、Na+添加对水体APA的影响.采集水样分别添加上述阴阳离子,样品平衡24 h后过0.45 μm滤膜,然后用于APA和动力学的测定.
APA采用对硝基苯磷酸二钠(p-NPP)水解法测定(周易勇等,2001).取水样2 mL,加入1 mL Tris-HCl缓冲液(pH=8.4, 0.05 mol·L-1),加入2 mL p-NPP(5 mmol·L-1),在30 ℃下保持6 h,之后加入1滴1 mol·L-1 NaOH终止反应,然后通过分光光度计于波长410 nm条件下测定对硝基苯酚的含量用以表征APA.AP动力学性质分析时分别取0.05、0.065、0.1、0.2、0.5、1.0、2.0 mmol·L-1的p-NPP,测定水样中APA,然后通过米氏方程计算其动力学参数(周易勇等,2001).
所有样品均做3次平行,实验数据以3次分析的平均值表示.实验准确度采用标准碱性磷酸酶样品(Sigma, P7640)进行标定:配制1.08 UN·mL-1(1UN标准品可以水解1 mmol p-NPP)碱性磷酸酶溶液,标定结果为(1.02±0.006) UN·mL-1.对3次平行变异系数>5%的样品补测数据,直至其变异系数 < 5%,以确保分析结果的精密度.
2.3 数据处理与分析将原水样测定的APA值设为100%,把其他加入不同阴阳离子条件下所测得的APA换算成相对酶活性B(式(1)),用以比对不同阴阳离子对APA的影响.
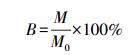 | (1) |
在动力学实验中,通过米氏方程确定不同底物浓度下,碱性磷酸酶所发生反应的最大反应速率(Vmax)及米氏常数(Km).经整理后米氏方程为:
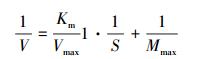 | (2) |
3 结果与讨论(Results and discussion)3.1 不同阴离子对APA的影响由表 1可知,无机阴离子Cl-、NO2-、NO3-、SO42-对APA基本无影响,即使在高浓度下也无明显影响.这同Xie等(2010)的研究结果一致,即使高浓度的Cl-、NO2-、NO3-和SO42-对污泥中的APA也无明显作用.含磷离子如磷酸根(PO43-)、六偏磷酸根((PO3)66-)、焦磷酸根(P2O74-)、β-甘油磷酸根((C3H4O6P)2-)对APA具有显著的抑制作用.当PO43-、(PO3)66-、P2O74-、(C3H4O6P)2-浓度为1 mmol·L-1时,与对照相比,水体中APA分别降低50.8%、55.8%、52.4%和14.4%.碱性磷酸酶是一种诱导酶,磷营养的增多可以抑制磷酸酶的产生与分泌,即所谓的“抑制-诱导”机制中的产物抑制机制.Kuenzler等(1965)研究指出,多种处于缺磷状态的海藻能够产生碱性磷酸酶,而磷营养过剩时,酶的合成受到抑制.高光等(2005)在太湖的模拟研究表明,当水体中活性磷>0.2 mg·L-1时,磷酸盐增加会显著抑制APA,使其活性显著减小.Nausch等(1998)研究磷酸酶与磷酸盐浓度关系时指出,当正磷酸盐浓度高于0.2 μmol·L-1时,磷酸酶活性受到抑制.Labry等(2016)报道了当磷酸盐浓度低于0.05 μmol·L-1时,磷酸酶会被诱导生成,高于这个浓度时APA受到抑制.但在一些其它湖泊中,活性磷浓度高达0.32 mg·L-1时也未显示出对APA的抑制作用.这说明不同水体中碱性磷酸酶的作用阈值是不同的.碱性磷酸酶对很多有机磷和多聚磷的降解速率都低于酶测试反应的底物p-NPP(Flint et al., 1977),加入多聚磷酸盐和有机磷可能会导致碱性磷酸酶催化活力降低,从而显示出对碱性磷酸酶的抑制作用.Bogé等(2013)在寡营养水体中的研究表明,水体中溶解性无机磷和有机磷共同控制APA,高浓度有机磷可以增加细胞间磷酸盐含量,显著抑制APA(Young et al., 2010).P2O74-在高浓度时具有强烈的抑制作用,可能是因为其水解时产生两个磷酸根.
表 1(Table 1)
| 表 1 不同阴离子、磷酸根和含磷有机物对APA的影响 Table 1 The effect of anions, phosphates and organic phosphates on the alkaline phosphatase activity | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 不同阴离子、磷酸根和含磷有机物对APA的影响 Table 1 The effect of anions, phosphates and organic phosphates on the alkaline phosphatase activity
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 不同阳离子对APA影响由表 2可知,不同阳离子对富营养化水体中APA的作用可分为3种:抑制、激活和无明显作用.碱金属(如Na+、K+)和碱土金属(如Mg2+、Ca2+)对APA影响不明显.碱土金属(如Mg2+、Ca2+)对碱性磷酸酶的激活作用小于110%,说明Mg2+、Ca2+的激活作用不明显.Alnuaimi等(2012)研究表明,Mg2+和Ca2+对碱性磷酸酶具有明显激活作用,但他们采用的浓度最高可达30 mmol·L-1.Keiding等(1997)曾报道活性污泥中Ca2+浓度大于2.5 mmol·L-1时,由于细菌细胞渗透压升高而导致酶从胞内释放出来,从而提高了酶的活性.碱性磷酸酶被认为是含有Mg2+的二聚金属酶,Mg2+同APA部位相结合,是酶的激活剂(Grzyb et al., 2012).但本研究表明,Mg2+对水体碱性磷酸酶无明显激活作用,这可能跟研究水样中Mg2+浓度较高(约为40 mmol·L-1),而本实验中采用的Mg2+浓度(1 mmol·L-1)较低有关.
表 2(Table 2)
| 表 2 不同金属离子对水体APA的影响 Table 2 The effect of metal ions on the alkaline phosphatase activity | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 不同金属离子对水体APA的影响 Table 2 The effect of metal ions on the alkaline phosphatase activity
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Al3+对碱性磷酸酶表现出明显的激活作用,且激活作用随Al3+浓度的增大而增强,添加1 mmol·L-1Al3+水体的碱性磷酸酶剩余活力达到284%.Al3+具有较强络合作用,能与磷酸酶反应底物有机磷或者水解生成的磷酸根络合,作为一种响应机制,系统APA显著增加(Jansson, 1981).Olsson等(1991)报道在酸性湖泊中,随Al3+浓度增加,湖水中磷酸酶活性出现增加.但当Al3+浓度>5 mmol·L-1时,Al3+与对硝基苯酚生成混凝沉淀,降低了APA(Xie et al., 2010).
Cu2+、Zn2+、Ni2+对水体中APA表现出抑制作用,其中以Cu2+的抑制作用最显著,当Cu2+浓度为1 mmol·L-1时,APA仅为空白的62.3%.有关Cu2+和Zn2+对土壤APA的抑制作用已有广泛报道(Huang et al., 2000),其抑制机理包括重金属通过与酶-基质混合物反应,或与酶蛋白的活性基团相结合(如与催化活性部位的硫氢基反应)等钝化酶活性.抑制方式依赖于基质种类和重金属数量(Juma et al., 1977; Gülser et al., 2008).此外,重金属还可通过降低系统微生物活性而减少磷酸酶的合成(Gülser et al., 2008).
Mn2+和Co2+可以与APA中的活性部位结合而使APA的活性升高(Cathala et al., 1975).Pb2+和Cr6+对APA表现出明显激活效应,Pb2+和Cr6+等金属离子对很多生物都有毒性作用,当加入高浓度的这些金属离子时,系统容易变得更加不稳定从而导致APA升高(Xie et al., 2010).国外有****发现,当厌氧系统或者污泥消化系统不稳定的时候,会出现APA升高的现象(Benitez et al., 1999).
3.3 不同离子条件下碱性磷酸酶的动力学性质不同离子浓度下米氏常数的测试结果见图 2,米氏常数Km和Vmax的数值见表 3.碱性磷酸酶的动力学是依据不同底物浓度下所测得的不同反应速率来衡量的,Km和Vmax是研究酶促反应的重要参数.Vmax表示酶的内在催化速率,表征了碱性磷酸酶的最大反应活性,Vmax越大,酶的催化能力越强(Hoppe et al., 2003).不加任何离子时,天鹅湖水体碱性磷酸酶Vmax为29.4 μmol·h-1,加入不同浓度的Cu2+、PO43-、(PO3)66-、P2O74-后Vmax变化相对稳定,这反映了随着这些离子的加入,酶和底物的最大反应速率变化不显著.而加入(C3H4O6P)2-后Vmax随其浓度的升高出现了明显降低.
图 2(Fig. 2)
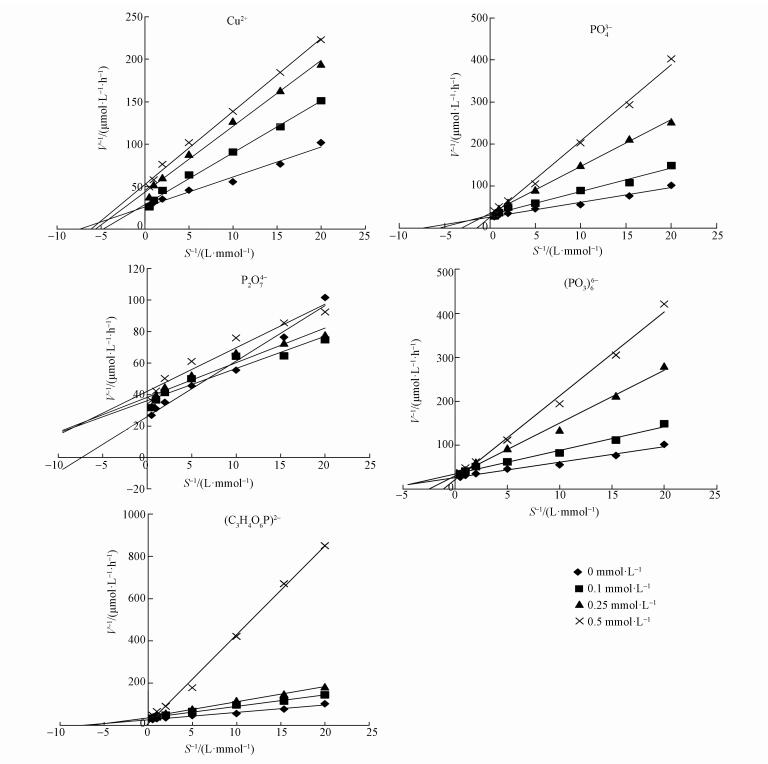 |
| 图 2 不同浓度离子对湖水中磷酸酶的米氏曲线 Fig. 2The Lineweaver-Burk plots for alkaline phosphatase activity at different concentrations of ions |
表 3(Table 3)
| 表 3 不同离子影响下碱性磷酸酶的Km、Vmax Table 3 The effect of anions, phosphates and organic phosphates on the alkaline phosphatase activity | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 不同离子影响下碱性磷酸酶的Km、Vmax Table 3 The effect of anions, phosphates and organic phosphates on the alkaline phosphatase activity
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
米氏常数(Km)可进一步指示水中磷的丰缺程度,它代表酶与底物亲和力的大小,Km值越小,酶与底物的亲和力越大;反之,则越小,也即形成酶-底物复合体的可能性越小(Hoppe et al., 2003).Km数值随Cu2+、PO43-、(PO3)66-、P2O74-的加入而变大,且浓度越高Km越大,说明Cu2+、PO43-、(PO3)66-、P2O74-的加入降低了酶与有机磷结合的亲和力,不利于有机磷的催化水解.
总体而言,Cu2+、PO43-、(PO3)66-、P2O74-在所测浓度范围(0~0.5 mmol·L-1)内,碱性磷酸酶的Vmax保持基本稳定,Km增大,因此,Cu2+、PO43-、(PO3)66-、P2O74-对碱性磷酸酶的抑制为竞争性抑制类型(周易勇等,2001;Xie et al., 2010).
Vmax/Km值通常表示碱性磷酸酶的催化效率(路娜等, 2010).由表 3可得,在0~0.5 mmol·L-1浓度范围内,随着Cu2+、PO43-、P2O74-、(PO3)66-、(C3H4O6P)2-浓度的提高,Vmax/Km值减小,催化效率降低.但引起下降的原因可能不同:Cu2+可能与AP活性部位和酶-底物复合物分别形成抑制剂-酶和抑制剂-酶-底物复合物,从而引起酶催化能力的下降.PO43-作为磷酸酶水解的产物之一,有可能显示出与磷酸酶竞争性抑制的特征而引起酶的催化能力下降.磷酸酶对大部分多聚磷酸盐和有机磷的降解速率均低于p-NPP,从而导致磷酸酶的催化效率降低(Xie et al., 2010).
4 结论(Conclusions)本文以天鹅湖富营养化水体为研究对象,探讨了磷和金属对水体中碱性磷酸酶的活性(APA)和动力学性质的影响.结果表明,PO43-、(PO3)66-、P2O74-、(C3H4O6P)2-会显著抑制水体磷酸酶的活性,而金属对水体碱性磷酸酶活性表现为抑制或激活作用:Cu2+、Zn2+、Ni2+显著降低了水体中碱性磷酸酶活性,其中以Cu2+的抑制作用最显著;Al3+、Mn2+、Co2+、Pb2+和Cr6+显著提高了水体APA活性.动力学结果表明,随着Cu2+、PO43-、P2O74-、(PO3)66-、(C3H4O6P)2-浓度的提高,Vmax/Km值减小,催化效率降低,Vmax/Km可作为表征水体磷酸酶催化能力的有效指标.总体而言,含磷基团和金属的添加显著改变了富营养化水体磷酸酶性质,将影响水体有机磷的转化和生物有效性,研究结果对探明水体富营养化机制及治理具有重要意义.本研究主要考察了单一因素对水体磷酸酶的调控作用,下一步可以考虑磷-重金属-有机污染物等复合因素对水体磷酸酶影响.
参考文献
| Alnuaimi M M, Saeed I A, Ashraf S S. 2012. Effect of various heavy metals on the enzymatic activity of E.coli alkaline phosphatase[J]. International Journal of Biotechnology and Biochemistry, 8(1): 47–59. |
| Benitez E, Nogales R, Elvira C, et al. 1999. Enzyme activities as indicators of the stabilization of sewage sludges composting with Eisenia foetida[J]. Bioresource Technology, 67(3): 297–303.DOI:10.1016/S0960-8524(98)00117-5 |
| Bogé G, Lespilette M, Jamet D, et al. 2013. The relationships between particulate and soluble alkaline phosphatase activities and the concentration of phosphorus dissolved in the seawater of Toulon Bay (NW Mediterranean)[J]. Marine Pollution Bulletin, 74(1): 413–419.DOI:10.1016/j.marpolbul.2013.06.003 |
| Cathala G, Brunel C. 1975. Bovine kidney alkaline phosphatase.Catalytic properties, subunit interactions in the catalytic process, and mechanism of Mg2+ stimulation[J]. Journal of Biological Chemistry, 250(15): 6046–6053. |
| 杜虹, 黄文魁, 陈旭明, 等. 2005. 柘林湾水体中碱性磷酸酶的活力分布及其影响因素[J]. 海洋环境科学, 2005, 24(2): 29–31.DOI:10.3969/j.issn.1007-6336.2005.02.009 |
| Flint K, Hopton J. 1977. Substrate specificity and ion inhibition of bacterial and particle associated alkaline phosphatases of waters and sewage sludges[J]. European Journal of Applied Microbiology and Biotechnology, 4(3): 195–204. |
| 冯丹, 王金生, 滕彦国. 2015. 重金属Cu对土壤碱性磷酸酶活性的影响[J]. 北京师范大学学报:自然科学版, 2015(1): 69–74. |
| Gülser F, Erdo?an E. 2008. The effects of heavy metal pollution on enzyme activities and basal soil respiration of roadside soils[J]. Environmental Monitoring and Assessment, 145(1/3): 127–133. |
| Grzyb J, Frαczek K. 2012. Activity of phosphohydrolytic enzymes in waters[J]. Ecological Chemistry and Engineering.A, 19(6): 583–589. |
| 高光, 朱广伟, 秦伯强, 等. 2005. 太湖水体中碱性磷酸酶的活性及磷的矿化速率[J]. 中国科学(D辑:地球科学), 2005, 35(增刊Ⅱ): 157–165. |
| Huang B Q, Hong H S. 1999. Alkaline phosphatase activity and utilization of dissolved organic phosphorus by Algae in subtropical coastal waters[J]. Marine Pollution Bulletin, 39: 205–211. |
| Hoppe H G. 2003. Phosphatase activity in the sea[J]. Hydrobiologia, 493: 187–200. |
| Huang Q, Shindo H. 2000. Effects of copper on the activity and kinetics of free and immobilized acid phosphatase[J]. Soil Biology and Biochemistry, 32(13): 1885–1892.DOI:10.1016/S0038-0717(00)00162-0 |
| Jansson M. 1981. Induction of high phosphatase activity by aluminum in acid lakes[J]. Archiv fur Hydrobiologie, 93(1): 32–44. |
| Juma N, Tabatabai M. 1977. Effects of trace elements on phosphatase activity in soils 1[J]. Soil Science Society of America Journal, 41(2): 343–346.DOI:10.2136/sssaj1977.03615995004100020034x |
| Keiding K, Nielsen P H. 1997. Desorption of organic macromoleeules from activated sludge-Effect of ionic composition[J]. Water Researeh, 31(7): 1665–1672.DOI:10.1016/S0043-1354(97)00011-0 |
| Kuenzler E J, Perras J P. 1965. Phosphatases of marine algae[J]. Biology Bulletin, 128: 271–284. |
| Labry C, Delmas D, Youenou A, et al. 2016. High alkaline phosphatase activity in phosphate replete waters:The case of two macrotidal estuaries[J]. Limnology and Oceanography, 61(4): 1513–1529. |
| 路娜, 胡维平, 邓建才, 等. 2010. 引江济太对太湖水体碱性磷酸酶动力学参数的影响[J]. 水科学进展, 2010, 21(3): 413–420. |
| Nausch M. 1998. Alkaline phosphatase activities and the relationship to inorganic phosphate in the Pomeranian Bight (southern Baltic Sea)[J]. Aquatic Microbial Ecology, 16(1): 87–94. |
| Olsson H.1991.Phosphatase Activity in an Acid, Limed Swedish Lake//Microbial Enzymes in Aquatic Environments[M]. New York, NY: Springer.206-219 |
| Perkins R, Underwood G. 2000. Gradients of chlorophyll a and water chemistry along an eutrophic reservoir with determination of the limiting nutrient by in situ nutrient addition[J]. Water Research, 34(3): 713–724. |
| 曲博, 李敏, 其美, 等. 2015. 外源植酸酶对野鸭湖湿地土壤有机磷转化的影响研究[J]. 生态环境学报, 2015, 24(2): 250–254. |
| 秦伯强, 高光, 朱广伟, 等. 2013. 湖泊富营养化及其生态系统响应[J]. 科学通报, 2013, 58(10): 855–864. |
| 秦延文, 郑丙辉, 李小宝, 等. 2012. 渤海湾海岸带开发对近岸沉积物重金属的影响[J]. 环境科学, 2012, 33(7): 2359–2367. |
| 孙善峰, 倪旻, 张盛周. 2012. 太湖表层沉积物中3种水解酶活性的时空变化特征[J]. 三明学院学报, 2012, 29(2): 24–29.DOI:10.3969/j.issn.1673-4343.2012.02.005 |
| Xie C, Lu R, Huang Y, et al. 2010. Effects of ions and phosphates on alkaline phosphatase activity in aerobic activated sludge system[J]. Bioresource Technology, 101(10): 3394–3399. |
| 谢春生.2012.碱性磷酸酶在点面污染源磷形态转化中的作用研究[D].杭州: 浙江大学http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2063053 |
| Young E B, Tucker R C, Pansch L A. 2010. Alkaline phosphatase in freshwater cladophora-epiphyte assemblages:regulation in response to phosphorus supply and localization[J]. Journal of Phycology, 46(1): 93–101.DOI:10.1111/(ISSN)1529-8817 |
| 周易勇, 李建秋, 张敏, 等. 2001. 浅水湖泊中沉积物碱性磷酸酶动力学参数的分布[M]. 北京: 科学出版社. |
| 张友.2017.荣成天鹅湖湿地有机磷分布和周转特征研究[D].北京: 中国科学院大学 |
| 张萍, 冯婧, 李哲, 等. 2015. 三峡澎溪河高阳平湖高水位时碱性磷酸酶活性及其动力学特征[J]. 湖泊科学, 2015, 27(4): 629–636. |
