 , 贺卓, 葛占标, 盛下放, 何琳燕
, 贺卓, 葛占标, 盛下放, 何琳燕

农业部农业环境微生物重点实验室, 南京农业大学生命科学学院, 南京 210095
收稿日期: 2018-03-13; 修回日期: 2018-04-17; 录用日期: 2018-04-17
基金项目: 国家自然科学基金(No.41471273)
作者简介: 燕传明(1991-), 男, E-mail:2015116058@njau.edu.cn
通讯作者(责任作者): 何琳燕, E-mail:helyan0794@njau.edu.cn
摘要: 针对目前重金属水污染现状,为探究微生物法修复重金属水污染机制,本试验以抗重金属革兰氏阴性菌Rhizobium sp.W33与革兰氏阳性菌Bacillus sp.H3为供试菌株,对不同重金属(Pb、Cd)浓度及pH条件下的菌株生长状况进行测定;比较不同状态细胞(Growing、Grown、Dead)的吸附能力;利用FTIR初步分析吸附相关官能团.结果表明:两株菌对Pb抗性较强,对Cd抗性相对较弱,最适生长pH均在6~7范围内;不同状态细胞的吸附能力大小为:Grown > Dead > Growing;随着重金属浓度的升高,Rhizobium sp.W33与Bacillus sp.H3的吸附容量逐渐增大,且对铅镉的吸附主要以胞外吸附为主,对铅有一定的胞内积累能力;FTIR分析显示菌株吸附过程中主要是—OH、—NH、—C=O、—CH2官能团在生物吸附过程中发挥作用.Rhizobium sp.W33与Bacillus sp.H3表面官能团特性及整体吸附能力存在明显差异.
关键词:重金属抗性细菌PbCd胞外吸附胞内聚集
Comparative study on adsorption characteristics of lead and cadmium by two heavy metal resistant bacteria
YAN Chuanming
 , HE Zhuo, GE Zhanbiao, SHENG Xiafang, HE Linyan
, HE Zhuo, GE Zhanbiao, SHENG Xiafang, HE Linyan

Key Laboratory of Agricultural and Environmental Microbiology, Ministry of Agriculture, College of Life Sciences, Nanjing Agricultural University, Nanjing 210095
Received 13 March 2018; received in revised from 17 April 2018; accepted 17 April 2018
Supported by the National Natural Science Foundation of China(No.41471273)
Biography: YAN Chuanming(1991—), male, E-mail: 2015116058@njau.edu.cn
*Corresponding author: HE Linyan, E-mail:helyan0794@njau.edu.cn
Abstract: In view of the current situation of heavy metal water pollution, the mechanism of remediation of heavy metal water pollution by microbiological method was explored. In this study, the heavy metal resistant gram-negative bacterium (Rhizobium sp. W33) and gram-positive bacterium (Bacillus sp. H3) were used as test strains. The effects of pH, lead (Pb) and cadmium (Cd) concentrations on the growth of strains were measured; the adsorption capacity of lead and cadmium by cells (Growing, Grown, Dead) of different states was compared; the adsorption related functional groups were preliminarily analyzed with FTIR. The results show that the strains had strong resistance to Pb compared to Cd. Moreover, the optimal growth pH was 6~7. The order of adsorption capacity of cells in different states was:Grown > Dead > Growing. The adsorption capacity of Rhizobium sp. W33 and Bacillus sp. H3 was gradually increased with the increase of heavy metal concentration, and the adsorption of lead and cadmium mainly focused on the extracellular adsorption, and there was a certain intracellular accumulation capacity of lead. The FTIR results show that the functional groups of —OH, —NH, —C=O, —2 played a role in the biosorption process. The surface functional groups and the overall adsorption capacity of Rhizobium sp. W33 and Bacillus sp. H3 was significantly different.
Keywords: heavy metal resistant bacteriaPbCdextracellular adsorptionintracellular aggregation
1 引言(Introduction)近年来, 随着工业和城市现代化的快速推进, 金属冶炼、矿山开采、化工生产等行业持续发展, 大量不达标工业废水的排放及人们的生产活动导致重金属水体污染问题越来越严重(Rajaganapathy et al., 2011).重金属铅镉作为机体生长发育非必需元素, 由于其具有高毒性及不可降解性等特点, 一旦进入环境中, 对人类和环境会造成极大危害.
重金属污染废水的常见治理技术包括化学沉淀法、电解法、离子交换法、膜处理法和微生物吸附法等(Cui et al., 2017), 由于物理化学方法在治理环境中重金属废水时成本较高, 且不能行之有效的处理低浓度(< 100 mg·L-1)废水(Tang et al., 2008), 因此以微生物吸附法为代表的生物法获得了越来越多的关注, 一方面它具有价格低廉、效率高、环境友好的特点, 另一方面还可以处理低浓度重金属废水.因此, 关于微生物吸附技术处理重金属污染方面的研究越来越广泛(张玉刚等, 2008).
微生物吸附法是利用具有生物活性或死亡的微生物体作为吸附剂进行吸附, 活性微生物体吸附包括胞外吸附和胞内积累, 胞外吸附主要由细胞壁上的基团与金属离子结合而吸附金属(Vijayaraghavan et al., 2008);胞内积累主要是利用生物体新陈代谢作用产生的能量, 通过单价或二价离子的转移系统把金属离子输送到细胞内, 与细胞内部某些分子结合而累积下来(郑玉建等, 2006).非活性微生物体吸附主要依赖细胞表面具有金属配位能力的基团, 如巯基、羧基、羟基等, 这些基团通过与吸附的金属离子形成离子键或共价键达到去除金属离子目的(董博等, 2013).
本文利用革兰氏阴性菌Rhizobium sp. W33与革兰氏阳性菌Bacillus sp. H3, 对比研究不同状态两株重金属抗性细菌对铅、镉吸附特性的差异, 通过红外光谱分析细菌表面主要吸附官能团以揭示细菌吸附重金属机制, 为水体重金属污染的微生物法治理提供材料和理论基础.
2 材料与方法(Materails and methods)2.1 材料、试剂与仪器2.1.1 试验菌种与培养基以本实验室保藏的具有铅镉抗性的根瘤菌Rhizobium sp. W33与芽孢杆菌Bacillus sp. H3为供试菌株.TY培养基:酵母粉3.0 g, 蛋白胨5.0 g, CaCl2 0.65 g, H2O 1 L, pH=7.0, 培养根瘤菌Rhizobium sp. W33用.LB培养基:酵母粉5.0 g, 蛋白胨10 g, NaCl 10 g, H2O 1 L, pH=7.0, 培养芽孢杆菌Bacillus sp. H3用.
2.1.2 主要试剂CdCl2·2.5H2O、Pb(NO3)2、NaOH、HCl、NaCl、CaCl2, 以上试剂均为分析纯
2.1.3 主要仪器ICP-OES(Optima 2100DV, Perkin Elmer, USA), 真空冷冻干燥机(Heto PowerDry LL3000, 上海汇分电子科技有限公司), Thermo Fisher傅立叶红外光谱仪(Nicolet iS5, USA)
2.2 方法2.2.1 菌悬液的制备选取实验室甘油管保藏的Rhizobium sp. W33与Bacillus sp. H3, 解冻后以体积比1%接菌量分别接入新鲜TY和LB培养基活化, 培养至对数期后再转接1次, 过夜培养后8000 r·min-1离心10 min, 沉淀经无菌去离子水洗涤两次后重悬起来, 保存菌悬液.
2.2.2 铅镉胁迫下细菌生长状况分别以Pb(NO3)2、CdCl2·2.5H2O配制浓度为5 g·L-1的Pb、Cd母液, 试验前准备摇瓶, 内装50 mL培养基灭菌备用, 设置Cd浓度梯度为1、5、10 mg·L-1, Pb浓度梯度为5、10、50 mg·L-1, 未添加重金属作为空白对照, 按1%接种量接入2.2.1节所述菌悬液, 160 r·min-1, 30 ℃, 48 h内每间隔3 h取样, 用分光光度计测定OD600值, 反映细菌生长状况.
2.2.3 不同pH条件下细菌生长状况及pH动态变化配制TY和LB液体培养基, 用1 mol·L-1 HCl(或NaOH)调整pH为5、6、7、8, 灭菌.按1%接种量接入2.2.1节所述菌悬液, 160 r·min-1, 30 ℃, 24 h内每间隔3 h取样, 测定OD600值和pH值, 监测不同pH条件下对菌株生长的影响及pH的动态变化.
2.2.4 不同状态细胞对Pb、Cd的吸附及其重金属分布将2.2.1节中菌悬液离心后, 沉淀经冷冻干燥作为干菌体;将沉淀细菌在121 ℃下高温灭菌25 min后冷冻干燥作为灭菌菌体.另取一部分等量菌液冷冻干燥后称重记录, 计算菌液浓度.在含重金属的液体培养基中接种菌悬液, 细胞在生长过程中伴随的吸附作为Growing吸附(Zhou et al., 2014);在含重金属的等体积无菌水中分别添加预先准备好的定量干菌体或定量灭菌菌体, 此吸附分别作Grown和Dead吸附(Huang et al., 2013).为了平行比较铅镉浓度对吸附的影响, 试验设置铅镉浓度梯度均为1、5、10 mg·L-1, 最终以吸附容量为指标探究菌株吸附能力.
参照Khan等(2016)方法稍作修改, 配制等量含不同重金属浓度的TY、LB培养基和无菌水, Growing状态下在TY、LB培养基中以体积比1%接种量分别接入2.2.1节所述Rhizobium sp. W33与Bacillus sp. H3菌悬液, 160 r·min-1, 30 ℃下培养至稳定期, 记录OD600值, 然后10000 r·min-1, 5 min离心收集上清液;Grown与Dead状态下在无菌水中分别添加与Growing状态下生长至稳定期时等量的干菌体和灭菌菌体, 200 min后离心收集细胞.不同状态细胞吸附后, 将溶液滤过0.45 μm滤膜, 然后用ICP-OES测定滤液中剩余重金属含量.菌体沉淀用无菌水清洗3次, 由于EDTA极强的络合能力, 用100 mmol·L-1 EDTA-PBS清洗后放至30 ℃, 160 r·min-1摇床内振荡30 min, 再次离心分别收集上清液和菌体, 上清液中金属离子含量即为胞外吸附量;利用Triton X-100对细胞膜的通透性, 将菌体重悬浮在5% HNO3和0.1% Triton X-100中, 95 ℃下水浴30 min, 待细胞裂解完全, 溶液变澄清后, 12000 r·min-1, 离心10 min;高温处理下, 在5% HNO3介质中, 胞内重金属离子已全部呈自由态的形式存在于溶液中, 此时上清液中的重金属含量即为重金属在细菌胞内的富集量;每个处理重复3次;测定前4 ℃保存(Khan et al., 2016).
 | (1) |
2.2.5 红外光谱实验重金属吸附前后的菌体进行真空冷冻干燥, 以1:99质量比与干燥KBr混合研磨均匀, 利用模具将混合好的粉末压成薄片, 红外光谱仪上进行检测, 记录数据.
3 结果与分析(Results and analysis)3.1 重金属胁迫下细菌生长曲线图 1所示为Cd浓度1、5、10 mg·L-1, Pb浓度5、10、50 mg·L-1及空白对照下, 菌株Rhizobium sp. W33与Bacillus sp. H3在48 h内的生长情况.Rhizobium sp. W33在镉浓度为1 mg·L-1时生长即受到抑制, 随着镉浓度的升高, 抑制效果更加明显;Bacillus sp. H3仅在镉浓度为10 mg·L-1受到明显抑制, 表现为延滞期延长, 对数生长期相应推迟, 都在20 h左右进入稳定期.铅离子浓度在5、10、50 mg·L-1时, 两株菌均表现出良好的抗性, 与对照组的生长速率相当, 在15 h左右即进入稳定期, 表明该两株菌对铅具有较强的耐受性.相比于铅, 镉的高毒性使得两株菌均生长缓慢.此外, 由图可知, Bacillus sp. H3比Rhizobium sp. W33生长速度快, 约提前5 h进入稳定期.
图 1(Fig. 1)
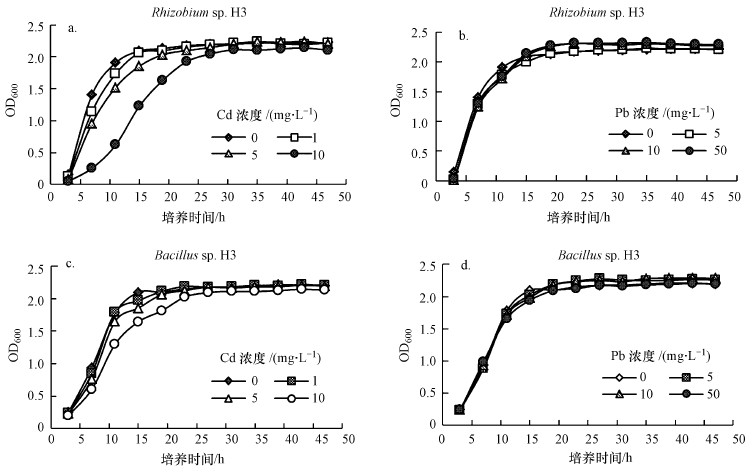 |
| 图 1 重金属镉、铅对菌株Rhizobium sp. W33(a、b)与Bacillus sp. H3(c、d)生长的影响 Fig. 1Effect of heavy metals (cadmium, lead) on the growth of Rhizobium sp. W33 (a, b) and Bacillus sp. H3 (c, d) |
3.2 不同pH条件下细菌生长状况如图 2所示, Rhizobium sp. W33与Bacillus sp. H3在pH为6~7范围内, 生长速度较快, 速率相当, 表明两株菌最适生长pH均在6~7范围内.偏酸(pH为5)条件对Rhizobium sp.W33的生长抑制比偏碱(pH为8)明显;Bacillus sp. H3在偏酸与偏碱条件下生长均受到明显抑制, 且偏碱性环境对菌株生长的抑制更强.此外, 由图 2还可以看出, 与Rhizobium sp. W33相比, Bacillus sp. H3无论在偏酸还是偏碱环境下延滞期较短, 对抗外界pH干扰的能力更强.
图 2(Fig. 2)
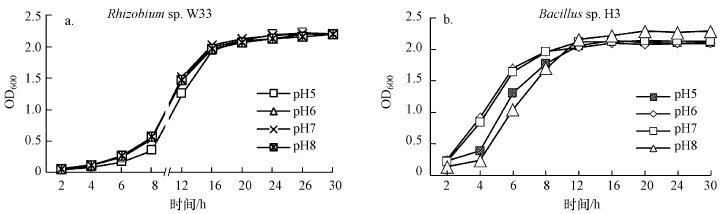 |
| 图 2 不同pH条件下Rhizobium sp. W33(a)与Bacillus sp. H3(b)生长曲线 Fig. 2The growth curves of Rhizobium sp. W33 (a) and Bacillus sp. H3 (b) under different pH conditions |
图 3所示为初始pH为5、6、7、8条件下, 培养过程中pH的动态变化, 由图可以看出, 酸性条件下两株菌的发酵液pH值逐渐升高达到8;碱性条件下的两株菌发酵液pH先略微下降, 然后逐步上升至8左右.有研究表明菌株可以调节培养基pH, 在pH>7的条件下菌株会分泌更多的胞外聚合物(Zhou et al., 2013), 这可能是发酵液偏碱性的原因.
图 3(Fig. 3)
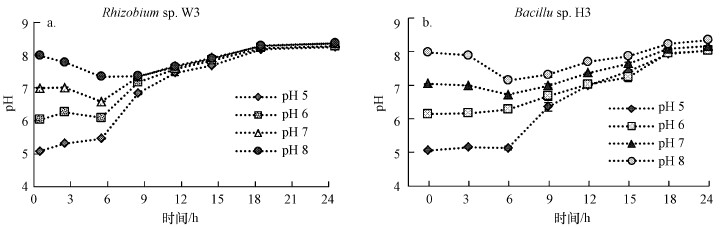 |
| 图 3 Rhizobium sp. W33(a)与Bacillus sp. H3(b)生长过程中pH的动态变化 Fig. 3Dynamic changes of pH during the growth of Rhizobium sp. W33 (a) and Bacillus sp. H3 (b) |
3.3 不同状态细胞对铅镉的吸附作用Growing状态为伴随细胞生长的吸附状态, Grown为活菌体吸附, Dead为死菌体吸附.图 4所示为Rhizobium sp. W33与Bacillus sp. H3不同状态细胞对铅镉的吸附能力.由图可知, 两株细菌对于重金属铅、镉的吸附能力差异较大, 革兰氏阴性菌Rhizobium sp. W33的吸附能力要优于革兰氏阳性菌Bacillus sp. H3.革兰氏阴性菌由于其本身固有的较高重金属抗性, 使其具有比革兰氏阳性菌更高的重金属生物积累能力(Noghabi et al., 2007).
图 4(Fig. 4)
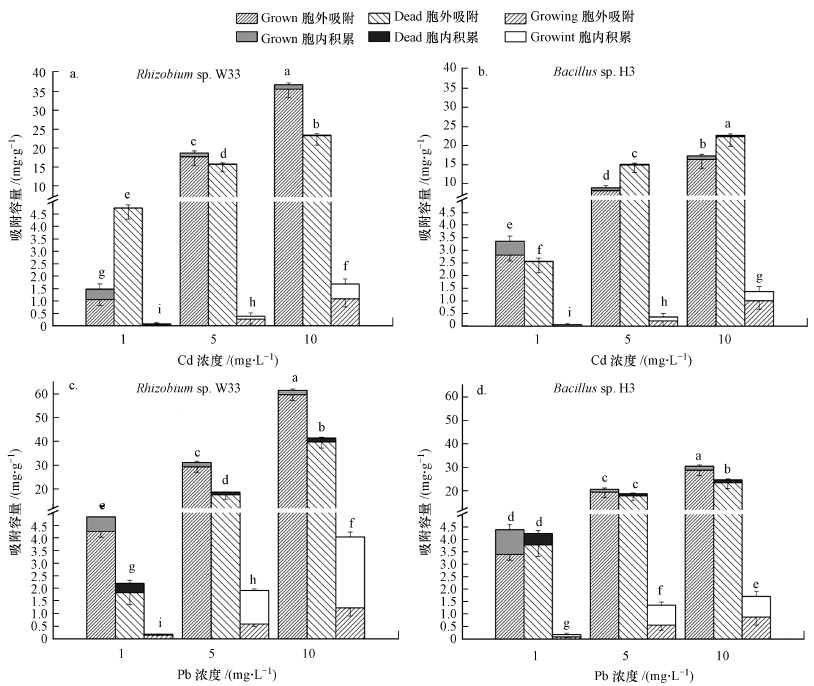 |
| 图 4 Grown、Dead和Growing状态下的Rhizobium sp. W33(a、c)与Bacillus sp. H3(b、d)对不同浓度镉铅的吸附能力、胞外吸附量和胞内积累量(误差线代表标准差) Fig. 4The Strains Rhizobium sp. W33 (a, c) and Bacillus sp. H3 (b, d) were used to determine the adsorption capacity of cadmium and lead at different concentrations in Grown, Dead and Growing states, as well as the comparison of extracellular adsorption capacity and intracellular accumulation volume (error line represents standard deviation) |
两株细菌均以Growing状态的吸附能力最弱.Grown状态的Rhizobium sp. W33吸附能力最强, 在设定浓度范围内对铅、镉的最大吸附容量分别达到62.4 mg·g-1和37.0 mg·g-1, 且随着重金属浓度的升高, Grown的吸附容量增加.Grown状态的Bacillus sp. H3对铅的吸附能力较强, 设定浓度范围内的最大吸附容量为30.8 mg·g-1, 而Dead状态对镉的吸附能力较强, 最大吸附容量为24.6 mg·g-1.Grown与Dead状态的Bacillus sp. H3的吸附容量低于Grown状态的Rhizobium sp. W33.
随着重金属浓度的升高, 菌株总吸附容量、胞外吸附容量都会随之升高.由于镉的高毒性, 胞内镉含量也伴随升高但不显著.Growing和Grown状态的Rhizobium sp. W33对铅、镉的吸附均以胞外吸附为主, 分别占总吸附容量的24.4%、95.5%、93.9%和58.7%、96.5%、91.0%;两种状态的Bacillus sp. H3对铅镉的胞外吸附量分别占总吸附容量的33.7%、93.4%、93.9%和13.2%、85.7%、90.9%.尽管Growing状态细胞吸附能力较低, 但当Pb为5和10 mg·L-1时, 细胞胞内铅积累占较大比重, 表明生长时细菌胞内可以积累铅.
3.4 FTIR分析FTIR确定吸附过程中表面官能团的变化有助于理解胞外吸附机制. FTIR中包含大量吸附峰, 表明菌体表面官能团的多样性以及复杂性, 部分吸附铅镉后的FTIR光谱图在峰形、峰位及特征峰相对强度上发生了变化, 可以预测参与Pb、Cd生物吸附的主要官能团.表 1与表 2为FTIR红外光谱显示的Grown、Dead和Growing状态的Rhizobium sp. W33和Bacillus sp. H3吸附铅镉前后的表面官能团变化.
表 1(Table 1)
| 表 1 Rhizobium sp. W33的FTIR红外光谱变化及其相应官能团 Table 1 FTIR infrared spectrum changes and corresponding functional groups of Rhizobium sp. W33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 Rhizobium sp. W33的FTIR红外光谱变化及其相应官能团 Table 1 FTIR infrared spectrum changes and corresponding functional groups of Rhizobium sp. W33
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2(Table 2)
| 表 2 Bacillus sp. H3的FTIR红外光谱变化及其相应官能团 Table 2 FTIR infrared spectrum changes and corresponding functional groups of Bacillus sp. H3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 Bacillus sp. H3的FTIR红外光谱变化及其相应官能团 Table 2 FTIR infrared spectrum changes and corresponding functional groups of Bacillus sp. H3
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
由表 1和表 2可知, Rhizobium sp. W33和Bacillus sp. H3的表面官能团上有明显不同, 也一定程度上体现了革兰氏阴性与阳性菌在细胞壁结构与理化性质方面的差异.由于在生长过程Growing状态细胞对于铅镉的吸附较少, 吸附前后FTIR光谱图上变化较小.Grown与Dead状态Rhizobium sp. W33均有大量官能团参与铅镉的吸附.其中Grown细胞吸附前后主要在3305、3400 cm-1发生偏移, 分别代表羟基(—OH)、胺基(—NH), 658 cm-1处代表蛋白质酰胺Ⅰ(CO)和Ⅱ(C—N)带也发生了一定程度的伸缩振动.Dead状态时除上述峰位发生变化外, 1243、1063 cm-1处也发生了变化, 对应磷酸二酯基团PO2-的不对称和对称伸缩带, 表明在死菌吸附过程中, 磷酸基团参与了对铅镉的吸附, 而且磷酸基团只在死菌中参与对铅镉的吸附, 具有一定的特异性.Grown状态Bacillus sp. H3在3550、3474、2926、1553、1086 cm-1处均发生了一定程度的偏移, 分别代表了糖类C—OH的OH伸缩, 烷基CH2反对称伸缩, 酰胺基团的N—H和C—N, 以及多糖的C—O—C和C—O基团, 它们可能参与金属离子铅镉吸附过程(Chakravarty et al., 2010);Dead状态Bacillus sp. H3在3234、620、475 cm-1处发生一定偏移, 它们分别是氨基与羟基的重叠带, 以及磷酸基团的吸收带.
4 讨论(Discussion)4.1 Rhizobium sp. W33与Bacillus sp. H3对铅、镉吸附的差异微生物吸附重金属是一个复杂的过程, 参与的主要成分和影响因素多样.细菌细胞壁成分多样, 肽聚糖、脂多糖、磷壁酸等物质都属于聚合电解质, 聚合电解质携带的带电基团对于不同金属有不同的亲和力和特异性.革兰氏阴性菌Rhizobium sp. W33的吸附能力要优于革兰氏阳性菌Bacillus sp. H3.Rhizobium sp. W33作为革兰氏阴性菌, 含有由脂类和多糖紧密相连而形成的脂多糖, 带有较强的负电荷(黄飞, 2013), 可以通过静电吸附作用更好的吸附重金属离子;相比之下, 革兰氏阳性菌Bacillus sp. H3细胞壁较厚, 结构简单, 还缺少外膜成分, 在一定程度上降低了革兰氏阳性菌的吸附能力.本研究中Rhizobium sp. W33对镉的抗性不如Bacillus sp. H3, 但对镉的吸附能力明显优于Bacillus sp. H3, 表明菌株对重金属抗性与生物吸附能力之间没有必然联系.有研究认为细菌的重金属抗性机制与新陈代谢活动有关, 可归纳为:渗透性屏障排斥、细菌胞外吸附与胞内积累、外排泵的主动运输、酶的解毒及降低细胞对目标金属离子的敏感性(Bruins et al., 2000).因此, 生物吸附可能参与到金属的抗性机制中, 但可能不是主要的因素(Li et al., 2017).
Huang等的研究表明, 在不同镉浓度下芽孢杆菌对镉的吸附均以胞外吸附为主, 胞内吸附量仅占总吸附量的20%左右(Huang et al., 2013);Pabst发现菌株吸附的镉中有90%的镉分布在细胞表面, 周质空间及细胞质中镉含量不足10%, 在镉胁迫下菌株会通过限制细胞表面镉向胞内运输来进行自我保护(Pabst et al., 2010).Sharma等通过透射电镜分析罗威登斯菌对于铅的吸附, 发现生物表面的吸附微不足道, 主要集中在外围边缘, 周质空间内(Sharma et al., 2017).本研究结果表明根瘤菌与巨大芽孢杆菌对于铅、镉的吸附, 均以胞外吸附为主, 但不同状态细胞胞内铅镉的积累量有显著差异, 因此, 还需进一步探究比较铅镉在细胞表面和胞内的分布规律, 以便进一步阐明细菌对重金属吸附的机制.
4.2 Growing、Grown与Dead状态的细胞吸附能力****在研究Growing、Grown与Dead状态的细胞吸附能力时结果不同.Zhou等研究Growing与Grown状态下细菌对镉的吸附, 结果表明低浓度条件下由于Growing的胞间作用使其对镉的吸附效果更好, 而随着浓度的升高, Growing状态生物量的积累受到抑制, 高浓度的镉对Grown细胞的影响与Growing相比不显著, 因此处于非活跃状态的Grown细胞吸附能力更好(Zhou et al., 2014).Mehtap等探究Growing、Grown、Dead对镍与铜的吸附, 结果均以Growing状态去除效率最高(Mehtap et al., 2012).本研究中两株细菌Growing状态对铅镉的吸附能力均很低, 可能与重金属抑制Growing状态生物量的积累有关.另一方面菌株生长伴随着复杂的生理生化变化, 包括依赖新陈代谢的形态学变化、主动运输、外排机制等, 还有一些胞外聚合物的产生、生物膜的形成, 这些因素都会减少细胞对重金属离子的吸收, 降低重金属毒害.另外, 有研究表明菌株吸附的动态过程中, Growing状态下伴随着生长与吸附同时进行, 而且还会存在吸附于菌体表面的金属离子再脱落的情况;Grown与Dead状态对铅、镉的最初吸附阶段为快速的表面吸附, Grown状态会进行缓慢的胞内积累过程, 直至达到吸附平衡.Dead状态由于不存在胞内积累, 因此吸附速率更加迅速, 达到吸附平衡时间更短(Huang et al., 2013).
有研究表明吸附过程中以活细胞为主的Grown吸附有胞内积累参与其中, 非活性的Dead状态无法依赖新陈代谢进行胞内重金属积累过程, 吸附能力仅与吸附位点数量有关, 只能进行胞外吸附(李洪强等, 2006).Bai等的研究结果表明芽孢杆菌在Grown状态时可以胞内积累38.5%的铅(Bai et al., 2014).本研究中两株细菌Grown与Dead细胞均以胞外吸附为主, 但Growing状态细胞吸附容量虽然较低, 胞内铅积累较高, 镉积累不高.因此, 细菌如何伴随生长进行胞内铅和镉的差异积累的机制还有待进一步研究.
4.3 Growing、Grown与Dead状态的表面官能团差异有研究用FTIR分析蜡状芽孢杆菌活菌与死菌吸附镉的前后光谱变化, 发现死菌参与重金属吸附的官能团变化更多, 伸缩更活跃(Huang et al., 2013).与活细胞相比, 死细胞表面有更多负电荷存在, 且高温条件下也会使死菌暴露更多的潜在吸附位点, 吸附过程中有比活菌更多的功能基团参与到生物吸附中.但死菌经高温处理后菌体表面的理化性质与结构会发生改变, 此外高浓度的镉会严重破坏活细胞表面状态, 导致细胞部分结合能力缺失(黄飞, 2013).本研究中Dead状态的Rhizobium sp. W33吸附时表面官能团比较活跃, 而Grown状态Bacillus sp. H3吸附时官能团表现活跃.生长过程中的细胞(Growing)由于防御体系的存在导致重金属去除率偏低, 菌体表面参与重金属吸附的基团较少, 因此FTIR光谱图中特征峰相对强度变化较小.
5 结论(Conclusions)1) 革兰氏阴性菌Rhizobium sp. W33吸附能力高于革兰氏阳性菌Bacillus sp. H3, 不同状态细胞对铅镉吸附容量表现为Grown>Dead>Growing.
2) Grown和Dead状态的两株细菌以胞外吸附为主的方式进行铅、镉的吸附, Growing细胞对铅有较好的胞内积累能力.
3) Grown状态细胞表面主要是—OH、—NH、—CN、—CO、—CH2官能团在生物吸附过程中发挥作用;Dead细胞吸附过程中还有磷酸基团参与对铅镉的吸附.
参考文献
| Bai J, Yang X H, Du R Y, et al. 2014. Biosorption mechanisms involved in immobilization of soil Pb by Bacillus subtilis DBM in a multi-metal-contaminated soil[J]. Journal of Environmental Sciences(Elsevier), 26(10): 2056–2064.DOI:10.1016/j.jes.2014.07.015 |
| Bruins M R, Kapil S, Oehme F W. 2000. Microbial resistance to metals in the environment[J]. Ecotoxicology and Environmental Safety, 45(3): 198–207.DOI:10.1006/eesa.1999.1860 |
| Chakravarty S, Mohanty A, Sudha T N, et al. 2010. Removal of Pb (Ⅱ) ions from aqueous solution by adsorption using bael leaves(Aegle marmelos)[J]. Journal of Hazardous Materials, 173(1/3): 502–509. |
| Cui Z J, Zhang, Yang H H, et al. 2017. Bioremediation of heavy metal pollution utilizing composite microbial agent of Mucor circinelloides, Actinomucor sp.and Mortierella sp.[J]. Journal of Environmental Chemical Engineering, 5(4): 3616–3621.DOI:10.1016/j.jece.2017.07.021 |
| 董博, 袁国强, 欧杰, 等. 2013. 微生物对实验室废水中重金属吸附作用的辅助因子[J]. 广东农业科学, 2013, 40(20): 182–184.DOI:10.3969/j.issn.1004-874X.2013.20.053 |
| 黄飞. 2013. 蜡状芽孢杆菌对水体中镉的吸附特性与机理研究[D]. 广州: 华南理工大学. 1-134http://cdmd.cnki.com.cn/Article/CDMD-10561-1014153379.htm |
| Huang F, Dang Z, Guo C L, et al. 2013. Biosorption of Cd(Ⅱ)by live and dead cells of Bacillus cereus RC-1 isolated from cadmium-contaminated soil[J]. Colloids and Surfaces B:Biointerfaces, 107: 11–18.DOI:10.1016/j.colsurfb.2013.01.062 |
| Huang W, Liu Z M. 2013. Biosorption of Cd(Ⅱ)/Pb(Ⅱ)from aqueous solution by biosurfactant-producing bacteria:isotherm kinetic characteristic and mechanism studies[J]. Colloids and Surfaces B:Biointerfaces, 105: 113–119.DOI:10.1016/j.colsurfb.2012.12.040 |
| Khan Z, Rehman A, Hussain S, et al. 2016. Cadmium resistance and uptake by bacterium, Salmonella enterica 43C, isolated from industrial effluent[J]. AMB Express, 6(1): 1–16.DOI:10.1186/s13568-015-0169-5 |
| Li D, Xu X, Yu H, et al. 2017. Characterization of Pb2+ biosorption by psychrotrophic strain Pseudomonas sp.I3 isolated from permafrost soil of Mohe wetland in Northeast China[J]. Journal of Environmental Management, 196: 8–15. |
| 李洪强, 刘成伦, 徐龙君. 2006. 微生物吸附剂及其在重金属废水处理中的应用[J]. 材料保护, 2006, 39(11): 48–52.DOI:10.3969/j.issn.1001-1560.2006.11.014 |
| Mehtap E, ünsal A. 2012. Comparison of heavy metal uptake capacities of growing, resting and dead cells of R.delemar via acid phosphatase activity[J]. New Biotechnology, 29: S195. |
| Noghabi K A, Zahiri H S, Yoon S C. 2007. The production of a cold-induced extracellular biopolymer by Pseudomonas fluorescens BM07 under various growth conditions and its role in heavy metals absorption[J]. Process Biochemistry, 42(5): 847–855.DOI:10.1016/j.procbio.2007.02.004 |
| Pabst M W, Miller C D, Dimkpa C O, et al. 2010. Defining the extracellular adsorption and internalization of copper and cadmium in a soil bacterium, Pseudomonas putida[J]. Chemosphere, 81(7): 904–910.DOI:10.1016/j.chemosphere.2010.07.069 |
| Rajaganapathy V, Xavier F, Sreekumar D, et al. 2011. Heavy metal contamination in soil, water and fodder and their presence in livestock and products[J]. Journal of Environmental Science and Technology, 4(3): 234–249.DOI:10.3923/jest.2011.234.249 |
| Sharma J, Shamima K, Dubey S K, et al. 2017. Metallothionein assisted periplasmic lead sequestration as lead sulfite by Providencia vermicola strain SJ2A[J]. Science of the Total Environment, 579: 359–365.DOI:10.1016/j.scitotenv.2016.11.089 |
| Vijayaraghavan K, Yun Y S. 2008. Bacterial biosorbents and biosorption[J]. Biotechnology Advances, 26(3): 266–291.DOI:10.1016/j.biotechadv.2008.02.002 |
| 张玉刚, 龙新宪, 陈雪梅. 2008. 微生物处理重金属废水的研究进展[J]. 环境科学与技术, 2008, 31(6): 58–63.DOI:10.3969/j.issn.1003-6504.2008.06.016 |
| 郑玉建, 张杰, 依不拉音. 2006. 微生物在水体重金属污染治理中的应用[J]. 国外(医学医学地理分册), 2006, 27(1): 39–42. |
| Zhou W Z, Liu D S, Zhang H O, et al. 2014. Bioremoval and recovery of Cd(Ⅱ)by Pseudoalteromonas sp.SCSE709-6:Comparative study on growing and grown cells[J]. Bioresource Technology, 165: 145–151.DOI:10.1016/j.biortech.2014.01.119 |
| Zhou W Z, Zhang H O, Ma Y H, et al. 2013. Bio-removal of cadmium by growing deep-sea bacterium Pseudoalteromonas sp.SCSE709-6[J]. Extremophiles, 17(5): 723–731.DOI:10.1007/s00792-013-0554-4 |
