 , 秦纪洪2, 孙辉1
, 秦纪洪2, 孙辉1

1. 四川大学环境科学与工程系, 四川省土壤环境保护工程技术中心, 成都 610065;
2. 成都大学环境工程系, 成都 610106
收稿日期: 2017-01-25; 修回日期: 2018-03-14; 录用日期: 2018-03-15
基金项目: 国家自然科学基金(No.41271094)
作者简介: 刘堰杨(1995—), 女, E-mail: vivianalau@qq.com
通讯作者(责任作者): 孙辉, E-mail: sunhuifiles@gmail.com
摘要: 溶解性有机质(DOM)对全球碳循环及气候变化具有重要意义.本文选取川西北4条高海拔河流,即杂谷脑河、抚边河及岷江(高山峡谷河流)与白河(高原河流),对其天然水体中有色溶解性有机质(CDOM)的紫外-可见光吸收光谱特征进行了研究与比较.结果表明,川西高海拔河流DOC变化范围为1.55~5.66 mg·L-1,CDOM(以a(355)表征)变化范围为0.96~6.31 m-1,荧光溶解性有机质(FDOM)(以lgFn(355)表征)变化保持在2.08~2.83之间.与高山峡谷区河流比较,高原河流芳香性、疏水性特征常数SUVA254、SUVA260较高,吸光度之比E2/E3、光谱斜率S275~295及光谱斜率之比SR较低,揭示了高原河流CDOM芳香性较强、疏水性组分丰富、分子结构较为复杂;SUVA254、SUVA260分别与SR、S275~295呈显著负相关,表明白河由于高通量陆源腐殖质输入影响了CDOM特征.川西高原4条高海拔河流中SUVA254、SUVA260存在显著相关关系,表明芳香性结构普遍存在于河流CDOM疏水组分中.川西高原天然河流水体中CDOM与DOM的浓度之间总体上无直接关联,因为不同天然水体在DOM形成过程中,陆源DOC输入组分和强度及转化机制存在差异.研究结果对于揭示高海拔区域在全球变化背景下有机碳循环的区域效应等方面具有重要意义.
关键词:溶解性有机质紫外-可见光吸收光谱天然水体川西高原河流
UV-VIS spectral characteristics of dissolved organic matter (DOM) of the natural alpine rivers in the western Sichuan Province
LIU Yanyang1
 , QIN Jihong2, SUN Hui1
, QIN Jihong2, SUN Hui1

1. Department of Environmental Science and Engineering, Sichuan University, Sichuan Research Center for Soil Environment Protection Engineering and Technology, Chengdu 610065;
2. Department of Environmental Engineering, Chengdu University, Chengdu 610106
Received 25 January 2017; received in revised from 14 March 2018; accepted 15 March 2018
Supported by the National Natural Science Foundation of China (No.41271094)
Biography: LIU Yanyang(1995—), female, E-mail: vivianalau@qq.com
*Corresponding author: SUN Hui, E-mail: sunhuifiles@gmail.com
Abstract: Dissolved organic matter (DOM) is an optically ubiquitous active substance which is playing an indispensable role in global biogeochemical cycling of carbon and significantly affects the fate and transport of organic pollutants. DOM sampling from four rivers, including the upper reaches of Minjiang River, Zagunao River, Fubian River in the alpine-gorge region and Bai River in the Zoige wetland region, was investigated in the western Sichuan plateau using UV-Vis and EEM fluorescence spectroscopy. The concentration of DOC, CDOM and FDOM, ranges from 1.55 to 5.66 mg·L-1, 0.96 to 6.31 m-1 and 2.08 to 2.83 in the four high elevation rivers, respectively. Compared with the three rivers in the alpine-gorge region, the river in the Zoige wetland region shows relatively high aromaticity (SUVA254) and hydrophobicity (SUVA260), as well as high molecular weight (E2/E3、S275~295 and SR). Bai River is rich in terrestrial-type DOM as evidenced by a strong correlation relationship between SUVA254/SUVA260 with SR/S275~295. Statistical analysis showed that SUVA254 and SUVA260 were significantly positively correlated in the four rivers, indicating the hydrophobic CDOM may possess aromatic structure. Additionally, significant correlation was not observed between DOC and CDOM in natural rivers, this is possibly due to the variations in the inputs of allochthonous DOM concentration in water. This study may provide the information on the characteristics of DOM in alpine natural waters, which is essential in realizing the cycling of carbon from terrestrial ecosystems into alpine natural waters in the face of a variable and changing climate.
Keywords: dissolved organic matterUV-Vis spectrumnatural watershedsalpine rivers in the western Sichuan
1 引言(Introduction)溶解性有机质(DOM)是土壤和水体中有机质降解、转化和矿化等过程形成的溶解性有机物质, 是生态系统中微生物主要的碳源和能源(Keil et al., 1991).DOM因广泛参与生物地球化学及生态过程且具有比长效有机质更高的生物活性, 所以其迁移、转化和动态对于从流域到全球尺度上的有机碳动态和碳循环都具有重要意义(Battin et al., 2009;Findlay et al., 2002;Anesio et al., 2004).有色溶解性有机质(CDOM)是具有独特光学性质的DOM, 其中, 荧光溶解性有机物(FDOM)是CDOM中吸收紫外-可见光后发出荧光的部分, 其特征为认识DOM结构和特征提供了重要依据.目前, 分析DOM主要通过紫外-可见光吸收光谱和三维荧光光谱.三维荧光光谱法是一种利用CDOM荧光特性来解析有机质的源汇、结构组成及转化降解特征的方法, 操作简单且灵敏度高, 并具有强大的信息解析量, 近年来越来越成为研究水体有机污染物的有效手段;紫外-可见光吸收光谱是利用价电子和分子轨道上的电子在能级间的跃迁来定性和定量某一物质, 因具有很高的灵敏度(Judd et al., 2006), 逐渐成为研究有机质最快捷简便和直观的技术手段之一.
川西高海拔地区介于青藏高原腹地与四川盆地之间的过渡地带, 主要地形为高寒湿地草甸和高山峡谷, 是我国主要江河源头集水区和重要水源补给区, 由于高寒气候导致湿地、草甸和草原的大量有机碳储存在土壤中, 也是我国低温有机碳库的主要分布区.在全球气候变化背景下, 川西高海拔地区因为气候和环境变化而导致积雪减少和季节性冻融格局改变, 湿地和草地干旱化和退化乃至沙化趋势日益严重, 由于该区域陆地和水体之间的有机碳联系紧密, 研究该区域自然水体中DOM特征, 对揭示该区域的土壤碳输出和全球变化的区域效应特征等方面都有重要的理论价值, 也可为该地区水资源管理与河流水质变化预测等提供科学依据.本文旨在通过分析川西高海拔区域的4条典型自然河流水体中DOM紫外-可见吸收光谱和紫外特征参数, 了解不同河流中DOM特征与规律.
2 材料与方法(Materials and methods)2.1 研究区域概况本研究选取川西北高海拔地区4条具有代表性的自然河流, 即杂谷脑河、抚边河、岷江(上游)和白河.其中, 杂谷脑河、抚边河与岷江(上游)属于长江水系且主要流经川西高山峡谷区, 水量丰富流速快, 河道多险滩、急流且底泥物质少或无, 植被分布呈垂直带状分布;白河是黄河在四川境内的重要支流, 发源于红原县分水岭, 在高寒高原和湿地中向北流经红原和若尔盖西部后注入黄河.
岷江(上游)是长江上游的一级支流, 也是长江上游水量最大的一条支流, 本次研究采样溯至岷江正源(松潘县岷江源), 研究茂县以上的岷江上游江段.杂谷脑河是岷江的主要支流, 发源于理县鹧鸪山的南麓, 在茂县注入岷江干流.抚边河源自小金县北部, 是大渡河二级支流, 在小金县注入小金川后在丹巴附近汇入大渡河干流.白河主要流经的若尔盖丘状高原区, 沿途因地形平缓而致河道蜿蜒曲折, 若尔盖丘状高原区由海拔高差小的低平谷地及淹水和季节性淹水的沼泽湿地组成;泥炭土深厚且广布, 草甸土发育且草毡层厚, 富含有机质的土壤广布, 因海拔极高、降水较为充沛、气温低而冻融侵蚀作用十分显著, 冻胀丘等微地形广布;植被多为高寒草甸及高寒灌丛草甸.
2.2 样品采集与处理本研究于2016年10月沿杂谷脑河、抚边河、白河、岷江沿程共设28个点采样, 其中, 杂谷脑河、抚边河、白河及岷江分别设置7、5、7及9个点(图 1).本研究采用特氟龙采样瓶收集水样, 采样瓶使用前先用肥皂水清洗一遍再用超纯水清洗6遍, 置于烘箱60 ℃烘干待用(Wurl et al., 2009).采样前用待测水样润洗采样瓶3次, 每个点采3个重复样.将采样瓶放置于4 ℃保温箱内避光保存, 在采样完毕后, 立即将水样运回实验室分析.分析前先将水样平衡至室温(25 ℃), 用0.45 μm针孔滤膜(PVDF, Millipore, USA)过滤.对于底泥、砂石较多的水样先采用快速滤纸初步过滤后再用针孔滤膜过滤.
图 1(Fig. 1)
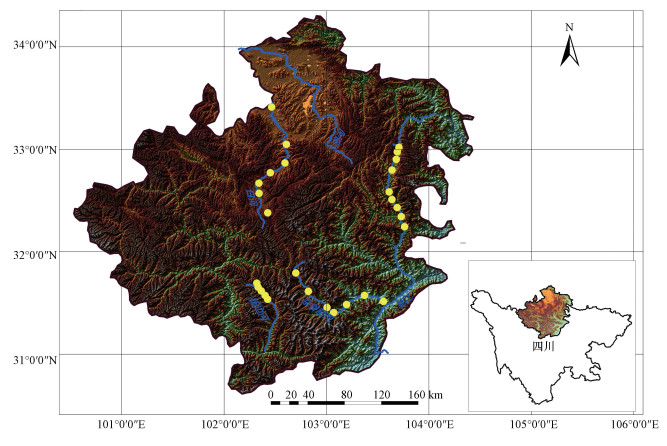 |
| 图 1 川西高海拔河流水样采样点分布 Fig. 1Locations for surface water sampling of four high elevation rivers in the western Sichuan |
2.3 样品分析所有水样DOM三维荧光光谱及紫外-可见光谱采用Horiba公司的Aqualog荧光光谱仪进行测定.紫外-可见吸收光谱测定范围为240~550 nm, 扫描间隔3 nm.三维荧光采用150 W氙灯为激发光源, PMT电压设为700 V, 配以1 cm石英比色皿;扫描波长范围为:激发波长(λEx)240~550 nm, 发射波长(λEm)214~619 nm;扫描光谱进行仪器自动校正;间隔和狭缝宽度分别为3.0 nm和2.5 nm.采用Millipore超纯水作空白, 系统自动处理去除拉曼及瑞利散射.荧光强度以单位R.U.(Roman Unit)标注.
所有水样中溶解性有机碳(DOC)浓度采用总有机碳/总氮分析仪(Milti N/C 2100S, 德国Jena)测定, 采用Millipore超纯水作空白.
2.4 数据处理2.4.1 三维荧光特征参数Fn(355):为λEx =355 nm、λEm =450 nm时对应的荧光强度, 用于表征FDOM浓度(高洁等, 2015).为便于与其他指标比较, 本文将Fn(355)取对数(以10为底)后进行分析.
2.4.2 紫外-可见光特征参数a(355):用于表示CDOM相对浓度, 吸收系数a的计算公式为:
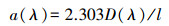 | (1) |
SUVA254:为254 nm处UV的吸收系数与DOC浓度之比, 用于表征DOM的芳香性.SUVA254越高, 说明有机质的芳香性程度越高, 腐殖程度也越高(Chin et al., 1994;Weishaar et al., 2003).
SUVA260:为260 nm处UV的吸收系数与DOC浓度之比, SUVA260与DOM中疏水性有机组分含量成正比(Jaffrain et al., 2007).
S275~295:为DOM为275~295 nm波段的吸收光谱斜率, 计算公式为:
 | (2) |
光谱斜率比值SR:
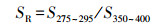 | (3) |
吸光度之比E2/E3:为250 nm和365 nm处吸光度之比, 用于表征DOM分子量大小.由于大分子(HMW)的CDOM在长波长的强光吸收, 随着分子大小的增大, E2/E3减小(Peuravouri et al., 1997;He et al., 2008).
2.4.3 数据处理数据统计分析主要利用SPSS 17.0软件包进行单因素方差分析与相关性分析, 采样点分布图采用ArcMap 10.2完成.
3 结果与分析(Results and analysis)3.1 高海拔河流水体CDOM的紫外-可见吸收光谱曲线特征4条河流CDOM在紫外-可见光波段的吸光度随波长增加而逐渐降低(图 2), 并且河流的吸收曲线中均无明显吸收峰出现, 这与很多自然水体的溶解性有机质的吸收曲线较为相似.高山峡谷区3条河流CDOM的吸光度较低, 在260~280 nm处有微弱的吸收峰出现, 可能是由CDOM发色团中的双键结构引起的(Pretsch et al., 2009).高原河流白河吸收光谱向长波方向移动(红移)且吸光度较高山峡谷河流高, 可能说明其腐殖化程度较高, CDOM共轭结构较多, 因此, 吸光能力较强(高洁等, 2015).
图 2(Fig. 2)
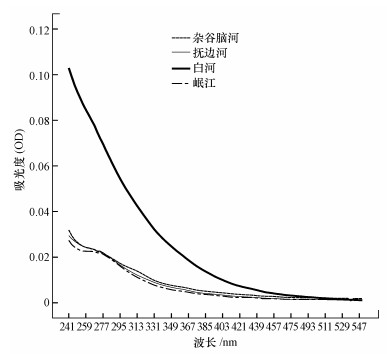 |
| 图 2 川西4条高海拔河流CDOM的紫外-可见吸收光谱 Fig. 2UV-Vis absorption spectra of CDOM in four high-elevation rivers in the western Sichuan |
3.2 高海拔河流水体DOM的紫外特征参数分析对川西高原4条河流的紫外特征参数(SUVA254、SUVA260、S275~295、SR、E2/E3)进行单因素方差分析(one-way ANOVA), 各特征参数的均值描述见图 3.
图 3(Fig. 3)
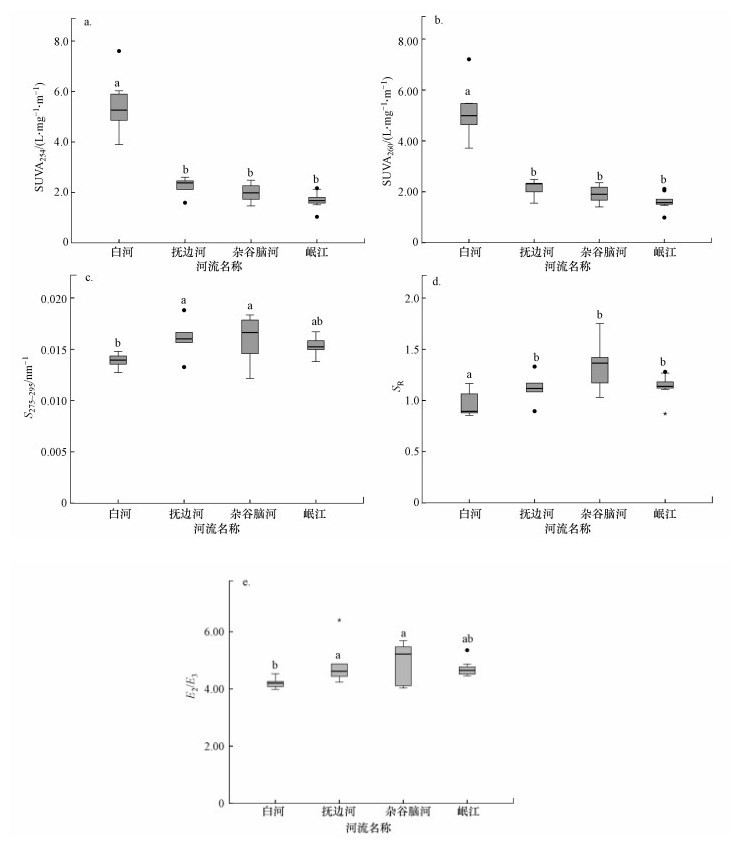 |
| 图 3 川西4条高海拔河流CDOM紫外-可见光参数特征(a.SUVA254, b.SUVA260, c.S275~295, d.SR, e.E2/E3; 各子图中不同字母表示差异性显著(p < 0.05)) Fig. 3Characteristics of UV-Vis spectroscopy-based CDOM parametersof CDOM in four high-elevation rivers in the western Sichuan(a.SUVA254, b.SUVA260, c.S275~295, d.SR, e.E2/E3) |
白河SUVA254值大于高山峡谷区河流, 说明其芳香性程度及腐殖化程度较高, 可能是白河流经草本泥炭沼泽接受了较多陆源腐殖质所致.与SUVA254类似, 白河SUVA260值大于其他3条河流, 表明其CDOM疏水性有机组分含量高.另外, 陆源腐殖质的高强度输入使白河CDOM急剧增加, 导致了SUVA254、SUVA260较大幅度的波动.
杂谷脑河S275~295与E2/E3的中位数均大于其他3条河流, 白河S275~295与E2/E3的中位数最低.一般来说, DOM主要通过光降解和生物作用进行转化降解, 杂谷脑河中微生物代谢效率相对较高, 自生源贡献较多, 因此, DOM小分子相对较多.而白河水体内含有丰富的大分子腐殖质, 可能是因为丘状高原海拔较高(3000 m以上), 水体内微生物代谢活动受到限制, 白河CDOM主要通过光降解将大分子DOM转化为能供微生物利用的小分子DOM.另外, 陆源腐殖质的大量输入也使白河中大分子CDOM增加.
SR值能表征DOM来源组成, 白河SR低于高山峡谷区的3条河流, 印证了白河与其他3条河流的CDOM在来源和结构组成上存在差异.
3.3 高海拔河流水体DOM、CDOM、FDOM的关系DOM、CDOM、FDOM三者性质各异又相互联系, 对川西高原4条河流的DOM、CDOM、FDOM进行单因素方差分析(one-way ANOVA)有助于进一步揭示高海拔河流水体间DOM特征的差异(图 4).
图 4(Fig. 4)
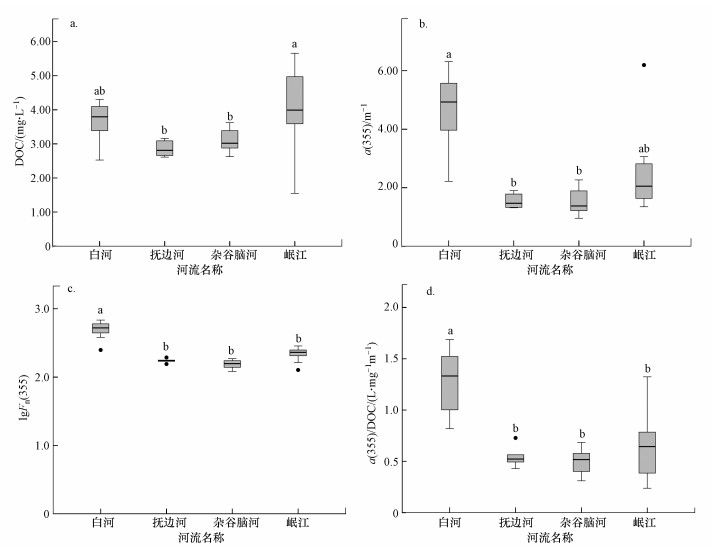 |
| 图 4 川西4条高海拔河流水体中DOC (a)、CDOM (a(355))(b)、FDOM (lgFn(355))(c)及CDOM/DOM (a(355)/DOC)(d)变化 Fig. 4Changes in DOC(a), CDOM(a(355))(b), FDOM(lgFn(355))(c) and CDOM/DOM(a(355)/DOC)(d) in four high-elevation rivers in the western Sichuan |
本研究中4条河流的DOC变化范围为1.55~5.66 mg·L-1(图 4a).据已有报道, 天然水体中总有机碳浓度范围为1~40 mg·L-1, 通常海水中平均为0.5 mg·L-1, 而江河中可达7 mg·L-1, 湿地和沼泽水体中可高达25 mg·L-1, 因此, 川西高海拔河流DOC处于自然河流水体正常范围.相较于其他3条河流, 岷江DOC均值较高且波动范围较大, 可能是由于岷江范围较长, 上下游之间沿岸土地利用方式存在差异.
川西高原河流CDOM(以a(355)表征)变化范围为0.96~6.31 m-1, 其中, 丘状高原河流变化范围为2.22~6.31 m-1, 高山峡谷区河流变化范围为0.96~6.19 m-1(图 4b).白河CDOM强度高于高山峡谷区河流且变化范围较大, 或许是由于大量陆源腐殖质输入导致水体生色组分的贡献率急剧增加.川西高原河流FDOM(以lgFn(355)表征)变化范围为2.08~2.83, 其中, 丘状高原河流变化范围为2.40~2.83, 高山峡谷区河流变化范围为2.08~2.46(图 4c).类似地, 白河FDOM均值较高, 并与高山峡谷区河流差异明显.整体来说, 这4条河流lgFn(355)值沿程变化程度较小, 说明FDOM含量保持相对稳定水平, 这与文献中(陈雪霜等, 2016)报道的现象一致.
为进一步分析CDOM与DOC关系, 本文以a(355)与DOC的比值表征CDOM/DOM以分析其关系, 即CDOM在DOM中的相对比例.白河与其他3条高山峡谷区河流差异显著(图 4d), 说明高山峡谷区的河流中非生色组分对DOC的贡献率不容忽视而白河恰好相反.
4 讨论(Discussion)4.1 高海拔河流DOM特征参数间关系不同河流水体中CDOM特征因其来源、转化、降解、环境条件和水文条件等而存在差异(表 1).白河由于流经高寒湿地接受陆源腐殖质输入导致其芳香性(SUVA254)高; 天才湖是人为影响较小的高原湖泊, 丰富的森林凋落物等向水体大量输入使水体中DOC较高(Du et al., 2016);长寿湖作为水库性湖泊受人为干扰大且集水区土地利用类型复杂, 因此, DOC、a(355)变化大(江韬等, 2016);珠江流域受人为排放源的影响DOC含量较高(Huang et al., 2016).类似地, 长江中下游因为人为源输入(甘淑钗等, 2013)导致DOC值远高于其上游支流杂谷脑河、抚边河、岷江.本研究中, 川西高原4条河流DOC含量均较低, 高山峡谷的杂谷脑河、抚边河、岷江DOC范围在1.55~5.66 mg·L-1, 高原河流白河DOC范围在2.53~4.31 mg·L-1, 因为这些区域属于长江、黄河上游源区, 植被良好、自然源DOC输入较少, 而且人为源对水体DOC贡献有限.因此, 与已经报道的其他地表水体DOC含量相比, 川西北高海拔河流的DOC总体上仍处于较低水平.
表 1(Table 1)
| 表 1 川西高原河流与其他报道的水体中DOM及相关参数比较 Table 1 Comparison of DOM and its related parameters in different surface waters with four alpine rivers in the western Sichuan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 川西高原河流与其他报道的水体中DOM及相关参数比较 Table 1 Comparison of DOM and its related parameters in different surface waters with four alpine rivers in the western Sichuan
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4条高海拔河流紫外特征参数(SUVA254、SUVA260、S275~295与SR、E2/E3)的相关性揭示了它们之间的内在关系(表 2).4条河流中, SUVA254、SUVA260均显著相关, 这表明CDOM的芳香性与疏水性关系密切, CDOM中芳香性结构可能存在于疏水组分中.此外, 4条河流中S275~295与E2/E3均呈现显著相关, 这说明川西高原4条高海拔河流中CDOM均能通过光降解将复杂的大分子有机质分解(图 5).
表 2(Table 2)
| 表 2 紫外特征参数相关性分析 Table 2 Correlations among the UV-Vis spectroscopy-based CDOM parameters | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 紫外特征参数相关性分析 Table 2 Correlations among the UV-Vis spectroscopy-based CDOM parameters
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
图 5(Fig. 5)
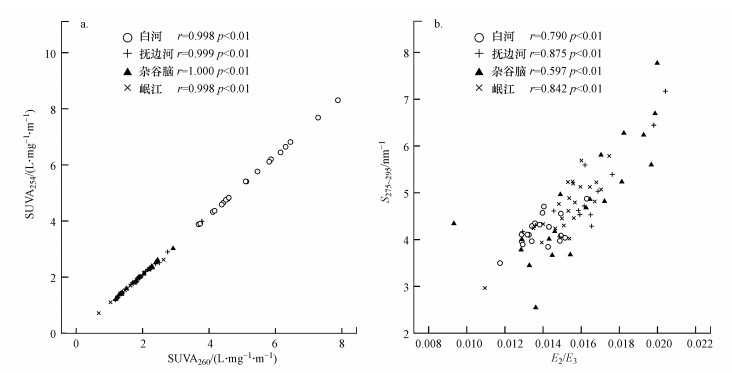 |
| 图 5 川西4条高海拔河流水体中SUVA254、SUVA260 (a)及S275~295、E2/E3 (b)的相关性分析 Fig. 5Correlation analysis between SUVA254、SUVA260 (a) and S275~295、E2/E3 (b) in four high-elevation rivers in the western Sichuan |
白河中SUVA254、SUVA260分别与SR、S275~295均呈显著负相关, 这或许揭示了外源输入CDOM因其芳香性及疏水性而导致白河CDOM分子结构较为复杂.杂谷脑河与抚边河中SUVA254、SUVA260分别与E2/E3、S275~295均呈显著相关关系, 可能暗示了这两条高山峡谷河流因河道多急流水体而溶解氧丰富, 微生物分解活动频繁从而导致小分子CDOM较多.
4.2 高海拔河流之间DOM差异高海拔河流水体中, DOC主要来源于陆地土壤中的有机碳, 通过地表径流和壤中流等汇入水体.因为不同流域的土壤有机碳特征、输入模式及转化机理等存在差异, 以及水体水力条件、流动路径、河水补给来源、滞留时间等流域水文过程不同, 使得不同河流水体中的DOC通量及动态变化各异(Lyon et al., 2010;Voss et al., 2015;Wallin et al., 2015), 这导致了4条高海拔河流水体中DOC含量的差异.
有研究指出, 沼泽地植被及高有机质土壤对水体CDOM有重要贡献(Shen et al., 2008;Clark et al., 2008).高原湿地海拔高、温度低、有机质分解缓慢等因素导致有机质高度积累且分解不彻底, 因此, 高寒湿地土壤中CDOM含量高且易因汇流进入地表水体, 其中的类腐殖质含有发色团而吸收紫外和可见光, 故白河水体CDOM生色团含量非常高.杂谷脑河等高山峡谷水体中微生物活性高, CDOM自生源贡献强, 同时, 沿岸居民点等人为源对CDOM的贡献源也不容忽视.这些因素的综合作用导致水体中无色DOC较多而CDOM均值低, 与陈雪霜等(2016)研究显示水体中的陆源DOC含有更高CDOM, 而水体生物自身降解产生更多的无色DOM的结果是一致的.
4.3 高原河流中DOM特征值间的关系高原河流中DOM与CDOM、FDOM具有不同的光学特征, 对其特征进行分析有利于了解水体性质.对高原水体的CDOM与DOC进行相关性分析, 发现4条河流中均无相关关系, 这与水库性湖泊(陈雪霜等, 2016)的结果相同, 与太湖水体研究结果(张运林等, 2007)相反.DOC一般可分为有色的和无色的, 当DOC中无色组分为常数或变化不大时, CDOM吸收系数与DOC浓度相关性非常好(陈雪霜等, 2016).川西高原河流CDOM无法反演DOC浓度, 可能是因为其沿岸土地利用方式不同.杂谷脑与抚边河集水区灌丛和森林面积占优, 杂谷脑下段集水区森林面积比例更高;岷江上游集水区草地(草地和高山草地)面积最大;白河集水区以高寒湿地分布为主.不同河流水体DOC输入强度和组分不同, 不同水下光场和水体环境也引起CDOM转化降解机制和强度的差异.
CDOM/DOC与CDOM、DOC间的相关性表明, 杂谷脑河中CDOM/DOC与CDOM显著相关;抚边河中CDOM/DOC与CDOM、DOC显著相关;岷江中CDOM/DOC与DOC相关;白河中CDOM/DOC与CDOM相关.有意思的是, 杂谷脑河中DOM非生色组分贡献率较大, 却是由生色组分(CDOM)主导DOC变化, 说明其中的CDOM易降解且生物可利用性较为突出.
分析lgFn(355)与a(355)、DOC的关系, 发现杂谷脑河、白河中FDOM均与CDOM、DOM相关(图 6), 这表明在DOM特征较为明显的河流中DOM荧光团与生色团、DOC相关(Singh et al., 2010).即使水体DOM来源、特征差别很大, FDOM作为水体DOM中较为稳定的组分, 构成了水体溶解性有机质的一部分.
图 6(Fig. 6)
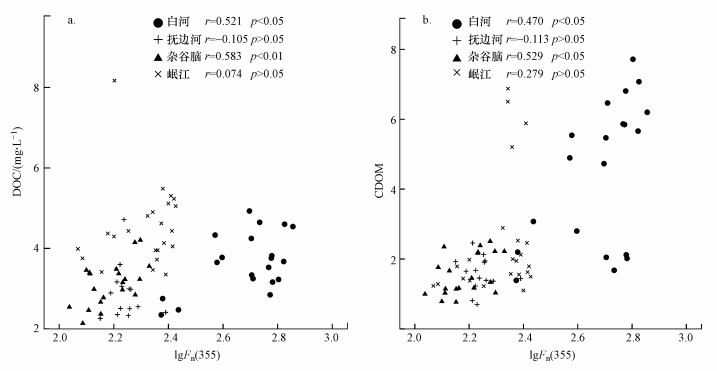 |
| 图 6 川西四条高海拔河流水体中FDOM (lgFn(355))与DOC (a)、CDOM (b)相关性分析 Fig. 6Correlation analysis between FDOM(lgFn(355)) and DOC(a), CDOM(b) in four high-elevation rivers in the north-western Sichuan |
5 结论(Conclusions)1) 高山峡谷河流的紫外-可见光吸收曲线特征体现为整体吸光度较低, 在260~280 nm处有微弱的吸收峰, 暗示其CDOM发色团中可能存在双键结构;高原河流水体CDOM吸光度较高, 显示其存在共轭结构、腐殖化程度较高而吸光能力较强.
2) 高原河流的SUVA254、SUVA260均高于高山峡谷河流, 揭示其水体中CDOM腐殖化程度高、芳香性与疏水性较强.E2/E3、S275~295特征进一步揭示两者在CDOM结构上的差异, 即高原河流白河CDOM结构较为复杂;高山峡谷河流光降解程度高, 水体中多为小分子CDOM.SR值表明, 两种河流的CDOM来源存在差异, 即高原河流接纳大量陆源腐殖质输入, 导致SUVA254、SUVA260大幅度波动;高山峡谷河流内微生物代谢活动旺盛.
3) 川西4条高海拔河流SUVA254、SUVA260存在显著相关, 表明河流CDOM疏水组分中有芳香性结构.其中, 高原河流中SUVA254、SUVA260分别与SR、S275~295呈显著负相关, 表明外源输入导致CDOM分子结构较为复杂, 芳香性与疏水性特征突出;杂谷脑河与抚边河中SUVA254、SUVA260分别与E2/E3、S275~295均相关, 暗示高山峡谷河流中微生物分解活动频繁从而小分子CDOM较多.
4) 4条河流中FDOM浓度及变化保持在相对稳定水平.高原河流中CDOM远大于高山峡谷河流, 与水体受纳陆源腐殖质且DOM降解率较低有关.高海拔河流水体中DOM、CDOM、FDOM间关系较为复杂, 不同河流中陆源DOC输入强度、组分及转化机制不同, CDOM总体上与DOM浓度并无共性.杂谷脑河、白河中FDOM均与CDOM、DOM存在相关关系, 显示DOM特征明显的水体中DOM荧光团与生色团、DOC相关.
致谢:沈丹杰、胡伟同学协助完成采样工作, 中国科学院水利部成都山地灾害与环境研究所唐翔宇研究员和刘琛老师为本研究提供了实验分析条件, 鲜青松、刘慧云博士为实验分析提供了建议, 在此一并表示感谢!
参考文献
| Anesio A M, Hollas C, Granéli W, et al. 2004. Influence of humic substances on bacterial and viral dynamics in freshwaters[J]. Applied and Environmental Microbiology, 70: 4848–4854.DOI:10.1128/AEM.70.8.4848-4854.2004 |
| Battin Y J, Luyssaert S, Kaplan L, et al. 2009. The boundless carbon cycle[J]. Nature Geoscience, 2: 598–600.DOI:10.1038/ngeo618 |
| 陈雪霜, 江韬, 卢松, 等. 2016. 典型水库型湖泊中CDOM吸收及荧光光谱变化特征:基于沿岸生态系统分析[J]. 环境科学, 2016, 37(11): 4168–4178. |
| Chin Y P, Aiken G R, O'Loughlin E. 1994. Molecular weight, polydispersity and spectroscopic properties of aquatic humic substances[J]. Environmental Science Technology, 28: 1853–1858.DOI:10.1021/es00060a015 |
| Clark C D, Litz L P, Grant S B. 2008. Salt marshes as a source of chromophoric dissolved organic matter (CDOM) to Southern California coastal waters[J]. Limnology and Oceanography, 53: 923–1933. |
| Du Y X, Zhang Y Y, Chen F Z, et al. 2016. Photochemical reactivities of dissolved organic matter (DOM) in a sub-alpine lake revealed by EEM-PARAFAC:An insight into the fate of allochthonous DOM in alpine lakes affected by climate change[J]. Science of the Total Environment, 568: 216–225.DOI:10.1016/j.scitotenv.2016.06.036 |
| Fichotc G, Benne R R. 2012. The spectral slope coefficient of chromophoric dissolved organic matter (S275-295) as a tracer of terrigenous dissolved organic carbon in river-influenced ocean margins[J]. Limnlolgy and Oceanography, 57(5): 1453–1466.DOI:10.4319/lo.2012.57.5.1453 |
| Findlay S E G, Sinsabaugh R L. 2002. Aquatic ecosystems:interactivity of dissolved organic matter[J]. Journal of North American Benthological Society, 23(3): 662–663. |
| 甘淑钗, 吴莹, 鲍红艳, 等. 2013. 长江溶解有机质三维荧光光谱的平行因子分析[J]. 中国环境科学, 2013, 33(6): 1045–1052.DOI:10.3969/j.issn.1000-6923.2013.06.012 |
| 高洁, 江韬, 李璐璐, 等. 2015. 三峡库区消落带土壤中溶解性有机质(DOM)吸收及荧光光谱特征[J]. 环境科学, 2015, 36(1): 151–162.DOI:10.3969/j.issn.1673-288X.2015.01.042 |
| He M C, Shi Y H, Lin C Y. 2008. Characterization of humic acids extracted from the sediments of the various rivers and lakes in China[J]. Journal of Environmental Sciences, 20(11): 1294–1299.DOI:10.1016/S1001-0742(08)62224-X |
| Helms J R, Stubbins A, Ritchie J D, et al. 2008. Absorption spectral slopes and slope ratios as indicators of molecular weight, source and photobleaching of chromophoric dissolved organic matter[J]. Limnology and Oceanography, 53(3): 955–969.DOI:10.4319/lo.2008.53.3.0955 |
| Huang W X, Xie Z Y, Yan W, et al. 2016. Occurrence and distribution of synthetic musks and organic UV filters from riverine and coastal sediments in the Pearl River estuary of China[J]. Marine Pollution Bulletin, 111: 153–159.DOI:10.1016/j.marpolbul.2016.07.018 |
| Jaffrain J, Gerard F, Meyer M, et al. 2007. Assessing the quality of dissolved organic matter in forest soils using ultraviolet absorption spectrophotometry[J]. Soil Science Society of America Journal, 71(6): 1851–1858.DOI:10.2136/sssaj2006.0202 |
| 江韬, 卢松, 王齐磊, 等. 2016. 三峡库区内陆腹地典型水库型湖泊中DOM吸收光谱特征[J]. 环境科学, 2016, 37(6): 2073–2081. |
| Judd K E, Crump B C, Kling G W. 2006. Variation in dissolved organic matter controls bacterial production and community composition[J]. Ecology, 87: 2068–2079.DOI:10.1890/0012-9658(2006)87[2068:VIDOMC]2.0.CO;2 |
| Keil R G, Kirchman D L. 1991. Contribution of dissolved amino acids and ammonium to the nitrogen requirements of heterotrophic Bacterioplankton[J]. Marine Ecology Progress Series, 71(1): 1–10. |
| Lyon S W, Morth M, Humborg C, et al. 2010. The relationship between subsurface hydrology and dissolved carbon fluxes for a sub-arctic catchment[J]. Hydrology and Earth system Science, 14(6): 941–950.DOI:10.5194/hess-14-941-2010 |
| Peuravouri I J, Pihlaja K. 1997. Molecular size distribution and spectroscopic properties of aquatic humic substances[J]. Analytica Chimica Acta, 337: 133–149.DOI:10.1016/S0003-2670(96)00412-6 |
| Pretsch E, Bühlmann P, Badertscher M. 2009. Structure Determination of Organic Compounds:Tables of Spectral Data[M]. Berlin Heidelberg: Springer: 64–65. |
| Shen Y, Fichot C G, Benner R. 2012. Floodplain influence on dissolved organic matter composition and export from the Mississippi-Atchafalaya River system to the Gulf of Mexico[J]. Limnology and Oceanography, 57(4): 1149–1160.DOI:10.4319/lo.2012.57.4.1149 |
| Singh S, D'Sa E, Swenson E. 2010. Seasonal variability in CDOM absorption and fluorescence properties in the Barataria Basin, Louisiana, USA[J]. Journal of Environmental Sciences, 22(10): 1481–1490.DOI:10.1016/S1001-0742(09)60279-5 |
| Voss B M, Peucker-Ehrenbrink B, Eglinton T I, et al. 2015. Seasonal hydrology drives rapid shifts in the flux and compositon of dissolved and particulate organic carbon and major and trace ions in the Franscr River, Canada[J]. Biogeoscience Discussion, 12(10): 7613–7669.DOI:10.5194/bgd-12-7613-2015 |
| Wallin M B, Weyhenmeyer G A, David B, et al. 2015. Temporal control on concentration, character, and export of dissolved organic carbon in two hemiboreal headwater streams draining contrasting catchments[J]. Journal of Geophysical Research:Biogeoscience, 120(5): 832–846.DOI:10.1002/2014JG002814 |
| Weishaar J L, Aiken G R, Berganmaschi B A, et al. 2003. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J]. Environmental Science Technology, 37: 4702–4708.DOI:10.1021/es030360x |
| Wurl O. 2009. Practical Guidelines for the Analysis of Seawater[M]. Florida: CRC Press: 81–83. |
| Xiao Y H, Sara-Aho T, Hartikainen H, et al. 2013. Contribution of ferric iron to light absorption by chromophoric dissolved organic matter[J]. Limnology and Oceanography, 58(2): 653–662.DOI:10.4319/lo.2013.58.2.0653 |
| 张运林, 秦伯强. 2007. 梅梁湾、大太湖夏季和冬季CDOM特征及可能来源分析[J]. 水科学进展, 2007, 18(3): 415–423.DOI:10.3321/j.issn:1001-6791.2007.03.018 |
