 , 吴胜军1, 姜毅1, 吴晓冰1,2, 李垒3, 邓占勇4, 王雨1
, 吴胜军1, 姜毅1, 吴晓冰1,2, 李垒3, 邓占勇4, 王雨1

1. 中国科学院重庆绿色智能技术研究院, 重庆 400714;
2. 中国科学院大学, 北京 100049;
3. 北京市水科学技术研究院, 北京 100048;
4. 重庆市开州区水务局, 重庆 405400
收稿日期: 2017-12-26; 修回日期: 2018-01-31; 录用日期: 2018-01-31
基金项目: 国家自然科学基金(No.41303053,41571497);重庆市科学技术委员会社会民生重点研发项目(No.cstc2017shms-zdyfX0074)
作者简介: 叶飞(1988-), 男, 博士, E-mail:yefei@cigit.ac.cn
通讯作者(责任作者): 王雨(1981—), 男, 博士, 副研究员.主要研究方向为微生物碳氮循环, E-mail:wangyu@cigit.ac.cn
摘要: 由"Candidatus Methylomirabilis oxyfera(M.oxyfera)"主导的亚硝酸盐型甲烷厌氧氧化过程(nitrite-dependent anaerobic methane-oxidizing,n-damo)是碳循环中新发现的一个过程.已有研究发现三峡库区消落带有n-damo菌的存在.为了解人类活动对n-damo菌群落结构的影响,对三峡库区受人类活动干扰程度不同的消落带n-damo菌群落进行了研究.结果表明,人为干扰水平高的小河消落带n-damo菌基因丰度(8.98×102~3.31×105 copies·g-1)整体上要高于白家溪(4.72×102~5.32×104 copies·g-1).此外,淹水都会导致两个地点n-damo菌基因丰度的增加.白家溪的n-damo菌丰度与累积淹水时间呈线性正相关,而小河的n-damo菌丰度与土壤总氮显著负相关.系统发育树和多样性分析表明,淹水前白家溪和小河相近高程土壤n-damo菌群落结构比较类似,但淹水后出现较大差异;较低高程土壤的群落多样性要明显高于较高高程土壤.消落带土壤中的n-damo菌群落具有明显的时空异质性,且淹水会导致这种异质性增加.淹水和人类活动对于n-damo菌的多样性具有同等的重要性.这些结果表明,淹水和人类活动都会影响消落带土壤中n-damo菌群落结构,而人类活动可能进一步增加n-damo菌的丰度和多样性.
关键词:消落带土壤n-damo菌丰度群落结构
Influences of anthropogenic disturbance on nitrite-dependent anaerobic methane-oxidizing bacterial community in water level fluctuation zone of the Three Gorges Reservoir
YE Fei1,2
 , WU Shengjun1, JIANG Yi1, WU Xiaobing1,2, LI Lei3, DENG Zhanyong4, WANG Yu1
, WU Shengjun1, JIANG Yi1, WU Xiaobing1,2, LI Lei3, DENG Zhanyong4, WANG Yu1

1. Chongqing Institute of Green and Intelligent Technology, Chinese Academy of Sciences, Chongqing 400714;
2. University of Chinese Academy of Sciences, Beijing 100049;
3. Beijing Academy of Water Science and Technology, Beijing 100048;
4. Chongqing Kaizhou Water Bureau, Chongqing 405400
Received 26 December 2017; received in revised from 31 January 2018; accepted 31 January 2018
Supported by the National Natural Science Foundation of China (No.41303053, 41571497) and the Program of the Chongqing Science and Technology Commission (No.cstc2017shms-zdyfX0074)
Biography: YE Fei (1988—), male, Ph.D., E-mail:yefei@cigit.ac.cn
*Corresponding author: WANG Yu, E-mail:wangyu@cigit.ac.cn
Abstract: Nitrite-dependent anaerobic methane-oxidizing (n-damo) mediated by "Candidatus Methylomirabilis oxyfera (M. oxyfera)" is a recently discovered process in carbon cycle. The presence of n-damo bacteria in the water level fluctuation zone (WLFZ) of the Three Gorges Reservoir (TGR) was reported previously. In order to understand the influence of human activities on the n-damo bacteria, the n-damo bacterial community from two WLFZs in the TGR with contrast anthropogenic disturbance was investigated. The results showed that the gene abundance of n-damo bacteria in the site of Xiaohe (8.98×102 to 3.31×105 copies·g-1), which has high level of anthropogenic disturbance, was generally higher than that of Baijiaxi (4.72×102 to 5.32×104 copies·g-1). Besides, the gene abundance increased after water flooding in both sites. A linear positive correlation was observed between the abundance and accumulate flooding time in Baijiaxi. Whereas the abundance in Xiaohe showed a significant negative correlation with the total nitrogen. Phylogenetic and diversity analyses showed that the community structure of n-damo bacteria was similar in parallel elevations of the two sites before flooding, but greater differences were observed after flooding. The community diversity of n-damo bacteria in soils of low elevations were higher than that of higher elevations. The community structure of n-damo bacteria in WLFZ showed obvious spatial-temporal heterogeneity, and the heterogeneity was further increased by water flooding. These results suggest that the water flooding and human activities are of equal importance in influencing the n-damo bacterial community diversity. Overall, both the water flooding and human activities could affect the n-damo bacterial community in WLFZ, and the human activities have the effect of increasing the abundance and diversity.
Key words: water level fluctuation zonesoiln-damo bacteriaabundacnecommunity structure
1 引言(Introduction)长期以来, 厌氧环境中的甲烷氧化仅限于协同硫酸盐及铁、锰氧化物的还原(Boetius et al., 2000; Beal et al., 2009), 而亚硝酸盐型甲烷厌氧氧化过程(nitrite-dependent anaerobic methane-oxidizing, n-damo)的发现, 彻底改变了人们对甲烷循环的传统认识.n-damo反应是指在厌氧环境下, 甲烷以硝酸盐和亚硝酸盐为电子受体而被氧化(Ettwig et al., 2009; Ettwig et al., 2010; Luesken et al., 2012), 这一过程主要由隶属于候选门NC10的Candidatus Methylomirabilis oxyfera (M. oxyfera)菌主导.
随着针对n-damo菌的特异性引物的开发和同位素示踪技术的发展, 人们发现n-damo菌在不同生境类型中广泛分布, 如湖泊沉积物(Kojima et al., 2012)、河流沉积物(Shen et al., 2014)、湿地土壤(Wang et al., 2012; Hu et al., 2014)和海岸带沉积物(Chen et al., 2015)等.Hu等(2014)基于稳定同位素数据推测全球湿地生态系统中n-damo过程所氧化的甲烷量可以达到4.1~6.1 Tg, 是全球湿地甲烷排放总量的2%~6%, 表明湿地中的n-damo是潜在的甲烷汇.由于n-damo菌生长非常缓慢, 主要分布于有利于其增长的比较稳定的环境中(Zhu et al., 2012).研究还发现, 硝酸盐、亚硝酸盐、甲烷、有机碳的浓度, 以及温度和盐度等环境因子对自然生境中n-damo菌的分布和活性有重要影响(沈李东, 2015).
三峡水库实行夏落冬涨的调度运行方案.夏季最低水位145 m, 冬季升至175 m, 水位变幅大且同自然洪枯规律相反.季节性水位涨落使库区淹没土地周期性露出水面, 形成了面积达348.9 km2的消落带.三峡库区消落带由于其所处的空间位置, 导致其不仅受到周期性水位波动的影响(Zhang et al., 2011), 周边人类活动的污染物输入同样会改变消落带环境(Bao et al., 2015).已有研究表明, n-damo菌能存在于三峡库区消落带土壤中, 且长期淹水会使n-damo菌丰度增加(Wang et al., 2016).黄培(2015)分析了自然消落带和受人为影响消落带中n-damo菌群落和多样性的分布情况, 发现仅在水下沉积物中检测到Group a组的n-damo菌.然而, 有关三峡库区消落带强烈的人为干扰和污染输入对消落带土壤中n-damo菌群落及其甲烷源汇角色的影响还缺乏深刻的认识.因此, 本文以受人为干扰程度不同的消落带土壤为研究对象, 通过比较n-damo菌的丰度、群落结构和多样性, 分析人类活动对消落带土壤中n-damo菌群落的影响, 以期进一步认识n-damo菌在消落带土壤生态系统的存在机制.
2 材料与方法(Materials and methods)2.1 样品的采集与保存本研究选取的白家溪(BJX)和小河(XH)消落带位于长江一级支流澎溪河流域, 处于三峡库区腹地的重庆市开州区境内(图 1).该区域属于中亚热带湿润季风气候, 年平均气温18.5 ℃, 四季分明, 年均降雨量大约1200 mm, 雨季长、雨日多、降水丰富.土壤类型以发育自紫色砂岩的紫色土为主.白家溪和小河消落带为三峡库区典型的支流库湾型消落带.其中, 白家溪研究区位于澎溪河消落带湿地自然保护区内, 人类活动较少, 代表了库区内人为干扰强度较低的区域(图 1).小河研究区位于居民聚集区, 由于生活污水收集管网不完善, 农业与生活污染会经消落带直接排放进入河流水体中.除此之外, 小河研究区附近的畜禽养殖进一步增加了污染物的输入(表 1).因此, 小河研究区代表了库区内受人为干扰严重的区域.
图 1(Fig. 1)
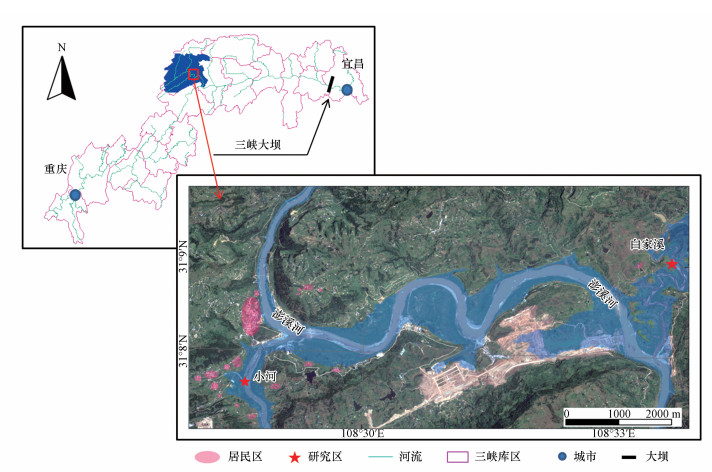 |
| 图 1 研究区示意图 Fig. 1The maps of the study region |
表 1(Table 1)
| 表 1 白家溪和小河研究区人类活动强度主要指标 Table 1 Indexes of anthropogenic activities intensity in BJX and XH areas | ||||||||||||||||||||||||||||||||||||
表 1 白家溪和小河研究区人类活动强度主要指标 Table 1 Indexes of anthropogenic activities intensity in BJX and XH areas
| ||||||||||||||||||||||||||||||||||||
在两个研究区内分别以海拔150 m为最低点, 沿消落带150~175 m海拔高程选择一个垂直样带每隔5 m设置采样点, 每条样带各6个采样点.样品的采集在2013年10月(水位上升初期)和2014年4月(水位下降末期)进行, 考察一个淹水周期内水位的波动对n-damo细菌群落的影响.样品采集过程尽量避开植物的影响.在水位线以上(干样)的每个高程样点, 用不锈钢土钻随机采集3个表层(0~10 cm)土壤样品; 水位线以下(湿样)的样点每个高程用彼得森采样器随机采集3个样品.每个样点的3个重复样充分混匀后组成一个混合样, 每个研究区共采集12个混合样.样品采集后放置于无菌密封袋, 冰盒保存运输至实验室.其中一份立即进行理化指标分析, 另一份于-20 ℃储存, 用于DNA提取和后续分子生物学实验.
2.2 土壤理化指标分析土壤pH值采用pH计(FE20, Mettler Toledo, USA)测定, 水土比为1:5.含水率用烘干称重法测定.土壤NH4+和NO3-用2 mol·L-1 KCl浸提后采用连续流动注射分析仪(FIA Star 5000, FOSS Tecator, Sweden)测定浸提液得到.土壤有机质(OM)采用烧失量法测定.总氮(TC)、总氮(TN)和总硫(TS)用元素分析仪(Vario EL cube, Elementar, Germany)测定.土壤中二价铁的测定方法是称取约2.0 g新土样, 加入20 mL浓度为0.1 mol·L-1的Al2(SO4)3溶液(pH=2.5), 180 r·min-1振荡1 h后马上过滤, 浸提液采用邻菲罗啉分光光度法使用紫外分光光度计(UV-1750, Shimadzu, Japan)于520 nm处用吸光度比色测定.三价铁的测定是将浸提液用1%的盐酸羟胺还原后测得总铁浓度, 差减法得到三价铁浓度(鲍士旦, 2000).
2.3 DNA的提取和聚合酶链式反应(PCR)称取约0.25 g土壤样品, 采用Power Soil? DNA Isolation Kit (Mobio, USA)试剂盒提取样品中的总DNA, 提取方法参照产品说明书.用超微量紫外分光光度计NanoVue Plus Spectrophotometer (GE Healthcare, UK)确定DNA浓度.用1%的琼脂糖凝胶电泳检验DNA的质量.提取的DNA溶液保存于-20 ℃冰箱中待用.
采用巢式PCR的方法对n-damo菌的pmoA功能基因进行扩增, 第一步扩增引物为A189_f-cmo682, 第二步使用引物cmo182-cmo568.扩增程序为:95 ℃预变性5 min; 95 ℃变性1 min, 55 ℃(第一步)或59 ℃(第二步)退火1 min, 72 ℃延伸1 min, 共35个循(Luesken et al., 2011).针对n-damo菌16S rRNA基因的扩增同样采取巢式PCR方式进行, 第一步使用引物202F-630R, 第二步使用引物p1F-p2R.扩增程序为:95 ℃预变性5 min; 95 ℃变性1 min, 55 ℃(第一步)或57 ℃(第二步)退火1 min, 72 ℃延伸1 min, 共35个循(Juretschko et al., 1998; Ettwig et al., 2009).本文所用引物序列如表 2所示.PCR反应使用GoTaq? Green Master Mix酶(Promega, USA).
表 2(Table 2)
| 表 2 本研究所用引物序列和相应的扩增程序 Table 2 The primers and thermal profiles used in this study | |||||||||||||||||||||||||||||||||||||||||
表 2 本研究所用引物序列和相应的扩增程序 Table 2 The primers and thermal profiles used in this study
| |||||||||||||||||||||||||||||||||||||||||
2.4 定量PCR分析为了避免丰度测定的潜在误差, 本文使用两对特异性引物(p1F-p1R和p2F-p2R)分别对n-damo菌的16S rRNA基因进行定量PCR分析(Ettwig et al., 2009), 引物序列如表 2.选取n-damo菌的16S rRNA基因阳性克隆, 用GeneJet Plasmid Miniprep Kit(Fermentas MBI, Lithuania)试剂盒提取质粒.用超微量紫外分光光度计NanoVue Plus(GE Healthcare, UK)测定质粒浓度, 并结合质粒的分子量计算出质粒的拷贝数.将质粒进行10倍梯度稀释建立质粒标准曲线.使用Realplex2 real-time PCR仪(Eppendorf, Germany)进行定量, 采用20 μL的反应体系, 具体为:SYBR? Premix Ex Taq TMⅡ (Takara, Dalian, China) 10 μL, 上、下游引物各0.5 μL(10 μmol·L-1), 模板DNA 2 μL(5~10 ng·μL-1), 无菌水补齐.扩增程序为:95 ℃预变性3 min; 95 ℃变性1 min, 63 ℃退火1 min, 72 ℃延伸1 min, 共40个循环.每个循环结束后采集荧光信号, 通过溶解曲线判断扩增产物的特异性, 对单一峰值的样品数值进行分析.每个样品做3个平行, 仅扩增效率和相关系数分别大于95%和0.98的结果被采用.
2.5 克隆文库构建与序列分析本研究同时对n-damo菌的16S rRNA和pmoA基因进行克隆和测序.使用GeneJETTM Gel Extraction Kit(Fermentas, Lithuania)纯化试剂盒对PCR扩增产物进行切胶纯化, 将PCR回收产物与PGEM-Teasy (Promega, USA)载体进行连接, 然后转入E. coli JM109(Takara, Dalian, China)感受态细胞, 最后进行蓝白斑筛选.从每个克隆文库随机选取约70个白色克隆, 用菌液PCR扩增验证阳性克隆后送测序.
所得序列用Contig软件对测序结果进行编辑, 去除载体序列后在NCBI上进行BLAST比对, 以确认克隆基因是否正确并获取相似序列.用MOTHUR将序列在97%的相似度水平下划分独立操作单元(OTU), 并计算香农多样性指数(Shannon diversity index)、Chao1丰富度指数(Chao1 richness estimate)和覆盖度(Good′s coverage) (Schloss et al., 2009).利用MEGA 5.0软件, 以邻接法(Neighbor-Joining, NJ)绘制n-damo菌的16S rRNA和pmoA基因系统发育树(Tamura et al., 2011).
2.6 数据分析利用IBM SPSS Statistics 19.0进行独立样本t检验和Pearson相关分析.运行CANOCO 5.0分析n-damo菌的16S rRNA基因群落组成.用R语言(version 3.2.1)中的mvpart程序包进行多元回归树(Multivariate Regression Tree, MRT)分析, 采取1-SE规则进行剪枝, 在兼顾分析误差的同时使树的规模较小(De′Ath, 2002).其他图形绘制使用origin 9.0软件.
3 结果(Results)3.1 土壤性质通过对两研究地点各理化指标的均值对比发现, 小河研究区土壤性质的主要指标均值总体上要高于白家溪(表 3), 表明较高程度的人为干扰会导致消落带土壤理化性质呈现较高水平.其中, 表示物质总量的土壤性质指标(如OM、TC、TN和C/N), 在小河研究区的均值要显著高于白家溪研究区(p < 0.05), 说明人为干扰对表征消落带土壤中物质总量的相关性质影响更大.除此之外, 小河消落带土壤的含水率和Fe2+/Fe3+也都要高于白家溪研究区, 但白家溪研究区的pH值显著高于小河(p < 0.05).
表 3(Table 3)
| 表 3 小河和白家溪研究区消落带土壤理化性质及显著性检验 Table 3 Soil properties between Xiaohe and Baijiaxi areas and test of significance | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 小河和白家溪研究区消落带土壤理化性质及显著性检验 Table 3 Soil properties between Xiaohe and Baijiaxi areas and test of significance
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 n-damo菌丰度本研究同时使用两对引物(p1F-p1R和p2F-p2R)对n-damo菌的16S rRNA基因丰度进行定量分析(图 2).与已有研究结果类似, 采用引物p1F-p1R定量分析的n-damo菌丰度大体上要略微高于p2F-p2R(Ettwig et al., 2009).但从图中可以看出, 这两对引物的定量结果没有显著差别.因此, 在后续分析中采用这两对引物结果的平均值进行分析.
图 2(Fig. 2)
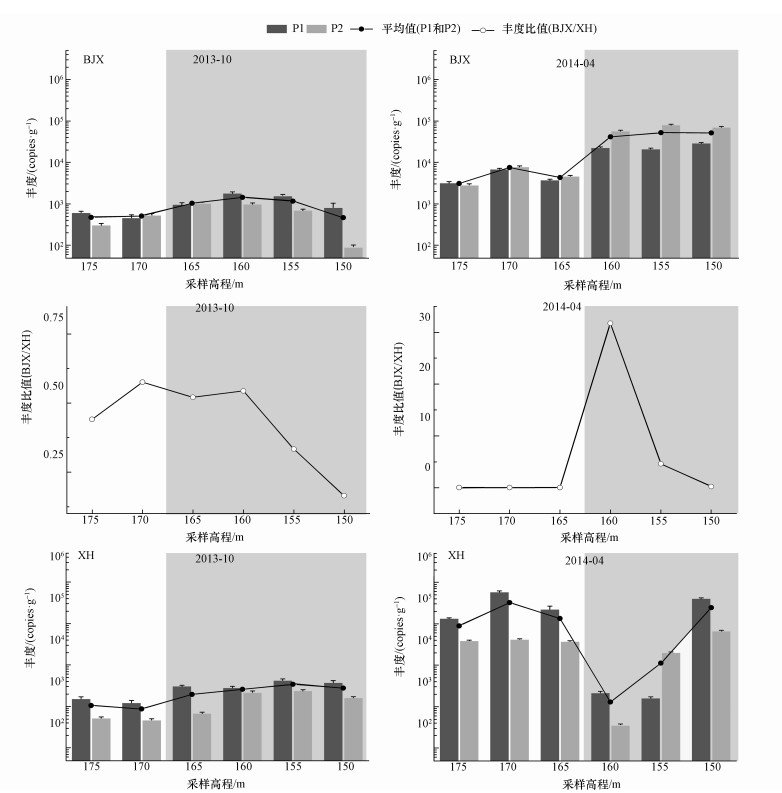 |
| 图 2 水位上升初期和水位下降末期白家溪和小河消落带不同高程土壤中n-damo菌丰度(采用p1F-p1R (P1)和p2F-p2R (P2)两对引物对n-damo菌丰度进行定量; 浅灰色背景表示样品位于水位线以下) Fig. 2Abundance of n-damo bacteria in soils of different elevations in the beginning and later stages of water flooding |
水位上升初期, 白家溪的n-damo菌丰度为4.72×102~1.45×103 copies·g-1(以干土计, 下同), 显著小于小河的n-damo菌丰度(8.98×102~3.54×103 copies·g-1)(p < 0.05).水位下降末期, 白家溪和小河的n-damo菌丰度分别为3.17×103~5.32×104和1.33×103~3.31×105 copies·g-1, 小河的n-damo菌丰度整体均值高于白家溪(图 2).此外, 白家溪水位上升初期和水位下降末期的湿样中n-damo菌丰度均值分别为1.04×103和4.93×104 copies·g-1, 要高于干样中的n-damo菌丰度(分别为4.98×102和5.08×103 copies·g-1).同样的, 水位上升初期, 小河湿样中(2.77×103 copies·g-1)的n-damo菌丰度均值要高于干样(9.92×102 copies·g-1); 但在水位下降末期, 干样中(1.87×105 copies·g-1)的n-damo菌丰度却要高于湿样(8.80×104 copies·g-1).
为了理解影响消落带土壤中n-damo菌丰度分布的主要环境因子, 本研究采用线性回归的方法分析白家溪和小河n-damo菌丰度与环境因子的关系.结果表明, 白家溪n-damo菌丰度与累积淹水时间表现出明显的正的线性关系, 且可绝系数R2从0.270(p=0.048)、0.404(p=0.016)变化到0.830(p=0.000), 与短期的累积淹水时间ST2013的线性关系更好(图 3).虽然小河n-damo菌丰度与累积淹水时间的线性关系同样随着累积淹水时间的缩短而越来越好, 但没有表现出显著的线性关系(p>0.05).然而, 小河n-damo菌丰度随着土壤TN的增加而显著降低(R2=0.401, p=0.016)(图 3).
图 3(Fig. 3)
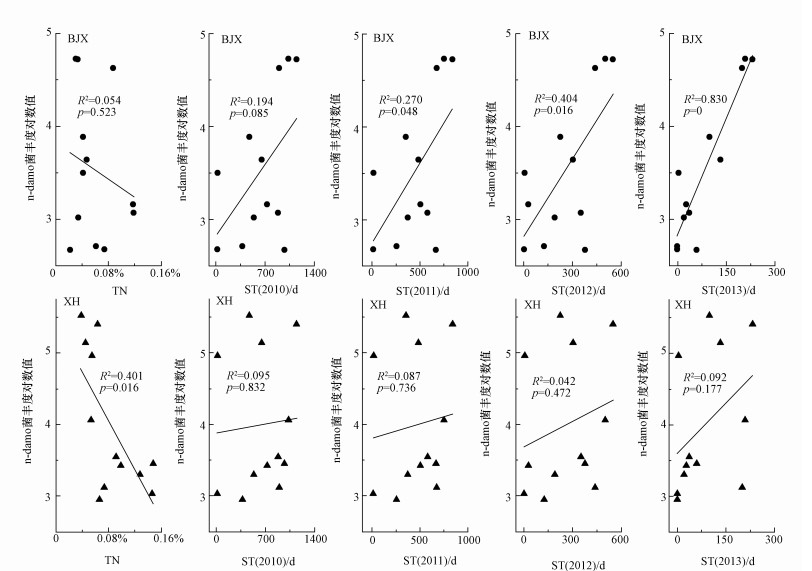 |
| 图 3 白家溪和小河n-damo菌丰度与土壤TN和累积淹水时间的线性关系(ST(2010)、ST(2011)、ST(2012)和ST(2013)分别表示从2010、2011、2012和2013年最低水位算起的累积淹水时间) Fig. 3Linear fitting of n-damo bacteria abundance in BJX and XH with soil TN and accumulated flooding time |
3.3 n-damo菌16S rRNA和pmoA序列系统发育分析由表 4可见, 白家溪和小河样品的16S rRNA和pmoA基因文库的覆盖度大体上要高于0.940, 这表明每个样品的测序深度可以较好地反映样品中n-damo菌群落多样性.白家溪和小河样品的16S rRNA基因克隆文库分别得到264和389个序列, 这653个序列在97%的相似性水平下被划分为21个OTUs.通过系统发育树可以看出, 白家溪和小河消落带土壤的16S rRNA基因序列可以被划分为Group a、b和d 3个组(图 4A).属于OTU4、5、13和20的16S rRNA基因序列与Candidatus Methylomirabilis oxyfera基因组(Ettwig et al., 2010)的完整序列一起划分为NC10门组(Group a).Group a组的4个OTUs包含的47个序列中有95.7%来自于小河消落带水位上升初期160 m高程和水位下降末期165 m高程土壤, 仅有2个序列来自于白家溪消落带水位上升初期的155 m高程土壤.除了OTU7共19个序列被划分为Group d外, 剩余的16个OTUs共587个序列都被划分为Group b组, 其中, 来自白家溪和小河土壤的序列数分别占其总序列数的92.0%和88.4%.但Group b和d组的序列都与Candidatus Methylomirabilis oxyfera的亲缘关系较远.基于n-damo菌16S rRNA基因的PCoA分析可以看出(图 5a), 水位上升初期, 白家溪和小河n-damo菌群落结构比较类似, 但水位下降末期的n-damo菌群落结构出现了较大的差异性.
图 4(Fig. 4)
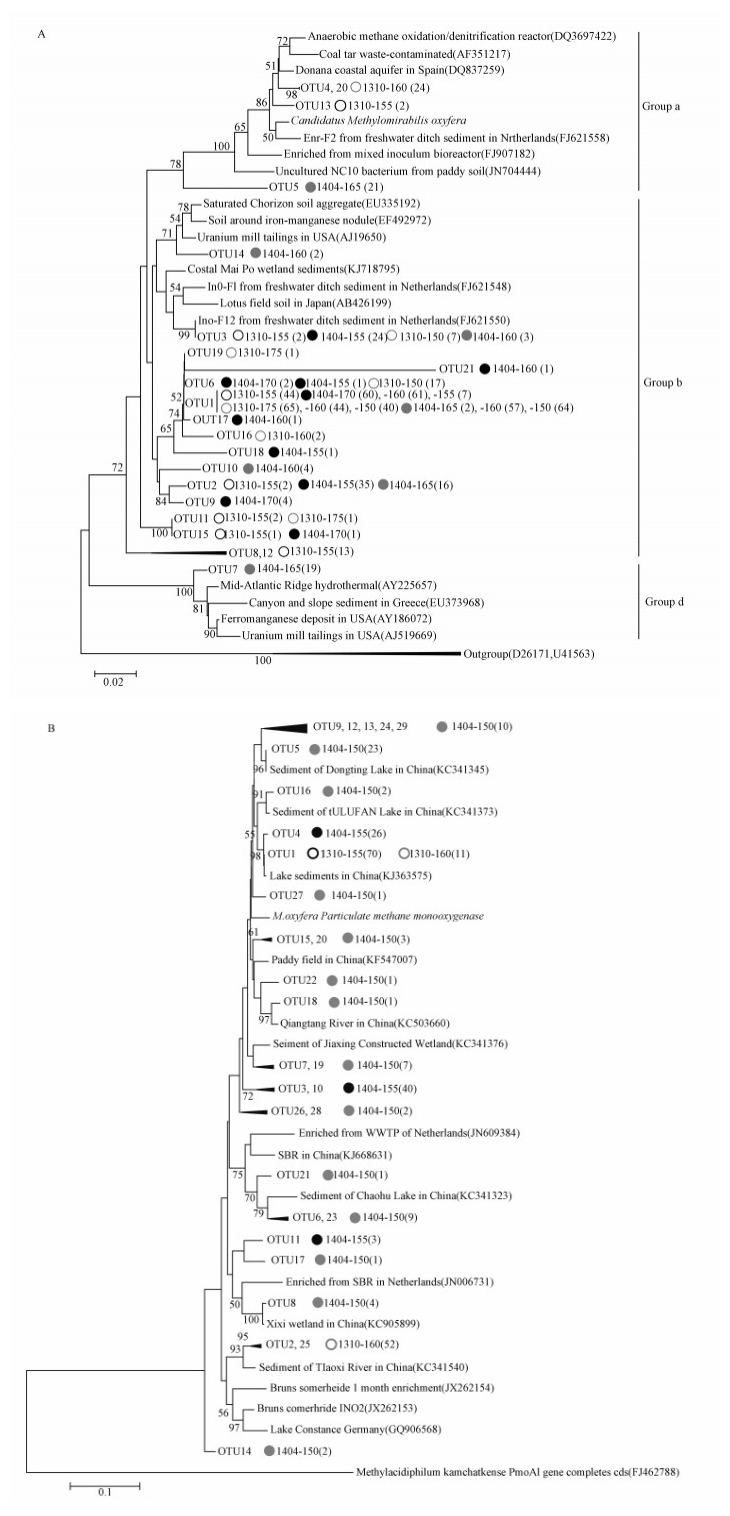 |
| 图 4 消落带土壤n-damo菌16S rRNA基因(A)和pmoA基因(B)序列系统发育树分析(每个OTU后面的数字表示采样时间、采样高程及序列数, 黑色和浅灰色字体分别表示来自白家溪和小河消落带的序列; 空心圈和实心圈分别表示水位上升前期和水位下降末期的样品) Fig. 4Phylogenetic tree of n-damo bacterial 16S rRNA gene (A) and pmoA gene (B) sequences form the WLFZ of the TGR |
图 5(Fig. 5)
 |
| 图 5 基于16S rRNA基因(a)和pmoA基因(b)的消落带土壤n-damo菌群落组成PCoA分析(黑色和浅灰色分别表示来自白家溪和小河消落带的样品; 空心圈和实心圈分别表示水位上升前期和水位下降末期的样品) Fig. 5The PCoA analysis of the n-damo bacterial communities based the 16S rRNA (a) and pmoA (b) genes |
表 4(Table 4)
| 表 4 小河和白家溪消落带n-damo菌序列信息和多样性 Table 4 Sequences information and diversity of n-damo bacteria in BJX and XH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 小河和白家溪消落带n-damo菌序列信息和多样性 Table 4 Sequences information and diversity of n-damo bacteria in BJX and XH
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
白家溪和小河都只有2个样品的pmoA功能基因的巢式PCR扩增为阳性(表 4、图 4B).这4个样品都是位于水位线以下的湿样, 分别是白家溪水位上升初期和水位下降末期155 m高程土壤样品, 小河水位上升初期160 m和水位下降末期150 m高程土壤样品.pmoA基因克隆文库共得到来自白家溪(139个)和小河(130个)消落带土壤的269个序列, 在97%的相似性水平下被划分为29个OTUs, 得到的pmoA基因序列与Candidatus Methylomirabilis oxyfera有较近的亲缘关系.除了OTU1同时包含来自白家溪和小河的序列, 剩余的OTU都是由来自单一研究区的序列组成(图 4B), 来自不同消落带土壤的pmoA序列较少出现在同一个OTU中, 且小河的OTU数(25个)明显要多于白家溪(5个).同时, 来自水位上升初期土壤的序列能很好地聚在一起, 而水位下降末期土壤的序列比较分散.从图 5b可以看出, 水位上升初期, 白家溪和小河n-damo菌群落结构比较接近, 水位下降末期的群落结构差别较大.
3.4 n-damo菌多样性分析从土壤n-damo菌16S rRNA基因的多样性来看, 白家溪水位上升初期的155 m土壤的多样性最高(1.148), 与水位下降末期同一高程的多样性(1.006)差别不大, 但要明显高于高程较高土壤的多样性.不同于白家溪, 虽然水位上升初期, 小河最大多样性同样出现在较低高程土壤(150 m), 但水位下降末期在165 m高程土壤有最大的多样性(1.482), 且高程越低, 多样性越小.但基于16S rRNA和pmoA基因的多样性表明, 在白家溪和小河, 水位下降末期土壤的n-damo菌多样性都要高于水位上升初期.
基于1-SE规则, MRT将多样性数据分为3类(图 6).第1次分割以采样时间为节点, 将样方分为2组(First和Second), 此次分割解释了多样性变化的12.6%.第2次分割以研究区为分界点, 将第1组的First组分为2组, 此次分割同样解释了多样性变化的12.6%.虽然MRT分析使用了4个因子作为自变量, 但土壤样品的干湿状态并没有出现在回归树中, 可能是由于n-damo菌多样性在干样和湿样间的分异比较小, 没有体现在基于1-SE规则剪枝后的回归树中.相比样品的干湿状态, 采样时间是影响消落带土壤n-damo菌多样性的主要因子, 其次是研究区.
图 6(Fig. 6)
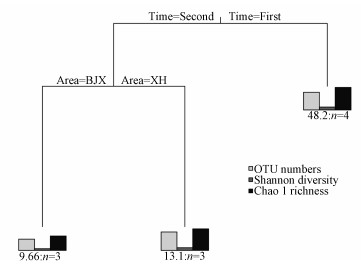 |
| 图 6 消落带土壤n-damo菌16S rRNA基因多样性与采样时间(First:水位上升初期, Second:水位下降末期)、研究区(BJX和XH)和土壤淹水状态(Dry和Wet)的多元回归树分析 Fig. 6Multivariate regression tree of the soil n-damo bacterial diversity associated with sampling times |
4 讨论(Discussion)小河消落带土壤中各项理化指标均不同程度的高于白家溪消落带, 尤其是OM、TC和TN等代表消落带土壤中物质总量的理化指标, 在两个消落带研究区之间表现出显著性差异.研究区所在的小河和白家溪消落带地理位置非常靠近, 具有类似的气候和土壤类型, 以及水文和地貌特征(王祥荣等, 2006; Bao et al., 2015), 进一步证实了小河研究区的人为活动干扰强度要明显高于白家溪研究区, 且外界干扰可以显著增加C、N元素含量.
n-damo菌在白家溪和小河消落带土壤中的丰度分别为4.72×102~5.32×104和8.98×102~3.31×105 copies·g-1, 要明显低于其他类似生境, 如日本的湖泊沉积物(105~106 copies·g-1)(Kojima et al., 2012), 以及淡水湿地(103~107 copies·g-1)(Zhu et al., 2015)和钱塘江沉积物(106~107 copies·g-1)(Shen et al., 2014)等.而淹水能导致n-damo菌丰度的增加, 这可能是因为淹水后的消落带土壤具有更好的厌氧环境, 有利于作为厌氧微生物的n-damo菌的生长(Luesken et al., 2012).整体上, 小河消落带的n-damo菌丰度要显著高于白家溪(p < 0.05), 但淹水后这种差异变得不显著.通常来说, 碳氮的可利用性是n-damo菌群落的决定性因子.潜在的n-damo菌反应速率往往受底物中NO2-和NO3-的影响(Norei et al., 2014), 且硝酸盐的浓度会显著影响n-damo菌的群落结构和分布(Chen et al., 2015).研究发现, 白家溪的n-damo菌丰度与累积淹水时间有较好的线性关系(p < 0.05), 进一步表明了淹水导致的厌氧环境对n-damo菌丰度的正效应.然而, 小河的n-damo菌丰度与累积淹水时间没有表现出显著的线性关系, 但与土壤TN有显著的负相关.这说明相比淹水, 人类活动对n-damo菌丰度的影响更强烈.
此外, 消落带土壤中n-damo菌的群落具有明显的时空异质性, 这可能跟淹水导致不同高程土壤的氧环境存在较大差异有关.研究表明, 自然环境中n-damo菌的分布受到氧浓度的限制(Kojima et al., 2012; Wang et al., 2012; Zhu et al., 2015).相比白家溪(1个OTU、2个序列), 小河有更多的序列(3个OTUs、45个序列)与Candidatus Methylomirabilis oxyfera的亲缘关系较近, 这说明人类活动导致的消落带土壤NO3-含量的升高, 使其成为n-damo菌适宜的生境(Norei et al., 2014; Chen et al., 2015).淹水前白家溪和小河消落带的n-damo菌群落结构比较类似, 但淹水后出现较大的差异, 这同样可以通过淹水后白家溪和小河消落带n-damo菌群落的多样性得到体现.淹水后白家溪和小河的n-damo菌多样性都升高, 但小河的多样性整体上要高于白家溪.研究表明, 波动环境条件能为不同的n-damo菌物种生存提供多样的微环境(Shen et al., 2014).由于人为活动引起的污染物输入, 小河消落带土壤微生境比白家溪更为复杂, 这为其涵养种类更丰富的n-damo菌创造了条件.本研究发现, 淹水和人为活动是影响消落带土壤n-damo菌多样性的主要因子.
三峡库区的甲烷排放一直以来都受到广泛关注(Qiu, 2009).研究表明, 三峡库区51.8%~77.4%的甲烷可以在沉积物中被厌氧氧化(Wang et al., 2014).虽然没有直接的证据表明三峡库区甲烷的氧化与任何微生物过程相关, 但依据在淡水生态系统中的相关研究(Deutzmann et al., 2014; Hu et al., 2014), 亚硝酸盐型甲烷厌氧氧化过程可能是三峡库区甲烷厌氧氧化的主要途径.而之前对三峡消落带甲烷排放中并未考虑这一过程, 因此, 在各种模型分析中, 存在高估其排放通量的可能性.关于三峡消落带甲烷排放机理和通量需要重新认识.
5 结论(Conclusions)三峡库区消落带土壤中n-damo菌的群落具有明显的时空异质性, 且淹水会导致这种异质性的增加.淹水和人类活动都会影响三峡库区消落带土壤中n-damo菌群落结构, 人类活动可能进一步增加n-damo菌的丰度和多样性.三峡消落带甲烷排放通量存在高估的可能性.
参考文献
| 鲍士旦. 2000. 土壤农化分析[M]. 北京: 中国农业出版社. |
| Bao Y H, Gao P, He X B. 2015. The water-level fluctuation zone of Three Gorges Reservoir - a unique geomorphological unit[J]. Earth-Science Reviews, 150: 14–24.DOI:10.1016/j.earscirev.2015.07.005 |
| Beal E J, House C H, Orphan V J. 2009. Manganese- and iron-dependent marine methane oxidation[J]. Science, 325(5937): 184–187.DOI:10.1126/science.1169984 |
| Boetius A, Ravenschlag K, Schubert C J, et al. 2000. A marine microbial consortium apparently mediating anaerobic oxidation of methane[J]. Nature, 407(6804): 623–626.DOI:10.1038/35036572 |
| Chen J, Zhou Z C, Gu J D. 2015. Complex community of nitrite-dependent anaerobic methane oxidation bacteria in coastal sediments of the Mai Po wetland by PCR amplification of both 16S rRNA and pmoA genes[J]. Applied Microbiology & Biotechnology, 99(3): 1463–1473. |
| De'Ath G. 2002. Multivariate regression trees:A new technique for modeling species-environment relationships[J]. Ecology, 83(4): 1105–1117. |
| Deutzmann J S, Stief P, Brandes, et al. 2014. Anaerobic methane oxidation coupled to denitrification is the dominant methane sink in a deep lake[J]. PNAS, 111(51): 18273–18278.DOI:10.1073/pnas.1411617111 |
| Ettwig K F, Butler M K, Le Paslier D, et al. 2010. Nitrite-driven anaerobic methane oxidation by oxygenic bacteria[J]. Nature, 464(7288): 543–548.DOI:10.1038/nature08883 |
| Ettwig K F, van Alen T, van de Pas-Schoonen K T, et al. 2009. Enrichment and molecular detection of denitrifying methanotrophic bacteria of the NC10 phylum[J]. Applied & Environmental Microbiology, 75(11): 3656–3662. |
| Hu B L, Shen L D, Lian X, et al. 2014. Evidence for nitrite-dependent anaerobic methane oxidation as a previously overlooked microbial methane sink in wetlands[J]. Proceedings of the National Academy of Sciences, 111(12): 4495–4500.DOI:10.1073/pnas.1318393111 |
| 黄培. 2015. 三峡库区消落带湿地反硝化型厌氧甲烷氧化菌的存在与分布特征[D]. 武汉: 武汉纺织大学 |
| Juretschko S, Timmermann G, Schmid M, et al. 1998. Combined molecular and conventional analyses of nitrifying bacterium diversity in activated sludge:Nitrosococcus mobilis and Nitrospira-like bacteria as dominant populations[J]. Applied & Environmental Microbiology, 64(8): 3042–3051. |
| 开县统计局. 2013. 开县统计年鉴(2012)[M]. 重庆: 开县年鉴编辑部. |
| Kojima H, Tsutsumi M, Ishikawa K, et al. 2012. Distribution of putative denitrifying methane oxidizing bacteria in sediment of a freshwater lake, Lake Biwa[J]. Systematic and Applied Microbiology, 35(4): 233–238.DOI:10.1016/j.syapm.2012.03.005 |
| Luesken F A, Wu M L, Op den Camp H J M, et al. 2012. Effect of oxygen on the anaerobic methanotroph 'Candidatus Methylomirabilis oxyfera':Kinetic and transcriptional analysis[J]. Environmental Microbiology, 14(4): 1024–1034.DOI:10.1111/emi.2012.14.issue-4 |
| Luesken F A, Zhu B, van A T A, et al. 2011. pmoA primers for detection of anaerobic methanotrophs[J]. Applied & Environmental Microbiology, 77(11): 3877–3880. |
| Norei K A', Thamdrup B. 2014. Nitrate-dependent anaerobic methane oxidation in a freshwater sediment[J]. Geochimica et Cosmochimica Acta, 132(Supplement C): 141–150. |
| Qiu J. 2009. Chinese dam may be a methane menace:wetlands around Three Gorges produce tonnes of the greenhouse gas[J]. Nature.DOI:10.1038/news.2009.962 |
| Schloss P D, Westcott S L, Ryabin T, et al. 2009. Introducing mothur:Open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied & Environmental Microbiology, 75(23): 7537. |
| Shen L D, Liu S, Zhu Q, et al. 2014. Distribution and diversity of nitrite-dependent anaerobic methane-oxidising bacteria in the sediments of the Qiantang River[J]. Microbial Ecology, 67(2): 341–349.DOI:10.1007/s00248-013-0330-0 |
| 沈李东. 2015. 亚硝酸盐型甲烷厌氧氧化微生物特性研究进展[J]. 环境科学, 2015, 36(3): 1133–1140. |
| Tamura K, Peterson D, Peterson N, et al. 2011. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 28(10): 2731–2739.DOI:10.1093/molbev/msr121 |
| Wang C, Xiao S, Zhong H, et al. 2014. Methane formation and consumption processes in Xiangxi Bay of the Three Gorges Reservoir[J]. Scientific Reports, 4(3): 4449. |
| Wang Y, Huang P, Ye F, et al. 2016. Nitrite-dependent anaerobic methane oxidizing bacteria along the water level fluctuation zone of the Three Gorges Reservoir[J]. Applied Microbiology & Biotechnology, 100(4): 1977–1986. |
| Wang Y, Zhu G B, Harhangi H R, et al. 2012. Co-occurrence and distribution of nitrite-dependent anaerobic ammonium and methane-oxidizing bacteria in a paddy soil[J]. FEMS Microbiol Lett, 336(2): 79–88.DOI:10.1111/fml.2012.336.issue-2 |
| 王祥荣, 蒋勇. 2006. 长江三峡库区(重庆段)沿江景观生态研究[M]. 北京: 中国建筑工业出版社. |
| Zhang Q F, Lou Z P. 2011. The environmental changes and mitigation actions in the Three Gorges Reservoir region, China[J]. Environmental Science & Policy, 14(8): 1132–1138. |
| Zhu B L, van Dijk G, Fritz C, et al. 2012. Anaerobic oxidization of methane in a minerotrophic peatland:Enrichment of nitrite-dependent methane-oxidizing bacteria[J]. Applied & Environmental Microbiology, 78(24): 8657–8665. |
| Zhu G B, Zhou L L, Wang Y, et al. 2015. Biogeographical distribution of denitrifying anaerobic methane oxidizing bacteria in Chinese wetland ecosystems[J]. Environmental Microbiology Reports, 7(1): 128–138.DOI:10.1111/emi4.2015.7.issue-1 |
