 , 罗亚婷, 龙碧波, 刘青林, 施积炎
, 罗亚婷, 龙碧波, 刘青林, 施积炎

浙江大学, 环境与资源学院, 杭州 310058
收稿日期: 2017-12-31; 修回日期: 2018-01-29; 录用日期: 2018-01-29
基金项目: 国家自然科学基金(No.U1532103,41721001)
作者简介: 叶斌晖(1987-), 男, 博士, E-mail:yebinhui1101@163.com
通讯作者(责任作者): 施积炎, E-mail:shijiyan@zju.edu.cn
摘要: 铬渣无序堆存造成的铬污染土壤迫切需要修复治理.本文以新筛选的功能微生物草酸青霉SL2(Penicillium oxalicum SL2)为材料,以重度铬污染土壤为研究对象,进行生物淋洗技术优化,并利用软X射线扫描透射显微光谱技术(STXM)及同步辐射X射线近边吸收结构谱学(XANES)分析淋洗后的草酸青霉SL2胞内铬空间分布化学形态.结果表明:分步处理并进行水洗预处理可明显提高草酸青霉SL2对高浓度铬污染土壤的总铬TCr淋出率(49.4%),淋出液中Cr(Ⅵ)在3 d内全部被还原;生物淋洗后,草酸青霉SL2胞内吸收累积了Cr(Ⅵ),部分被还原为Cr(Ⅲ),两个价态的Cr在空间分布上具有一定的一致性;胞内铬形态主要为磷酸铬、草酸铬钾及半胱氨酸铬类化合物,其含量分别为46.9%、33.0%和20.1%.
关键词:草酸青霉SL2铬土壤生物淋洗形态转化
Research on bioleaching of soils contaminated by high concentration of chromium with Penicillium oxalicum SL2 and the intracellular speciation transformation of chromium
YE Binhui
 , LUO Yating, LONG Bibo, LIU Qinlin, SHI Jiyan
, LUO Yating, LONG Bibo, LIU Qinlin, SHI Jiyan

College of Environmental & Resources Sciences, Zhejiang University, Hangzhou 310058
Received 31 December 2017; received in revised from 29 January 2018; accepted 29 January 2018
Supported by the National Natural Science Foundation of China(No. U1532103, 41721001)
Biography: YE Binhui(1987—), male, Ph.D., yebinhui1101@163.com
*Corresponding author: SHI Jiyan, E-mail:shijiyan@zju.edu.cn
Abstract: Chromium contaminated soils caused by disorderly stockpiling of chromium slags need to be remediated immediately. In this study, a newly isolated strain of functional fungus, Penicillium oxalicum SL2, was used as bioleaching material, soils contaminated by high concentration of chromium were used as study object and the bioleaching process was optimized. Scanning transmission X-ray microscope (STXM) and synchrotron based X-ray absorption near edge structure (XANES) technology were conducted for the analyzing of Cr accumulation, spatial distribution and chemical speciation in the intracellular of fungi P. oxalicum SL2 after bioleaching. The results showed that the leaching rate (49.4%) of total chromium (TCr) in soils contaminated by high concentration of chromium was significantly improved by two-step processing and washing pretreatment with P. oxalicum SL2, and the concentration of Cr(Ⅵ) in the leachate was totally reduced in 3 d. After bioleaching, part of Cr(Ⅵ) was absorbed and some other part was reduced to Cr(Ⅲ), and spatial distribution of Cr(Ⅵ) and Cr(Ⅲ) was consistent to a certain degree. The results of XANES showed that the intracellular Cr mainly consisted of chromium phosphate, potassium chromium oxalated and cysteine chromium analogue compounds, whose the proportion was 46.9, 33.0 and 20.1%, respectively.
Key words: Penicillium oxalicum SL2chromiumsoilsbioleachingspeciation transformation
1 引言(Introduction)根据2016年11月我国环境保护部公布的“《重金属污染综合防治“十二五”规划》实施情况全面考核结果”, 全国15个省堆存半个世纪的670余万吨铬渣已全部处置完毕, 但国内仍有大量铬盐厂遗留铬污染场地, 铬渣长期堆存造成的土壤铬污染问题依然十分严峻, 对场地周边居民及生态环境安全构成严重威胁, 铬污染土壤的治理修复问题迫在眉睫(Chai et al., 2009).Cr元素在自然界中一般以Cr(Ⅵ)和Cr(Ⅲ)两种稳定的价态存在, 其中Cr(Ⅵ)易溶于水, 迁移能力极强, 且具有“三致性”, 而Cr(Ⅵ)水溶性低迁移能力弱, 易与有机物结合形成复合物沉淀, 且是葡萄糖、脂质和氨基酸代谢的必要微量元素, 毒性相对较低(Petrilli et al., 1977; Viti et al., 2014).因此, 将Cr(Ⅵ)还原为Cr(Ⅵ)是土壤铬污染治理的重要途径, 土壤中的铬形态转化研究具有重要意义.
微生物修复技术由于其具有污染物去除彻底、成本较低及环境友好等特点, 越来越受到青睐.自20世纪70年代首次发现P. dechromaticans能还原Cr(Ⅵ)以来(Romanenko et al., 1977), 研究者分离纯化了大量铬还原微生物(Dhal et al., 2013), 如苍白杆菌(Ochrobactrum anthropi)、丛植菌根真菌、复合真菌等都可有效还原Cr(Ⅵ)为Cr(Ⅵ), 但普遍耐受性较低, 还原效率不高(Cheng et al., 2010c; Wu et al., 2015; Sharma et al., 2016), 新型的高耐受及具有高效Cr(Ⅵ)还原能力的功能性微生物材料有待进一步开发.
另一方面, 土壤中的Cr(Ⅵ)在特定情况下, 如遇到强氧化性锰将会被氧化为Cr(Ⅵ) (谭文峰和刘凡, 2001), 因此对于铬污染土壤的微生物修复技术, 土壤中的总铬淋出率同样关键.如产黄青霉F1(Penicillium chrysogenum F1)、黑曲霉(Aspergillus niger)、烟曲霉(Aspergillus fumigatus)等, 对重金属具有一定耐受性并能分泌一定量的有机酸, 降低土壤淋洗体系中的pH值, 从而达到重金属淋出效果(Deng et al., 2013; Qu et al., 2013; Seh-Bardan et al., 2012).而铬渣污染土壤中的Cr(Ⅵ)往往浓度较高, 对微生物毒性较强, 相关的微生物淋洗研究相对较少(Chai et al., 2009; Qian et al., 2017).
课题组新筛选出一株具有高效Cr(Ⅵ)还原能力的真菌, 命名为草酸青霉SL2(Penicillium. Oxalicum SL2), 其Cr(Ⅵ)耐受能力为2000 mg·L-1(施积炎等, 2015), 与已报道的铬还原微生物相比具有明显优势(Kanmani et al., 2012), 并能分泌大量有机酸, 降低体系中pH值, 有利于土壤重金属的淋出.本文以草酸青霉SL2为微生物修复材料, 对高浓度铬污染土壤进行生物淋洗研究, 并利用软X射线扫描透射显微光谱技术(STXM)及X射线吸收近边结构技术(XANES)对生物淋洗后的草酸青霉SL2菌体内铬元素累积分布及形态转化进一步探索, 以期为重金属污染土壤的生物淋洗技术开发和利用提供数据支持.
2 材料与方法(Materials and methods)2.1 试验菌体所使用的菌种为新分离的丝状真菌, 经18S rDNA、26S rDNA和ITS序列比对分析, 鉴定为草酸青霉, 命名为草酸青霉SL2(Penicillium oxalicum SL2), 保存于中国典型培养物菌种保藏管理中心(CCTCC), 保存号为CCTCC M 2014505.所用PDA培养基配方为:200 g土豆削皮切块并煮沸30 min后, 8层纱布过滤, 滤液用蒸馏水补充至1000 mL, 加入20 g葡萄糖后搅拌充分溶解, 分装后在121 ℃高压灭菌30 min.固体培养基为上述PDA中每1000 mL再加入20 g琼脂.
2.2 供试土壤供试土壤采自某铬渣污染场地, 将土样风干后破碎, 20目过筛后备用.土壤pH采用电位法, 有机质检测方法为灼烧减量法, 含水率采用烘干法, 土壤阳离子交换量(CEC)采用乙酸钠-火焰光度法(鲁如坤, 2000).取部分土样过100目筛, 称重后并置于Teflon管内, 置于消解仪中进行三酸消解(DigiBlock EHD36, LabTech, USA), 定容稀释后采用电感耦合等离子体原子发射光谱法(ICP-AES)测定TCr、Cd、Pb、Zn等重金属浓度.Cr(Ⅵ)浓度使用二苯碳酰肼分光光度法进行检测(Long et al., 2013).
供试土壤pH为9.7呈碱性, 含水率为4.6%, 有机质含量为5.92%, CEC含量为19.2 cmol·kg-1.由于采样点所在地块未来土地使用类型为商服用地, 以浙江省《污染场地风险评估技术导则—2013》中的商服及工业用地筛选值作为参考标准.供试土壤中总铬(TCr)含量为24066.5 mg·kg-1, 是筛选值的9.6倍, Cr(Ⅵ)含量为10045.7 mg·kg-1, 是筛选值的20.1倍, Cr(Ⅵ)含量占TCr的41.7%, Cd、Pb、Zn等都未超过筛选值, 属于典型的高浓度铬染土壤.
表 1(Table 1)
| 表 1 供试土壤理化性质 Table 1 Physico-chemical properties of tested soils | ||||||||||||||||||
表 1 供试土壤理化性质 Table 1 Physico-chemical properties of tested soils
| ||||||||||||||||||
2.3 生物淋洗试验2.3.1 一步处理过20目筛后的土壤分装在250 mL的锥形瓶中, 121 ℃下灭菌30 min, 共3次, 每次间隔2 h, 灭菌后备用.草酸青霉SL2在PDA斜面中培养5 d后, 用无菌水20 mL及吐温20(0.05%)冲洗, 收集新鲜孢子悬浮液, 稀释成107个·mL-1后待用.250 mL三角瓶中加入灭菌后的PDA液体培养基99 mL, 灭菌后的土壤2.5 g(土水比, m:V = 2.5 g:100 mL), 直接加入孢子悬液1 mL, 置于30 ℃, 180 r·min-1下培养9 d.
2.3.2 分步处理250 mL三角瓶中加入PDA培养基99 mL及1 mL孢子悬浮液, 预培养48 h后, 将菌丝球移至含有铬污染土壤的新培养基中, 土水比及培养条件同上.一步处理与分步处理具体过程可见图 1.
图 1(Fig. 1)
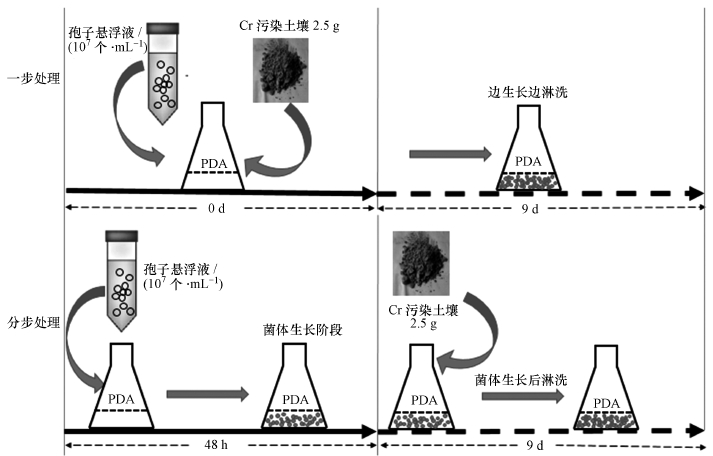 |
| 图 1 铬污染土壤一步处理及分步处理过程 Fig. 1Process of one step and two-step bioleaching of soils contaminated by chromium |
2.3.3 水洗预处理土水比1:10条件下180 r·min-1转速, 30 ℃下振荡60 min后取出, 并用去离子水冲洗3次, 每次6000 r·min-1下离心10 min, 去除上清液.然后, 土壤在60 ℃下烘干至恒重, 密封灭菌3次后备用.土水比同上, 并在分步处理条件下进行生物淋洗试验.
2.3.4 计算方法总铬TCr及Cr(Ⅵ)淋出率计算方法为:
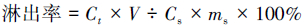 | (1) |
2.4 同步辐射技术2.4.1 软X射线扫描透射显微光谱(STXM)分析将锥形瓶中的菌丝球用镊子取出, 置于PBS中重悬, 3000 r·min-1下离心10 min后, 用双蒸水淋洗3次, 去除菌丝球表面土壤颗粒, 用含2.5%戊二醛的磷酸盐缓冲液(PBS, 0.1 mol·L-1, pH = 7)在4 ℃下固定过夜后, 将菌丝体用PBS重悬冲洗3次, 每次15 min, 再用含0.1%锇酸的PBS二次固定1 h, 然后用PBS冲洗3次, 每次15 min.固定后的样品依次用梯度乙醇溶液(30%、50%、70%、80%、90%、95%及100%)进行脱水, 每次15 min.两次固定和脱水后的菌丝体样品转移到纯丙酮中包埋20 min, 再转移到包埋剂及丙酮混合溶液中(V/V = 1/1), 室温下包埋1 h, 之后转移到包埋剂及丙酮混合溶液中(V/V =3/1), 室温下包埋3 h, 再把样品置于纯包埋剂中过夜, 最后将渗透处理的样品包埋,并在70 ℃下过夜得到包埋好的样品.使用切片机进行切片, 厚度为2000 nm, 置于镍网中待用.STXM成像在上海光源SSRF的BL08U1A线站中进行, 将镍网中的样品薄片粘于N4Si3窗上的3M胶带上, 在光镜下寻找到目标样品后, 对其进行双能分析.选择重铬酸钾和乙酸铬作为Cr(Ⅵ)和Cr(Ⅵ)的能量校准物质, 确定边前, 三价及六价的能量值分别为574.0、578.2及580.9 eV, 最后使用IDL 7.1软件进行处理分析.
2.4.2 X射线吸收近边结构(XANES)分析由于X-射线吸收近边结构(XANES)在元素结合形态原位分析中体现的精确性及敏感性, 被用于菌丝体胞内Cr形态分析.菌丝体收集后在-80 ℃下冷冻过夜, 冷冻干燥72 h后取出置于玛瑙研钵中, 添加液氮充分研磨, 过100目筛后压成直径10 mm薄片, 粘于3M胶带(Scotch 810, 3M, USA)上待测.Cr参比样品为:重铬酸钾(K2Cr2O7)、草酸铬钾(K3CrC6O12)、铬酸钙(CaCr2O7)、磷酸钙(CrPO4)、醋酸钙(CrC6H9O6)、三氧化二铬(Cr2O3)、硫化铬(Cr2S3)、硫酸铬(Cr2(SO4)3)、半胱氨酸铬(Cr-Cys)及组氨酸铬(Cr-His).菌丝体样品及Cr参比样品在上海同步辐射装置(SSRF)14W1线站检测, 储存环能量3.5 GeV, 最大环流300 mA.使用铬箔作为内参校准第一拐点能量(5989 eV), 利用透射模式检测标样图谱, 使用Lytle探测器在荧光模式下收集菌丝体样品Cr的K边图谱.所收集到的数据用Origin、Athena等软件进行数据处理及分析.
3 结果(Results)3.1 不同接种方式对草酸青霉SL2处理铬污染土壤的影响用草酸青霉SL2进行铬污染土壤生物淋洗的一步和分步处理过程中, pH值都明显下降(pH为3.5左右), 分步处理中的初始pH值较低(图 2), 可能是由于菌丝球中含有部分酸性液体.分步处理时, 体系中pH值下降较快, 可能更有利于菌丝体的生长及有机酸分泌.
图 2(Fig. 2)
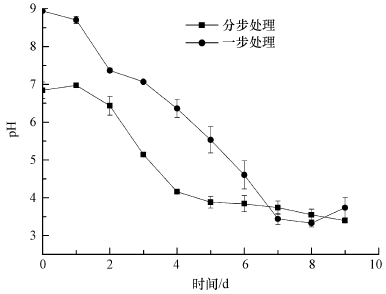 |
| 图 2 草酸青霉SL2对铬污染土壤分别进行一步处理和分步处理过程中的pH变化 Fig. 2pH changes during the bioleaching of soils contaminated by chromium with one step and two-step by P. oxalicum SL2 |
由图 3a可知, 在草酸青霉SL2作用下, 一步及分步生物淋洗过程中, 泥浆上清液中Cr(Ⅵ)浓度先上升后下降, 表明其土壤中Cr(Ⅵ)在24 h内其淋出率大于还原率, 24 h后Cr(Ⅵ)还原率逐步提高, 其浓度迅速下降, 在第4 d时基本被还原, 且分步处理的Cr(Ⅵ)还原效率较高.另外, 根据图 3b, 一步及分步处理组中的土壤TCr淋出率交替上升, 最后, 分步处理组的TCr淋出率更高(43.0%), 一步处理组中土壤TCr淋出率为36.4%, 这可能与分步处理的淋洗过程中pH值相对较低相关.
图 3(Fig. 3)
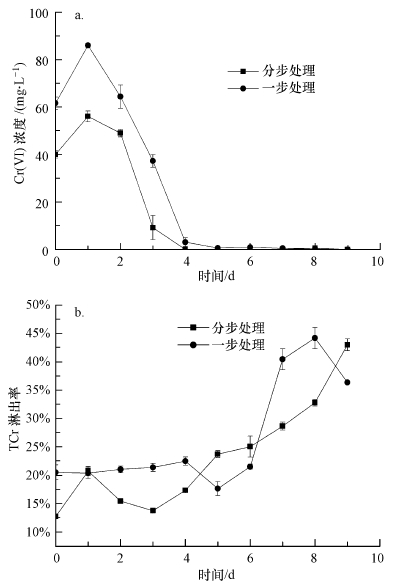 |
| 图 3 草酸青霉SL2对铬污染土壤一步处理和分步处理过程中Cr(Ⅵ)(a), TCr淋出率(b)变化 Fig. 3The leaching rate of Cr(Ⅵ) and TCr during the bioleaching of soils contaminated by chromium with one step and two steps by P. oxalicum SL2 |
3.2 水洗预处理对草酸青霉SL2处理铬污染土壤的影响由上可知, 分步处理可有效增加草酸青霉SL2生物淋洗效率, 以下试验在分步处理基础上验证水洗预处理的作用.如图 4所示, 水洗预处理与非水洗预处理的土壤生物淋洗过程中, pH值均在第9 d降至3.5左右, 2~4 d的pH值下降速率较快, 4~9 d的pH值缓慢下降.表明水洗预处理对生物淋洗过程中的pH值影响较小.
图 4(Fig. 4)
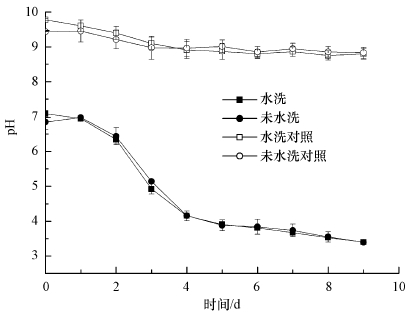 |
| 图 4 水洗预处理对草酸青霉SL2生物淋洗铬污染土壤过程中pH的影响 Fig. 4The change of pH value during the bioleaching of Cr(Ⅵ) contaminated soils with or without water pretreatment by P. oxalicum SL2 |
如图 5a所示, 水洗预处理的泥浆上清液中Cr(Ⅵ)浓度先上升后下降, 到第3 d基本为0 mg·L-1, 未水洗预处理组的Cr(Ⅵ)初始浓度较高, 在第4 d降至0 mg·L-1, 且两个处理的泥浆上清液中Cr(Ⅵ)浓度在4~9 d内稳定保持在检测限以下, 对应的对照组Cr(Ⅵ)随时间缓慢升高, 未水洗对照中Cr(Ⅵ)浓度为99.5 mg·L-1, 水洗对照为57.7 mg·L-1.另一方面, 水洗预处理中的TCr淋出率在第9 d达到49.4%(包括水洗淋出的TCr (6.2 ± 0.3) mg), 未水洗处理则为43.0%.
图 5(Fig. 5)
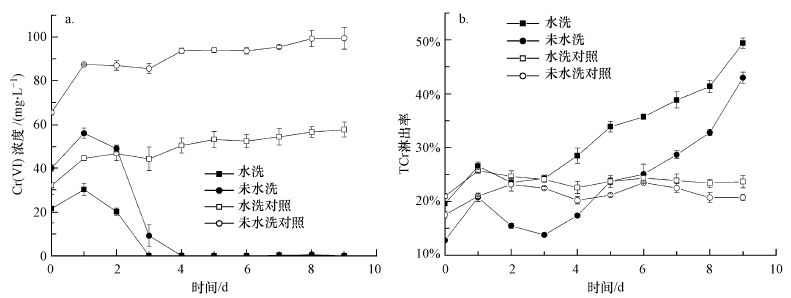 |
| 图 5 水洗预处理对草酸青霉SL2生物淋洗铬污染土壤过程中淋滤液中Cr(Ⅵ)浓度(a)及TCr淋出率(b)的影响 Fig. 5The concentration of Cr(Ⅵ) and TCr in leachate during the bioleaching of soils contaminated by chromium with or without water pretreatment by P. oxalicum SL2 |
3.3 草酸青霉SL2处理铬污染土壤后菌体内的铬累积分布根据基于同步辐射的STXM技术(图 6)可知, 草酸青霉SL2经过高浓度铬污染土壤的生物淋洗后, 其胞内吸收并累计了少量Cr(Ⅵ), 部分已转化为Cr(Ⅵ).Cr(Ⅵ)在菌体内的分布相对较广, 部分区域浓度较高, 而Cr(Ⅵ)分布较少, 推测草酸青霉SL2对进入胞内的Cr(Ⅵ)具有一定的还原能力.
图 6(Fig. 6)
 |
| 图 6 草酸青霉SL2对Cr(Ⅵ)污染土壤进行生物淋洗后菌体内Cr(Ⅵ)(a)、Cr(Ⅵ)(b)的累积分布 Fig. 6The accumulation and distribution of Cr(Ⅵ) (a) and Cr(Ⅵ) (b) in fungi mycelium after the bioleaching of Cr(Ⅵ) contaminated soils by P. oxalicum SL2 |
3.4 草酸青霉SL2处理铬污染土壤后菌体内Cr形态转化情况根据基于同步辐射的XANES技术, 对经过高浓度铬污染土壤生物淋洗的草酸青霉SL2菌丝体进行Cr元素K边图谱采集及综合线性拟合分析(图 7), 拟合优度因子R-factor为0.002278.结果显示, 菌体内的Cr主要以Cr(Ⅵ)形式存在, 推测Cr主要形态为与磷酸铬、草酸铬钾及半胱氨酸铬相似的化合物, 含量分别为46.9%、33.0%和20.1%左右.
图 7(Fig. 7)
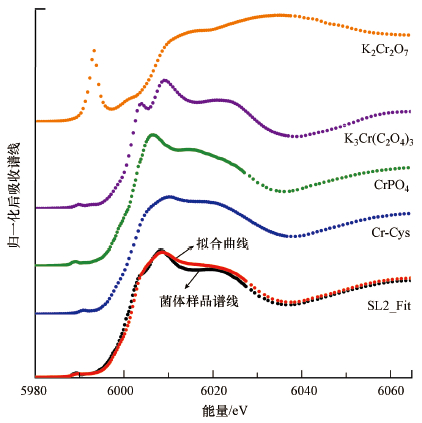 |
| 图 7 草酸青霉SL2生物淋洗后菌体内Cr元素K边XANES图谱线性综合拟合分析 (标样依次为重铬酸钾、草酸铬钾、磷酸铬、半胱氨酸铬) Fig. 7Linear combination analysis of chromium K-edge XANES spectra of P. oxalicum SL2 mycelium after bioleaching (Reference samples are as follows: K2Cr2O7, K3Cr(C2O4)3, Cr-Cysteine) |
4 讨论(Discussion)目前, 微生物修复技术由于其环境友好、去除较彻底及成本较低等特点, 功能微生物材料已被广泛用于重金属污染土壤及其它固废的生物淋洗研究(Zeng et al., 2016; Deng et al., 2013; Qu and Lian. 2013).接种方式、土水比、温度、水洗预处理等都会对生物淋洗效果产生影响, 如崔雨琪等(2014)对黑曲霉(Aspergillus niger Y9)的研究发现, 相比于一步处理, 分步处理15 d后可使土壤中Zn、Cd、Pb的淋出率分别提高17.2%、16.3%及126%, 类似的结果在Qu and Lian (2013)的研究中也有体现.本研究中, 草酸青霉SL2的分步淋洗处理土壤中TCr的淋出率相比于一步处理, 其提高了6.3%.这可能是由于分步处理后菌体的重金属耐受性提高, 生物量增长, 并使得有机酸分泌量增加从而进一步降低了泥浆体系中的pH值, 促进土壤中TCr的淋出.此外, 草酸青霉SL2对铬污染土壤的生物淋洗过程中, 泥浆中Cr(Ⅵ)浓度被迅速降低(图 3b), 结合图 3a中TCr的不断升高, 而Cr元素在环境中一般以三价和六价为稳定价态(Fukai, 1967), 可知其中的Cr(Ⅵ)应是被还原为Cr(Ⅵ).体系中Cr(Ⅵ)的充分还原可显著降低其生物毒性及迁移性(Wu et al., 2016), 使其更适应菌体的生长繁殖, 形成良好的生物淋洗循环, 造成Cr(Ⅵ)快速还原的机理有可能是胞外还原性有机酸草酸的分泌, 也可能是葡萄糖氧化酶等Cr(Ⅵ)还原相关酶的作用(Romo-Rodríguez et al., 2015).
另一方面, 水洗预处理可有效提取土壤中水溶态碱金属氯化物(NaCl、KCl及CaCl2等)和部分Cr(Ⅵ), 可降低土壤中有害物质, 减少其对菌体的毒害作用, 更有利于生物淋洗的运行.如Wang等(2009)的研究显示, 利用黑曲霉(Aspergillus niger)进行固废焚烧粉煤灰的生物淋洗中, 水洗预处理可有效降低菌体淋洗的迟滞期, 达到快速繁育, 增加有机酸分泌量, 快速降低pH, 从而提高生物淋洗效果的目的.在本研究中, 水洗预处理未显著降低土壤中pH值, 但TCr淋出率有所增加, 达到了49.4%, 这可能是由于有机酸的分泌种类发生变化造成的(Wang et al., 2009).
可见, 草酸青霉SL2具备一定的Cr(Ⅵ)耐性及还原能力, 具有应用于铬污染土壤生物淋洗的潜力, 深入了解其Cr(Ⅵ)还原解毒机制将有利于指导其生物淋洗修复技术.众所周知, Cr(Ⅵ)的生物毒性远高于Cr(Ⅵ), 因为Cr一般以Cr(Ⅵ)形态从胞膜中的硫酸盐通道进入胞内从而被吸收, 而Cr(Ⅵ)则不能通过胞膜(Viti et al., 2014).Wu等(2016)的STXM研究显示, 其Cr元素的两种价态主要分布在丛植菌根胞外的EPS中, 小部分被吸收入胞内, 表明其解毒机制以胞外Cr(Ⅵ)的吸附及还原为主(Park et al., 2006).在本文中, 草酸青霉SL2进行铬污染土壤生物淋洗(9 d)后, 对菌体进行STXM成像及双能分析, 发现胞内Cr元素含量较少, 但Cr(Ⅵ)及Cr(Ⅵ)在胞内的空间分布具有一定的一致性, 主要富集于菌丝体内, 且部分还原为Cr(Ⅵ)并可能发生胞内转运.
最后, 以铬污染土壤生物淋洗后的草酸青霉SL2菌体为研究对象, 对其胞内Cr形态进行原位检测分析.XANES分析结果显示, 草酸青霉SL2胞内Cr赋存形态主要以磷酸铬、草酸铬钾及半胱氨酸铬为主(图 7).自然界中的真菌通常会分泌如草酸、柠檬酸等小分子有机酸, 对于重金属元素的形态及生物地球化学循环等具有重要作用(Gadd, 1999).土曲霉(Aspergillus terreus)可将CaCO3转化为CaC2O4晶体(Pinzari et al., 2010);白僵菌(Beauveria caledonica)则能将Zn3(PO4)2转化为ZnC2O4.不溶于水的草酸盐晶体的形成可显著降低重金属元素的移动性及生物毒性, 这可能同样是草酸青霉SL2的解毒作用机制之一(Wu et al., 2010).此外, 一些阴离子组分(磷酸盐、碳酸盐)同样对真菌的重金属形态转化具有重要作用(Liang et al., 2016; Li et al., 2014).拟青霉(Paecilomyces javanicus)(Rhee et al., 2014; Liang et al., 2016)及黑曲霉(Aspergillus niger)(Li et al., 2016)可在有机磷水解作用介导下生成稳定的磷氯铅矿(Pb5(PO4)3Cl)或氟代磷氯铅矿(Pb5(PO4)3F), 丛植菌根暴露在低浓度Cr(Ⅵ)环境下在胞外形成磷酸铬(> 60%)等(Wu et al., 2016).最后, 半胱氨酸含活泼的巯基是谷胱甘肽的前体之一, 具有重金属解毒作用.本文中发现草酸青霉SL2胞内含半胱氨酸铬, 推测其Cr(Ⅵ)解毒机制可能和GSH系统相关, 如Lin等(1993)研究发现酿酒酵母(Saccharomyces cerevisiae)中的Cu-GSH复合物, Wu等(2016)的研究中发现胞内含有少量组氨酸铬, 关于真菌重金属生物修复过程中发现谷胱甘肽、半胱氨酸及组氨酸等重金属络合物的研究较少.值得注意的是, STXM的结果显示胞内存在Cr(Ⅵ), 而XANES分析则未发现Cr(Ⅵ), 这可能有以下几个原因:①样品前处理不同, STXM中分析的样品经过固定、脱水、包埋并切片, 直接观察菌体内部Cr累积分布, 而XANES则是通过冷干、研磨、过筛及压片;② STXM与XANES技术对Cr的两个价态的辨识信号识别能力存在差异;③XAFS和STXM的光斑大小和能量都不同, 可能会造成Cr的价态具有差异;④STXM检测的是菌丝球中单个菌丝体中的部分截面中Cr的形态分布, 而XAFS为多个菌丝球冷干压片制成, Cr在菌丝体中的形态分布可能具有一定的异质性.
5 结论(Conclusions)1) 分步淋洗可提高草酸青霉SL2对高浓度铬污染土壤的生物淋洗效率, 更有利于pH值下降, TCr淋出率达到43.0%, 淋出液中Cr(Ⅵ)在第4 d被全部还原.
2) 分步淋洗条件下, 进行水洗预处理对pH值影响不大, 但可明显提高草酸青霉SL2对土壤中的TCr淋出率, 达到49.4%, 淋出液中Cr(Ⅵ)在第3 d被全部还原.
3) 草酸青霉SL2对高浓度铬污染土壤进行生物淋洗后, 通过STXM检测到胞内含有少量Cr(Ⅵ)及Cr(Ⅵ), 两个价态的Cr元素在胞内的空间分布具有一定的一致性, 胞内Cr(Ⅵ)可被还原为Cr(Ⅵ);通过XANES分析, 判断Cr主要形态为与磷酸铬、草酸铬钾及半胱氨酸铬相似的化合物, 含量分别为46.9%、33.0%和20.1%左右, 推测草酸青霉SL2对Cr(Ⅵ)的耐性及还原和菌体磷元素、有机酸及半胱氨酸的代谢密切相关.
参考文献
| Chai L Y, Huang S H, Yang Z H, et al. 2009. Cr (Ⅵ) remediation by indigenous bacteria in soils contaminated by chromium-containing slag[J]. Journal of Hazardous Materials, 167(1/3): 516–522. |
| 崔雨琪, 方迪, 毕文龙, 等. 2014. 一株黑曲霉的分离鉴定及其对土壤重金属的生物淋出效果[J]. 应用与环境生物学报, 2014, 20(3): 420–425. |
| Cheng Y J, Yan F B, Huang F, et al. 2010. Bioremediation of Cr(Ⅵ) and immobilization as Cr(Ⅲ) by Ochrobactrum anthropi[J]. Environmental Science & Technology, 44(16): 6357–6363. |
| Deng X H, Chai L Y, Yang Z H, et al. 2013. Bioleaching mechanism of heavy metals in the mixture of contaminated soil and slag by using indigenous Penicillium chrysogenum, strain F1[J]. Journal of Hazardous Materials, 248-249(1): 107–114. |
| Dhal B, Thatoi H N, Das N N, et al. 2013. Chemical and microbial remediation of hexavalent chromium from contaminated soil and mining/metallurgical solid waste:a review[J]. Journal of Hazardous Materials, s250-251(30): 272–291. |
| Fukai R. 1967. Valency state of chromium in seawater[J]. Nature, 213(5079): 901. |
| Gadd G M. 1999. Fungal production of citric and oxalic acid:Importance in metal speciation, physiology and biogeochemical processes[J]. Advances in Microbial Physiology, 41: 47–92.DOI:10.1016/S0065-2911(08)60165-4 |
| Kanmani P, Aravind J, Preston D. 2012. Remediation of chromium contaminants using bacteria[J]. International Journal of Environmental Science and Technology, 9(1): 183–193.DOI:10.1007/s13762-011-0013-7 |
| Li Z, Wang F, Bai T, et al. 2016. Lead immobilization by geological fluorapatite and fungus Aspergillus niger[J]. Journal of Hazardous Materials, 320: 386–392.DOI:10.1016/j.jhazmat.2016.08.051 |
| Liang X, Kierans M, Ceci A, et al. 2016. Phosphatase-mediated bioprecipitation of lead by soil fungi[J]. Environmental Microbiology, 18(1): 219–231.DOI:10.1111/emi.2016.18.issue-1 |
| Lin C M, Crawford B F, Kosman D J. 1993. Distribution of 64Cu in Saccharomyces cerevisiae:cellular locale and metabolism[J]. Journal of General Microbiology, 139(7): 1605–1615.DOI:10.1099/00221287-139-7-1605 |
| Long D Y, Tang X J, Cai K, et al. 2013. Cr(Ⅵ) resistance and removal by indigenous bacteria isolated from chromium-contaminated soil[J]. Journal of Microbiology and Biotechnology, 23(8): 1123–1132.DOI:10.4014/jmb |
| 鲁如坤. 2000. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社. |
| Park D, Yun Y S, Park J M. 2006. Comment on the removal mechanism of hexavalent chromium by biomaterials or biomaterial-based activated carbons[J]. Industrial & Engineering Chemistry Research, 45(7): 2405–2407. |
| Petrilli F L, Flora S D. 1977. Toxicity and mutagenicity of hexavalent chromium on salmonella-typhimurium[J]. Applied and Environmental Microbiology, 33(4): 805–809. |
| Pinzari F, Zotti M, Mico A D, et al. 2010. Biodegradation of inorganic components in paper documents:Formation of calcium oxalate crystals as a consequence of Aspergillus terreus Thom growth[J]. International Biodeterioration & Biodegradation, 64(6): 499–505. |
| Qian X Y, Fang C L, Huang M S, et al. 2017. Characterization of fungal-mediated carbonate precipitation in the biomineralization of chromate and lead from an aqueous solution and soil[J]. Journal of Cleaner Production, 164: 198–208.DOI:10.1016/j.jclepro.2017.06.195 |
| Qu Y, Lian B. 2013. Bioleaching of rare earth and radioactive elements from red mud using Penicillium tricolor RM-10[J]. Bioresource Technology, 136(3): 16–23. |
| Qu Y, Lian B, Mo B B, et al. 2013. Bioleaching of heavy metals from red mud using Aspergillus niger[J]. Hydrometallurgy, 136(1): 71–77. |
| Rhee Y J, Hillier S, Pendlowski H, et al. 2014. Fungal transformation of metallic lead to pyromorphite in liquid medium[J]. Chemosphere, 113(113): 17–21. |
| Romanenko V I, Koren'Kov V N. 1977. Pure culture of bacteria using chromates and bichromates as hydrogen acceptors during development under anaerobic conditions[J]. Mikrobiologiia, 46(3): 414–417. |
| Romo-rodríguez P, Acevedoaguilar F J, Lopeztorres A, et al. 2015. Cr(Ⅵ) reduction by gluconolactone and hydrogen peroxide, the reaction products of fungal glucose oxidase:Cooperative interaction with organic acids in the biotransformation of Cr(Ⅵ)[J]. Chemosphere, 134: 563–570.DOI:10.1016/j.chemosphere.2014.12.009 |
| Seh-Bardan B J, Othman R, Wahid S A, et al. 2012. Column Bioleaching of arsenic and heavy metals from gold mine tailings by Aspergillus fumigatus[J]. Clean-Soil Air Water, 40(6): 607–614.DOI:10.1002/clen.v40.6 |
| Sharma S, Malaviya P. 2016. Bioremediation of tannery wastewater by chromium resistant novel fungal consortium[J]. Ecological Engineering, 91: 419–425.DOI:10.1016/j.ecoleng.2016.03.005 |
| 谭文峰, 刘凡. 2001. 几种土壤铁锰结核对Cr(Ⅲ)的氧化特性(Ⅰ)-氧化锰矿物类型与吸附离子的影响[J]. 环境科学学报, 2001, 21(5): 592–596. |
| 施积炎, 龙碧波, 何俊昱, 等. 还原六价铬的草酸青霉及其筛选方法: CN 104560738 A[P]. 2015 |
| Viti C, Marchi E, Decorosi F, et al. 2014. Molecular mechanisms of Cr(Ⅵ) resistance in bacteria and fungi[J]. Fems Microbiology Reviews, 38(4): 633–659.DOI:10.1111/1574-6976.12051 |
| Wang Q H, Yang J, Wang Q, et al. 2009. Effects of water-washing pretreatment on bioleaching of heavy metals from municipal solid waste incinerator fly ash[J]. Journal of Hazardous Materials, 162(2/3): 812–818. |
| Wu S L, Zhang X, Sun Y Q, et al. 2015. Transformation and immobilization of chromium by arbuscular mycorrhizal fungi as revealed by SEM-EDS, TEM-EDS and XAFS[J]. Environmental Science & Technology, 49(24): 14036–14047. |
| Wu S L, Zhang X, Sun Y Q, et al. 2016. Chromium immobilization by extra-and intraradical fungal structures of arbuscular mycorrhizal symbioses[J]. Journal of Hazardous Materials, 316: 34–42.DOI:10.1016/j.jhazmat.2016.05.017 |
| Zeng J, Gou M, Tang Y Q, et al. 2016. Effective bioleaching of chromium in tannery sludge with an enriched sulfur-oxidizing bacterial community[J]. Bioresource Technology, 218: 859–866.DOI:10.1016/j.biortech.2016.07.051 |
