 , 黄娴1, 晏彩霞1,2
, 黄娴1, 晏彩霞1,2
 , 杨毅2,3, 周俊良2, 刘敏3
, 杨毅2,3, 周俊良2, 刘敏31. 江西师范大学地理与环境学院, 鄱阳湖湿地与流域研究教育部重点实验室, 南昌 330022;
2. 华东师范大学河口海岸学国家重点实验室, 上海 200062;
3. 华东师范大学地理科学学院, 教育部地理信息科学重点实验室, 上海 200241
收稿日期: 2018-01-25; 修回日期: 2018-03-16; 录用日期: 2018-03-16
基金项目: 国家自然科学基金(No.41601523,41601521);江西省自然科学基金(No.20161BAB213079,20161BAB213077);鄱阳湖湿地与流域研究教育部重点实验室开放基金(No.PK2016006);江西省教育厅科技计划项目(No.GJJ150307,GJJ160320);江西师范大学博士启动基金
作者简介: 聂明华(1986—), 男, E-mail: brightchina@163.com
通讯作者(责任作者): 晏彩霞(1986—), 女, 博士, 副教授, 研究领域为环境地球化学, 发表学术论文20余篇. E-mail: wysycx@foxmail.com
摘要: 利用三维荧光光谱法(3D-EEM)结合平行因子分析(PARAFAC)和自组织神经网络分析(SOM),解析了不同来源水体中不同粒径胶体的荧光特性,同时与挑峰法进行比较,以期寻找一种更好的分析天然胶体来源、粒径、荧光特性间关系的方法.基于PARAFAC模型,研究区水体中不同粒径胶体共解析出2个类腐殖质荧光峰(C1和C3)及3个类蛋白荧光峰(C2、C4和C5).其中,300 kDa~1 μm分级胶体荧光强度最高,C1、C2、C3组分的荧光强度随粒径增大而增强,C4、C5组分的荧光强度随粒径增大而减弱.不同来源胶体(生活污水:进水和出水;农业污水:大盈和天恩桥;天然水体:吴淞口)的荧光强度变化大致规律为:吴淞口 > 进水 > 大盈 > 天恩桥 > 出水.SOM分析结果与PARAFAC一致,且可视化程度更高,但EEM-SOM模型存在输入变量多、兼具挑峰法缺点的问题.而PARAFAC-SOM模型不仅兼具了前两者的优点,还具有输入变量少、运行时间短、可靠性高等优点.同时,该模型还成功应用于胶体其他理化参数的分析(Parameters-SOM模型),使得前期工作结果系统性更强、更直观.因此,PARAFAC-SOM模型是相对较好的分析天然胶体来源、粒径、荧光特性间关系的方法.
关键词:胶体粒径分级三维荧光光谱平行因子分析自组织神经网络分析
Fluorescence characterization of fractionated colloids in different sources of waters based on PARAFAC and SOM
NIE Minghua1
 , HUANG Xian1, YAN Caixia1,2
, HUANG Xian1, YAN Caixia1,2
 , YANG Yi2,3, ZHOU Junliang2, LIU Min3
, YANG Yi2,3, ZHOU Junliang2, LIU Min3 1. Key Laboratory of Poyang Lake Wetland and Watershed Research, Ministry of Education, School of Geography and Environment, Jiangxi Normal University, Nanchang 330022;
2. State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062;
3. Key Laboratory of Geographic Information Science of the Ministry of Education, School of Geographical Sciences, East China Normal University, Shanghai 200241
Received 25 January 2018; received in revised from 16 March 2018; accepted 16 March 2018
Supported by the National Natural Science Foundation of China (No.41601523, 41601521), the Natural Science Foundation of Jiangxi(No.20161BAB213079, 20161BAB213077), the Opening Fund of Key Laboratory of Poyang Lake Wetland and Watershed Research (Jiangxi Normal University), Ministry of Education (No.PK2016006), the Foundation of Jiangxi Educational Committee (No.GJJ150307, GJJ160320) and the Doctoral Scientific Research Foundation of Jiangxi Normal University
Biography: NIE Minghua (1986—), male, E-mail: brightchina@163.com
*Corresponding author: YAN Caixia, E-mail: wysycx@foxmail.com
Abstract: Fluorescence characterization of fractionated colloids in different sources of waters is investigated using excitation emission matrix fluorescence spectroscopy (3D-EEM) based on parallel factor analysis (PARAFAC) and self-organizing map (SOM). Meanwhile, the results in the present study are compared to those in the previous study which were analyzed based on the peak-picking method. This study aims to evaluate the different approaches including PARAFAC, SOM and combined PARAFAC and SOM to investigate the size-dependent fluorescence properties of colloids from different sources. PARAFAC identified two humic-like fluorophores (i.e. C1 and C3) and three protein-like fluorophores (i.e. C2, C4 and C5). Thereinto, the fluorescence intensity of C1, C2, and C3 increases with the increased colloidal size; for C4 and C5, the fluorescence intensity decreases. The highest fluorescence intensity is generally present in the 300 kDa~1 μm fraction. The fluorescence intensity of bulk waters from the different sources including domestic wastewaters (Influent and Effluent), agricultural wastewaters (Daying and Tianenqiao) and the pristine natural river (Wusongkou) is decreased as the following order:Wusongkou > Influent > Daying > Tianenqiao > Effluent. The results in SOM model are agreed with those in PARAFAC model, but with a higher visualization. Furthermore, EEM-SOM model needs more input variables and has the same problem as those of peak-picking method. PARAFAC-SOM model not only has the advantages of PARAFAC and EEM-SOM model, but also has advantages on fewer input variables, shorter running time, and higher reliability. In addition, PARAFAC-SOM model was successfully applied to analyze the physicochemical properties of colloids (i.e. Parameters-SOM model). Parameters-SOM model makes the results in the previous study more systematic and visual. Therefore, PARAFAC-SOM model is the best approach to visualize the relationship between colloidal size and the fluorescence properties from different sources.
Keywords: colloidsfractionation3D-EEMPARAFACSOM
1 引言(Introduction)天然胶体(Colloids)是指至少一维尺寸为1 nm~1 μm的微颗粒, 其物质组成复杂, 通常由多相混合的无机和有机物质组成(Lead et al., 2006; Wilkinson et al., 2007).无机胶体主要为金属盐类、粘土等, 而有机胶体包括小分子有机物(如腐殖酸、富里酸)和生物聚合物(如胞外聚合物)等大分子物质(Worms et al., 2010).由于有机胶体表面有较多的活性官能团及特殊的大分子内部结构, 其对环境中重金属、药物等污染物的环境行为具有重要影响(Worms et al., 2010; Yan et al., 2015).研究表明, 荧光特性是控制这一过程的重要因子.以药物为例, 对于吸附方面, 胶体荧光强度越高其所吸附的药物污染物越多(Yan et al., 2015);对于光降解方面, 腐殖质含量的增加可以促进对乙酰氨基酚及卡马西平的直接光降解(Carlos et al., 2012); 并且胶体荧光特性还因其粒径的不同而不同(Guéguen et al., 2011).但目前有关胶体粒径与其荧光特性间关系的研究还不多, 加上分析方法和检测技术的差异, 一些相互矛盾的研究结果在不同报道中时有出现.比如, 通常0.5~2 kDa主要为富里酸, 2~5 kDa主要是腐殖酸(Thurman, 2012; Huguet et al., 2010), 但有研究在13~150 kDa粒径中也发现了类腐殖质物质(Boehme et al., 2006).因此, 亟需开展不同来源水体、不同粒径胶体的荧光特性研究.
三维激发发射荧光光谱矩阵(3D-EEM)结合“挑峰法(Peak Picking Method)”是目前较多的用来分析胶体荧光物质组成的方法之一(McKnight et al., 2001; Maie et al., 2007), 笔者前期工作中也主要使用该方法(聂明华等, 2017).但挑峰法主要依靠荧光团的峰值所对应的激发、发射波长对, 因而有时会丢失一部分重叠区域的信息.因此, 其他更精确的分析方法逐渐流行起来, 比如荧光区域分析(FRI)(Chen et al., 2003)、平行因子分析(PARAFAC)(Guéguen et al., 2011)、自组织神经网络分析(SOM)(Bieroza et al., 2009)及多种分析方法的组合(如PARAFAC & SOM的结合)(Cuss et al., 2015)等.在众多分析方法中, PARAFAC & SOM的结合应用具有变量降维、省时、可视化效果好、可信度高等优点(聂泽宇, 2017).值得注意的是, 这些研究大多是基于胶体整体的荧光特性, 而对不同粒径天然胶体的研究还非常少, 并且不同粒径胶体对污染物的环境行为亦不同(Zheng et al., 2009; Chen et al., 2010).因此, 为了更好地了解不同粒径胶体对污染物迁移行为的影响, 利用不同技术及分析方法表征不同粒径胶体荧光特性的研究亟待展开.
本研究拟选取生活污水、农业污水、天然水体3种不同来源的水样作为水中胶体来源, 采用切向超滤技术(CFUF)及3D-EEM结合的分析技术, 利用PARAFAC、SOM及PARAFAC & SOM相结合的分析方法, 研究不同粒径胶体的荧光光谱特性, 同时对比作者在前期工作中利用挑峰法所得到的相关结果(聂明华等, 2017), 以期获得更好的分析天然胶体来源、粒径、荧光特性间关系的方法, 从而为研究胶体及其对水环境中污染物的归趋作用提供数据支持.
2 材料与方法(Materials and methods)2.1 样品采集、分离及分析于2013年1、4月分别采集污水处理厂污水(进水、出水)、养殖区污水(大盈和天恩桥)及天然水体(吴淞口), 采样点分布如图 1所示.养殖区污水及天然水体采自表层水样(0.5 m内), 污水厂进出水分别采自污水厂进出口处.将带回的水样立即用孔径为1 μm的玻璃纤维滤膜(PAUL, USA)进行过滤,同时, 立即将过滤完的水样利用CFUF(Pellicon System, Millipore)进行胶体分离.借助不同截留孔径的超滤膜(regenerated Cellulose, Pellicon 2 PLAC, Millipore), 包括300、10、5、1 kDa(1 kDa=1000 Dalton), 将过滤水(< 1 μm)分离为300 kDa~1 μm、10~300 kDa、5~10 kDa和1~5 kDa的胶体浓缩液.水样信息、胶体质量浓度(CC)、胶体态有机碳质量浓度(COC)、3D-EEM仪器测试方法等请参照课题组前期工作(聂明华等, 2017).
图 1(Fig. 1)
 |
| 图 1 采样点分布图 Fig. 1Distribution of the sampling sites |
2.2 数据分析与处理挑峰法(类蛋白荧光峰:峰D和峰T, 类腐殖质荧光峰:峰A和峰C)及荧光指数(FI值、腐殖化指数HIX、自生源指数BIX)的判别和分析方法分别参照Coble(1996)及Huguet等(2009; 2010)研究所述方法, 详细信息参照课题组前期工作(聂明华等, 2017).在进行PARAFAC及SOM分析前, 利用Matlab 2010a软件, 根据Zepp等(2004)所述方法进行主要拉曼峰、瑞利峰散射校正.所有样品在测试前通过稀释的方法以去除内滤效应对分析结果的影响.校正后的数据不仅去除散射峰的干扰, 同时亦有利于PARAFAC及SOM结果的对比.
PARAFAC采用Matlab 2010a软件中的DOMFluor工具箱对所有水样的3D-EEM数据进行模拟分析并验证(Stedmon et al., 2008).分析过程中天恩桥300 kDa~1 μm分级胶体浓缩液数据作为异常值扣除.模型最终组分个数由最小平方和误差决定, 本研究中5组分数最合理.结果的可靠性通过折半分析及残差、载荷分析来保证.平行因子组分的浓度采用荧光峰最高处的荧光强度(Fmax)来表示.
SOM的构建根据Bieroza等(2012)的方法并基于Matlab 2010a的SOM工具箱(2.0版本)进行(http://www.cis.hut.fi/projects/somtoolbox/).SOM运算理论详见文献(Kohonen, 2001; 2012).为了对比SOM及PARAFAC & SOM结合对分析结果的影响, 分别建立两种SOM模型:①基于3D-EEM的SOM模型(EEM-SOM模型), 模型数据由20个样品数×4087个变量(61×67个PEx-Em变量)组成;②基于PARAFAC的SOM模型(PARAFAC-SOM模型), 模型数据由19个样品数×5个PARAFAC组分组成(天恩桥300 kDa~1 μm分级胶体浓缩液数据作为异常值扣除).同时, 利用PARAFAC-SOM模型原理, 建立了基于胶体理化参数的Parameters-SOM模型, 模型数据由20个样品数×9个胶体理化参数组成(包括CC、COC、FI、HIX、BIX、峰D、峰T、峰A、峰C).所有数据均事先经标准化处理(方差为1, 均值为0)以去除浓度效应对分析的影响(Boehme et al., 2004; Bieroza et al., 2009).SOM输出结果由训练得出的量化误差(QE)、拓扑图形误差(TE)决定.EEM-SOM模型、PARAFAC-SOM模型、Parameters-SOM模型的QE和TE值分别为23.017和0.000、0.546和0.000、1.006和0.000, 3个模型最终优化的SOM神经元数量分别为24个(4×6)、20个(4×5)、24个(4×6).
3 结果与讨论(Results and discussion)3.1 平行因子分析(PARAFAC)3.1.1 不同来源及粒径胶体荧光组分分析通过PARAFAC, 本研究中共解析出5个荧光尖峰和2个肩峰(图 2).参照文献可知(Coble, 1996; 傅平青等, 2004; Huguet et al., 2009; 冯伟莹等, 2016), C1和C3为类富里酸荧光组分(C1:λEx/λEm=380 nm /400 nm; C3: λEx/λEm=340 nm/450 nm), C3肩峰为类腐殖酸荧光组分(λEx/λEm=260 nm/450 nm), C2和C4肩峰为类色氨酸荧光组分(C2: λEx/λEm=340 nm/350 nm; C4肩峰: λEx/λEm=290 nm /360 nm), C4和C5为类络氨酸荧光组分(C4: λEx/λEm=240 nm/360 nm; C5: λEx/λEm= 280 nm/330 nm).对比前期工作(聂明华等, 2017)可知, C3(包含肩峰)、C4(包含肩峰)、C5组分已能够覆盖挑峰法中所有的荧光团, 而C1和C2组分则隐藏在散射峰中.虽然前期工作在挑峰法分析前已利用同步测定的超纯水荧光数据进行了校正, 但仍然有较强的散射峰干扰(详见前期工作(聂明华等, 2017)中的图 3), 因此, 利用挑峰法无法将散射峰干扰下的荧光组分解析出来, 而PARAFAC模型能够较好地解决这一问题.
图 2(Fig. 2)
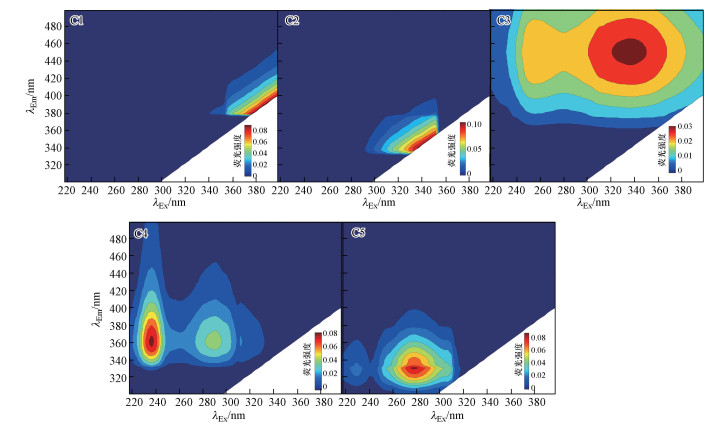 |
| 图 2 不同粒径胶体中5个荧光组分的3D-EEM Fig. 23D-EEM of the five components from PARAFAC |
图 3(Fig. 3)
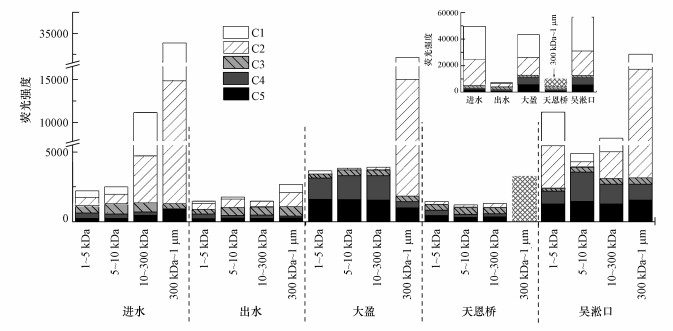 |
| 图 3 不同粒径胶体PARAFAC组分的荧光强度(C1、C3:类富里酸;C3肩峰:类腐殖酸;C2、C4肩峰:类色氨酸;C4、C5:类络氨酸) Fig. 3Fluorescence intensity of PARAFAC components in the different fractionated colloids |
3.1.2 不同粒径及来源胶体的荧光组分分布特征分析不同粒径及来源胶体的荧光组分浓度以PARAFAC模型输出的Fmax值来表示, 结果如图 3所示.结果表明, 300 kDa~1 μm分级中荧光强度最高, 并且C1和C2组分所占的比例最大, 不同来源水样的平均值分别为75%、71%, 这是造成PARAFAC分析结果与挑峰法各组分荧光强度分布规律不一致的主要原因(挑峰法中300 kDa~1 μm分级胶体的荧光组分较少(聂明华等, 2017)).不同粒径胶体的荧光强度分布结果表明, 随粒径增大, C1、C2、C3组分的荧光强度大体呈增加趋势(除进水的C3组分外), 而C4、C5组分的荧光强度大体呈递减趋势, 即类蛋白荧光峰主要存在于小粒径胶体中, 类腐殖荧光峰主要存在于大粒径胶体中, 该结论与挑峰法的分析结果一致(聂明华等, 2017), 但相较于挑峰法, PARAFAC不仅能够分析胶体荧光组成, 还能够进一步定量分析各组分的荧光强度.不同来源胶体的荧光强度变化大致规律为:吴淞口 > 进水 > 大盈 > 天恩桥 > 出水(图 3插图).所有采样点中, 300 kDa~1 μm分级荧光组分均占主导(不同荧光组分的平均值接近50%), 其他3个分级胶体间的差距较小.并且300 kDa~1 μm分级中C1和C2组分的比例最高, 尤其是进水、大盈及吴淞口, 而在出水中最低.相关分析表明, C1与C2(r=0.992, p < 0.01)、C4与C5(r=0.874, p < 0.01)间存在显著正相关关系, 表明类富里酸与类色氨酸,以及类络氨酸与类色氨酸荧光组分具有同源性.同时, C3与C5间存在显著负相关关系(r=-0.570, p=0.11), 表明类腐殖酸与类络氨酸荧光组分不同源.
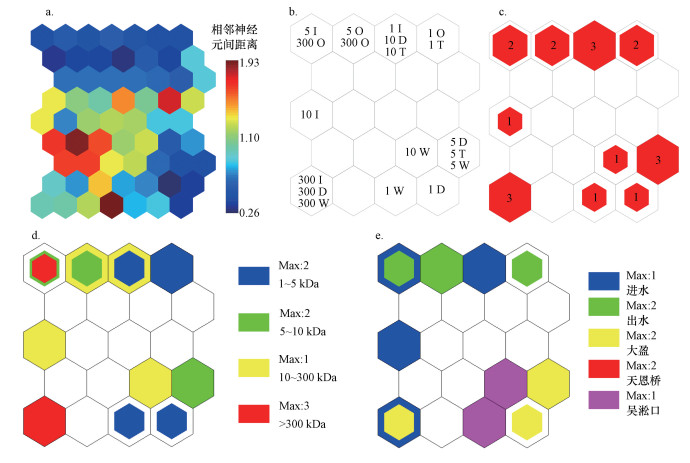
3.2 基于3D-EEM数据的神经网络图谱分析(EEM-SOM模型)3.2.1 不同粒径及来源胶体的映射分布分析由SOM训练可获得用于聚类分析的统一距离矩阵图(U-matrix图, 图 4a)和展示各神经元中样本分布特征的映射分布图(图 4b).U-matrix图中颜色越红表示与周围神经元间的距离越大、与周围神经元间的荧光性质差异越大(聂泽宇等, 2017).因此, U-matrix图可用于对样品进行聚类分析.由图 4a可知, U-matrix图左上方中部、右下方均有一明显的区别于其他样本的高值带, 参考图 4b可知, 左上方中部样本均为吴淞口采样点的不同粒径胶体样品, 右下方样本为300 kDa~1 μm分级胶体样品.这些结果说明SOM可以依据荧光强度对不同来源、不同粒径胶体样品进行分析.
图 4(Fig. 4)
 |
| 图 4 基于水样3D-EEM的SOM视觉化输出图(a. U-matrix统一距离矩阵图;b.样本映射分布图(字母代表采样点:I.进水, O.出水, D.大盈, T.天恩桥, W.吴淞口;数字代表水样粒径:1.胶体水样(1~5 kDa), 5.胶体水样(5~10 kDa), 10.胶体水样(10~300 kDa), 300.胶体水样(300 kDa~1 μm));c. Hits图(数字指胜利次数);d.不同粒径水样映射图;e.不同采样点水样映射图(映射样本的类型及数量用正六边形的颜色及大小表示, 满正六边形代表各神经元内某类水样的最大映射数(Max值)) Fig. 4SOM visualization based on EEMs of the water samples |
根据SOM的Hits图(图 4c~4e), 可进一步将不同来源及粒径胶体样品进行可视化分析, 展现其样本映射数量和位置差异.由图 4d可知, 1~5 kDa、300 kDa~1 μm分级胶体样品分别分布在SOM图左上方和右下方.根据SOM图下方神经元的荧光强度较高的规律可知(Bieroza et al., 2011), 300 kDa~1 μm分级胶体的荧光强度更高, 该结果与PARAFAC的分析结果一致.图 4e为不同来源水样的映射分布图, 由图可知, 大盈及吴淞口样品主要分布于SOM图的上方, 出水及天恩桥样品主要分布于SOM图下方.结合图 4a可知, 大盈及吴淞口样品荧光强度较大, 出水及天恩桥样品荧光强度较小, 该结果与PARAFAC分析结果一致.综合以上分析结果表明, SOM与PARAFAC均能够较好地分析胶体样品荧光特性, 在定量分析上PARAFAC更具优势, 而SOM的可视化程度更高.
3.2.2 典型神经元3D-EEM特性分析从图 5可以看出:①SOM图右下方样本的干扰峰较多, 且其荧光强度较大;②SOM图左上方样本中峰D和峰T荧光团荧光强度较大, 右下方样品中峰C和峰A荧光团荧光强度较大.结合不同粒径、不同来源样本在SOM图的分布特征(见3.2.1节)可知, 随胶体粒径增加, 胶体中峰D和峰T荧光团比例逐渐减小, 而峰C和峰A荧光团比例逐渐增大.该结论与前期工作中用挑峰法分析的结果一致(详见前期工作(聂明华等, 2017)中的2.2节), 即类蛋白荧光峰主要存在于小粒径分级胶体中, 类腐殖质荧光峰主要存在于大粒径分级胶体中(聂明华等, 2017).不同来源水体中, 大盈及吴淞口水样以类蛋白荧光峰为主, 出水及天恩桥水样以类腐殖荧光峰为主.但EEM-SOM模型仍然使用挑峰法进行荧光组分的判定, 因此, 无法避免重叠区域信息的缺失.
图 5(Fig. 5)
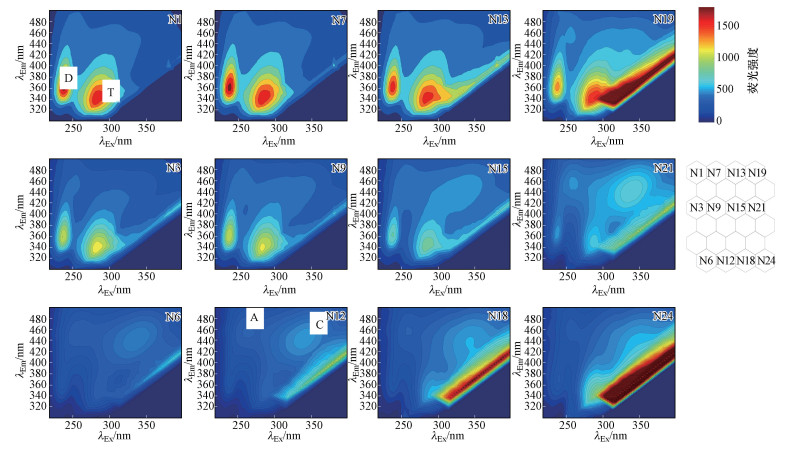 |
| 图 5 典型神经元的参考3D-EEM荧光光谱图 Fig. 5Fluorescence spectrum reference 3D-EEMs in typical neurons |
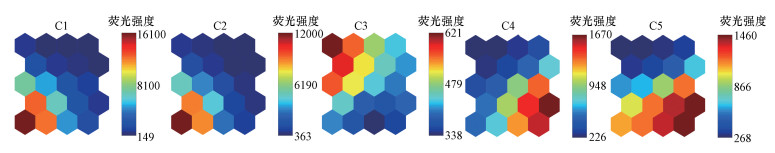
3.3 基于PARAFAC组分的神经网络图谱分析(PARAFAC-SOM模型)PARAFAC-SOM模型将PARAFAC组分作为SOM的输入变量, 可进一步了解荧光组分在SOM图中的响应, 不仅可以泛化、可视化不同来源及粒径胶体间荧光组分的变化规律, 而且可以进一步观察各荧光组分之间的相互关系.在SOM的组分面分析中, 若一系列SOM组分面的变化规律相似, 则表明这些组分面代表的变量间存在正相关关系(Zhang et al., 2015).并且, 相较于EEM-SOM模型, PARAFAC-SOM模型具有降低输入变量数(由4087个PEx-Em变量减少为5个)、节省运行时间、提高可靠性(QE值由23.017减小至0.546)等优点.
基于PARAFAC-SOM模型的SOM视觉化输出图见图 6.对比EEM-SOM模型输出结果(图 4)可知, PARAFAC-SOM模型的样本映射结果与EEM-SOM模型截然相反, 即1~5 kDa、300 kDa~1 μm分级胶体样品分别分布于SOM图右侧和左侧(图 6d), 大盈及吴淞口样品主要分布于SOM图的下方, 出水及天恩桥样品主要分布于SOM图上方(图 6e).为了进一步了解产生这些差异的原因, 需要对C1~C5组分面图加以分析(图 7).由图 7可知, C1和C2以左下方神经元的值更高, C3以左上方神经元的值更高, C4和C5以右下方神经元的值更高.结合样本在SOM图中的分布规律可知(图 6b~6e):①300 kDa~1 μm分级胶体样品的C1和C2荧光强度值较大, 表明大粒径胶体类富里酸和类色氨酸荧光物质较多;②出水水样各粒径胶体的C3荧光强度值较大, 表明出水水样的类腐殖酸物质较多;③大盈及吴淞口水样各粒径胶体的C4和C5荧光强度值较大, 表明这些水样中胶体的类色氨酸、类络氨酸物质较多;④C1与C2、C4与C5相似的组分面分布规律表明, 类富里酸与类色氨酸、类色氨酸与类络氨酸物质具有同源性;⑤C3与C4、C5相反的组分面分布规律表明, 类腐殖酸与类色氨酸、类络氨酸荧光组分不同源.
图 6(Fig. 6)
 |
| 图 6 基于PARAFAC组分的SOM视觉化输出图(各子图及符号含义与图 4相应部分相同) Fig. 6SOM visualization based on PARAFAC components of the water samples |
图 7(Fig. 7)
 |
| 图 7 基于SOM的PARAFAC组分可视化图 Fig. 7Visualization of PARAFAC components based on SOM |
以上结论与PARAFAC、EEM-SOM模型中的分析结果均基本一致, 说明PARAFAC-SOM模型能够较好地区分不同来源、不同粒径胶体的荧光特性.换言之, 利用荧光特性能够指示胶体的粒径、来源等信息.结合PARAFAC及EEM-SOM模型分析结果可知, PARAFAC-SOM模型是一种可视化程度较高(相较于PARAFAC)、输入变量较少、运行时间较短、可靠性较高(相较于EEM-SOM模型)的分析不同来源及粒径胶体荧光性质的方法.
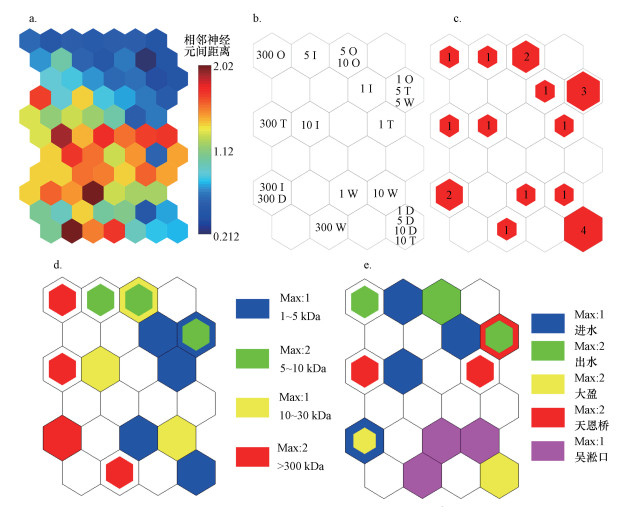
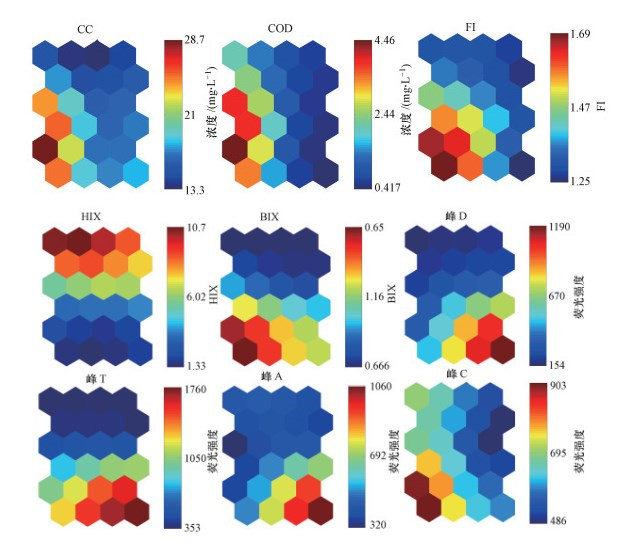
3.4 基于胶体理化参数的神经网络图谱分析(Parameters-SOM模型)利用PARAFAC-SOM模型原理, 建立基于胶体理化参数的Parameters-SOM模型(图 8).该模型的输出结果与PARAFAC-SOM模型基本一致, 即1~5 kDa、300 kDa~1 μm分级胶体样品分别分布于SOM图右侧和左侧(图 8d), 大盈及吴淞口样品主要分布于SOM图的下方, 出水及天恩桥样品主要分布于SOM图上方(图 8e).结合各理化参数的组分面图可知(图 9):①300 kDa~1 μm分级胶体的CC、COC、FI、BIX、峰C值较高;②大盈及吴淞口样品的峰T、峰D、峰A值较高;③出水及天恩桥样品的HIX值较高.这些结果表明:①大粒径胶体的胶体质量浓度及胶体态有机碳质量浓度较高(CC和COC值较大)、生物分解的内源来源可能性大(FI值较大)、自生源可能性高(BIX值较大)、类富里酸荧光物质较多(峰C值较大);②大盈及吴淞口水样类色氨酸、类络氨酸及类腐殖酸物质较多(峰T、峰D、峰A值较大);③出水及天恩桥水样各粒径胶体的腐殖化程度较高(HIX值较大).该模型将前期工作中的所有参数统一输出, 是对前期工作的全新阐释, 同时各参数的组分面图可反映各参数间的相关关系, 因此, 具有系统性强、直观等优点.
图 8(Fig. 8)
 |
| 图 8 基于胶体多种理化参数的SOM视觉化输出图(各子图及符号含义与图 4相应部分相同) Fig. 8SOM visualization based on the physicochemical properties of the water samples |
图 9(Fig. 9)
 |
| 图 9 基于SOM的胶体多种理化参数可视化图 Fig. 9Visualization of physicochemical properties of colloids based on SOM |
4 结论(Conclusions)1) 通过PARAFAC可知, 不同来源、不同粒径水体中共解析出2个类腐殖质荧光峰(C1和C3)及3个类蛋白荧光峰(C2、C4和C5), 其中以300 kDa~1 μm分级胶体荧光强度最高;随粒径增大, C1、C2、C3组分的荧光强度大体呈增加趋势, 而C4、C5组分的荧光强度大体呈递减趋势.不同来源胶体的荧光强度变化大致规律为:吴淞口>进水>大盈>天恩桥>出水.
2) 3种SOM模型训练结果与PARAFAC、前期工作所得结论基本一致, 即300 kDa~1 μm分级胶体样品荧光强度较大、类腐殖质荧光峰占主导;大粒径胶体生物分解的内源来源可能性大、自生源可能性高, 小粒径胶体的腐殖化程度高.
3) 几种模型比较表明:PARAFAC量化效果好、可视化程度不高;EEM-SOM模型可视化程度高, 但输入变量多, 兼具挑峰法的缺点;PARAFAC-SOM模型输入变量少、运行时间短、可靠性和可视化程度高, 同时该模型可延伸应用于其他胶体理化参数的分析, 具有系统性强、直观的优点.因此, PARAFAC-SOM模型是相对较好的分析不同来源及粒径胶体荧光特性的分析方法.
参考文献
| Bieroza M, Baker A, Bridgeman J. 2009. Exploratory analysis of excitation-emission matrix fluorescence spectra with self-organizing maps as a basis for determination of organic matter removal efficiency at water treatment works[J]. Journal of Geophysical Research:Biogeosciences, 114(G4).DOI:10.1029/2009JG000940 |
| Bieroza M, Baker A, Bridgeman J. 2012. Exploratory analysis of excitation-emission matrix fluorescence spectra with self-organizing maps-A tutorial[J]. Education for Chemical Engineers, 7(1): 22–31.DOI:10.1016/j.ece.2011.10.002 |
| Bieroza M, Baker A, Bridgeman J. 2011. Classification and calibration of organic matter fluorescence data with multiway analysis methods and artificial neural networks:an operational tool for improved drinking water treatment[J]. Environmetrics, 22: 256–270.DOI:10.1002/env.v22.3 |
| Boehme J, Coble P, Conmy R, et al. 2004. Examining CDOM fluorescence variability using principal component analysis:seasonal and regional modeling of three-dimensional fluorescence in the Gulf of Mexico[J]. Marine Chemistry, 89(1): 3–14. |
| Boehme J, Wells M. 2006. Fluorescence variability of marine and terrestrial colloids:examining size fractions of chromophoric dissolved organic matter in the Damariscotta River estuary[J]. Marine Chemistry, 101(1): 95–103. |
| Carlos L, Mártire D O, Gonzalez M C, et al. 2012. Photochemical fate of a mixture of emerging pollutants in the presence of humic substances[J]. Water Research, 46(15): 4732–4740.DOI:10.1016/j.watres.2012.06.022 |
| Chen G, Lin C, Chen L, et al. 2010. Effect of size-fractionation dissolved organic matter on the mobility of prometryne in soil[J]. Chemosphere, 79: 1046–1055.DOI:10.1016/j.chemosphere.2010.03.038 |
| Chen W, Westerhoff P, Leenheer J A, et al. 2003. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 37(24): 5701–5710. |
| Coble P G. 1996. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy[J]. Marine Chemistry, 51(4): 325–346.DOI:10.1016/0304-4203(95)00062-3 |
| Cuss C W, Guéguen C. 2015. Relationships between molecular weight and fluorescence properties for size-fractionated dissolved organic matter from fresh and aged sources[J]. Water Research, 38: 487–497. |
| 冯伟莹, 朱元荣, 吴昌丰, 等. 2016. 太湖水体溶解性有机质荧光特征及其来源解析[J]. 环境科学学报, 2016, 36(2): 475–482. |
| 傅平青, 刘丛强, 尹祚英, 等. 2004. 腐殖酸三维荧光光谱特性研究[J]. 地球化学, 2004, 33(3): 301–308.DOI:10.3321/j.issn:0379-1726.2004.03.010 |
| Guéguen C, Cuss C W. 2011. Characterization of aquatic dissolved organic matter by asymmetrical flow field-flow fractionation coupled to UV-Visible diode array and excitation emission matrix fluorescence[J]. Journal of Chromatography A, 1218(27): 4188–4198.DOI:10.1016/j.chroma.2010.12.038 |
| Guéguen C, Granskog M A, McCullough G, et al. 2011. Characterisation of colored dissolved organic matter in Hudson Bay and Hudson Strait using parallel factor analysis[J]. Journal of Marine Systems, 88(3): 423–433.DOI:10.1016/j.jmarsys.2010.12.001 |
| Huguet A, Vacher L, Relexans S, et al. 2009. Properties of fluorescence dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 40(6): 706–719.DOI:10.1016/j.orggeochem.2009.03.002 |
| Huguet A, Vacher L, Saubusse S, et al. 2010. New insights into the size distribution of fluorescent dissolved organic matter in estuarine waters[J]. Organic Geochemistry, 41(6): 595–610.DOI:10.1016/j.orggeochem.2010.02.006 |
| Kohonen T. 2012. Self-organization and Associative Memory[M]. Berlin: Springer Science & Business Media. |
| Kohonen T. 2001. Self-Organizing Maps (third ed)[M]. Berlin: Springer Science & Business Media. |
| Lead J R, Wilkinson K J. 2006. Aquatic colloids and nanoparticles:current knowledge and future trends[J]. Environmental Chemistry, 3(3): 159–171.DOI:10.1071/EN06025 |
| Maie N, Scully N M, Pisani O, et al. 2007. Composition of a protein-like fluorophore of dissolved organic matter in coastal wetland and estuarine ecosystems[J]. Water Research, 41(3): 563–570.DOI:10.1016/j.watres.2006.11.006 |
| McKnight D M, Boyer E W, Westerhoff P K, et al. 2001. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology and Oceanography, 46(1): 38–48.DOI:10.4319/lo.2001.46.1.0038 |
| 聂明华, 晏彩霞, 杨毅, 等. 2017. 黄浦江流域典型污水中不同粒径胶体的三维荧光光谱特征[J]. 环境科学, 2017, 38(8): 91–98. |
| 聂泽宇, 邬剑宇, 吴小东, 等. 2017. 荧光溶解性有机质EEMs的新旧自组织映射图解分析方法比较研究[J]. 环境科学学报, 2017, 37(1): 357–369. |
| Stedmon C A, Bro R. 2008. Characterizing dissolved organic matter fluorescence with parallel factor analysis:a tutorial[J]. Limnology and Oceanography:Methods, 27: 572–579. |
| Thurman E M. 2012. Organic Geochemistry of Natural Waters[M]. Berlin: Springer Science & Business Media. |
| Wilkinson K J, Lead J R. 2007. Environmental Colloids and Particles:Behaviour, Separation and Characterisation[M]. Chichester: John Wiley & Sons. |
| Worms I A M, Szigeti Z A G, Dubascoux S, et al. 2010. Colloidal organic matter from wastewater treatment plant effluents:Characterization and role in metal distribution[J]. Water Research, 44(1): 340–350.DOI:10.1016/j.watres.2009.09.037 |
| Yan C X, Yang Y, Liu M, et al. 2015. Selected emerging organic contaminants in the Yangtze Estuary, China:a comprehensive treatment of their association with aquatic colloids[J]. Journal of Hazardous Materials, 283: 14–23.DOI:10.1016/j.jhazmat.2014.09.011 |
| Zepp R G, Sheldon W M, Moran M A. 2004. Dissolved organic fluorophores in southeastern US coastal waters:correction method for eliminating Rayleigh and Raman scattering peaks in excitation-emission matrices[J]. Marine Chemistry, 89(1/4): 15–36. |
| Zhang Y, Liang X, Wang Z, et al. 2015. A novel approach combining self-organizing map and parallel factor analysis for monitoring water quality of watersheds under non-point source pollution[J]. Scientific Reports, 5: 16079.DOI:10.1038/srep16079 |
| Zheng Z, Zhang H, He P J, et al. 2009. Co-removal of phthalic acid esters with dissolved organic matter from landfill leachate by coagulation and flocculation process[J]. Chemosphere, 75: 180–186.DOI:10.1016/j.chemosphere.2008.12.011 |
