, 张泽明1, 张洪海1,3, 杨桂朋1,2,3
, 张泽明1, 张洪海1,3, 杨桂朋1,2,3

1. 中国海洋大学化学化工学院, 青岛 266100;
2. 海洋国家实验室海洋生态与环境科学功能实验室, 青岛 266071;
3. 中国海洋大学海洋化学研究所, 青岛 266100
收稿日期: 2017-12-25; 修回日期: 2018-02-03; 录用日期: 2018-02-03
基金项目: 国家重点研发计划(No.2016YFA0601301);中央高校基本科研业务费专项资金(No.201762031,201762030);青岛海洋国家实验室"鳌山人才"卓越科学家计划项目(No.2015ASTP-OS12)
作者简介: 邹亚文(1993-), 女, E-mail:m17864272612@163.com
通讯作者(责任作者): 杨桂朋(1963—), 男, 教授、博士生导师, 教育部“****”, 主要从事海洋化学的研究工作.已在国内外重要学术刊物上发表研究论文360余篇, 其中发表SCI论文150篇. E-mail: gpyang@ouc.edu.cn
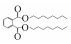
摘要: 采用固相微萃取-气相色谱-质谱联用(GC-MS)技术,研究了不同介质、光源、起始浓度、H2O2浓度等对3种常见邻苯二甲酸酯(PAEs)光化学降解过程的影响,并对邻苯二甲酸二(2-乙基己基)酯(DEHP)光降解的中间产物进行了检测,提出了可能发生的降解路径.结果表明:在不同介质中,邻苯二甲酸二甲酯(DMP)和邻苯二甲酸二乙酯(DEP)在Millipore-Q水中降解速度最快,而DEHP在天然海水中降解速度最快;3种PAEs在紫外灯照射下比模拟日光下降解速度快;相同紫外光照条件下,不同初始浓度的DMP、DEP和DEHP在研究浓度范围内(0.5~10 μg·L-1)的光降解率随着浓度的增加呈现减小趋势;此外,体系中H2O2的存在会明显加快PAEs的降解速率;通过GC-MS分析,检测出了DEHP在UV/H2O2条件下降解产生的中间产物,并且发现DEHP是从侧链开始降解的.
关键词:邻苯二甲酸二甲酯邻苯二甲酸二乙酯邻苯二甲酸二(2-乙基己基)酯光化学降解
Study on photochemical degradation of three kinds of phthalicacidesters in aqueous solution
ZOU Yawen1
 , ZHANG Zeming1, ZHANG Honghai1,3, YANG Guipeng1,2,3
, ZHANG Zeming1, ZHANG Honghai1,3, YANG Guipeng1,2,3

1. College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100;
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. Institute of Marine Chemistry, Ocean University of China, Qingdao 266100
Received 25 December 2017; received in revised from 3 February 2018; accepted 3 February 2018
Supported by the National Key Research and Development Program (No.2016YFA0601301), the Fundamental Research Funds for the Central Universities (No.201762031, 201762030) and the Aoshan Talents Program of Qingdao National Laboratory for Marine Science and Technology (No.2015ASTP-OS12)
Biography: ZOU Yawen(1993—), female, E-mail:m17864272612@163.com
*Corresponding author: YANG Guipeng, E-mail: gpyang@ouc.edu.cn
Abstract: The photodegradation processes of three kinds of common phthalate esters (PAEs) under different media, light source, initial concentration and concentration of H2O2 were studied by solid phase microextraction-gas chromatography-mass spectrometry (GC-MS). The photodegradation intermediates of di-(2-ethylhexyl) phthalate (DEHP) were detected and the possible degradation pathways were proposed. The results showed that the photoreaction rates of dimethyl phthalate (DMP) and diethyl phthalate (DEP) were the highest in Millipore-Q water, whereas that of DEHP was the highest in natural seawater. The photodegradation rates of three kinds of PAEs under UV irradiation were much faster than those under simulated sunlight. Exposed to the same UV lamp, the photodegradation rates of DMP, DEP and DEHP decreased along with the increase of initial concentrations (0.5~10 μg·L-1). In addition, H2O2 could significantly accelerate the degradation rates of PAEs. Based on GC-MS analysis, the intermediate products of DEHP degradation in the UV/H2O2 system were detected. We could infer that the degradation occurred on the side chains of DEHP.
Key words: dimethyl phthalatediethylphthalatedi-(2-ethylhexyl) phthalatephotochemical degradation
1 引言(Introduction)邻苯二甲酸酯(PAEs)又名酞酸酯, 在工业上主要用作增塑剂来增大塑料的可塑性和提高塑料强度, 在塑料中的添加量高达20% ~ 60%(Wams, 1987).由于PAEs与塑料主体之间以非共价键的方式相结, 因此, 在使塑料软化的过程中极易释放出来进入环境, 目前已广泛存在于水、大气、土壤及生物体中(Liu et al., 2010; 沙玉娟等, 2006; Wang et al., 2008).PAEs的分子结构类似激素, 被称为“环境激素”, 具有肾毒性和生殖毒性等(van Wezel et al., 2000; Hauser et al., 2006), 微量的PAEs就会对生物体产生很大的不利影响, 干扰内分泌(甘健彪, 2002; Xu et al., 2009).近年来, 国内外水体中都有PAEs的检出报道, 例如, 北美和欧洲的大部分国家在工业废水、生活污水和地表水中都检测出PAEs(Clara et al., 2012);而在我国长江口及邻近海域、黄河、黄浦江、松花江等水体及水厂排放水中均检测到PAEs, 主要为邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二辛酯(DOP)和邻苯二甲酸(2-乙基己基)酯(DEHP)等(胡雄星等, 2007; 王军良等, 2011; 张彦鹏等, 2011).此外, PAEs蒸气压较低, 进入水环境后很难再向大气环境迁移, 主要是在水体中发生相应的迁移转化(徐红燕等, 2010).在水环境中, PAEs或以溶解状态存在, 或吸附于悬浮物的表面, 或转移到沉积物中, 性质十分稳定, 不易分解, 易引起二次污染(李海涛等, 2006).鉴于PAEs的污染和危害, 美国环保局将DMP、DEP、DBP、DnOP、邻苯二甲酸丁基苄基酯(BBP)和DEHP等6种邻苯二甲酸酯类化合物列入了重点控制的污染物名单中, 我国将3种邻苯二甲酸酯类(DMP、DBP和DEHP)物质列入水中优先控制污染物.
目前, PAEs的人工降解方法主要有臭氧-活性炭法(刘军等, 2003)、生物降解法(尤华丽, 2004)、光化学氧化和光催化氧化法(郑和辉等, 2006).其中, 生物降解法对菌株的培养筛选费时费力, 而且对于大分子的PAEs难以降解, 降解过程容易产生毒性大的邻苯二甲酸单酯;臭氧-活性炭法只是将污染物转移, 并没有完全降解污染物.邻苯二甲酸酯在水环境中具有浓度低(通常为μg·L-1或ng·L-1水平)、毒性大等特点, 就处理方法的有效性和实用性而言, 高级氧化技术中的化学氧化法和光降解法对去除水体中邻苯二甲酸酯具有很好的效果(陈德强等, 2005; 芮旻等, 2005), 可以通过光化学降解的方法将水体中污染物降解为毒性小或者无毒性的物质.此外, 关于PAEs的光化学研究主要侧重于降解的可行性及动力学规律等方面(Tawabini et al., 2004; Loshin, 2013), 且降解方法大多采用TiO2催化降解(Yuan et al., 2008), 其降解机制尚不十分清楚.因此, 本文采用UV/H2O2氧化技术, 重点研究3种常见的PAEs(DMP、DEP和DEHP)的光化学降解过程及影响因素, 并分析鉴定DEHP的降解产物, 推测其可能的降解途径和反应历程.这对于进一步了解PAEs在水体中的光降解过程及机制具有重要的理论和实际意义.
2 材料与方法(Materials and methods)2.1 试剂邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸(2-乙基己基)酯(DEHP)、内标物苯甲酸苄酯(BBZ)(≥99.0%)购自美国西格玛奥德里奇Sigma-Aldrich公司;正己烷(色谱纯)购自德国Merck公司;天然海水(NSW)采集于东海海区;人工海水(ASW)的组成为1 kg溶液含有24.7 g NaCl、13.0 g MgCl2·6H2O、9.0 g Na2SO4·10H2O、1.5 g CaCl2·2H2O和954 g H2O;30% H2O2(分析纯).
2.2 仪器Agilent 7890A气相色谱配5975C质谱检测器(GC-MS)(美国Agilent公司);固相微萃取探针(青岛贞正分析仪器有限公司);SUNTEST CPS/CPS+光化学反应仪(美国ATLAS公司).
2.3 实验方法2.3.1 光照实验用不同介质配制不同浓度的PAEs溶液, 混合均匀后分别装入直径为3 cm的石英玻璃瓶中, 分别在308 nm的紫外灯(8 W)和光照强度为765 W·m-2的模拟日光(MNRG)灯下进行光照实验.在配制溶液过程中, 天然海水经0.22 μm的醋酸纤维膜进行过滤, 去除掉海水中的微生物和藻类.在不加入H2O2的样品中, 每隔5 h取样一次, 在加入H2O2的样品中, 前2 h每隔30 min取样一次, 2 h后每隔2 h取样一次.
2.3.2 样品分析取样后, 首先进行固相微萃取, 然后用气相色谱-质谱仪(GC-MS)进行分离与分析.固相微萃取:取10 mL水样, 加入1 μL 1000 μg·L-1的内标物(苯甲酸苄酯, BBZ)标准溶液, 将涂有100 μm厚聚二甲基硅氧烷的固相微萃取探针插入待测样品, 在35 ℃下以500 r·min-1搅拌萃取40 min, 将探针插入GC-MS进样6 min.通过GC-MS检测得到PAEs和内标BBZ对应的峰面积, 根据校正因子f计算出浓度.
2.3.3 检测条件色谱条件:色谱柱选用DB-1MS(30 m×0.25 mm, 0.25 μm), 进样口温度为260 ℃;程序升温条件为:初始温度70 ℃, 保持2 min;以25 ℃·min-1的速率升温到150 ℃, 以3 ℃·min-1的速率升温到170 ℃, 以30 ℃·min-1的速率升温到195 ℃, 以60 ℃·min-1的速率升温到225 ℃, 保持3 min;最后以8 ℃·min-1的速率升温到280 ℃, 保持4 min.载气流量为1 mL·min-1, 样品采取不分流进样.
质谱条件:EI工作电压70 eV, 四级杆温度150 ℃, 离子源230 ℃, 溶剂延迟7 min, 采用SIM模式定性/定量离子(张泽明等, 2017).
2.3.4 降解率的计算PAEs的光降解率η按以下公式计算:
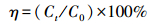 | (1) |
 | (2) |
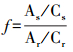 | (3) |
3 结果与讨论(Results and discussion)3.1 不同光源和起始浓度对PAEs光降解的影响由于邻苯二甲酸酯在天然水环境中浓度低(通常为μg·L-1或ng·L-1水平), 本文采用Millipore-Q水分别配制不同浓度(0.5、1.0、5.0和10.0 μg·L-1)的DMP、DEP和DEHP溶液, 研究不同光源(紫外灯和模拟日光灯)对PAEs光降解过程的影响, 3种PAEs的降解率如表 1所示.结果表明, 3种PAEs在研究浓度范围内, 随着初始浓度的增加降解速率呈减小趋势, 但影响程度不明显, 该结论与刘芃岩等(2009)的观点一致.
表 1(Table 1)
| 表 1 3种PAEs在不同光源和不同起始浓度条件下光照10 h的光降解率 Table 1 The photodegradation rates of three PAEs under different light sources and initial concentrations after 10 hours of light | |||||||||||||||||||||||||||||||||||||||||||||
表 1 3种PAEs在不同光源和不同起始浓度条件下光照10 h的光降解率 Table 1 The photodegradation rates of three PAEs under different light sources and initial concentrations after 10 hours of light
| |||||||||||||||||||||||||||||||||||||||||||||
此外, 3种PAEs在紫外光照射下的光降解率(30%左右)明显大于模拟日光灯照射下的光降解率(10%左右), 这主要是因为水环境中PAEs的光解过程主要是通过吸收290~400 nm的紫外光进行, 而在模拟日光条件下, 该波段的紫外光含量很低, 所以导致模拟日光灯下PAEs的降解速率比较低(冯关涛, 2009).因此, 本文重点选用紫外灯作为DMP、DEP和DEHP光降解的照射条件.
3.2 不同介质对PAEs光降解速率的影响用不同介质(Millipore-Q水、人工海水和天然海水)配制1.0 μg·L-1的DMP、DEP和DEHP溶液并置于石英瓶中, 于紫外光下照射, 定时取样检测并计算其降解率, 结果如图 1所示.同时, 对PAEs在不同介质中的浓度变化进行数据拟合, 得到的拟合方程如表 2所示, 从可决系数(R2 > 0.96)可以看出, PAEs的光降解符合准一级反应动力学.
图 1(Fig. 1)
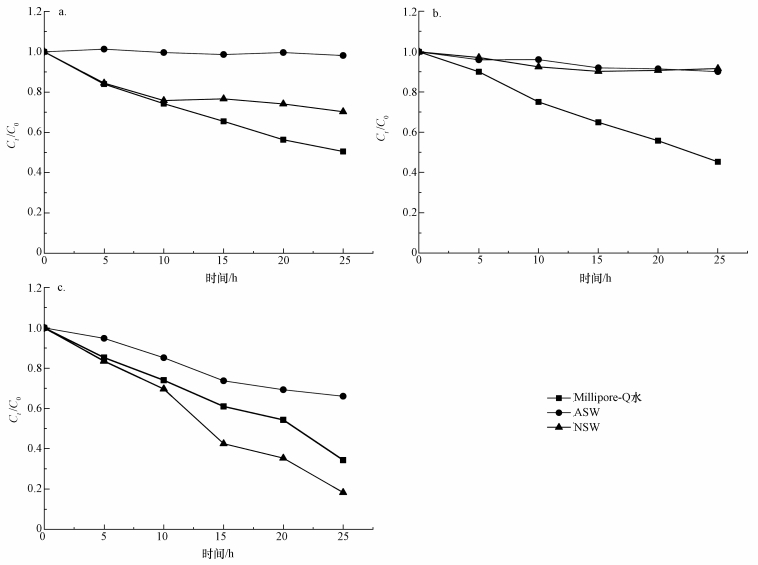 |
| 图 1 不同介质对DMP(a)、DEP(b)和DEHP(c)光降解的影响 Fig. 1Effects of different media on photodegradation of DMP(a), DEP(b) and DEHP(c) |
表 2(Table 2)
| 表 2 不同介质下的PAEs光降解动力学方程 Table 2 The kinetics equation of PAEs photodegradation under different media | ||||||||||||||||||||||||||||||||||||||
表 2 不同介质下的PAEs光降解动力学方程 Table 2 The kinetics equation of PAEs photodegradation under different media
| ||||||||||||||||||||||||||||||||||||||
PAEs的光解就其光化学转化过程可分为直接光解和间接光解.其中, 直接光解机理是指PAEs吸收光子的能量跃迁至激发单重态发生反应直接转化为产物;间接光解机理是指当环境中存在的某些物质吸收光能呈激发状态后再诱发一系列PAEs参与的反应.由图 1可知, 在相同紫外光照射下, Millipore-Q水中DMP、DEP和DEHP都发生了明显的降解, 且降解速率明显高于人工海水中3种PAEs的降解速率.与Millipore-Q水相比, 人工海水中含有多种离子, 如阴离子NO3-、SO42-、HCO3-和Cl-等都有捕获·OH的能力或对紫外光有较强的吸收能力, 从而对DMP、DEP和DEHP的降解产生抑制作用, 且随着离子浓度增大, 抑制作用增强(郑勋超, 2009; 潘晶等, 2007).天然海水中, DMP和DEP的光降解速率比Millipore-Q水中的降解速率低, 而DEHP的降解速率明显高于Millipore-Q水中的降解速率.研究表明(施银桃等, 2002; Hammad et al., 2008), Fe2+、Mn2+、Co2+和Cr3+可以提高DMP、DEP和DEHP的降解速率, 主要原因是这些重金属离子能与海水中的溶解氧和H2O2发生氧化还原反应并产生·OH, 从而促进PAEs的降解.DEHP主要从支链开始降解, DMP和DEP从苯环开始降解, 因此, DEHP的降解速率大于DMP和DEP的降解速率(谷传涛等, 2015; Sundstrom et al., 2010).此外, 天然海水中含有大量的溶解有机物, 有研究通过吸收光能产生中间产物(Zepp et al., 1985), 从而促进了PAEs的间接光解, 而且DEHP较DMP、DEP更为疏水, 与DOM作用更强, 更易接触到DOM产生的自由基(Latch et al., 2006), 因而DEHP的间接降解明显高于其直接降解.这表明在相同浓度下, PAEs的降解率是随着烷基链长度的增加而增大(Xu et al., 2010).本文研究的3种PAEs支链中碳原子数目的顺序为DEHP>DEP>DMP, 而在Millipore-Q水和天然海水中的降解速率并不是随着碳链的增长呈线性变化, 这可能与DMP、DEP和DEHP的分子结构有一定的关系(刘芃岩等, 2009; 吴楚萍, 2010).
3.3 不同H2O2浓度对PAEs光降解的影响在UV/H2O2反应体系中, H2O2可以起到氧化产生·OH的作用, 因此, 本文对不同浓度H2O2条件下PAEs光降解速率的差异进行了研究.分别向Millipore-Q水配制的DMP、DEP和DEHP溶液加入不同浓度(0、10、20、30和40 mg·L-1)的H2O2, 紫外光照10 h, 定时取样进行检测, 结果如图 2所示.
图 2(Fig. 2)
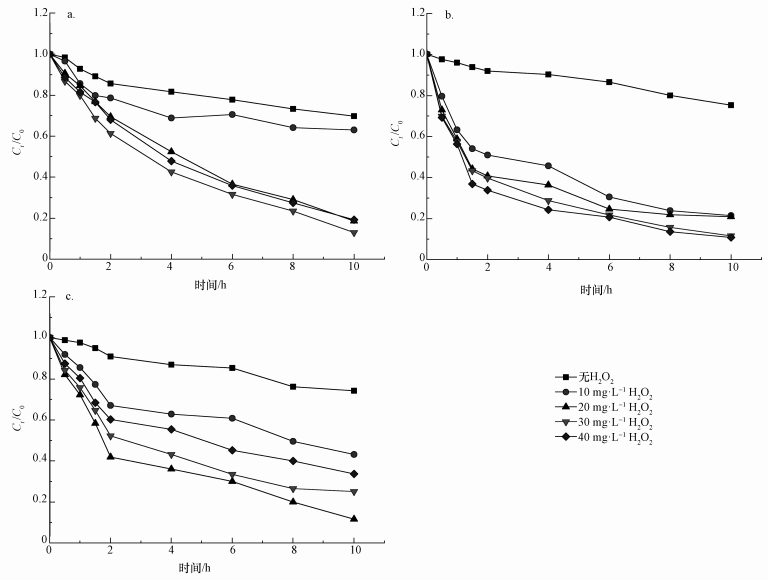 |
| 图 2 不同H2O2浓度对DMP(a)、DEP(b)和DEHP(c)光降解的影响 Fig. 2Effects of hydrogen peroxide concentrations on degradation of DMP(a), DEP(b) and DEHP(c) |
结果表明, H2O2对3种PAEs的光降解均有明显的促进作用, 然而高浓度H2O2对PAEs的影响却不尽相同.随着H2O2浓度的逐渐增大, DMP的光降解速率迅速加大, 当H2O2的浓度为30 mg·L-1时, DMP在10 h时的降解率达到87%, 但随着H2O2浓度进一步增加至40 mg·L-1时, DMP的光降解速率反而有所降低;DEP光降解速率随着H2O2浓度的增加而逐渐增大, 在H2O2浓度为40 mg·L-1时, DEP降解速率最大, 10 h时的降解率达到83%;DEHP在H2O2浓度为20 mg·L-1时降解速率最大, 在10 h时降解率达到90%.主要原因是H2O2作为一种强氧化剂, 在紫外光照射下分解生成·OH, 而·OH是一个很活泼的基团, 一旦形成会诱发一系列的自由基链反应, 通过电子转移等途径将水样中的有机污染物氧化成CO2和H2O(Weiss, 1952).H2O2有双重作用:其一, H2O2在UV辐射下分解产生·OH从而使DMP氧化降解;同时, H2O2又作为·OH的捕获剂清除·OH(陈德强等, 2005).当H2O2浓度较低时, 产生·OH的作用大于其对·OH的清除作用, 所以当H2O2的浓度从低到高增大时, PAEs的降解速率逐渐增大;随着H2O2浓度的继续增加, H2O2对·OH的清除作用大于产生·OH的作用, 从而使PAEs降解速率变小.3种PAEs光降解速率最大时H2O2浓度从大到小的顺序为DEP>DMP>DEHP, 主要是由于DMP、DEP和DEHP的分子结构不同, ·OH的进攻部位不同, DEHP主要是从支链开始降解, 而DMP和DEP则是从苯环开始降解(吴楚萍, 2010), 从而使3种PAEs光降解速率最大时的H2O2浓度不同.
3.4 H2O2条件下不同光照对PAEs的影响为了进一步研究H2O2对PAEs光降解的影响, 本文进行了在H2O2条件下不同光照的光降解实验.用Millipore-Q水配制1.0 μg·L-1的DMP、DEP和DEHP溶液, 分别在DMP中加入30 mg·L-1的H2O2, DEP中加入40 mg·L-1的H2O2, DEHP中加入20 mg·L-1的H2O2, 在两种光源下进行光降解实验, 同时进行暗反应对照试验, 结果如图 3所示.
图 3(Fig. 3)
 |
| 图 3 不同光源(UV和模拟日光)对DMP(a)、DEP(b)和DEHP(c)光降解的影响 Fig. 3Effects of different light sources on degradation of DMP(a), DEP(b) and DEHP(c) |
在黑暗/H2O2条件下, 只有DMP发生了降解, 而DEP和DEHP基本不发生降解, 此结论与文献报道一致(Chang et al., 2014).DMP、DEP和DEHP在紫外光照射下的降解速率依旧明显大于在模拟日光和黑暗条件下的降解速率, 而且模拟日光照射下, 3种PAEs的降解速率也明显增大.通过对照实验说明3种PAEs的降解主要是由光降解造成的, 这与H2O2遇到光的辐射, 分解成·OH, 通过电子转化等途径将水体中的有机污染物降解有主要关系.从降解曲线斜率的变化趋势可以看出, 降解初期(< 2 h)DMP、DEP和DEHP的降解速率明显较大, 但随着降解的继续进行, 降解速率减小, 这与降解产生的初级或者次级产物有关.由于部分降解产物(邻苯二甲酸酐、邻苯二甲酸单酯和邻苯二甲酸酯等)也吸收紫外光, 与DMP、DEP和DEHP对紫外光的吸收产生了竞争, 从而降低了3种PAEs的降解速率.此外, 溶液中的H2O2在紫外灯照射下产生·OH, 但随着反应的进行, H2O2被不断的消耗, ·OH得不到补充, 因此, 3种PAEs降解初期的降解速率较大.
3.5 DEHP的光催化降解机理本文以H2O2为催化剂, 进行紫外光照射来研究DEHP的光催化降解机理, 分别取光照0、30、90和150 min时的产物进行GC-MS分析测定.图 4为不同时间DEHP的GC-MS总离子流图, 对谱图中几个重要的峰进行分析, 通过GC-MS法检测出降解的中间产物(表 3), 进而讨论邻苯二甲酸酯类化合物可能的降解途径.
图 4(Fig. 4)
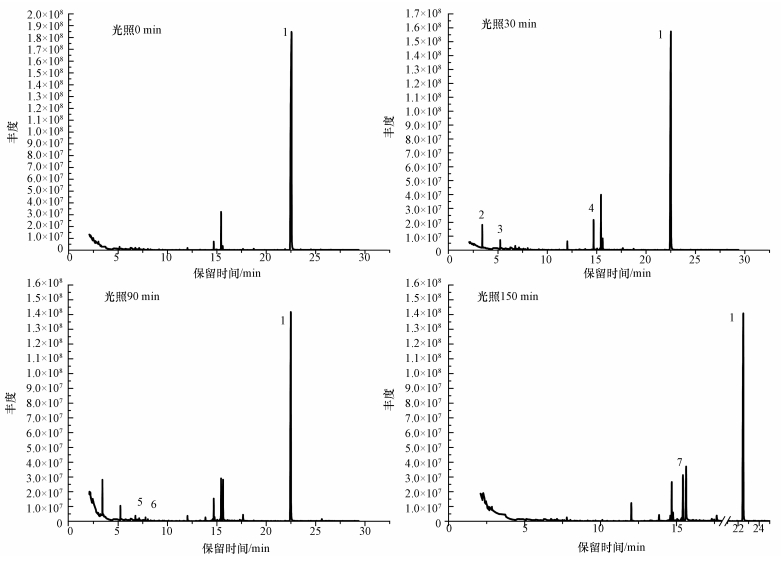 |
| 图 4 DEHP不同降解时间的气相色谱-质谱总离子流图 (图中数字编号参考见表 3) Fig. 4GC-MS total ion flow diagram of DEHP in different degradation times |
表 3(Table 3)
| 表 3 GC-MS的检测产物 Table 3 Molecular structure of intermediates analyzed from GC-MS fragments | ||||||||||||||||||||||||||||||||
表 3 GC-MS的检测产物 Table 3 Molecular structure of intermediates analyzed from GC-MS fragments
| ||||||||||||||||||||||||||||||||
如图 5所示, H2O2是一种强氧化剂, 在紫外灯照射下可以分解成·OH, ·OH首先进攻DEHP酯基上的烷氧键, 生成中间体(1)(邻醛基苯甲酸辛酯), 然后中间体(1)与·OH结合生成稳定的中间体(2)(邻苯二甲酸单辛酯);邻苯二甲酸单辛酯在·OH的攻击下, C—O键发生断裂生成中间体(3)(邻苯二甲酸);最后, 邻苯二甲酸在·OH的作用下, 生成中间体(4)(苯甲酸), 直链降解后的产物可能重组生成直链二醇及直链羧酸, 最终矿化为CO2和H2O (Xu et al., 2010; Peng et al., 2013; Yu, 2010; Huang et al., 2010).在紫外光照90和150 min后的溶液中, 检测出苯环三取代产物和羟基化产物, 可能是激发态的苯环和水中羟基、甲基等自由基反应产生的结果(刘青等, 2013).DEHP的光降解过程中除了产生以上的中间体外, 还有醇类、酮类和醛类等化合物生成(Chen, 2010), 因浓度较低较难检测出来.
图 5(Fig. 5)
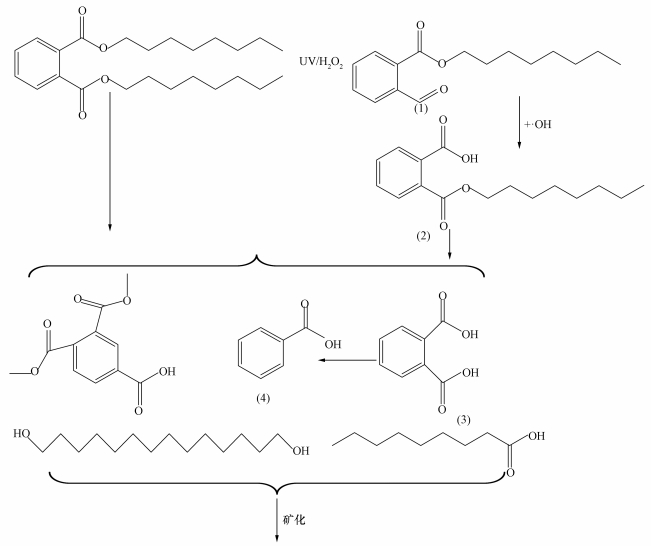 |
| 图 5 DEHP的UV/H2O2降解途径的推理 Fig. 5DEHP′s UV/H2O2 degradation pathway |
4 结论(Conclusions)1) 紫外灯照射下DMP、DEP和DEHP的降解速率明显大于模拟日光灯照射下的降解速率.在研究浓度范围内(0.5 ~10 μg·L-1), 随着PAEs初始浓度的增加, 降解率呈现减小趋势.
2) 紫外灯照射下DMP、DEP和DEHP在不同水体介质中的光化学降解反应均符合准一级动力学, 其中, 各介质中DMP和DEP的降解速率为Millipore-Q水>天然海水>人工海水, 而DEHP的降解速率为天然海水>Millipore-Q水>人工海水.
3) DMP、DEP和DEHP在UV/H2O2体系中的降解效果明显, 其降解速率远大于在UV、模拟日光/H2O2和黑暗/H2O2条件下的光降解速率.
4) DEHP在UV/H2O2降解过程中生成的产物主要包括苯甲酸、苯二甲酸、羟基化合物和苯环三取代产物.此外, DEHP是先从侧链开始发生降解反应的, 生成了邻苯二甲酸单辛酯, 然后在·OH的进一步进攻下生成苯甲酸.
参考文献
| Chang C F, Man C Y. 2014. Magnetic photocatalysts of copper phthalocyanine-sensitized titania for the photodegradation of dimethyl phthalate under visible light[J]. Colloids & Surfaces a Physicochemical & Engineering Aspects, 441(3): 255–261. |
| Chen C Y. 2010. The oxidation of di-(2-ethylhexyl) phthalate (DEHP) in aqueous solution by UV/H2O2 photolysis[J]. Water, Air, & Soil Pollution, 209(1/4): 411–417. |
| 陈德强, 吴振斌, 成水平, 等. 2005. UV/H2O2体系光降解邻苯二甲酸二丁酯研究[J]. 环境科学研究, 2005, 18(6): 50–52. |
| Clara M, Windhofer G, Weilgony P, et al. 2012. Identification of relevant micropollutants in Austrian municipal wastewater and their behaviour during wastewater treatment[J]. Chemosphere, 87(11): 1265.DOI:10.1016/j.chemosphere.2012.01.033 |
| 冯关涛. 2009. 酞酸酯类污染物光降解及机理研究[D]. 保定: 河北大学http://cdmd.cnki.com.cn/article/cdmd-10075-2010023262.htm |
| 甘健彪. 2002. 邻苯二甲酸酯的环境激素行为与测定[J]. 福建环境, 2002(5): 50–51. |
| 谷传涛, 王春英. 2015. 水体中邻苯二甲酸酯类的光催化降解研究进展[J]. 江西理工大学学报, 2015(1): 12–18. |
| 胡雄星, 韩中豪, 周亚康, 等. 2007. 黄浦江表层水体中邻苯二甲酸酯的分布特征及风险评价[J]. 环境化学, 2007, 26(2): 258–259. |
| Hammad K M, Jung J Y. 2008. Ozonation catalyzed by homogeneous and heterogeneous catalysts for degradation of DEHP in aqueous phase[J]. Chemosphere, 72(4): 690–696.DOI:10.1016/j.chemosphere.2008.02.037 |
| Hauser R, Meeker J D, Duty S, et al. 2006. Altered semen quality in relation to urinary concentrations of phthalate monoester and oxidative metabolites[J]. Epidemiology, 17(6): 682–691.DOI:10.1097/01.ede.0000235996.89953.d7 |
| Huang W B, Chen C Y. 2010. Photocatalytic degradation of diethyl phthalate (DEP) in Water Using TiO2[J]. Water Air & Soil Pollution, 207(1/4): 349–355. |
| Latch D E, Mcneill K. 2006. Microheterogeneity of singlet oxygen distributions in irradiated humic acid solutions[J]. Science, 311(5768): 1743–1747.DOI:10.1126/science.1121636 |
| 李海涛, 黄岁樑. 2006. 水环境中邻苯二甲酸酯的迁移转化研究[J]. 环境污染与防治, 2006, 28(11): 853–858.DOI:10.3969/j.issn.1001-3865.2006.11.015 |
| Liu H, Liang H, Liang Y, et al. 2010. Distribution of phthalate esters in alluvial sediment:a case study at JiangHan Plain, Central China.[J]. Chemosphere, 78(4): 382–388.DOI:10.1016/j.chemosphere.2009.11.009 |
| 刘军, 王珂, 贾瑞宝, 等. 2003. 臭氧-活性炭工艺对饮用水中邻苯二甲酸酯的去除[J]. 环境科学, 2003, 24(4): 77–80. |
| 刘芃岩, 冯关涛, 刘金巍, 等. 2009. 邻苯二甲酸酯的光降解研究[J]. 环境科学学报, 2009, 29(5): 1049–1055. |
| 刘青, 陈成, 陈泓哲, 等. 2013. 邻苯二甲酸二甲酯的紫外光-H2O2降解机制研究[J]. 环境科学, 2013, 34(7): 2670–2676. |
| Loshin D. 2013. Chapter 6 - Introduction to High-Performance Appliances for Big Data Management[M]. Amsterdam: Elsevier Inc. 49-59 |
| Peng X, Feng L, Li X. 2013. Pathway of diethyl phthalate photolysis in sea-water determined by gas chromatography-mass spectrometry and compound-specific isotope analysis[J]. Chemosphere, 90(2): 220–226.DOI:10.1016/j.chemosphere.2012.06.045 |
| 潘晶, 陈永强, 索艳丽, 等. 2007. 水质对UV/H2O2降解邻苯二甲酸二甲酯反应动力学的影响[J]. 安全与环境学报, 2007, 7(3): 25–29. |
| 芮旻, 高乃云, 徐斌, 等. 2005. UV、H2O2、O3及其联用工艺对水中DMP的去除效果和降解机理分析[J]. 环境科学学报, 2005, 25(11): 1457–1463.DOI:10.3321/j.issn:0253-2468.2005.11.005 |
| Sundstrom D W, Weir B A, Klei H E. 2010. Destruction of aromatic pollutants by UV light catalyzed oxidation with hydrogen peroxide[J]. Environmental Progress & Sustainable Energy, 8(1): 6–11. |
| Tawabini B S, AlSuwaiyan M S. 2004. Removal of dimethyl phthalate from water by UV-H2O2 process[J]. Journal of Environmental Engineering & Science, 3(4): 289–294. |
| 沙玉娟, 夏星辉, 肖翔群. 2006. 黄河中下游水体中邻苯二甲酸酯的分布特征[J]. 中国环境科学, 2006, 26(1): 120–124. |
| 施银桃, 李海燕, 曾庆福, 等. 2002. Mn(Ⅱ)催化臭氧氧化去除水中邻苯二甲酸二甲酯的研究[J]. 武汉纺织大学学报, 2002, 15(1): 39–42. |
| Wams T J. 1987. Diethylhexylphthalate as an environmental contaminant——a review[J]. The Science of the Total Environment, 66: 1.DOI:10.1016/0048-9697(87)90072-6 |
| van Wezel A P, Van V P, Posthumus R, et al. 2000. Environmental risk limits for two phthalates, with special emphasis on endocrine disruptive properties[J]. Ecotoxicol Environ Saf, 46(3): 305–321. |
| Wang P, Wang S L, Fan C Q. 2008. Atmospheric distribution of particulate- and gas-phase phthalic esters (PAEs) in a Metropolitan City, Nanjing, East China[J]. Chemosphere, 72(10): 1567–1572.DOI:10.1016/j.chemosphere.2008.04.032 |
| Weiss J. 1952. The free radical mechanism in the reactions of hydrogen peroxide[J]. Advances in Catalysis, 4: 343–365. |
| 王军良, 徐超, 庄晓伟, 等. 2011. 水中邻苯二甲酸酯污染现状及高级氧化降解技术研究[J]. 工业水处理, 2011, 31(4): 5–10.DOI:10.11894/1005-829x.2011.31.(4).5 |
| 吴楚萍. 2010. TiO2/浮石光催化降解水中邻苯二甲酸酯类污染物的研究[D]. 广州: 暨南大学http://cdmd.cnki.com.cn/Article/CDMD-10559-2010124585.htm |
| Xu B, Gao N Y, Cheng H, et al. 2009. Oxidative degradation of dimethyl phthalate (DMP) by UV/H2O2 process[J]. Journal of Hazardous Materials, 162(2): 954–959. |
| Xu L, Yang X, Guo Y, et al. 2010. Simulated sunlight photodegradation of aqueous phthalate esters catalyzed by the polyoxotungstate/titania nanocomposite[J]. Journal of Hazardous Materials, 178(1): 1070–1077. |
| 徐红燕, 周仕林, 陶红, 等. 2010. 废水中邻苯二甲酸酯降解的研究进展[J]. 上海理工大学学报, 2010, 32(5): 418–422. |
| 尤华丽. 2004. 四种邻苯二甲酸酯的生物降解性研究[J]. 中山大学研究生学刊:自然科学与医学版, 2004(1): 81–87. |
| Yuan B, Li X, Graham N. 2008. Reaction pathways of dimethyl phthalate degradation in TiO2-UV-O2 and TiO2-UV-Fe(Ⅵ) systems[J]. Chemosphere, 72(2): 197–204.DOI:10.1016/j.chemosphere.2008.01.055 |
| Zepp R G, Schlotzhauer P F, Sink R M. 1985. Photosensitized transformations involving electronic energy transfer in natural waters:role of humic substances[J]. Environmental Science & Technology, 19(1): 74–81. |
| 张彦鹏, 周爱国, 刘存富, 等. 2011. 长江流域武汉段水体中邻苯二甲酸酯含量研究[J]. 环境科学与技术, 2011, 34(11): 130–134.DOI:10.3969/j.issn.1003-6504.2011.11.027 |
| 张泽明, 张洪海, 李建龙, 等. 2017. 固相微萃取-气相色谱-质谱联用测定海水与沉积物中邻苯二甲酸酯类污染物[J]. 分析化学, 2017, 45(3): 348–356.DOI:10.11895/j.issn.0253-3820.160699 |
| 郑和辉, 钱城. 2006. 邻苯二甲酸酯降解状况研究进展[J]. 中国公共卫生, 2006, 22(2): 228–230.DOI:10.11847/zgggws2006-22-02-63 |
| 郑勋超. 2009. Ag-TiO2/浮石对二沉池出水深度处理的研究[D]. 广州: 暨南大学http://cdmd.cnki.com.cn/Article/CDMD-10559-2009108428.htm |