 , 田柳1,2, 崔建升1,2
, 田柳1,2, 崔建升1,2
 , 马佳颖1,2
, 马佳颖1,21. 河北科技大学环境科学与工程学院, 河北省污染防治生物技术实验室, 石家庄 050018;
2. 河北省药用分子化学重点实验室, 石家庄 050018
收稿日期: 2018-04-11; 修回日期: 2018-05-14; 录用日期: 2018-05-14
基金项目: 国家自然科学基金(No.21876043,21407041);河北省自然科学基金(No.B2015208042)
作者简介: 武彤(1982-), 女, 博士, E-mail:Tongwu_st@126.com
通讯作者(责任作者): 崔建升, 教授、硕士生导师, 长期从事环境学和环境影响评价等的教学和科研工作, 在国内外核心学术期刊上发表论文50余篇, 其中SCI收录10余篇. E-mail:Cui11603@163.com
摘要: 采用高效液相色谱法对α-六溴环十二烷(α-HBCD)对映体进行手性拆分,制备获得(+)-和(-)-对映体.以玉米为受试植物,利用水培实验方法,采用不同浓度梯度的(+)α-HBCD、(-)α-HBCD及(rac)α-HBCD溶液对发芽后的玉米幼苗进行暴露,开展α-HBCD对映体对植物生理和基因损伤作用研究.结果表明,不同α-HBCD对映体暴露后玉米根部形态发育异常,(+)α-HBCD处理的玉米根须明显稀疏;植物根部组织、地上部的生物量和长度的相对抑制率与暴露浓度线性相关,其中,(+)α-HBCD对玉米生长的抑制最强;玉米地上部叶绿素含量随α-HBCD暴露浓度的增加而显著降低,且降低量顺序为(+)α-HBCD >(rac)α-HBCD >(-)α-HBCD;低浓度的(+)α-HBCD显著诱导了玉米根部组织和地上部超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性,高浓度时则表现为显著的抑制作用,其中,SOD对α-HBCD胁迫反应更为敏感;组蛋白H2AX的磷酸化(γ-H2AX)水平呈现出不同的变化趋势,其中,(+)α-HBCD诱导γ-H2AX焦点数量增加最为显著.综上,α-HBCD对映体对玉米生理和基因水平均产生了选择性损伤作用,(+)α-HBCD的损伤作用强于(-)和(rac)α-HBCD.本研究可为综合评价手性HBCD的环境行为和生态风险提供重要信息.
关键词:六溴环十二烷对映体选择性差异形态抗氧化酶γ-H2AX
Physiological and genetic damage effects of hexabromocyclododecane enantiomers on maize
WU Tong1,2
 , TIAN Liu1,2, CUI Jiansheng1,2
, TIAN Liu1,2, CUI Jiansheng1,2
 , MA Jiaying1,2
, MA Jiaying1,2 1. Pollution Prevention Biotechnology Laboratory of Hebei Province, School of Environmental Science and Engineering, Hebei University of Science and Technology, Shijiazhuang 050018;
2. Hebei Province Key Laboratory of Medicinal Chemistry, Shijiazhuang 050018
Received 11 April 2018; received in revised from 14 May 2018; accepted 14 May 2018
Supported by the National Natural Science Foundation of China(No.21876043, 21407041) and the Natural Science Foundation of Hebei Province(No.B2015208042)
Biography: WU Tong(1982—), female, Ph.D., E-mail:Tongwu_st@126.com
*Corresponding author: CUI Jiansheng, E-mail:Cui11603@163.com
Abstract: Enantiomeric separation and preparation of α-HBCD were performed on high performance liquid chromatography (HPLC). The enantioselective physiological and genetic damage effects of α-HBCD on maize were investigated by hydroponic experiments. The germinated maize seedlings were exposed to different concentrations of (+)α-HBCD, (-)α-HBCD and (rac)α-HBCD solution in the present study. Results indicated that the root morphology of maize was abnormal after exposure to α-HBCD enantiomers. Early root development was more influenced by (+)α-HBCD than (-)-and (rac)α-HBCD. All the biomass and length of maize roots and shoots were inhibited, and the relative inhibition rates were positively correlated with the exposure concentration. The strongest inhibitory effect was observed in the (+)α-HBCD treatment. The chlorophyll content of maize shoots decreased significantly with an increasing exposure concentration of α-HBCD. The reduction were in the order of (+)α-HBCD > (rac)α-HBCD > (-)α-HBCD treatments. In contrast to (-)-and (rac)α-HBCD, the antioxidant enzyme activities of superoxide dismutase (SOD) and catalase (CAT) both in roots and shoots were significantly induced by exposure to lower concentrations of (+)α-HBCD and inhibited at higher concentrations. SOD was more sensitive to the stress reaction of α-HBCD. The level of histone H2AX phosphorylation (γ-H2AX) showed different trends with increasing concentration of α-HBCD enantiomers and racemate. The most significant induction of γ-H2AX was observed in the (+)α-HBCD treatment. All of these results demonstrated the significant physiological and genetic damage effects of α-HBCD enantiomers on maize with a higher effect of (+)α-HBCD than (-) and (rac)α-HBCD. The results of this study would offer important information for comprehensive assessment of the environmental behaviors and ecological risk of chiral HBCD.
Keywords: HBCDenantioselectivity differencesmorphologyantioxidant enzymeγ-H2AX
1 引言(Introduction)六溴环十二烷(HBCD)是继多溴联苯醚和四溴双酚A外全球第三大溴代阻燃剂, 主要用于聚苯乙烯保温泡沫板、纺织品和电子产品(Yang et al., 2012).由于HBCD的持久性及生物积累性, 目前已在各种生物及非生物样品中被广泛检出.有研究表明, HBCD是肝酶诱导物和内分泌干扰物(Hamers et al., 2006;Van et al., 2006).2013年, 斯德哥尔摩公约将其列入持久性有机污染物(POPs)受控名单中.作为一种新型的手性POPs, HBCD受到国际社会的广泛关注.
在非生物环境中, 手性污染物具有相同的物理和化学性质.然而手性物质的不同对映体能够与酶或生物受体发生特异性相互作用, 这使其在生物环境中显现出不同的对映体生物特性、毒性和代谢行为(Covaci et al., 2006;Huang et al., 2016).长期以来, 人们在研究手性有机污染物的环境行为和毒理效应时, 忽视了其对映体之间的手性差异.工业生产的HBCD主要含有3种异构体, 即α-HBCD、β-HBCD和γ-HBCD(Li et al., 2016), 每个异构体分别具有左右旋对映体.由于不同异构体结构不同, 导致它们在环境中的积累分布及毒性都存在差异.一般而言, 在生物体中α-HBCD的含量要大于β-和γ-HBCD(Guerra et al., 2010).Palace等(2008)研究发现, HBCD对虹鳟鱼的甲状腺有破坏作用, 且γ-HBCD的破坏性更强.Hong等(2015)研究表明, HBCD的3种异构体均能诱导青鳉鱼胚胎畸形、心脏凋亡及活性氧的产生.近期在对海洋桡足类生物日本虎斑猛水蚤的研究中发现(Hong et al., 2017), HBCD的异构体均会抑制日本虎斑猛水蚤的生长, 且α-和β-HBCD的毒性要高于γ-HBCD, α-HBCD的生物富集潜力最大.Zhang等(2008)在研究6种HBCD对映体对人肝癌细胞(Hep G2)的毒性实验中发现, (+)-对映体的毒性大于(-)-对映体.
目前对HBCD毒性研究大多集中在细胞及动物中(Shi et al., 2017; Wang et al., 2016), 且研究多停留在异构体水平上的考察, 有关HBCD对植物的毒性尤其在对映体水平上的毒性研究鲜有报道.植物是食物链形成的基础, 也是生态系统中的生产者, 对污染物在环境中的迁移、转化等行为具有举足轻重的作用.因此, 研究HBCD对植物的毒性效应, 更易于了解HBCD进入生态系统后所产生的影响, 并为进一步探讨HBCD的生态毒理奠定基础.
本课题组的前期研究初步考察了γ-HBCD对映体对玉米的氧化胁迫损伤, 然而遗憾的是并未考察在一般生物体中含量较高的α-HBCD对植物的毒性作用, 且考察指标有待深入和拓展.本研究采用实验室水培模式, 从表观形态、植物生理(包括生长指标的剂量效应关系、机体光合作用能力及内部生物大分子响应)和基因损伤方面进一步考察α-HBCD对映体对玉米的毒性影响, 以期为综合评估手性污染物的环境行为和生态效应提供重要信息.
2 材料与方法(Materials and methods)2.1 试剂与仪器主要试剂:α-HBCD标准品(100 μg·mL-1)购于AccuStandard公司(New Haven, USA), 其立体结构见图 1;流动相甲醇为色谱纯, 其余试剂均为分析纯.
图 1(Fig. 1)
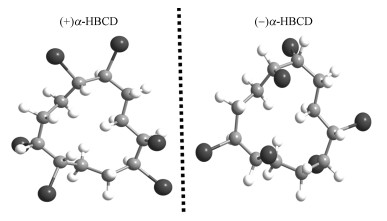 |
| 图 1 α-HBCD立体结构图 Fig. 1Chemical structures of α-HBCD |
主要仪器:高效液相色谱(HPLC, 岛津LC-20 AD)、紫外-可见分光光度计(岛津UV-2550)、低温高速离心机(5418, Eppendorf, AC 22331, Hanburge)、恒温培养箱(A1000, Conviron公司).
2.2 对映体的分离与制备采用HPLC对α-HBCD进行对映体拆分, 优化得到最佳拆分条件, 根据紫外检测器出峰位置进行手动收集分离液, 得到(+)和(-)α-HBCD, 分离液分别氮吹后甲醇定容.
2.3 植物暴露配置不同浓度梯度(0.5、1.0、2.0、3.0和5.0 μg·L-1)的(+)α-HBCD、(-)α-HBCD及(rac)α-HBCD暴露液.选取均匀饱满的玉米种子, 浸泡在10% H2O2溶液中消毒10 min, 去离子水清洗后均匀平铺在托盘中, 放入培养箱, 在(27.0±0.5) ℃下发芽, 环境相对湿度控制在60%~70%.培养96 h后选取长势均一的玉米幼苗转移到盛有HBCD溶液的棕色玻璃水培罐中进行暴露, 每盆放5颗, 每个处理设置3个平行, 每个实验重复3次, 每24 h更换1次暴露液(Wu et al., 2016), 更换暴露液前检测溶液中对映体外消旋化的比率(< 9%), 确定对映体转化的影响可忽略不计.暴露72 h后, 记录地上和根部组织的鲜重和长度, 计算得到α-HBCD对映体对玉米生长的相对抑制率R(式(1)).实验设置去离子水和甲醇空白对照, 两组对照结果一致, 说明溶剂甲醇未对植物生长产生影响.
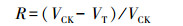 | (1) |
2.4 叶绿素的提取与分析叶绿素的提取参照Liu等(2012)的方法, 取0.1 g叶片, 剪成细丝放入试管中, 加入10 mL丙酮-无水乙醇混合液, 室温下避光反应至叶片完全变白, 取上清液, 用分光光度计检测其在663 nm和645 nm的吸光度.
2.5 酶与γ-H2AX的提取与分析将培养的玉米分为地上部分和地下部分, 加入磷酸缓冲液(pH=7.8)在4 ℃下研磨至匀浆状, 离心15 min(4 ℃, 5000 g), 提取上清液, 即得到粗酶液.
采用Bradford的方法(1976), 以100 μg·mL-1牛血清蛋白为标准溶液, 0.005%的考马斯亮蓝G-250溶液为染料, 在595 nm下绘制标准曲线, 检测样品中的蛋白水平.超氧化物歧化酶(SOD)的测定参照Beauchamp等(1971)的方法并略作改动, 采用氮蓝四唑(NBT)光还原法检测, 将显色液(50 mmol·L-1磷酸缓冲液(pH=7.8)、130 mmol·L-1甲硫氨酸、750 μmol·L-1氮蓝四唑、100 μmol·L-1 EDTA-Na2及20 μmol·L-1核黄素)与粗酶液混匀, 将1支对照管置于暗处, 其它各管于4000 lx日光下反应15~30 min, 以不照光的对照管作空白, 于560 nm处测定各管吸光值.过氧化氢酶(CAT)参照Aebi(1984)的方法并略作改动, 将反应液(200 mmol·L-1 H2O2及50 mmol·L-1磷酸缓冲液(pH=7.0))与粗酶液快速混合, 240 nm处测定吸光值, 连续测定3 min.γ-H2AX焦点数量采用植物γ-H2AX酶联免疫试剂盒提供的方法检测(Matsuzak et al., 2010).
2.6 数据分析所有数据均为3次重复实验所得结果, 实验数据以平均值±标准偏差(Mean±SD)来表示.采用Origin 8.0对数据进行回归分析, SPSS 17.0对拟合的模型进行显著性检验.
3 结果与讨论(Results and discussion)3.1 α-HBCD对映体的分离与制备优化得到最佳分离条件:流速0.4 mL·min-1, 流动相为95%甲醇:5%水, 紫外检测器波长220 nm, 柱温25 ℃, 所用的色谱柱为Nucleode β-PM手性柱.由于相同的对映体在同一根手性柱上出峰顺序相同, 根据Zhang等(2008)的报道, 先流出色谱柱的是(-)α-HBCD, 其次为(+)α-HBCD.采用外标法定量, 制备得到的(-)α-HBCD和(+)α-HBCD单体纯度>98%.α-HBCD对映体分离谱图如图 2所示.对制备得到的单体样品进行定量测定, (+)和(-)α-HBCD的最终浓度分别为3.28和2.79 μg·mL-1.
图 2(Fig. 2)
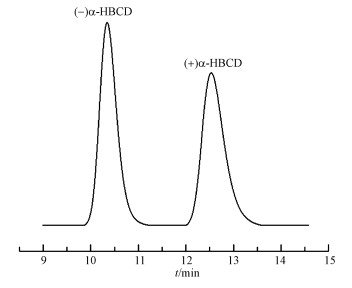 |
| 图 2 α-HBCD对映体分离图谱 Fig. 2Enantiomeric separation of α-HBCD |
3.2 α-HBCD及其对映体对植物根形态和生长的影响根系是玉米从外界吸收养分的主要器官, 当受到外界环境刺激时, 根的形态结构产生相应的变化以提高适应能力(Shahid et al., 2017).在本实验污染物暴露体系中, 植物根与暴露液的直接接触使其成为最先受到影响的部位.图 3为各对映体在暴露浓度为5.0 μg·L-1时玉米根组织的生长情况, 可以看出, 经(+)α-HBCD的暴露, 成熟区的根毛变得十分稀疏, 而(-)α-HBCD与空白相比无显著变化, (rac)α-HBCD处理植物根的生长介于两者之间, 表明(+)α-HBCD对玉米的影响较(rac)α-HBCD及(-)α-HBCD严重.根毛是根表皮的亚细胞扩展, 占根表总面积的67%, 而根表面积则与营养吸收密切相关, 因此, 稠密的根毛可以促进植物营养的吸收, 有益于植物生长, 而稀疏的根毛则会减少营养的吸收并间接引起植物损伤(Ma et al., 2001).
图 3(Fig. 3)
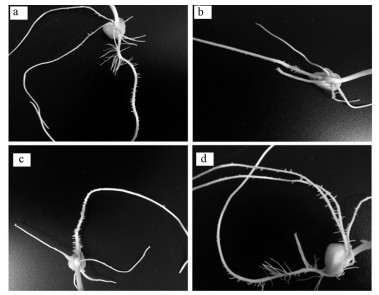 |
| 图 3 HBCD暴露后根部组织图片(a.空白对照, b.(+)α-HBCD, c.(rac)α-HBCD, d. (-)α-HBCD) Fig. 3Photos of maize roots tissue treated by HBCD (a. control, b. (+)α-HBCD, c. (rac)α-HBCD, d. (-)α-HBCD) |
α-HBCD暴露后, 玉米的生长受到了影响, 幼苗的根部组织生物量和长度、地上部生物量和长度均受到显著抑制, 根据公式(1)计算得到各项生长指标的相对抑制率, 发现植物生长相对抑制率均随暴露浓度的增加而增加, 且两者之间呈显著的线性关系(p < 0.05)(表 1).殷培杰等(2005)在氯苯甲酸植物毒性实验中发现, 氯苯甲酸浓度与根长度抑制率之间也存在极显著的线性关系, 拟合直线方程的斜率可直观评价植物毒性.本实验中, 暴露浓度-根部组织生物量(长度)抑制率的拟合方程斜率大于暴露浓度-地上生物量(长度)抑制率的拟合方程斜率;就(+)α-HBCD而言, 其对根部组织生物量及长度的拟合方程斜率分别是地上部的1.53和1.34倍, 表明HBCD对玉米根部的影响程度大于对地上部的影响.Zhu等(2017)研究HBCD对黑麦草的毒性影响时发现, HBCD主要积累在植物的根部, 根系富集因子(RCF)在1.46~4.43范围内, 只有很少部分转移到茎(茎富集因子SCF:0.198 ~ 0.305)和叶(叶富集因子LCF:0.042 ~ 0.062), 可见根部对α-HBCD更为敏感.α-HBCD不同对映体对玉米生长的影响存在显著差异, (+)α-HBCD暴露浓度-抑制率的拟合方程斜率均大于(rac)和(-)α-HBCD暴露浓度-抑制率的拟合方程斜率.当暴露浓度为5.0 μg·L-1时, (+)α-HBCD处理的植物根部组织生物量的相对抑制率达到33.46%(空白组和处理组根部组织生物量分别为0.218和0.145 g), 分别是(rac)和(-)α-HBCD处理的1.50倍和1.14倍, 地上部的生物量抑制率为26.95%(空白组和处理组地上部生物量分别为0.491和0.359 g), 分别是(rac)和(-)α-HBCD处理的1.29倍和1.11倍, 表明α-HBCD对玉米产生了对映体选择性毒性, 且(+)α-HBCD的毒性大于(rac)和(-)α-HBCD.
表 1(Table 1)
| 表 1 α-HBCD暴露浓度-表观指标抑制率之间的量化关系 Table 1 Quantitative relationship between α-HBCD exposure concentration and inhibition rate | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 α-HBCD暴露浓度-表观指标抑制率之间的量化关系 Table 1 Quantitative relationship between α-HBCD exposure concentration and inhibition rate
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3 α-HBCD及其对映体对植物幼苗叶绿素含量的影响植物通过叶绿体进行光合作用将CO2和H2O转化成储存着能量的有机物, 当植物在受到环境胁迫时, 其光合作用受阻, 最终会导致植物生长发育的改变(Cambrolle et al., 2013).而α-HBCD对玉米根形态和生长量的影响是否与植物光合作用有关?基于此问题, 进一步对植物体叶绿素含量进行了测定.叶绿素是光合作用中最重要和最有效的色素, 其含量在一定程度上能反映植物同化物质的能力.因此, 植物叶片中叶绿素含量的多少可以反映其光合作用的能力水平.
由图 4可以看出, α-HBCD暴露后, 玉米叶绿素含量受到影响, 且不同对映体间存在较大的差异.在最低暴露浓度(0.5 μg·L-1)时, (-)及(rac)α-HBCD处理的玉米叶绿素含量较空白对照有所增加, 且(-)α-HBCD处理增加显著;之后植物叶绿素含量随暴露浓度的增加呈下降趋势, 这可能是由于植物最初对环境胁迫的应激反应所致.(+)α-HBCD暴露的植物叶绿素含量则展现出了不同的变化规律, 其随暴露浓度的增加持续下降.在最低暴露浓度(0.5 μg·L-1)下, 叶绿素含量较空白值下降了21.8%, 表明低浓度的(+)α-HBCD就已抑制了玉米的光合作用能力;(+)α-HBCD在最大暴露浓度(5.0 μg·L-1)时, 玉米叶片中叶绿素含量较空白对照下降了29.4%, 分别为(-)和(rac)α-HBCD处理的8.45和4.15倍, 表明(+)α-HBCD的毒性最强, 其次是(rac)α-HBCD, 而左旋(-)α-HBCD毒性最弱.Hsiao等(2014)在咪唑烟酸对映体对拟南芥的选择性毒性研究中发现, 经对映体暴露后, 拟南芥中叶绿含量显著下降, 且下降顺序为(+)-咪唑烟酸大于(±)-和(-)-咪唑烟酸;Wei等(2016)在手性除草剂甲氧咪草烟对映体对玉米幼苗选择性毒性研究中发现, 相同浓度暴露下的玉米幼苗叶绿素含量均受到抑制, 抑制率为(R)-甲氧咪草烟>(rac)-甲氧咪草烟>(S)-甲氧咪草烟.本研究结果与之相似, 均为右旋对映体的毒性最大.
图 4(Fig. 4)
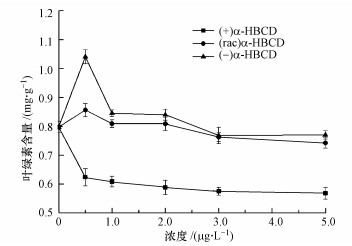 |
| 图 4 暴露3 d后玉米叶片叶绿素含量 Fig. 4Chlorophyll content of maize leaves after 3 days of exposure |
3.4 α-HBCD及其对映体对植物抗氧化酶的影响当植物受到环境胁迫时, 体内会产生过量的活性氧(ROS)物质, 而活性氧的产生会使植物体遭受氧化损伤.抗氧化酶系统被认为是植物遭受逆境胁迫时重要的防御体系, 它们主要通过清除体内的ROS来保护机体(Cuypers et al., 2010;Sekmen et al., 2012).SOD和CAT是典型的两种抗氧化酶, SOD作为防御的第一条线, 可以催化超氧阴离子自由基(O2·-)发生歧化反应, 生成氧气(O2)和过氧化氢(H2O2), 生成的H2O2可以被CAT分解为O2和H2O(Lawniczak et al., 2013;Lin et al., 2000), 它们在植物体内的协同作用, 可以使植物在一定程度上减缓逆境胁迫的伤害(Liu et al., 2011).
随着α-HBCD暴露浓度的增加, 玉米体内SOD和CAT活性总体呈先增加后减小的变化趋势, 但不同对映体之间存在差异(图 5).(+)、(rac)和(-)α-HBCD处理的玉米根部组织SOD活性均先增加后减少, 且分别于0.5、1.0和1.0 μg·L-1时达到最大值, 其活性分别是空白对照组的1.87、1.34和1.17倍.地上部SOD均高于空白对照组, (+)和(rac)α-HBCD处理的样品也呈先增加后减小的趋势;在最大暴露浓度(5.0 μg·L-1)下, 相比空白对照组, (+)、(rac)和(-)α-HBCD处理的玉米根部组织SOD活性分别降低了51.65%、43.94%和18.35%, 而植物地上部SOD活性仍高于空白值, 表明根部组织受损比地上部更为严重.值得注意的是, (+)α-HBCD在低暴露浓度下即诱导植物出现较强的应激反应, 且在高浓度下对酶活性的抑制最大, 表明α-HBCD对映体对玉米的毒性大小为(+)α-HBCD > (rac)α-HBCD > (-)α-HBCD.
图 5(Fig. 5)
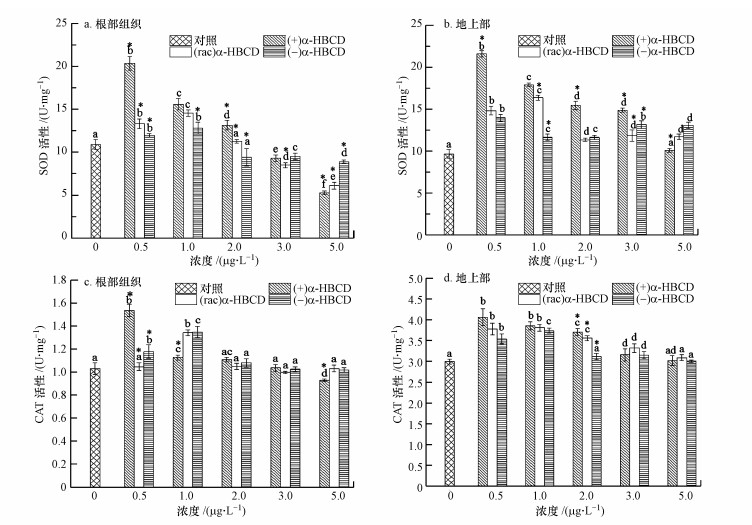 |
| 图 5 α-HBCD及其对映体对玉米体内SOD和CAT活性的影响(不同字母表示各浓度处理之间存在显著差异(p < 0.05), *表示不同对映体之间存在显著差异(p < 0.05), 下同) Fig. 5Effects of α-HBCD and its enantiomers on SOD and CAT activity in maize |
植物组织CAT活性检测表明, (+)α-HBCD暴露的玉米体内CAT活性于0.5 μg·L-1时即显著增加到最大值(p < 0.05), 根部组织与地上部的CAT活性分别是空白对照的1.49倍和1.35倍.(rac)和(-)α-HBCD暴露时, CAT活性均在1.0 μg·L-1时达到最大, 且二者变化趋势相似.与空白对照组相比, 当暴露浓度为5.0 μg·L-1时, 除(+)α-HBCD处理的玉米根部组织CAT活性降低了9.7%, (rac)和(-)α-HBCD处理的根部组织与地上部的CAT活性均与空白值无显著性差异.CAT活性结果同样表明植物根部组织受损严重, 且(+)α-HBCD毒性最大.
SOD与CAT活性在达到最大值后, 随着暴露浓度的增加, 酶的活性与暴露浓度呈负相关关系.可见严重的氧化胁迫破坏了抗氧化系统, 降低了细胞对氧自由基的清除能力, 影响了玉米的正常代谢, 导致玉米生长受损.这说明胁迫进一步加剧时, 抗氧化物酶活性会受到抑制, 植物对环境胁迫的抗性存在一定的阈值范围.
有研究表明, 植物的光合作用能力与抗氧化酶之间存在着某种协同关系, 逆境胁迫下, ROS的产生与清除之间的平衡被打破, 自由基在植物体内大量积累, 降低了叶片的光合能力(张仁和等, 2011;裴斌等, 2013).本研究发现, 玉米叶片中叶绿素含量变化与抗氧化酶变化趋势基本一致, 在最低浓度(+)α-HBCD暴露下, 植物体内产生的ROS较多, 从而使抗氧化酶的活性升高以清除过量的ROS, 叶绿素的含量也急剧下降, 光合作用能力减弱.两种抗氧化酶活性变化相比, SOD的活性提高幅度较大, 表明SOD对α-HBCDs胁迫反应更为敏感, 是玉米的主要保护酶, 这也与干旱胁迫对玉米的影响研究的结论一致(张仁和等, 2011).
3.5 α-HBCD及其对映体诱导γ-H2AX焦点的产生ROS的过量产生会导致DNA双链断裂(DSB)损伤(Roldán-Arjona et al., 2009), 使植物基因遭到破坏, 此时组蛋白H2AX迅速磷酸化形成γ-H2AX, 一个DSB可诱导γ-H2AX分子聚集形成唯一焦点, γ-H2AX产生焦点的数量与DSB存在着一一对应关系(Wu et al., 2016).因此, 测定γ-H2AX焦点的水平, 可以间接反映基因水平上的损伤程度.Tologa等(2012)在研究新型杀虫剂啶虫脒对结肠腺癌细胞(CaCo-2)的基因毒性评价中观察到γ-H2AX焦点数量随啶虫脒浓度的增加而增加.
α-HBCD不同对映体暴露3 d后, 玉米体内的γ-H2AX焦点数量均有所增加(图 6), 且对映体间存在显著差异.(+)和(rac)α-HBCD处理使玉米根部组织γ-H2AX含量呈先增加后减小的趋势, 且(+)α-HBCD在最低浓度暴露下(0.5 μg·L-1)即达到最大值, 相比空白对照组增加了25.5%, 此时产生的焦点数量最多, 表明产生的DSB损伤最为严重;(rac)α-HBCD处理组在较高浓度暴露时(2.0 μg·L-1)达到最大值, 比空白对照组增加了21.2%;而(-)α-HBCD处理的根部组织γ-H2AX含量则表现出随暴露浓度增加持续增加的趋势, 在暴露浓度为(5.0 μg·L-1)时较空白值增加了22.8%, 可见高浓度的(rac)和(-)α-HBCD也会引起植物DNA的损伤, 但损伤程度均低于最低浓度下(0.5 μg·L-1)(+)α-HBCD引起的损伤, 表明其毒性弱于(+)α-HBCD.植物地上部的检测结果表明, 经(+)α-HBCD处理后γ-H2AX焦点数量先增加后减少, 在2.0 μg·L-1的暴露浓度下, γ-H2AX水平达到最高, 比空白对照组增加了22.6%;而(rac)和(-)α-HBCD处理玉米地上部γ-H2AX焦点数量随暴露浓度增加而增大, 在最高浓度5.0 μg·L-1时比空白对照组分别增加了8.6%和20.2%.结果显示, (+)α-HBCD引起γ-H2AX焦点数量增加的浓度剂量最低, 且与(rac)和(-)α-HBCD相比, 其诱导产生的焦点数最多, 可见(+)α-HBCD对玉米基因水平上的损害是最大的.Lang等(2012)发现在博来霉素处理下, 拟南芥机体内γ-H2AX焦点数量有显著响应, 揭示了其对植物基因毒性的敏感性.
图 6(Fig. 6)
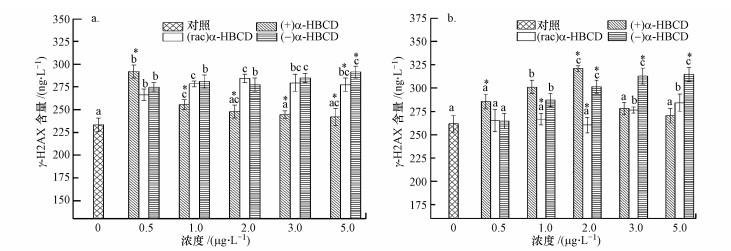 |
| 图 6 暴露3 d后玉米体内γ-H2AX焦点数量的变化(a.根部组织,b.地上部) Fig. 6γ-H2AX induction in maize tissues after 3 days of exposure |
γ-H2AX焦点数量的降低, 可能是α-HBCD暴露初期, 体内的ROS物质积累, 引起机体内DNA双链断裂, 而随着暴露浓度增加, 机体内的SOD、CAT及其它抗氧化物质对ROS进行清除, 再加上损伤细胞自身会募集损伤修复相关因子对已形成的断裂位点进行修复, 使得γ-H2AX焦点数量有所下降.Macphail等(2003)在研究X射线对V79细胞的损伤时, 同样也观察到γ-H2AX焦点数量随时间呈现先增加后下降趋势.近期有研究也表明(Yang et al., 2016), Hep G2细胞在受到γ射线照射后, 细胞中γ-H2AX焦点数量在一定时间范围内先增加后减少, 说明DNA在受损后, 启动了细胞的自我修复机制.
α-HBCD对映体对玉米暴露后, 植物机体内抗氧化酶(SOD和CAT)活性的增加表明其诱导了玉米体内ROS的产生, 过度ROS的累积可能是造成植物体光合作用受阻和DNA双链断裂基因损伤的直接原因, 在植物表观形态上表现出生长发育的改变.
手性α-HBCD对玉米根的形态和生长、幼苗叶绿素含量、抗氧化酶及γ-H2AX焦点水平的影响均存在显著的对映体选择性差异, 可能与其不同的立体构型有关.Huang等(2016)在近期对玉米体中HBCD的吸收和生物转化研究中发现, (+)α-HBCD更易与CYP亚型酶CYP71C3v2结合, 而(-)α-HBCD与GST亚型酶GST31有更强的键合, 说明α-HBCD的不同立体结构与生物体作用的靶标位点之间有着高度的选择性, 这极有可能是造成对映体之间毒性差异的原因, 这一实验结论也为本文进一步对HBCD对映体对植物的毒性机理研究指明了方向.
4 结论(Conclusions)1) 研究表明, 玉米的表观生长形态受到α-HBCD的影响, 玉米根组织形态结构发生了显著的变化.不同浓度的α-HBCD对玉米的生长存在显著的抑制作用, 暴露浓度与植物根部组织、地上部的生物量和长度的相对抑制率线性相关.
2) 本文明确了玉米生长受限的作用机制, α-HBCD诱导了机体内部ROS的产生, ROS的累积可能进一步造成植物体光合作用受阻和DNA双链断裂的基因毒性, 这是导致植物生长发育改变的重要影响因素.
3) α-HBCD对玉米产生了对映体选择性毒性作用.(+)α-HBCD暴露使玉米成熟区的根毛变得十分稀疏, (+)α-HBCD对植物生长的剂量效应拟合线斜率最高, 且诱导植物体叶绿素含量、SOD和CAT活性及γ-H2AX焦点数量变化最为显著, 表明(+)α-对映体对玉米的毒性影响大于(-)和(rac)α-对映体, 可能与其不同的空间构型密切相关.
参考文献
| Aebi H. 1984. Catalase in vitro[J]. Methods in Enzymology, 105: 121–126.DOI:10.1016/S0076-6879(84)05016-3 |
| Beauchamp C, Fridovich I. 1971. Superoxide dismutase:Improved assays and an assay applicable to acrylamide gels[J]. Analytical Biochemistry, 44(1): 276–287.DOI:10.1016/0003-2697(71)90370-8 |
| Bradford M M. 1976. A rapid and sensitive method for quantitation of microgram quantities of protein utilizing principle of protein-dye binding[J]. Analytical Biochemistry, 72(1/2): 248–254. |
| Cambrolle J, Mancilla-Leyton J M, Munozvalles S, et al. 2013. Effects of copper sulfate on growth and physiological responses of Limoniastrum monopetalum[J]. Environmental Science & Pollution Research, 20(12): 8839–8847. |
| Covaci A, Gerecke A C, Law R J, et al. 2006. Hexabromocyclododecanes (HBCDs) in the environment and humans:A Review[J]. Environmental Science & Technology, 40(12): 3679–3688. |
| Cuypers A, Plusquin M, Remans T, et al. 2010. Cadmium stress:an oxidative challenge[J]. Biometals, 23(5): 927–940.DOI:10.1007/s10534-010-9329-x |
| Guerra P, Eljarrat E, Barceló D. 2010. Simultaneous determination of hexabromocyclododecane, tetrabromobisphenol A, and related compounds in sewage sludge and sediment samples from Ebro River Basin (Spain)[J]. Analytical and Bioanalytical Chemistry, 397(7): 2817–2824.DOI:10.1007/s00216-010-3670-3 |
| Hamers T, Kamstra J H, Sormeveld E, et al. 2006. In vitro profiling of the endocrine·disrupting potency of brominated flame retardants[J]. Toxicological Sciences, 92(1): 157–173.DOI:10.1093/toxsci/kfj187 |
| Hong H Z, Lv D M, Liu W X, et al. 2017. Toxicity and bioaccumulation of three hexabromocyclododecane diastereoisomers in the marine copepod Tigriopus japonicas[J]. Aquatic Toxicology, 188: 1–9.DOI:10.1016/j.aquatox.2017.04.010 |
| Hong H Z, Shen R, Liu W X, et al. 2015. Developmental toxicity of three hexabromocyclododecane diastereoisomers in embryos of the marine medaka Oryzias melastigma[J]. Marine Pollution Bulletin, 101(1): 110–118.DOI:10.1016/j.marpolbul.2015.11.009 |
| Hsiao Y L, Wang Y S, Yen J H. 2014. Enantioselective effects of herbicide imazapyr on Arabidopsis thaliana[J]. Journal of Environmental Science and Health, 49(9): 646–653.DOI:10.1080/03601234.2014.922404 |
| Huang H L, Zhang S Z, Lv J T, et al. 2016. Experimental and theoretical evidence for diastereomer-and enantiomer-specific accumulation and biotransformation of HBCD in maize roots[J]. Environmental Science & Technology, 50(22): 12205–12213. |
| Lang J L, Smetant O, Sanchez-Calderon L, et al. 2012. Plant γH2AX foci are required for proper DNA DSB repair responses and colocalize with E2F factors[J]. New Phytologist, 194(2): 353–363.DOI:10.1111/j.1469-8137.2012.04062.x |
| Lawniczak M, Romestaing C, Roussel D, et al. 2013. Preventive antioxidant responses to extreme oxygen level fluctuation in a subterranean crustacean[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 165(2): 299–303. |
| Li B, Yao T Q, Sun H W, et al. 2016. Diastereomer-and enantiomer-specific accumulation, depuration, bioisomerization, and metabolism of hexabromocyclododecanes (HBCDs) in two ecologically different species of earthworms[J]. Science of the Total Environment, 542: 427–434.DOI:10.1016/j.scitotenv.2015.10.100 |
| Lin C C, Kao C H. 2000. Effect of NaCI stress on H2O2 metabolism in rice leaves[J]. Plant Growth Regulation, 30(2): 151–155.DOI:10.1023/A:1006345126589 |
| Liu C C, Liu Y G, Guo K, et al. 2011. Effect of drought on pigments, osmotic adjustment and antioxidant enzymes in six woody plant species in karst habitats of southwestern China[J]. Environmental and Experimental Botany, 71(2): 174–183.DOI:10.1016/j.envexpbot.2010.11.012 |
| Liu H J, Xiong M Y, Tian B L. 2012. Comparative phytotoxicity of Rac-metolachlor and S-metolachlor on rice seedlings[J]. Journal of Environmental Science and Health, 47(5): 410–419.DOI:10.1080/03601234.2012.657046 |
| Ma Z, Bielenberg D G, Brown K M, et al. 2001. Regulation of root hair density by phosphorus availability in Arabidopsis thaliana[J]. Plant, Cell & Environment, 24(4): 459–467. |
| Macphail S H, Banáth J P, Yu T Y, et al. 2003. Expression of phosphorylated histone H2AX in cultured cell lines following exposure to X-rays[J]. International Journal of Radiation Biology, 79(5): 351–359.DOI:10.1080/0955300032000093128 |
| Matsuzak K, Harada A, Takeiri A, et al. 2010. Whole cell-ELISA to measure the γH2AX response of six aneugens and eight DNA-damaging chemicals[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 700(1/2): 71–79. |
| Palace V P, Pleskach K, Halldorsan T, et al. 2008. Biotransformation enzymes and thyroid axis disruption in juvenile rainbow trout (Oncorhynchus mykiss) exposed to hexabromocyclododecane diastereoisomers[J]. Environmental Science & Technology, 42(6): 1967–1972. |
| 裴斌, 张光灿, 张淑勇, 等. 2013. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报, 2013, 33(5): 1386–1396. |
| Roldán-Arjona T, Ariza R R. 2009. Repair and tolerance of oxidative DNA damage in plants[J]. Mutation Research/Reviews in Mutation Research, 681(2/3): l69–179. |
| Sekmen A H, Turkan I, Tanyolac Z O, et al. 2012. Different antioxidant defense responses to salt stress during germination and vegetative stages of endemic halophyte Gypsophila oblanceolata Bark[J]. Environmental and Experimental Botany, 77: 63–76.DOI:10.1016/j.envexpbot.2011.10.012 |
| Shahid M, Dumat C, Khalid S, et al. 2017. Foliar heavy metal uptake, toxicity and detoxification in plants:A comparison of foliar and root metal uptake[J]. Journal of Hazardous Materials, 325: 36–58.DOI:10.1016/j.jhazmat.2016.11.063 |
| Shi D L, Lv D M, Liu W X, et al. 2017. Accumulation and developmental toxicity of hexabromocyclododecanes (HBCDs) on the marine copepod Tigriopus japonicus[J]. Chemosphere, 167: 155–162.DOI:10.1016/j.chemosphere.2016.09.160 |
| Tologa ?, Nilüfer ?, ?zgür V, et al. 2012. In vitro genotoxicity evaluation of acetamiprid in CaCo-2 cells using the micronucleus, comet and γH2AX foci assays[J]. Pesticide Biochemistry and Physiology, 104(3): 212–217.DOI:10.1016/j.pestbp.2012.08.004 |
| Van der Ven L T M, Verhoef A, Van De Kuil T, et al. 2006. A 28-day oral dose toxicity study enhanced to detect endocrine effects of hexabromocyclododecane in Wistar rats[J]. Toxicological Sciences, 94(2): 281–292.DOI:10.1093/toxsci/kfl113 |
| Wang F D, Zhang H J, Geng N B, et al. 2016. New insights into the cytotoxic mechanism of hexabromocyclododecane from a metabolomic approach[J]. Environmental Science & Technology, 50(6): 3145–3153. |
| Wei J, Zhang X X, Li X S, et al. 2016. Enantioselective phytotoxicity of imazamox against maize seedlings[J]. Bulletin of Environmental Contamination and Toxicology, 96(2): 242–247.DOI:10.1007/s00128-015-1682-6 |
| Wu T, Huang H L, Zhang S Z. 2016. Accumulation and phytotoxicity of technical hexabromocyclododecane in maize[J]. Journal of Environmental Sciences, 42: 97–104.DOI:10.1016/j.jes.2015.06.018 |
| Yang C J, Wang Q X, Liu X D, et al. 2016. NU7441 enhances the radiosensitivity of liver cancer cells[J]. Cellular Physiology and Biochemistry, 38: 1897–1905.DOI:10.1159/000445551 |
| Yang R Q, Wei H, Guo J H, et al. 2012. Emerging brominated flame retardants in the sediment of the Great Lakes[J]. Environmental Science & Technology, 46(6): 3119–3126. |
| 殷培杰, 李培军, 刘宛, 等. 2005. 氯苯甲酸植物毒性实验中两类指标的比较研究[J]. 农业环境科学学报, 2005, 24(1): 1–5.DOI:10.3321/j.issn:1672-2043.2005.01.001 |
| 张仁和, 郑友军, 马国胜, 等. 2011. 干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J]. 生态学报, 2011, 31(5): 1303–1311. |
| Zhang X L, Yang F X, Xu C, et al. 2008. Cytotoxicity evaluation of three pairs of hexabromocyclododecane (HBCD) enantiomers on Hep G2 cell[J]. Toxicology in Vitro, 22(6): 1520–1527.DOI:10.1016/j.tiv.2008.05.006 |
| Zhu H K, Sun H W, Yao Y M, et al. 2017. Fate and adverse effects of hexabromocyclododecane diastereoisomers (HBCDDs) in a soil-ryegrass pot system[J]. Chemosphere, 184: 452–459.DOI:10.1016/j.chemosphere.2017.05.166 |
