 , 彭剑峰2
, 彭剑峰2
 , 宋永会2, 张盼月1, 石国强2
, 宋永会2, 张盼月1, 石国强21. 湖南大学环境科学与工程学院, 长沙 410082;
2. 中国环境科学研究院城市水环境科技创新基地, 北京 100012
收稿日期: 2017-07-13; 修回日期: 2017-10-24; 录用日期: 2017-10-25
基金项目: 国家水体污染控制与治理科技重大专项(No.2012ZX07202-005,2014ZX07510-001)
作者简介: 房昀昊(1994-), 男, E-mail: f757195339@163.com
通讯作者(责任作者): 彭剑峰(1977—), 男, 研究员, 博士, 主要从事小流域污染控制技术. E-mail: pjf1995@163.com
摘要: 为了研究人工湿地中植物根际、污水水质和深度等对细菌群落结构特征分布的影响,利用高通量测序技术,对人工湿地中芦苇(Phragmites communis)、香蒲(Typha orientalis Presl)2种植物根际3个不同深度细菌群落特征进行了研究.细菌群落丰富度和多样性研究结果表明,芦苇根际细菌群落丰富度和多样性均大于香蒲根际,细菌在芦苇根际周围可以更好地生存;同一植物根际细菌的丰富度和多样性随着深度的增加逐渐减少.相似度和差异性分析结果表明,相同植物根际细菌群落结构相似度较高,而不同根际群落结构有一定的差别.优势细菌菌群分析结果发现,细菌群落在门类水平上达到13门以上,优势细菌种群均以变形菌门、酸杆菌门、绿弯菌门、厚壁菌门为主,相对丰度约为55%~78%;纲类水平也达到20纲以上,主要有α-变形杆菌纲、β-变形菌、δ-变形菌纲、γ-变形菌纲、芽孢杆菌纲、酸杆菌纲、相对丰度达到50%以上,植物根际富集的主要纲类细菌是β-变形菌纲.影响细菌群落结构丰富度和多样性的主要环境因素是营养物浓度、植物、采样深度和温度.
关键词:人工湿地植物根际高通量测序技术细菌群落
High throughput sequencing analysis of microbial communities in different plant rhizosphere in subsurface-flow constructed wetland
FANG Yunhao1,2
 , PENG Jianfeng2
, PENG Jianfeng2
 , SONG Yonghui2, ZHANG Panyue1, SHI Guoqiang2
, SONG Yonghui2, ZHANG Panyue1, SHI Guoqiang2 1. College of Environmental Science and Engineering, Hunan University, Changsha 410082;
2. Urban Water Environment Technology Innovation Base, Chinese Academy of Environmental Sciences, Beijing 100012
Received 13 July 2017; received in revised from 24 October 2017; accepted 25 October 2017
Supported by the National Major Science and Technology Program for Water Pollution Control and Treatment(No.2012ZX07202-005, 2014ZX07510-001)
Biography: FANG Yunhao(1994—), male, E-mail: f757195339@163.com
*Corresponding author: PENG Jianfeng, E-mail: pjf1995@163.com
Abstract: To investigate the effects of plant types, sewage water quality and sampling depth on bacterial communities in constructed wetlands, the distribution of bacterial communities in two kinds of plants, namely Phragmites communis and Typha orientalis Presl, were measured by using high-throughput sequencing technique. The results show that the richness and diversity of bacterial communities grown around Phragmites communis' rhizosphere were higher than that of Typha orientalis Presl, so the rhizosphere of Phragmites communis was more suitable for bacterial survival. Correspondingly, with the increasing of sampling-depth in same-kind plant, the richness and diversity of rhizosphere bacteria decreased. Additionally, the similarity analysis of bacterial communities shows that the distributions of bacterial communities in one plant were more similar than that in different plants. There were 13 phylum found in plant's rhizospheres. The predominant microbes were Proteobacteria, Acidobacteria, Chloroflexi and Firmicutes with their relative abundance reaching as high as 55%~78%. more than 20 class were found in plant's rhizospheres, in which the relative abundance of Alphaproteobacteria, Betaproteobacteria, Deltaproteobacteria, Gammaproteobacteria, Bacilli and Acidobacteria took up above 50%. Bettaproteobacteria was the main group in class level. Therefore, the major factors influencing the richness and diversity of microbial communities were nutrient content, plant types, sampling depth and temperature.
Key words: constructed wetlandsplant rhizospherehigh-throughput sequencing techniquemicrobial community
1 引言(Introduction)人工湿地是模仿自然湿地的生态处理技术, 通过物化反应和微生物的相互作用完成对污水的净化.近年来, 世界各地设计和建造了许多人工湿地(Vymazal, 2011; Zhang et al., 2009), 使得该技术被广泛地运用于不同类型的污水处理中(Chen et al., 2011).人工湿地可有效地去除污染物中的重金属、致病性细菌、氮、磷等有害有机污染物.据报道, 人工湿地对工业和农业废水中COD的去除率在60%以上, 而对生活污水COD的去除率能达到90%以上, 但对氮、磷污染物的去除率只有50%左右, 且不同类型的人工湿地系统对污水的净化能力有较大的差异.污水净化过程(沉淀、分解、吸附和植物吸收)与微生物的活性密不可分(Saeed et al., 2012; Zhou et al., 2015), 且微生物群落结构多样性与污水处理效果呈正相关(梁威等, 2002).细菌是微生物的重要组成部分, 能参与到碳、氮、硫等元素的循环过程中(Francis et al., 2007; Ghosh et al., 2009), 对促进底泥中污染物的分解、减少污染积累、维持良好水质具有重大的作用.因此, 研究植物根际细菌群落结构多样性与人工湿地对处理过程及环境条件之间的关系, 不仅有助于深入了解功能微生物的重要作用, 而且有利于提高该人工湿地污水净化效果和运行稳定性.
当前利用巢式PCR(RT-PCR)(Dong et al., 2012)、荧光原位杂交技术(FISH)(Sanz et al., 2007)、变性梯度凝胶电泳(DGGE)(Wakelin et al., 2008; 雷旭等, 2015; 熊家晴等, 2017)对人工湿地中微生物群落结构特征进行的研究较多, 例如, 雷旭等(2015)对复合垂直流人工湿地不同植物根际微生物群落特征进行了研究, 熊家晴等(2017)对垂直流人工湿地中微生物群落特征进行了研究.高通量测序技术是近年来兴起的一种分析方法, 主要通过大量的平行序列合成生成大量的DNA数据, 并且通过大量的可识别的OUT来评估各种环境样品的微生物多样性(Chen et al., 2015), 具有分析结果精确、实验运行快等优点.目前该技术已被广泛应用于人工湿地微生物群落结构特征的研究(Chen et al., 2015; Cao et al., 2017).例如, Chen等(2015)利用高通量测序技术对3种处理方式下的人工湿地细菌群落结构进行了分析, Cao等(2017)采用高通量测序技术对2个河口人工湿地微生物群落结构进行了分析比较.
目前, 大部分研究主要集中在水平潜流和垂直流人工湿地微生物群落结构等方面, 而对于水平潜流人工湿地中不同植物不同深度底泥细菌群落特征的研究较少.本研究选取的人工湿地由于处理量较大、植物种类较多、水质复杂等原因, 湿地底泥微生物群落结构也较复杂.为了使测序得到的微生物群落特征更加准确, 本文采用Miseq高通量测序技术对6个植物根际底泥样品的细菌群落结构进行分析, 表征不同深度不同植物根际底泥细菌群落特征, 并探究环境影响因子对细菌群落特征的影响.
2 材料和方法(Materials and methods)2.1 研究区域与采样点的设置实验样品取自人工湿地, 该人工湿地位于白塔堡河入浑河河口处, 占地15万km2.白塔堡河(123°20'24.9"~123°39'38.4"E, 41°37'06.3"~41°43'31.5"N)位于沈阳市浑南新区, 是浑河水系的主要支流.河流总长48.45 km, 总面积182 km2, 主要作用为农灌、废水泄洪和输送浑南新区污水.
该人工湿地采用潜流和表流相结合的技术对城市污水中的生活污水和工业污水进行水质净化, 湿地基质为砂石、陶粒和鹅卵石(图 1), 处理工艺为:进水→潜流湿地区→表流湿地区→滞留湿地区→生物稳定塘湿地区→湿地沉淀稳定塘→出水(图 2), 即污水先经过潜流湿地基质空隙, 流动过程中在微生物、基质和植物共同作用下, 可去除50%以上的污染物.由于该区去除了大部分的污染物, 所以研究该区域内2种植物根际底泥的微生物群落特征, 对探究人工湿地的运行具有重要的意义.其中, 芦苇底泥取自该潜流湿地中段, 而香蒲底泥取自该潜流湿地区的尾段.然后再经过后面的湿地区, 进行深度处理, 去除大部分污染物.该潜流人工湿地理化指标如表 1所示, 从进水到每个处理的湿地出水pH都呈弱碱性, 进水水质较差, 溶解氧较低, 通过两次湿地处理后水质较好, 溶解氧达到12.5 mg·L-1.通过整个系统的处理, 污染物去除率超过90%, 出水水质较好, 达到一级A标准.处理能力为丰水期3万t·d-1, 枯水期1.5万t·d-1, 潜流湿地区规格为150 m×80 m.该人工湿地除了能降低污染物浓度, 还起到环境宣教、典型示范和科技研发的作用, 并且形成特有的人工生态景观.
图 1(Fig. 1)
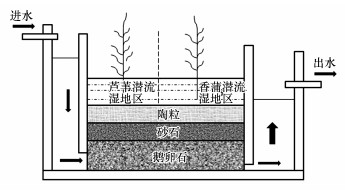 |
| 图 1 潜流人工湿地结构示意图 Fig. 1Sketch map of subsurface-flow wetland system structure |
图 2(Fig. 2)
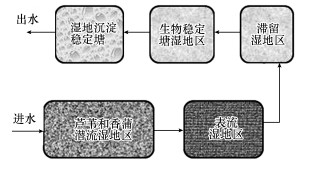 |
| 图 2 组合湿地系统示意图 Fig. 2Sketch map of subsurface-flow combined wetland system |
表 1(Table 1)
| 表 1 示范基地进、出水水质 Table 1 Water quality of experiment site | ||||||||||||||||||||||||||||||||||||
表 1 示范基地进、出水水质 Table 1 Water quality of experiment site
| ||||||||||||||||||||||||||||||||||||
2.2 样品的采集与分析底泥样品取自潜流湿地区2种不同植物(芦苇和香蒲)且不同深度根际底泥, 使用底泥采样器对每一种植物分别在5、10、20 cm深度处采集3个底泥样品, 香蒲5、10、20 cm深度底泥样品分别记为XP1、XP2、XP3, 芦苇5、10、20 cm深度底泥样品分别记为LW1、LW2、LW3, 为了减少误差, 每个样品都取自3个不同采样点(每个采样点两端及中间区域), 将3个采样点采集的样品进行混合, 采样时间为2015年6月.6个样品采样后放入无菌管中, 放入有冰块保温箱中, 运到实验室保存于-80 ℃冰箱中.
2.3 基因组DNA提取DNA提取使用Power Soil DNA Kit(王佳等, 2016), 实验操作参考试剂盒中的实验方法说明.使用1%的琼脂糖凝胶电泳对DNA的浓度和质量进行检验.
2.4 PCR扩增细菌的16S rRNA基因扩增利用巢式PCR扩增方法, 上下引物分别为338F(ACTCCTACG GGAGGCAGCAG)和806R(GGACTACHVGGGTWTC TAAT), 反应条件为:95 ℃预变性3 min; 95 ℃变性0.5 min, 55 ℃退火1.5 min, 72 ℃延伸1.5 min, 循环27次; 最后72 ℃延伸10 min, 终止温度10 ℃.
使用1%的琼脂糖凝胶电泳对扩增产进行检验.采用PCR扩增体系为20 μL:5×FastPlu Buffer 4 μL, 2.5 mmol·L-1 dNTPs 2 μL, 上、下引物各0.8 μL, FastPlu Polymerase 0.4 μL, BSA 0.2 μL, DNA模板2 μL, 最终用ddH2O补充到20 μL.
2.5 数据分析Paired-end测序通过Illumina平台, 在0.97相似度下使用QIIME软件获得物种分类的OTU, 通过OUT的计算得到Shannon指数、系统发育多样性指数(Phylogenetic diversity)和物种数(Observed species)指数.不同水平分类柱状图是各分类水平上的物种组成比例情况, 可以了解不同分类学水平上的群落结构, 柱形图通过QIIME(v1.8.0)软件绘制, 群落分布柱形图是根据QIIME(v1.8.0)软件计算的结果用R(v3.1.1)软件绘制而成.
3 结果与分析(Results and discussion)3.1 细菌群落结构丰富度和多样性克隆覆盖率指数是指测序过程中微生物群落覆盖程度, 克隆覆盖率为0.92时, 说明测序较为稳定, 本研究中每个样品克隆覆盖率均在0.90以上(表 2), 表明测序对样品覆盖度较高, 测序的数据量比较合适.而物种数可以估计各个底泥样品中细菌群落的丰富度.Shannon-Wiener多样性指数用来表示物种多样性(Müller et al., 2002), 通过研究Shannon-Wiener多样性指数可以统计各个底泥中微生物群落结构的多样性.通过这两个指数的大小可以研究人工湿地细菌丰富度和多样性.
表 2(Table 2)
| 表 2 人工湿地各个底泥样品微生物菌群丰度和多样性信息 Table 2 Abundance and diversity of bacteria in constructed wetlands | |||||||||||||||||||||||||||||||||||
表 2 人工湿地各个底泥样品微生物菌群丰度和多样性信息 Table 2 Abundance and diversity of bacteria in constructed wetlands
| |||||||||||||||||||||||||||||||||||
由表中计算结果可知, 6个样品的物种数都超过了4000, Shannon-Wiener多样性指数均大于8.79, 表明该潜流人工湿地细菌群落结构较为稳定, 人工湿地的运行也较为稳定.芦苇湿地3个底泥样品的Shannon-Wiener多样性指数为10.03~10.51, 香蒲湿地3个底泥样品的Shannon-Wiener多样性指数为8.79~9.59.芦苇根际和香蒲根际物种数的平均值分别为4840和4007, Shannon-Wiener多样性指数平均值分别为10.25和9.31, 芦苇根际底泥物种数和Shannon-Wiener多样性指数平均值均大于香蒲根际, 说明芦苇根际底泥细菌群落丰富度和多样性均高于香蒲根际微生物.通过比较同一深度不同植物物种数和Shannon指数, 发现随着水流方向物种数和Shannon-Wiener多样性指数逐渐减少, 说明细菌群落丰富度和Shannon-Wiener多样性指数逐渐递减.分别比较芦苇和香蒲3个深度物种数和Shannon-Wiener多样性指数, 发现随着深度的增加, 物种数和Shannon-Wiener多样性指数逐渐减少, 说明植物根际细菌丰富度和多样性逐渐递减.有研究发现, 人工湿地中不同深度底泥微生物数量有差异, 深度较浅的微生物数量较多(付融冰等, 2005).
研究表明, 影响微生物群落结构主要因素包括植物根际、污水营养水平和温度等(王青璐等, 2009).植物根际通过根际效应来影响微生物群落结构丰富度和多样性, 其丰富度和多样性在不同植物根际底泥中差别较大, 其中, 赵庆节等(2011)发现湿地底泥微生物丰富度和多样性顺序是美人蕉<香蒲<旱伞草<芦苇; 雷旭等(2015)发现梭鱼草、美人蕉和再力花中, 美人蕉根际微生物群落丰富度和多样性更高.营养物质也会影响微生物生长发育, 营养物质浓度越高, 微生物生长速度越快, 则微生物种类丰富度及多样性越高.研究表明, 沿着污水处理的方向污染物浓度逐渐削减, 微生物所需要营养物浓度降低, 微生物的丰富度和多样性随着水流方向逐渐递减(Martín et al., 2013), 而随着植物根际深度的增加, 污染物的浓度也减少(王青璐等, 2009).温度通过影响微生物的酶活性影响微生物生长发育, 温度超过4 ℃, 人工湿地中生物膜上的生物量会随着温度增加而增加(吴振斌等, 2003), 而生物膜上的生物量代表了微生物的种类和数量.本研究发现, 芦苇根际底泥细菌群落丰富度和多样性均高于香蒲, 一方面是由于芦苇根际分泌物更有利于菌落生长发育(赵庆节等, 2011); 另一方面是由于潜流人工湿地中污水首先经过芦苇根际底泥细菌的处理, 供微生物生长发育的有机物、氮、磷等营养物质较为丰富, 所以细菌丰富度和多样性相对较高; 然后再经香蒲根际底泥的处理, 细菌所需的营养物逐渐减少, 因而香蒲根际底泥细菌丰富度和多样性相对较低.微生物群落丰富度和多样性随着深度增加而逐渐递减, 这一方面是由于营养物质随着深度增加逐渐减少(吴振斌等, 2003); 另一方面, 随着深度增加, 温度降低(表 3), 而温度又与细菌群落多样性呈正相关.总体来说, 影响细菌群落丰富度和多样性的主要因素是植物根际、污水营养水平和采样深度, 而温度也是影响细菌群落丰富度和多样性的重要因素.
表 3(Table 3)
| 表 3 人工湿地各个底泥样品物理指标 Table 3 Physical index in constructed wetlands | |||||||||||||||||||||
表 3 人工湿地各个底泥样品物理指标 Table 3 Physical index in constructed wetlands
| |||||||||||||||||||||
3.2 细菌群落结构相似性和差异性聚类分析利用Heatmap图, 结果见图 3.每个样品的细菌群落结构有相似的地方, 也有明显的差别, 总体可划分为以下3个分支:XP2、XP3分支; XP1分支; LW1、LW2、LW3分支.相同植物细菌群落结构相似度较高, 这是由于相同植物根际分泌物较为相似, 且分泌物浓度差异较小(Calheiros et al., 2010).从Venn图(图 4)可以得到2种植物中共有和特有的OTUs, 直观地显示出样品间OTU的重叠情况, 香蒲和芦苇共有OTUs约为5000个, 所特有的OTUs分别为3317和3410个.
图 3(Fig. 3)
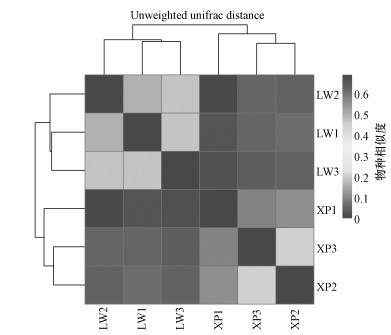 |
| 图 3 微生物群落层序聚类分析 Fig. 3Hierarchical cluster analysis of microbial communitiesfrom each activated sludge |
图 4(Fig. 4)
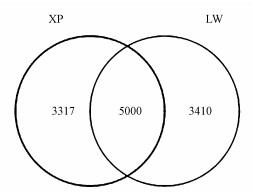 |
| 图 4 OTU venn分析结果 Fig. 4Analysis of OTU venn |
对于芦苇根际底泥细菌分析发现, LW1与LW2、LW3根际底泥群落结构虽然相似, 但也有一些差异.对于香蒲根际底泥细菌群落结构, XP1根际微生物群落结构与XP2、XP3相似性较小, 这是由于XP1处于进水较浅位置, 根际污水营养物质较为丰富, 适宜微生物生长.出现差异性的原因一方面是由于植物根际所分泌的物质主要为有机酸、芳香族蛋白质等, 虽然组成物质较为相似, 但每个物质浓度不同, 而且每种植物根际随着生长周期分泌能力也不同(陆松柳等, 2011); 另一方面原因是污水营养物质浓度和温度对差异性也有一定的影响.总体来说, 同一植物根际底泥3个不同深度样品细菌群落结构相似度较高, 不同植物根际底泥细菌群落结构有一定的相似度, 但相似度较低.
3.3 优势细菌菌群3.3.1 门类水平各个样品在门分类水平上具有较高的多样性(图 5a), 达到13个门以上, 主要包括变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、放线菌门(Actinobacteria)、硝化螺旋菌门(Nitrospirae)等, 并以变形菌门、酸杆菌门、绿弯菌门、厚壁菌门的细菌为主, 四者的约占总测序序列的70%~85%.有研究表明, 人工湿地底泥优势菌种以变形菌门、绿弯菌门和酸杆菌门为主, 所占比例高于80%(Chen et al., 2015); 而用于处理焦化废水的活性污泥在门类水平上的优势菌种以变形菌门、酸杆菌门和拟杆菌门为主(Ma et al., 2015); 四环素废水处理中, 活性污泥在门类水平上的优势菌种以变形菌门、放线菌门和厚壁菌门为主, 所占比例超过80%(Yang et al., 2016).
图 5(Fig. 5)
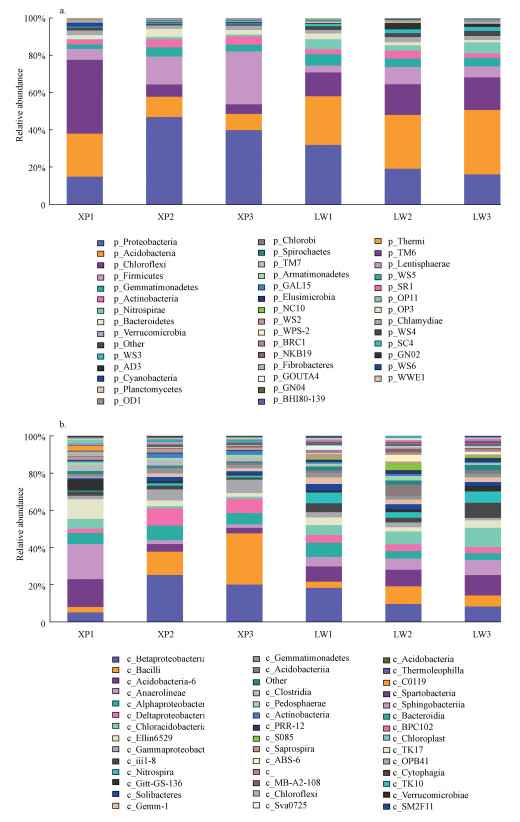 |
| 图 5 各底泥样品门分类(a)及纲分类(b)水平上细菌菌落组成 Fig. 5Sedimentation classification of bacterial sequencing at level of phylum(a) and level of class(b) |
优势菌门类中, 变形菌门在各样品中均占较大的比例(15%~45%), 此研究结果与之前有关人工湿地的研究一致(Ansola et al., 2014).变形菌门在生物脱氮除磷等其他污染物降解中具有核心作用(Hoefel et al., 2005), 通过潜流湿地进出水水质也能说明被测湿地底泥具有良好的脱氮除磷及去除污染物能力.酸杆菌门和绿弯菌门出现在6个样品中, 分别占总测序序列的10%~40%和15%~45%;底泥中的酸杆菌门可以参与到枯枝落叶分解的碳循环中(Eichorst et al., 2007); 丝状细菌属于绿弯菌门, 通常出现在污水处理过程中, 它们在枯枝落叶分解的碳循环中具有潜在作用(Chen et al., 2015), XP1中绿弯菌门占总测序序列的40%, 该点相对丰度最高, 表明此处丝状菌快速生长.6个样品中都出现了厚壁菌门, 且香蒲根际底泥中的厚壁菌门丰富度高于芦苇底泥, 厚壁菌门在城市污水处理厂中普遍存在(Ye et al., 2011), 说明厚壁菌门在污水处理中有重要的作用.
3.4.2 纲类水平各个样品在纲水平具有较高的多样性(图 5b), 达到20纲以上, 主要包括α-变形杆菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、芽孢杆菌纲(Bacilli)、酸杆菌纲(Acidobacteria-6)、厌氧绳菌纲(Anaerolineae)、硝化螺菌纲(Nitrospira)、芽单胞菌门(Gemmatimonadetes)等.虽然有一些研究报道了不同类型人工湿地细菌纲类分布, 但关于人工湿地主要纲类仍在讨论, 因为不同处理方法产生了不同的细菌(Ibekwe et al., 2007; Calheiros et al., 2009).出现不一致的原因主要是由于湿地类型、废水的差异来源, 土壤基质、操作参数和环境参数不同(Truu et al., 2009).
α-变形杆菌纲、β-变形菌、δ-变形菌纲、γ-变形菌纲、厌氧绳菌纲在各个样品中皆有分布, 且含量较高, 皆属于革兰氏阴性菌, 说明该人工湿地根际周围更容易富集革兰氏阴性菌, 有利于对污染物进行生物降解.细菌群落中富集β-变形菌纲是最多的, 香蒲根际底泥中富集的β-变形菌纲高于芦苇, 说明香蒲根际在10 cm处进行枯枝落叶降解时出现了许多可以利用的有机碳, 因为该类细菌更喜欢在高含量的有机质中生存(Wobus et al., 2003).此外, 还发现了很多有益菌, 如硝化螺旋菌纲(Nitrospira), 它能将NO2氧化为NO3-, 减少污水中氮离子含量, 若缺少该有益菌, 会导致氨氮、硝酸盐、亚硝酸盐等氮循环体系的间断, 从而引发水生生态环境的破坏和河流中水生生物的死亡.研究表明(Kieft et al., 1994), 杆菌等对环境变化适应能力较强, 而假单胞杆菌对环境变化适应能力极差, 主要受营养物浓度影响较为明显.本研究取得了相同的结果, 芽孢杆菌纲、酸杆菌纲等杆菌在6个样品中均有分布, 且含量较高; 假单胞杆菌在2种植物根际周围很少发现, 说明假单胞杆菌在根际底泥微生物中的竞争力差, 不能在根际中大量存在.
4 结论(Conclusions)1) 本研究人工湿地中细菌种类较为丰富且多样性较高, 可以更有效地去除污染物.人工湿地细菌丰富度和多样性随着深度和水流方向逐渐减少, 呈规律性变化.芦苇根际底泥细菌丰富度和多样性均高于香蒲根际底泥.影响细菌群落丰富度和多样性的主要因素为植物根际、污水营养水平和采样深度, 而温度也是影响细菌群落丰富度和多样性的重要因素.
2) 同一植物不同深度细菌群落结构相似度较高, 但也有一定差异性.香蒲和芦苇相似的OTUs约有5000个, 有一定的相似度, 但相似度较低.
3) 6个植物根际底泥样品的优势菌门以变形菌门、拟杆菌门、绿弯菌门为主, 变形菌门在各样品中均占较大的丰度比例, 平均比例高达27.5%.而优势菌纲以α-变形杆菌纲、β-变形菌、δ-变形菌纲、γ-变形菌纲、芽孢杆菌纲、酸杆菌纲为主, 含量最多的是β-变形菌, 平均含量达到18%.
参考文献
| Ansola G, Arroyo P, Sáenz L E. 2014. Characterisation of the soil bacterial community structure and composition of natural and constructed wetlands[J]. Science of the Total Environment, 473(3): 63–71. |
| Calheiros C S, Duque A F, Moura A, et al. 2009. Changes in the bacterial community structure in two-stage constructed wetlands with different plants for industrial wastewater treatment[J]. Bioresource Technology, 100(13): 3228–3235.DOI:10.1016/j.biortech.2009.02.033 |
| Calheiros C S, Teixeira A, Pires C, et al. 2010. Bacterial community dynamics in horizontal flow constructed wetlands with different plants for high salinity industrial wastewater polishing[J]. Water Research, 44(17): 5032–5038.DOI:10.1016/j.watres.2010.07.017 |
| Cao Q, Wang H, Chen X, et al. 2017. Composition and distribution of microbial communities in natural river wetlands and corresponding constructed wetlands[J]. Ecological Engineering, 98: 40–48.DOI:10.1016/j.ecoleng.2016.10.063 |
| Chen G Q, Shao L, Chen Z M, et al. 2011. Low-carbon assessment for ecological wastewater treatment by a constructed wetland in beijing[J]. Ecological Engineering, 37(4): 622–628.DOI:10.1016/j.ecoleng.2010.12.027 |
| Chen Y, Wen Y, Tang Z, et al. 2015. Effects of plant biomass on bacterial community structure in constructed wetlands used for tertiary wastewater treatment[J]. Ecological Engineering, 84: 38–45.DOI:10.1016/j.ecoleng.2015.07.013 |
| Dong X, Reddy G B. 2012. Ammonia-oxidizing bacterial community and nitrification rates in constructed wetlands treating swine wastewater[J]. Ecological Engineering, 40(3): 189–197. |
| Eichorst S A, Breznak J A, Schmidt T M. 2007. Isolation and characterization of soil bacteria that define Teniglobus gen.nov., in the phylum Acidobacteria[J]. Appllied and Environment Microbiology, 73(8): 2708–2717.DOI:10.1128/AEM.02140-06 |
| Francis C A, Beman J M, Kuypers M M. 2007. New processes and players in the nitrogen cycle:the microbial ecology of anaerobic and archaeal ammonia oxidation[J]. Isme Journal, 1(1): 19–27.DOI:10.1038/ismej.2007.8 |
| 付融冰, 杨海真, 顾国维. 2005. 人工湿地基质微生物状况与净化效果相关分析[J]. 环境科学研究, 2005, 18(6): 44–49. |
| Ghosh W, Dam B. 2009. Biochemistry and molecular biology of lithotrophic sulfur oxidation by T-axonomically diverse bacteria and archaea[J]. Fems Microbiology Reviews, 33(6): 999–1043.DOI:10.1111/j.1574-6976.2009.00187.x |
| Hoefel D, Monis P T, Grooby W L, et al. 2005. Profiling bacterial survival through a water treamentprocess and subsequent distribution system[J]. Journal of Applied Microbiology, 99(1): 175–186.DOI:10.1111/jam.2005.99.issue-1 |
| Ibekwe A M, Lyon S R, Leddy M, et al. 2007. Impact of plant density and microbial composition on water quality from a free water surface constructed wetland[J]. Applied Microbiology, 102(4): 921–936. |
| Kieft T L, Ringelberg D B, White D C. 1994. Changes in esterlinked phospholipid fatty acid profiles of subsurface bacteria during starvation and desication in a porous medium[J]. Applied and Environmental Microbiology, 60(9): 3292–3299. |
| 雷旭, 李冰, 李晓, 等. 2015. 复合垂直流人工湿地系统中不同植物根际微生物群落结构[J]. 生态学杂志, 2015, 34(5): 1373–1381. |
| 梁威, 吴振斌, 周乔红, 等. 2002. 构建湿地基质微生物与净化效果及相关分析[J]. 中国环境科学, 2002, 22(3): 282–285. |
| 陆松柳, 张辰, 徐俊伟. 2011. 植物根系分泌物分析及对湿地微生物群落的影响研究[J]. 生态环境学报, 2011, 20(4): 676–680. |
| Ma Q, Qu Y, Shen W, et al. 2015. Bacterial community compositions of coking wastewater treatmentplants in steel industry revealed by Illumina high-throughputsequencing[J]. Bioresource Technology, 179: 436–443.DOI:10.1016/j.biortech.2014.12.041 |
| Martín M, Gargallo S, Hernández-Crespo C, et al. 2013. Phosphs and nitrogen removal from tertiary treated urban wastewaters by a vertical flow constructed wetland[J]. Ecological Engineering, 61(19): 34–42. |
| Müller A K, Westergaard K, Christensen S, et al. 2002. The diversity and function of soil microbial communities exposed to different disturbances[J]. Microbial Ecology, 44(1): 49–58.DOI:10.1007/s00248-001-0042-8 |
| Saeed T, Sun G. 2012. A review on nitrogen and organics removal mechanisms in subsurface flow constructed wetlands:dependency on environmental parameters, operating conditions and supporting media[J]. Environment Management, 112(24): 429–448. |
| Sanz J L, K?chling T. 2007. Molecular biology technique used in wasterwater treatment:An overview[J]. Process Biochemistry, 42(2): 119–133.DOI:10.1016/j.procbio.2006.10.003 |
| Truu M, Juhanson J, Truu J. 2009. Microbial biomass, activity and community composition in constructed wetlands[J]. Science of the Total Environment, 407(13): 3958–3971.DOI:10.1016/j.scitotenv.2008.11.036 |
| Vymazal J. 2011. Constructed wetlands for wastewater treatment:five decades of experience[J]. Environment Science, 45(1): 61–69.DOI:10.1021/es101403q |
| Wakelin S A, Colloff M J, Kookanna R S. 2008. Effect of wastewater treatment plant effluent on microbial funcrion and community structure in the sediment of a freshwater stream with variable seasonal flow[J]. Applied and Environmental Microbiology, 74(9): 2659–2668.DOI:10.1128/AEM.02348-07 |
| Wobus A, Bleul C, Maassen S, et al. 2003. Microbial diversity and functional characterization of sediments from reservoirs of different trophic state[J]. Fems Microbiology Ecology, 46(3): 331–347.DOI:10.1016/S0168-6496(03)00249-6 |
| 王佳, 彭剑峰, 宋永会, 等. 2016. 浑河底泥细菌与古菌群落结构空间变化特征研究[J]. 环境科学学报, 2016, 36(1): 92–97. |
| 王青璐, 彭明春, 赵安娜. 2009. 人工湿地中影响微生物空间分布因素的探讨[J]. 环境科学导刊, 2009, 28(2): 1–3. |
| 吴振斌, 周乔红, 贺锋, 等. 2003. 构建湿地中试系统基质剖面微生物活性的研究[J]. 中国环境科学, 2003, 23(4): 422–426. |
| 熊家晴, 李珊珊, 葛媛, 等. 2017. 处理高污染河水垂直流人工湿地微生物群落特性[J]. 环境工程学报, 2017, 11(3): 1959–1965.DOI:10.12030/j.cjee.201511160 |
| Yang K, Yue Q, Kong J, et al. 2016. Microbial diversity in combined UAF-UBAF system with novel sludge and coal cinder ceramic fillers for tetracycline wastewater treatment[J]. Chemical Engineering Journal, 285: 319–330.DOI:10.1016/j.cej.2015.10.019 |
| Ye L, Shao M F, Zhang T, et al. 2011. Analysis of the bacterial community in a laboratory-scale nitrification reactor and a wastewater treatment plant by 454-pyrosequencing[J]. Water Research, 45(15): 4390–4398.DOI:10.1016/j.watres.2011.05.028 |
| Zhou Y L, Jiang H L, Cai H Y. 2015. To prevent the occurrence of black water agglomerate through delaying decomposition of cyanobacterial bloom biomass by sediment microbial fuel cell[J]. Journal of Hazardous Materials, 287(1): 7–15. |
| Zhang D Q, Gersberg R M, Tansoon K. 2009. Constructed wetlands in China[J]. Ecological Engineering, 35(10): 1367–1378.DOI:10.1016/j.ecoleng.2009.07.007 |
| 赵庆节. 2011. 种植不同植物的人工湿地土壤微生物群落研究[J]. 上海交通大学学报, 2011, 29(3): 47–52. |
