 , 李蕾, 赵小飞, 伍迪, 瞿莉, 彭绪亚
, 李蕾, 赵小飞, 伍迪, 瞿莉, 彭绪亚

重庆大学三峡库区生态环境教育部重点实验室, 重庆 400045
收稿日期: 2017-06-25; 修回日期: 2017-08-08; 录用日期: 2017-08-09
基金项目: 中央高校基本科研业务费项目(No.106112017CDJXY210006)
作者简介: 何琴(1988-), 女, 博士, E-mail:hq88221@163.com
通讯作者(责任作者): 彭绪亚(1963—), 男, 教授, 博士生导师, 研究领域主要为固体废物污染控制与资源化.E-mail: xypeng33@126.com
摘要: 以中温餐厨垃圾(FW)厌氧消化反应器为研究对象,结合稳定运行过程中的微生物群落结构特征,考察了两种常见的厌氧消化反应器-完全混合式反应器(CSTR)和有回流的推流式反应器(R-PFR)的运行效率和稳定性.结果表明,两种构型的反应器均能在3.0 kg·m-3·d-1(以VS计)负荷下稳定高效地运行.R-PFR具有更稳定的稳定性指数,如总碱度(TA)和挥发性脂肪酸比TA值(VFA/TA),以及更低的氨氮(TAN)和游离氨(FAN)浓度,但产气效率(如比甲烷产率(SMP))不及CSTR.R-PFR中以Chloroflexi门(37.35%)和Firmicutes门(31.22%)为优势细菌,而CSTR中以Bacteroidetes门(31.14%)与Firmicutes门(44.41%)为优势细菌.CSTR和R-PFR均以Methanosaeta属为优势产甲烷菌(98.72%和84.90%),乙酸型产甲烷途径为主要的产甲烷途径.但CSTR中除Methanosaeta属以外还有一定丰度的混合营养型的Methanosarcina,以及氢营养型Methanospirillum和Methanolinea.CSTR中具有对VFA和TAN更具耐受性的产甲烷菌群,更有利于餐厨垃圾产甲烷过程的稳定进行.由于R-PFR的敏感性较低,有利于处理剧烈变化的底物,但R-PFR容易出现严重的局部酸化现象,不利于长期处理过高负荷的易降解底物(如餐厨垃圾).这些结果可为优化餐厨垃圾厌氧消化工艺设计提供基础依据.
关键词:餐厨垃圾厌氧消化微生物群落推流式反应器完全混合式反应器
Comparison of R-PFR and CSTR performance and microbial community structure during anaerobic digestion of food waste
HE Qin
 , LI Lei, ZHAO Xiaofei, WU Di, QU Li, PENG Xuya
, LI Lei, ZHAO Xiaofei, WU Di, QU Li, PENG Xuya

Key Laboratory of the Three Gorges Reservoir Region's Eco-environment, Ministry of Education, Chongqing University, Chongqing 400045
Received 25 June 2017; received in revised from 8 August 2017; accepted 9 August 2017
Supported by the Fundamental Research Funds for the Central Universities(No.106112017CDJXY210006)
Biography: HE Qin(1988—), female, Ph.D., E-mail:hq88221@163.com
*Corresponding author: PENG Xuya, E-mail:xypeng33@126.com
Abstract: To identify the most efficient system for conversion of food waste (FW) into biogas, FW fermentation was investigated in two types of reactors:a completely-stirred tank reactor (CSTR) and a plug-flow reactor with a reflux ratio (R-PFR). The efficiency, stability, and microbial community structure in the reactors were compared. Stable fermentation was achieved under an organic loading rate (OLR) of 3.0 kgVS·m-3·d-1 in both reactors. Compared with the CSTR, total alkalinity (TA) and ratio of volatile fatty acids (VFA) to TA (VFA/TA) were more stable, and inhibitors such as total ammonia-nitrogen (TAN) and free ammonia-nitrogen (FAN) concentrations were lower in R-PFR. However, specific methane production (SMP) was higher in the CSTR. The phyla Chloroflexi (37.35%) and Firmicutes (31.22%) were predominant in the R-PFR, whereas Firmicutes (44.41%) and Bacteroidetes (31.14%) were more abundant in the CSTR. The genus Methanosaeta accounted for 98.72% and 84.90% of the total population in the CSTR and R-PFR, respectively, indicating that the main methanogenic pathway in both reactors was acetoclastic methanogenesis. In addition to Methanosaeta, mixotrophic methanogens such as Methanosarcina (9.72%) and hydrogenotrophic methanogens such as Methanospirillum and Methanolinea were detected in the CSTR. The methanogenic community obtained in the CSTR had a greater tolerance to high ammonia and VFA levels, which is conducive to stable and efficient methanogenesis. R-PFR may be more appropriate for highly variable substrate, as shock loads can vary spatially in the reactor. However, R-PFR systems are not suitable for long-term treatment of highly degradable substrate such as FW, as local acidification may occur. Our results provide a basis for the optimization of anaerobic FW digestion.
Key words: food wasteanaerobic digestionmicrobial communityplug-flow reactorcompletely-stirred tank reactor
1 引言(Introduction)餐厨垃圾(Food waste, FW)具有高有机质含量(主要是蛋白质、油脂和有机酸)、高含水率及低热值的特性, 相比于常规的固体废物处理方法(如焚烧和填埋), 厌氧消化更适合处理餐厨垃圾, 同时以沼气的方式从中回收可再生能源.而不同的反应器构型会影响厌氧消化系统的运行效率, 完全混合式反应器(Completely-stirred tank reactor, CSTR)和推流式反应器(Plug-flow reactor, PFR)是有机物厌氧消化领域中最常见的两种反应器(Guo et al., 2014; Kim et al., 2013; Kothari et al., 2014; Masse et al., 2013; Patinvoh et al., 2017).CSTR的最大特点是通过搅拌桨叶或混合泵进行连续性地或周期性地混合, 理论上底物进入反应器后会与其中的污泥完全混合, 不存在任何组分的浓度梯度.相反地, 理想的PFR不将底物与所有污泥完全混合, 而是与部分污泥混合后从反应器的进料端进入反应器, 使其在反应器长度方向呈活塞方式依次向前推进, 直至反应器的出料端出料(Kothari et al., 2014; Rowse, 2011).CSTR中底物和消化污泥完全混合, 微生物和基质能够充分接触, 传质效率高.而PFR不需要搅拌, 尤其是在面对高含固率有机物(如畜禽粪便、农作物秸秆)的发酵处理时, 减小了动力消耗, 降低了运行成本(Rowse, 2011), 因此, 两类反应器在实际运行过程中均被广泛使用(Guo et al., 2014; Kim et al., 2013; Masse et al., 2013; Patinvoh et al., 2017).
选择合适的反应器对提高厌氧消化的运行效率、保证过程稳定性都具有重要意义(Kastner et al., 2012), 因此, 研究人员也尝试对这两类反应器进行比选.例如, Yue等(2011)采用不同构型的反应器发酵牛粪, 发现CSTR更适合为产乙醇准备AD纤维;Wright等(2004)在对美国纽约州5个牛场的消化反应器进行经济性比较过程中发现, CSTR反应器的产气量和经济性明显高于PFR等反应器.可见, 现有的反应器对比研究基本集中于对运行性能进行分析(Kastner et al., 2012; Wright et al., 2004; Yue et al., 2011).然而, 微生物参与有机底物厌氧消化过程的各个阶段(水解、酸化、产氢产乙酸和产甲烷)是厌氧消化过程的作用主体.不同的运行条件, 如反应器构型对微生物群落结构也具有明显的影响, 进而会影响反应器的性能.鉴于此, 本研究拟在探析不同运行条件下运行性能差异的同时, 研究微生物群落的差异, 以便于分析两类反应器性能差异的微生物机理.
为了缓和PFR进料端过高的局部负荷, 提高其运行稳定性, 本研究的PFR在运行过程中使用5:1的回流比, 即使用有回流的推流式反应器(Plug-flow reactor with a reflux ratio, R-PFR), 分别在CSTR和R-PFR中进行餐厨垃圾的厌氧消化, 采用理化分析研究两个反应器的运行效率及稳定性参数差异, 结合高通量测序研究两个系统中的微生物生态多样性和群落结构差异.旨在系统地考察两种构型反应器的性能, 为优化餐厨垃圾厌氧消化工艺设计提供依据.
2 材料与方法(Materials and methods)2.1 消化底物与接种物消化底物为取自重庆大学某学生食堂的餐厨垃圾.取回后采用筛网手动滤除多余的水分和油脂, 去除骨头、塑料袋和纸巾等杂质, 并采用粉碎机破碎至粒径≤5 mm.密封后于-18 ℃条件冷冻保存, 使用前2 d于4 ℃解冻.
接种污泥取自重庆市白市驿某户农家沼气池的常温消化污泥.该消化污泥在接种前过10目筛, 去除其中的无机大颗粒混杂物, 再对筛下污泥进行进一步破碎处理并混合均匀, 这一部分污泥作为CSTR的接种污泥;为满足R-PFR运行含固率(Total solids, TS)要求(20%~40%)(Kothari et al., 2014), 上述污泥进一步沉淀离心后用于R-PFR的接种.最后这两种污泥均需在(37±1) ℃下预孵化2周, 以去除其中残留的有机物.餐厨垃圾和接种污泥的理化性质见表 1.
表 1(Table 1)
| 表 1 餐厨垃圾与接种污泥的物理化学性质 Table 1 Physicochemical properties of food waste and inoculum | ||||||||||||||||||||||||||||||
表 1 餐厨垃圾与接种污泥的物理化学性质 Table 1 Physicochemical properties of food waste and inoculum
| ||||||||||||||||||||||||||||||
2.2 实验装置及运行CSTR总容积为50 L, 工作容积为30 L, 从反应器顶部进料口进料, 底部出料口出料或取样.搅拌转速为90 r·min-1, 采用搅拌3 h、停歇3 h的间歇搅拌方式.通过与循环加热水箱相连的容器夹套维持消化污泥温度为(37±1) ℃.一次性向反应器内投加30 L经预孵化后的接种污泥, 采用每天进、出料一次的半连续方式运行.
R-PFR总容积为30 L, 工作容积为18 L, 顶部进料口进料, 底部出料口出料.温度为(37±1) ℃, 温控方式同CSTR.一次性投加18 L接种污泥, 采用半连续方式运行, 回流比为5:1, 即进料时先从R-PFR底部出料口取出部分污泥分成6份, 一份作为出料, 剩余的5份污泥与餐厨垃圾混合均匀后从反应器顶部进料口进料.两种构型反应器的实验系统示意图见图 1.
图 1(Fig. 1)
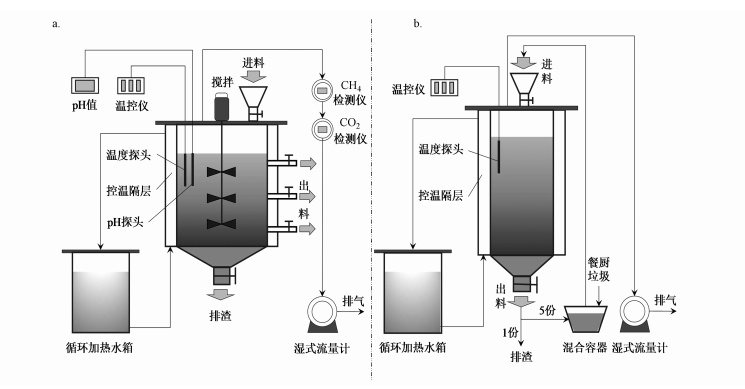 |
| 图 1 厌氧消化实验系统示意图 (a.CSTR体系; b.R-PFR体系) Fig. 1Schematic diagram of anaerobic digestion experiment system (a.CSTR system; b.R-PFR system) |
CSTR和R-PFR均在3.0 kg·m-3·d-1(以VS计)负荷下运行1个水力停留时间(Hydraulic retention time, HRT)(HRT为45 d).监测两个反应系统在运行期间的理化性质动态及稳定运行时的微生物群落结构状况, 以对比分析不同构型反应器对厌氧消化过程的影响.其中, 考虑到R-PFR构型的特殊性, 理论上进料1个HRT后的出料才能代表进料第1 d的出料.但为缓和在R-PFR进料端过高的局部负荷, 提高其运行稳定性, 本研究的R-PFR在运行过程中使用了5:1的回流比, 故原反应器中的18 L接种污泥在18.0/(0.4×6)=7.5 d即完成了替换, 即第8 d的出料就可代表进料第1 d的出料.故本研究所展示的R-PFR中与出料相关的参数(即稳定性参数)是该反应器在3.0 kg·m-3·d-1(以VS计)负荷下运行从第8 d开始计算的1个HRT(即实际运行的8~52 d)的数据, 而采用第1 d开始的1个HRT(即实际运行的1~45 d)的产气参数数据来匹配所展示的稳定性参数.另外, 为方便分析, 在下文中将实际运行第8 d的稳定性参数的时间标记为所展示稳定性参数的第1 d, 后面的时间顺延.
2.3 理化指标分析方法CSTR的pH值、产气量和气体成分通过在线监测, 每天记录一次数据.R-PFR的pH值在每天进料前用PHS-3E酸度计(上海雷磁, 中国)测定;产气量通过湿式气体流量计(长春汽车滤清器有限责任公司, 中国)测定;而气体成分通过BIOGAS 5000便携式沼气分析仪(Geotech, 英国)测定, 每天一次.
在进料前取污泥样品进行其他理化参数的测定.TS含量、挥发性固体(Volatile solids, VS)含量每2~3 d测定一次;总碱度(Total alkalinity, TA)、总氨氮(Total ammonia nitrogen, TAN)、总挥发性脂肪酸(Volatile fatty acids, VFA)在TAN低于1300 mg·L-1情况下每3 d测定一次, 否则每天测定一次;VFA成分每3 d测定一次;这些指标的具体测定方法参考文献(Li et al., 2016).每个指标测定设3个平行样, 结果取平均值.
沼气产量换算成标准状态(0 ℃、101.325 kPa)下的气体体积.VS去除率(VS reduction, RVS)和游离氨(Free ammonia nitrogen, FAN)浓度计算方法参考文献(Li et al., 2016).比沼气产率(Specific biogas production, SBP)和比甲烷产率(Specific methane production, SMP)分别表示系统添加单位有机质(以1 kg VS计)所产生的沼气量(m3·kg-1)和甲烷量(m3·kg-1).
2.4 统计学分析使用PASW Statistic软件(version 18.0)分析各个理化指标的均值和标准偏差, 并对两个反应器理化指标之间的统计学差异进行T检验评估(显著性水平5%).
2.5 微生物Illumina MiSeq高通量测序由于两种接种污泥在预孵化过程中所处环境条件基本相同, 经相同时间预孵化后两种接种污泥的微生物群落结构仍基本相同, 故在接种污泥预孵化完成后分别对两种接种污泥各采集3个样品, 将两种污泥样品进行两两混匀后作为接种污泥样品;随后在两个反应器的稳定运行的同一天各采集3个污泥样品.
使用E.Z.N.A Soil DNA试剂盒(Omega, 美国), 参照操作说明书进行基因组DNA抽提.使用AxyPrep DNA gel Recovery Kit(AXYGEN, USA)对所提取的DNA进行纯化, 随后将3份DNA进行混合.然后对16S rRNA基因片段进行PCR扩增(ABI GeneAmp? 9700型, ABI, 美国).细菌扩增引物为338F(5′-ACTCC TACGG GAGGC AGCAG-3′)和806R(5′-GGACT ACCAG GGTAT CTAAT-3′);古菌扩增引物为Arch344F (5′-ACGGG GYGCA GCAGG CGCGA-3′)和Arch915R(5′-GTGCT CCCCC GCCAA TTCCT-3′)(王晓华等, 2016).每个样本3个重复进行PCR扩增, 20 μL PCR反应体系如下:4 μL的5×FastPfu Buffer, 2 μL的2.5 mmol·L-1 dNTPs, 0.8 μL的上下游引物(5 μmol·L-1), 0.4 μL的FastPfu Polymerase(TransGen AP221-02, TransGen Biotech, 中国), 0.2 μL的BSA, 10 ng的DNA模板, 用超纯水补足体积.16S rRNA基因扩增程序如下:95 ℃预变性3 min;95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s, 35个循环;最后在72 ℃延伸10 min.扩增产物混合后用2%琼脂糖凝胶电泳检测, 纯化后再送往上海美吉生物技术有限公司进行Illumina MiSeq高通量测序.采用Qiime软件(version 1.17)和UCHIME对原始数据进行过滤、修剪并嵌合体序列.采用Uparse (version 7.1)进行运算分类单元(Operational Taxonomic Units, OTU)聚类分析(97%相似度), 并通过RDP Classifier (version 2.2)对OTU的代表序列作分类学分析(70%的相关系数阈值).基于OTU聚类分析结果, 采用Mothur软件(Mothur v.1.30.1)对OTU进行多样性指数分析.将序列提交到NCBI SRA数据库, 登录号为SRP093199.
3 结果与讨论(Results and discussion)3.1 运行效率对比分析CSTR和R-PFR在运行期间的效率参数变化情况如图 2所示.从图 2a和2b可以看出, 两个反应器的VS去除率(RVS)在整个运行期间均维持在较高水平, 且R-PFR的RVS(90.72%±1.37%)高于CSTR(87.10%±1.98%)(p<0.05).产气方面, CSTR的甲烷含量(60.42%±3.72%)显著高于R-PFR(56.03%±0.80%)(p<0.05).
图 2(Fig. 2)
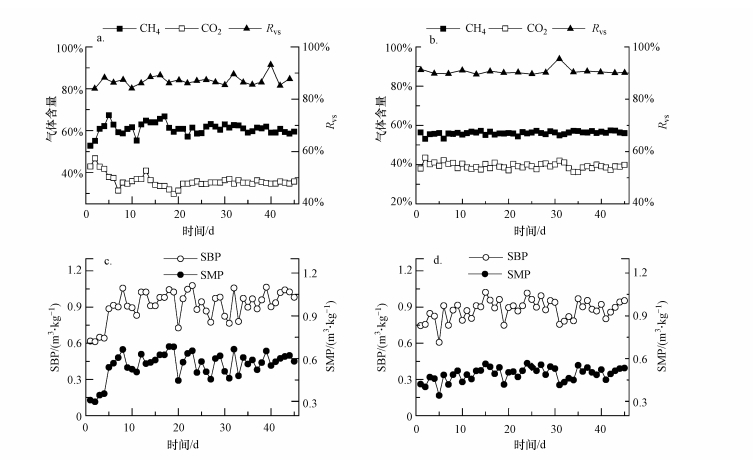 |
| 图 2 运行过程中效率参数变化情况 (CSTR(a)和R-PFR(b)的CH4、CO2含量和RVS; CSTR(c)和R-PFR(d)的SBP和SMP) Fig. 2Variations of efficiency parameters during the operation (Methane content, carbon dioxide content and RVS in CSTR (a) and R-PFR (b); SBP and SMP in CSTR (c) and R-PFR (d)) |
CSTR的比甲烷产率(SMP)和比沼气产率(SBP)在运行初期有一个较大的提升(1~8 d)(图 2c), 在这个阶段, 微生物群落完成了从接种污泥的猪粪和秸秆厌氧消化向餐厨垃圾厌氧消化的驯化.而在R-PFR中这种提升的趋势较平缓, 且维持时间较长(1~15 d)(图 2d).整个运行期间, R-PFR的SBP((0.876±0.084) m3·kg-1)与CSTR的SBP ((0.914±0.123) m3·kg-1)并无明显差异(p>0.05), 但SMP((0.491±0.049) m3·kg-1)却显著低于CSTR的SMP((0.555±0.094) m3·kg-1)(p<0.05).这样的差别可能是由这两种构型反应器的不同进料或混合方式及不同TS含量引起的.因为R-PFR是外部混合, 反应器内部没有搅拌及其较高的TS含量导致其传质效果较差.另外, 由于R-PFR推流式运行方式及回流比5:1的特性, 新鲜进料仅与其5倍体积的污泥混合, 虽然R-PFR在运行过程中的TS含量约为CSTR的2.5倍(图 4e和4f), 其进料端与新鲜物料混合的污泥中的微生物数量与CSTR相比仍然有限, 单位微生物上所承受的负荷仍远高于CSTR.而水解酸化细菌为应对进料有机物而大量增殖, 快速水解产酸;相比之下, 世代时间较长的产甲烷菌则不能及时消耗增加的酸, 从而在局部引起水解酸化过程与产甲烷过程的不平衡, 甚至严重时出现局部的酸积累现象, 抑制产甲烷活性, 产甲烷速率受影响(Li et al., 2015; Rowse, 2011).相反地, 餐厨垃圾进入CSTR后在搅拌桨叶的作用下同反应器中的所有污泥完全混合, 单位微生物的平均负荷要远低于R-PFR, 且低TS含量及搅拌作用保证了良好的传质效果, 故水解酸化细菌大量繁殖所产生的有机酸, 由于浓度稀释对产甲烷菌的抑制效果减弱, 厌氧消化过程能够高效有序地进行, 加速产甲烷.本研究中R-PFR得到的SMP与Guo等(2014)中温发酵餐厨垃圾报道的SMP((0.493±0.032) m3·kg-1)相近, 并均高于Zhang等(2013)中温厌氧消化餐厨垃圾得到的SMP(0.405 m3·kg-1).
图 4(Fig. 4)
 |
| 图 4 运行过程中稳定性参数变化情况 (CSTR(a)和R-PFR(b)的VFA; CSTR(c)和R-PFR(d)的TAN、FAN和pH值; CSTR(e)和R-PFR(f)的TA、VFA/TA和TS) Fig. 4Variations of stability parameters during the operation (VFA in CSTR(a) and R-PFR(b); TAN, FAN and pH in CSTR(c) and R-PFR(d); TA, VFA/TA and TS in CSTR(e) and R-PFR(f)) |
选择与各个反应器运行期间的SMP和SBP均值最接近的第38 d(CSTR)和第38 d(R-PFR)的24 h产气记录, 分别做SBP速率和累积SBP曲线, 结果如图 3所示.从图中可以看出, CSTR在进料后快速产气, 并在进料后的13 h之内达到总SBP的80%.而R-PFR在进料后的最大SBP速率(0.050 m3·kg-1·h-1)明显低于CSTR(0.109 m3·kg-1·h-1), 且在约18 h之后才达到总SBP的80%.进一步印证了上述关于CSTR与R-PFR进料与混合方式及TS含量差异对产气影响的分析.另外, R-PFR的累积SBP曲线接近线性, 说明在24 h的进料间隔内该系统中底物量足够R-PFR中的微生物利用, 有可能在此基础上继续提高进料有机负荷(OLR)会加大微生物负载, 加剧进料端的局部酸化现象, 甚至影响整个系统的产甲烷效率(Li et al., 2014; Qiao et al., 2013; Rowse, 2011).
图 3(Fig. 3)
 |
| 图 3 CSTR(a)和R-PFR(b)中24 h SBP速率和累积SBP变化曲线 Fig. 3SBP rate and cumulative SBP in CSTR (a) and R-PFR (b) |
3.2 稳定性参数对比CSTR和R-PFR的稳定性参数在运行期间的变化情况如图 4所示.开始进料后, 由于水解酸化细菌为应对突如其来的负载而大量繁殖, 产生大量VFA, 但产甲烷菌的繁殖速率较慢, 还没有足够量的产甲烷菌来代谢掉这部分VFA, 从而造成CSTR反应器暂时的酸积累现象(图 4a).这个现象导致CSTR的pH值在最开始进料的几天内较低, 但在微生物完成驯化后得到了缓解, pH值逐渐上升并维持在一个较高的水平(图 4c).而R-PFR的pH值则在发酵开始第4 d才有迅速下降的趋势, 随后在波动中缓慢回升.这可能是由于R-PFR中的酸积累现象只在进料端出现, 取样口距离进料端有一定的距离, 监测指标有延迟.但整个运行期间, 两个系统的pH值均维持在厌氧消化的适宜范围内(7.0~8.0)(Weiland, 2010).另外, R-PFR中的VFA波动较小, 维持在(0.403±0.056) g·L-1, 与CSTR的整体VFA水平((0.560±0.417) g·L-1)并无明显差异(p>0.05).但两个反应器中的VFA成分有较大区别, R-PFR中以乙酸为主, 约占总VFA的68.21%±0.82%, 其余是少量的丙酸(17.94%±0.57%)和正戊酸(13.85%±0.43%)(图 4b).而CSTR的VFA以乙酸和丙酸为主要成分, 分别占总VFA的44.22%±9.57%和34.70%±6.80%(图 4a).
足够的TA可保证厌氧消化系统具有良好的缓冲能力, 避免pH值迅速降低而导致某些微生物受到抑制.如图 4e所示, CSTR的TA在运行初期呈波动中上升的趋势, 并在运行期末达到平台期.R-PFR的TA浓度则是在整个运行期间呈逐渐上升的趋势, 运行结束时为7.422 g·L-1, 均值为(5.426±1.450) g·L-1, 明显低于CSTR(p<0.05), 但在整个运行期间更加平稳(图 4f).VFA/TA值则可以直观地反映VFA对TA的消耗能力, 常被用于评判厌氧反应器的稳定性(Li et al., 2014).如图 4e和4f所示, CSTR的VFA/TA由于运行初期的酸积累而出现暂时较高的现象, 随后维持在较低水平, 均值为0.106±0.107.R-PFR中的VFA/TA则随时间呈缓慢下降的趋势, 均值为0.082±0.029.故两个反应器在整个运行期间的VFA/TA整体水平并没有明显差异(p>0.05), 且均低于失稳阈值0.350(Li et al., 2014), 说明两个反应器均具有足够的碱度缓冲VFA变化对微生物的酸碱环境带来的影响.
蛋白质等含氮有机物在厌氧代谢中通过氨化作用可产生大量的氨, 这些无机铵盐为微生物生长提供了N源;且游离氨(NH3)与铵离子(NH4+)构成碱度, 也有利于系统缓冲容量的提升(Li et al., 2014; Zhang et al., 2013), 但过量的氨氮会严重抑制产甲烷过程(Kim et al., 2011; Yenigün et al., 2013).CSTR和R-PFR中初期TAN水平并无明显差异, 随后CSTR中的TAN快速积累, 并在34 d后达到平台期((1.588±0.095) g·L-1)(图 4c), 而R-PFR中的TAN呈逐渐积累的趋势, 最终达1.615 g·L-1(图 4d), 均没有超过TAN抑制阈值3.000 g·L-1(Yenigün et al., 2013).也有报道称, 由于NH3可以直接穿透细胞并阻碍新陈代谢, FAN才是引起氨抑制的主要原因(Kim et al., 2011), 且当FAN浓度超过0.200 g·L-1就可以抑制整个厌氧消化(Garcia et al., 2009; 唐波等, 2016).而CSTR的FAN浓度变化趋势与TAN类似, 最高值为0.144 g·L-1;R-PFR的FAN也呈逐渐上升的趋势, 运行结束时达到0.067 g·L-1.虽然CSTR的TAN和FAN水平均明显高于R-PFR(p<0.05), 但都未达到以往报道的抑制阈值, 故两个反应器中均不存在氨抑制.而CSTR中的TA整体水平较高也可能归因于其中较高的TAN浓度.
综上, R-PFR具有更加平稳的稳定性参数(如VFA、pH值、VFA/TA), 以及较低的TAN和FAN浓度, 这也有可能与R-PFR的特殊进料和混合方式有关.因为餐厨垃圾从反应器顶部进料口以类似于推流的方式推进至反应器底部出料口, 使得消化底物在反应器内的停留时间更长, 故从出料端测得的代谢产物相关指标则会更加平稳, 这个特点使得R-PFR比CSTR更适于处理剧烈变化的底物.但也从另一方面说明利用出料端的指标监测结果判断R-PFR运行稳定性可能是不全面的, 可以考虑根据R-PFR长度方向多点采样的监测结果综合评价R-PFR稳定性.
3.3 微生物多样性对比对Miseq测序所得各个样品的微生物16S rRNA基因进行统计分析, 结果见表 2.从表 2可以看出, 各个样品良好的文库覆盖率表明所测序列量已经基本上可完整反映该样品实际序列信息.表征丰富度的ACE指数和Chao1指数结果显示, R-PFR的细菌群落丰富度稍微高于CSTR, 但均低于接种污泥;而CSTR的古菌群落丰富度则最高.表征多样性的Shannon和Simpson指数结果显示, 接种污泥的细菌多样性最高, 接下来是CSTR;而古菌多样性则是R-PFR最高.故两个反应器的丰富度指数与多样性指数结果并不一致.而这些参数的水平与反应器稳定性之间的相关性也没有统一的定论(Li et al., 2016), 故有必要基于Miseq测序结果分析对比两个反应器的微生物群落结构.
表 2(Table 2)
| 表 2 各反应器样品中微生物序列的统计分析结果 Table 2 Statistics analysis of microbial sequence in samples retrieved from different reactors | |||||||||||||||||||||||||||||||||||||||||||||||||
表 2 各反应器样品中微生物序列的统计分析结果 Table 2 Statistics analysis of microbial sequence in samples retrieved from different reactors
| |||||||||||||||||||||||||||||||||||||||||||||||||
3.4 细菌群落结构对比如图 5a所示, 两个反应器及接种污泥中检测到了不同的细菌群落结构.接种污泥的细菌在门水平上分布比较均匀, 几个主要的细菌门为Bacteroidetes(27.13%)、Chloroflexi(19.38%)、Firmicutes(18.77%)、Proteobacteria(11.90%)和Spirochaetae(10.82%).经过一段时间的餐厨垃圾厌氧消化, 污泥中的细菌群落结构出现了较大变化, 最直观的变化是反应器中不再以多个细菌门均分功能, 而是由少数细菌门占据优势地位, 同时其余细菌门减少到较小的比例.CSTR和R-PFR中分别以Firmicutes(44.41%)和Bacteroidetes(31.14%)及Chloroflexi(37.35%)和Firmicutes(31.22%)为最主要的细菌门.这些细菌门均是餐厨垃圾厌氧消化体系中常见的优势细菌门(Guo et al., 2014; Yi et al., 2014), 主要负责餐厨垃圾的水解酸化等过程.如此, 接种污泥中消化猪粪和农作物秸秆等复杂底物的细菌群落演替为CSTR和R-PFR中消化餐厨垃圾的细菌群落.
图 5(Fig. 5)
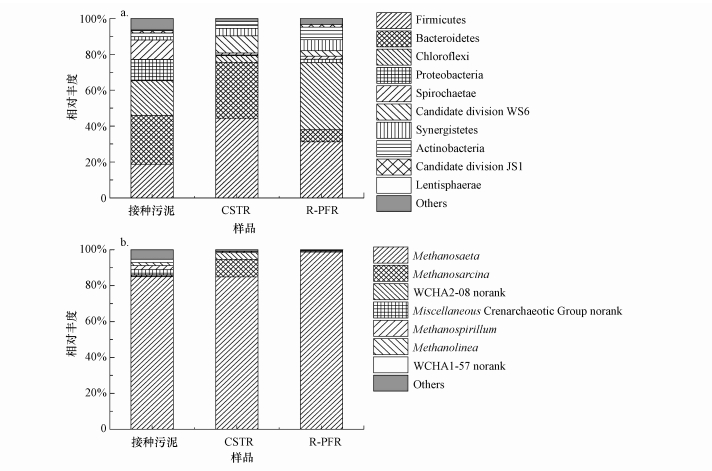 |
| 图 5 细菌门水平(a)和古菌属水平(b)的相对丰度 Fig. 5Taxonomic compositions of microbial communities at the phylum level (a) and archaeal communities at the genus level (b) |
表 3显示了细菌群落在科和属水平的分类组成.Firmicutes门的成员可产生如蛋白酶、脂肪酶和纤维素酶等胞外酶, 与有机物的降解和VFA的形成密切相关(Lim et al., 2014).虽然Firmicutes门作为两个反应器中共同的优势细菌门, 但其成员在两个反应器中具有不同的功能分布.R-PFR中最优势的科为可发酵多种糖类的发酵细菌Clostridia纲的Christensenellaceae科(Morotomi et al., 2012).而CSTR中Christensenellaceae科仅有1.89%, 替代其优势地位的Syntrophomonadaceae科(16.28%)约占该纲的44%, 其成员主要是可降解4~18个碳原子脂肪酸的脂肪酸降解菌, 由于降解过程中会产生H2或甲酸等中间产物, 需与消耗H2或甲酸的产甲烷菌互养(Schink et al., 2014).而CSTR中如Methanosarcina、Methanospirillum、Methanolinea等耗氢的微生物的存在(图 5b), 有可能是Syntrophomonadaceae科能大量繁殖的原因.另外, CSTR中还有较高比例的Family XI. Incertae Sedis, 其主要属Sedimentibacter的成员是专性厌氧微生物, 不能发酵碳水化合物, 主要发酵氨基酸或丙酮酸并以乙酸或丁酸为主要产物(De Vos et al., 2009).而另外两个细菌科Ruminococcaceae科和Clostridiaceae科在两个反应器中的相对丰度相差不大.Ruminococcaceae科的主要属Fastidiosipila属主要参与酸化过程并为后续过程贡献乙酸和丁酸(Falsen, 2005).而Clostridiaceae科的主要属Clostridium属的成员涉及有机物(如纤维素、木质素、蛋白质、脂肪等)的水解、酸化及产氢产乙酸过程(Li et al., 2013), 如Clostridium butyricum可降解葡萄糖产生乙酸和H2等(Lin et al., 2007).Firmicutes门Bacilli纲在CSTR中的相对丰度为6.33%, 高于R-PFR中的2.63%, 其主要属Streptococcaceae科Streptococcus属是兼性厌氧的同型发酵球菌, 发酵葡萄糖的主要产物是乳酸(Toit et al., 2014).另外, 还在CSTR中检测到Lachnospiraceae科Defluviitalea属和Thermoanaerobacteraceae科Gelria属, 其中, Defluviitalea属可发酵纤维素、葡萄糖、蔗糖等, Gelria属与氢型产甲烷菌互养降解一些氨基酸和糖类(Jabari et al., 2012; Plugge et al., 2002).Yuan等(2015)在低pH值的污泥发酵产酸系统检测到了更高丰度的Peptostreptococcaceae_incertae_sedis, 这与本研究的R-PFR中检测到稍高比例的Peptostreptococcaceae_incertae_sedis的现象一致, 因为进料端存在局部pH值较低的现象.
表 3(Table 3)
| 表 3 细菌群落在科水平和属水平的分类组成 Table 3 Taxonomic compositions of bacterial communities at the family and genus level | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 细菌群落在科水平和属水平的分类组成 Table 3 Taxonomic compositions of bacterial communities at the family and genus level
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bacteroidetes门在水解和酸化过程中也起着非常重要的作用, 主要涉及蛋白质、脂肪、纤维素及其他多糖的降解(Guo et al., 2014; Jaenicke et al., 2011).Bacteroidia纲(15.10%)和Sphingobacteriia纲(8.54%)约占Bacteroidetes门的76%, 是Bacteroidetes门在CSTR中最主要的两个纲, 其次是VC2.1_Bac22(6.64%).而R-PFR中的优势纲是Bacteroidia(2.94%)和vadinHA17(2.54%).来自Bacteroidia纲Porphyromonadaceae科的主要属Petrimonas属是典型的发酵型细菌, 并以乙酸、H2和CO2为葡萄糖发酵的最终产物(Luo et al., 2014; Sakamoto, 2014);而Proteiniphilum属则是专性厌氧的蛋白质水解菌, 并以乙酸为主要的水解产物, 且会产NH3(Sakamoto, 2014), 而CSTR中较高水平的氨氮也许可归因于Proteiniphilum属的代谢过程.Bacteroidia纲Rikenellaceae科(8.45%)的成员主要来自各种动物的消化道(Graf, 2014), 而本研究中的Rikenellaceae可能来自于所用接种污泥的消化底物猪粪, 其主要属vadinBC27_wastewater-sludge_group也曾在本实验室的另一个处理餐厨垃圾的厌氧消化反应器中出现(Li et al., 2015).Rikenellaceae的成员可利用乳酸作为底物进行发酵, 并以乙酸和丙酸作为主要的产物(Yi et al., 2014).Sphingobacteriia纲的优势科ST-12K33科也曾在污水污泥的干式厌氧消化反应器(TS范围17%~19%)中以17.4%~22.0%的高丰度出现(Liu et al., 2016).
Chloroflexi门是R-PFR中的优势菌之一, 其主要科Anaerolineaceae科(34.16%)的成员大多是严格厌氧的多细胞丝状微生物(Yamada et al., 2006), 主要涉及餐厨垃圾中碳水化合物的发酵降解(Yi et al., 2014).而Chloroflexi门在CSTR中仅占3.66%, 仅为R-PFR中的1/10.出现这个现象的原因可能是CSTR的搅拌措施容易破坏其丝状结构, 不利于其生长, 从而Chloroflexi在CSTR中所涉及的功能被Firmicutes门和Bacteroidetes门的成员所取代.而Actinobacteria门也在R-PFR中进一步富集, 相对丰度显著高于接种污泥和CSTR.而Actinobacteria在R-PFR中富集的原因也有可能是R-PFR的运行方式更适于其丝状结构的生长.主要属Bogoriellaceae科Georgenia属约占该门总OUT数的73%, 其成员主要是兼性厌氧菌, 主要负责碳水化合物的水解(Altenburger, 2002).
另外, CSTR和R-PFR中分别检测到4.19%和6.04%的Synergistetes门.Synergistetes门的唯一科Synergistaceae科, 其成员的主要特点是可利用氨基酸作为能源(Jumas-Bilak et al., 2014), 在厌氧消化反应器中主要涉及产氢产乙酸作用, 有氢型产甲烷菌存在时可促进其生长并发酵更多种类的底物.
综上, 两个反应器中得到了不同细菌群落结构, 完成餐厨垃圾的水解、酸化及产氢产乙酸过程.然而, 不同的细菌群落结构则会对系统带来不同的影响.例如, CSTR中蛋白质水解菌Porphyromonadaceae科的富集有可能是导致CSTR中氨氮水平比R-PFR更高的原因.另外, Synergistaceae科是R-PFR中主要的产H2微生物, 而CSTR中可产氢的细菌除Synergistaceae科以外, 还有大量的可产H2的Syntrophomonadaceae科, 而这些产H2细菌的富集, 可为氢营养型产甲烷菌提供充足的底物, 促进产甲烷途径的多样性.
3.5 古菌群落结构对比产甲烷作用由一类特殊的微生物——产甲烷菌利用产氢产乙酸阶段的产物(如乙酸、H2/CO2), 以及甲酸、甲醇和甲胺类等简单的有机化合物进行产甲烷的过程(Demirel et al., 2008).接种污泥中, Methanosarcinales是主要优势菌目, 相对丰度为85.56%, Methanosaeta是主导的优势菌属, 相对丰度为85.01%.从图 5b可以看出, 经过一段时间的餐厨垃圾厌氧消化后, 两个反应器的产甲烷菌群落仍以Methanosaeta为主导优势菌属.CSTR中的Methanosaeta相对丰度为84.90%, 与接种污泥相比无明显变化, 其次是Methanosarcina(9.72%)、WCHA2-08_norank(3.75%)及Methanolinea、Methanospirillum等其他产甲烷菌(1.63%);而R-PFR中Methanosaeta的相对丰度相比于接种污泥有所上升, 占98.72%, 处于绝对优势地位, 而Methanosarcina相对丰度仅有约0.13%.
Methanosaeta和Methanosarcina是目前发现仅有的两类可以利用乙酸产甲烷的微生物, 但Methanosaeta只能利用乙酸作为底物进行产甲烷作用, 是严格的乙酸型产甲烷菌;Methanosarcina则既能利用乙酸也能利用H2/CO2、甲醇及甲胺类产甲烷(De Vrieze et al., 2012; Demirel et al., 2008; Guo et al., 2014).相同的底物使得它们之间存在一定的竞争作用, 而本研究的两个反应器中乙酸型产甲烷菌的优势地位表明系统中的主要产甲烷途径是乙酸型产甲烷途径.
CSTR中的Methanosarcina相对丰度与接种污泥相比增大了近24倍, 且是R-PFR中Methanosarcina相对丰度的近75倍.CSTR中Methanosarcina相对富集的原因则可能是CSTR中如Syntrophomonadaceae科、Clostridiaceae科、Synergistaceae科等产氢细菌的富集(在CSTR和R-PFR中分别占21.96%和10.17%).这类产氢细菌的产物被可以耗氢的微生物(如Methanosarcina、Methanospirillum和Methanolinea)消耗, 消除H2积累的抑制影响, 以此形成良性循环, 促进这两类微生物的生长.另外, 也可能由于CSTR中氨氮浓度更高且搅拌措施不利于保护Methanosaeta的丝状结构, 以及CSTR相对较短的HRT不利于世代时间更长的Methanosaeta的增殖, 所以Methanosaeta的相对丰度与接种污泥相比并没有明显的提升, 而是具有更高氨氮耐受性及更短世代时间的Methanosarcina大幅度提升(Conklin et al., 2006; De Vrieze et al., 2012; Demirel et al., 2008; Guo et al., 2014; Li et al., 2015).
如上所述, Methanosaeta属的氨氮耐受性和VFA耐受性均弱于Methanosarcina, 且生长速率也比氢营养型产甲烷菌慢.然而由于餐厨垃圾的高蛋白含量且易降解等特性, 其厌氧消化系统中通常含有较高水平的TAN和VFA(Guo et al., 2014; Kastner et al., 2012; Li et al., 2015; Zhang et al., 2013).故推测本研究中的CSTR若继续长期运行后其产甲烷菌群落会逐渐由单一优势的乙酸营养型Methanosaeta向Methanosaeta与Methanosarcina等混合营养型产甲烷菌共同作用的方向转移, 从而使得系统产甲烷过程更加稳定(Conklin et al., 2006; De Vrieze et al., 2012).
4 结论(Conclusions)1) 在相同的有机负荷(OLR)下, PFR进料方式导致其进料端局部微生物所承受负荷相比于CSTR更高, 且由于PFR构型及较高的TS含量导致其传质效率差, 故PFR和CSTR分别驯化得到了不同的微生物群落结构, 餐厨垃圾厌氧消化性能差异明显.
2) 两个反应器中得到了不同细菌群落结构, 除共同优势菌门Firmicutes门以外, Chloroflexi门和Bacteroidetes门分别为PFR和CSTR的另一优势菌门.另外, CSTR中蛋白质水解菌的富集有可能是导致CSTR中氨氮水平比PFR更高的原因;而CSTR中产H2细菌的富集, 可为氢营养型产甲烷菌提供充足的底物, 促进产甲烷途径的多样性.
3) 由于接种污泥中优势产甲烷菌的影响, CSTR和PFR均以Methanosaeta属为优势产甲烷菌, 以乙酸型产甲烷途径为主要的产甲烷途径.但CSTR中驯化得到了对高VFA和TAN更具耐受性的产甲烷菌群, 如除Methanosaeta属以外还有一定丰度的混合营养型的Methanosarcina, 以及氢营养型Methanospirillum和Methanolinea, 这样的产甲烷菌群更有利于餐厨垃圾产甲烷过程的稳定进行.
4) 由于PFR中特性, 其稳定性指数如TA和VFA/TA表现得更加平稳, 产气效率SMP却不及CSTR;相反地, CSTR稳定性指标响应更加及时.
5) 由于PFR可将冲击负荷的影响限制在局部, 敏感性较低, 有利于处理剧烈变化的底物.但PFR容易出现严重的局部酸化现象, 不利于长期处理过高负荷的易降解底物(如餐厨垃圾).
参考文献
| Altenburger P. 2002. Georgenia muralis gen. nov., sp.nov., a novel actinobacterium isolated from a medieval wall painting[J]. International Journal of Systematic and Evolutionary Microbiology, 52(3): 875–881. |
| Conklin A, Stensel H D, Ferguson J. 2006. Growth kinetics and competition between Methanosarcina and Methanosaeta in mesophilic anaerobic digestion[J]. Water Environment Research, 78(5): 486–496.DOI:10.2175/106143006X95393 |
| De Vos P, Garrity G M, Jones D, et al. 2009. The Firmicutes//Bergey's Manual? of Systematic Bacteriology[M]. New York: Springer Science Business Media |
| De Vrieze J, Hennebel T, Boon N, et al. 2012. Methanosarcina:The rediscovered methanogen for heavy duty biomethanation[J]. Bioresource Technology, 112: 1–9.DOI:10.1016/j.biortech.2012.02.079 |
| Demirel B, Scherer P. 2008. The roles of acetotrophic and hydrogenotrophic methanogens during anaerobic conversion of biomass to methane:a review[J]. Reviews in Environmental Science and Bio/Technology, 7(2): 173–190.DOI:10.1007/s11157-008-9131-1 |
| Falsen E. 2005. Fastidiosipila sanguinis gen. nov., sp.nov., a new Gram-positive, coccus-shaped organism from human blood[J]. International Journal of Systematic and Evolutionary Microbiology, 55(2): 853–858.DOI:10.1099/ijs.0.63327-0 |
| Garcia M L, Angenent L T. 2009. Interaction between temperature and ammonia in mesophilic digesters for animal waste treatment[J]. Water Research, 43(9): 2373–2382.DOI:10.1016/j.watres.2009.02.036 |
| Graf J. 2014. The Family Rikenellaceae//Rosenberg E, Delong E F, Lory S, et al. The Prokaryotes[M]. Berlin Heidelberg: Springer. 857-859 |
| Guo X, Wang C, Sun F, et al. 2014. A comparison of microbial characteristics between the thermophilic and mesophilic anaerobic digesters exposed to elevated food waste loadings[J]. Bioresource Technology, 152: 420–428.DOI:10.1016/j.biortech.2013.11.012 |
| Jabari L, Gannoun H, Cayol J L, et al. 2012. Characterization of Defluviitalea saccharophila gen.nov., sp.nov., a thermophilic bacterium isolated from an upflow anaerobic filter treating abattoir wastewaters, and proposal of Defluviitaleaceae fam.nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 62(Pt 3): 550–555.DOI:10.1099/ijs.0.030700-0 |
| Jaenicke S, Ander C, Bekel T, et al. 2011. Comparative and joint analysis of two metagenomic datasets from a biogas fermenter obtained by 454-pyrosequencing[J]. PLoS One, 6(1): e14519.DOI:10.1371/journal.pone.0014519 |
| Jumas-Bilak E, Marchandin H. 2014. The Phylum Synergistetes//Rosenberg E, Delong E F, Lory S, et al. The Prokaryotes[M]. Berlin Heidelberg: Springer. 931-954 |
| Kastner V, Somitsch W, Schnitzhofer W. 2012. The anaerobic fermentation of food waste:a comparison of two bioreactor systems[J]. Journal of Cleaner Production, 34: 82–90.DOI:10.1016/j.jclepro.2012.03.017 |
| Kim D, Oh S. 2011. Continuous high-solids anaerobic co-digestion of organic solid wastes under mesophilic conditions[J]. Waste Management, 31(9/10): 1943–1948. |
| Kim J, Lee S, Lee C. 2013. Comparative study of changes in reaction profile and microbial community structure in two anaerobic repeated-batch reactors started up with different seed sludges[J]. Bioresource Technology, 129: 495–505.DOI:10.1016/j.biortech.2012.11.119 |
| Kothari R, Pandey A K, Kumar S, et al. 2014. Different aspects of dry anaerobic digestion for bio-energy:An overview[J]. Renewable and Sustainable Energy Reviews, 39: 174–195.DOI:10.1016/j.rser.2014.07.011 |
| Li A, Chu Y, Wang X, et al. 2013. A pyrosequencing-based metagenomic study of methane-producing microbial community in solid-state biogas reactor[J]. Biotechnol Biofuels, 6(1): 3.DOI:10.1186/1754-6834-6-3 |
| Li L, He Q, Ma Y, et al. 2016. A mesophilic anaerobic digester for treating food waste:process stability and microbial community analysis using pyrosequencing[J]. Microb Cell Factories, 15(1): 65.DOI:10.1186/s12934-016-0466-y |
| Li L, He Q, Ma Y, et al. 2015. Dynamics of microbial community in a mesophilic anaerobic digester treating food waste:Relationship between community structure and process stability[J]. Bioresource Technology, 189: 113–120.DOI:10.1016/j.biortech.2015.04.015 |
| Li L, He Q, Wei Y, et al. 2014. Early warning indicators for monitoring the process failure of anaerobic digestion system of food waste[J]. Bioresource Technology, 171: 491–494.DOI:10.1016/j.biortech.2014.08.089 |
| Lim J W, Chiam J A, Wang J. 2014. Microbial community structure reveals how microaeration improves fermentation during anaerobic co-digestion of brown water and food waste[J]. Bioresource Technology, 171: 132–138.DOI:10.1016/j.biortech.2014.08.050 |
| Lin P, Whang L, Wu Y, et al. 2007. Biological hydrogen production of the genus Clostridium:Metabolic study and mathematical model simulation[J]. International Journal of Hydrogen Energy, 32(12): 1728–1735.DOI:10.1016/j.ijhydene.2006.12.009 |
| Liu C, Li H, Zhang Y, et al. 2016. Evolution of microbial community along with increasing solid concentration during high-solids anaerobic digestion of sewage sludge[J]. Bioresource Technology, 216: 87–94.DOI:10.1016/j.biortech.2016.05.048 |
| Luo J, Feng L, Chen Y, et al. 2014. Stimulating short-chain fatty acids production from waste activated sludge by nano zero-valent iron[J]. Journal of Biotechnology, 187: 98–105.DOI:10.1016/j.jbiotec.2014.07.444 |
| Masse D I, Gilbert Y, Saady N M, et al. 2013. Low-temperature anaerobic digestion of swine manure in a plug-flow reactor[J]. Environment Technology, 34(17/20): 2617–2624. |
| Morotomi M, Nagai F, Watanabe Y. 2012. Description of Christensenella minuta gen. nov., sp.nov., isolated from human faeces, which forms a distinct branch in the order Clostridiales, and proposal of Christensenellaceae fam.nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 62(1): 144–149.DOI:10.1099/ijs.0.026989-0 |
| Patinvoh R J, Kalantar Mehrjerdi A, Sárvári Horváth I, et al. 2017. Dry fermentation of manure with straw in continuous plug flow reactor:Reactor development and process stability at different loading rates[J]. Bioresource Technology, 224: 197–205.DOI:10.1016/j.biortech.2016.11.011 |
| Plugge C M, Balk M, Zoetendal E G, et al. 2002. Gelria glutamica gen. nov., sp.nov., a thermophilic, obligately syntrophic, glutamate-degrading anaerobe[J]. International Journal of Systematic and Evolutionary Microbiology, 52: 401–407.DOI:10.1099/00207713-52-2-401 |
| Qiao W, Takayanagi K, Niu Q, et al. 2013. Long-term stability of thermophilic co-digestion submerged anaerobic membrane reactor encountering high organic loading rate, persistent propionate and detectable hydrogen in biogas[J]. Bioresource Technology, 149: 92–102.DOI:10.1016/j.biortech.2013.09.023 |
| Rowse L E. 2011. Design of Small Scale Anaerobic Digesters for Application in Rural Developing Countries[D]. Florida: University of South Florida. 26-27 |
| Sakamoto M. 2014. The Family Porphyromonadaceae//Rosenberg E, Delong E F, Lory S, et al. The Prokaryotes[M]. Berlin Heidelberg: Springer. 811-824 |
| Schink B, Oz R M. 2014. The Family Syntrophomonadaceae//Rosenberg E, Delong E F, Lory S, et al. The Prokaryotes[M]. Berlin Heidelberg: Springer. 371-379 |
| 唐波, 李蕾, 何琴, 等. 2016. 总氨氮在餐厨垃圾厌氧消化系统中的积累及其抑制作用[J]. 环境科学学报, 2016, 36(1): 210–216. |
| Toit M D, Huch M, Cho G, et al. 2014. The genus Streptococcus//Holzapfel W H, Wood B J B. Lactic Acid Bacteria: Biodiversity and Taxonomy[M]. Chichester: John Wiley & Sons, Ltd. 457-505 |
| 王晓华, 李蕾, 何琴, 等. 2016. 驯化对餐厨垃圾厌氧消化系统微生物群落结构的影响[J]. 环境科学学报, 2016, 36(12): 4421–4427. |
| Weiland P. 2010. Biogas production:current state and perspectives[J]. Appl Microbiol Biot, 85(4): 849–860.DOI:10.1007/s00253-009-2246-7 |
| Wright P, Inglis S, Ma J, et al. 2004. Comparison of Five Anaerobic Digestion Systems on Dairy Farms[C]. 2004 ASAE/CSAE Annual International Meeting. Ottawahttps://www.researchgate.net/publication/301391257_Comparison_of_Five_Anaerobic_Digestion_Systems_on_Dairy_Farms |
| Yamada T, Sekiguchi Y, Hanada S, et al. 2006. Anaerolinea thermolimosa sp. nov., Levilinea saccharolytica gen.nov., sp.nov.and Leptolinea tardivitalis gen.nov., sp.nov., novel filamentous anaerobes, and description of the new classes Anaerolineae classis nov.and Caldilineae classis nov.in the bacterial phylum Chloroflexi[J]. International Journal of Systematic and Evolutionary Microbiology, 56(6): 1331–1340.DOI:10.1099/ijs.0.64169-0 |
| Yenigün O, Demirel B. 2013. Ammonia inhibition in anaerobic digestion:A review[J]. Process Biochemistry, 48(5/6): 901–911. |
| Yi J, Dong B, Jin J, et al. 2014. Effect of increasing total solids contents on anaerobic digestion of food waste under mesophilic conditions:performance and microbial characteristics analysis[J]. PloS One, 9(7): e102548.DOI:10.1371/journal.pone.0102548 |
| Yuan Y, Wang S, Liu Y, et al. 2015. Long-term effect of pH on short-chain fatty acids accumulation and microbial community in sludge fermentation systems[J]. Bioresource Technology, 197: 56–63.DOI:10.1016/j.biortech.2015.08.025 |
| Yue Z, Teater C, Maclellan J, et al. 2011. Development of a new bioethanol feedstock-Anaerobically digested fiber from confined dairy operations using different digestion configurations[J]. Biomass and Bioenergy, 35(5): 1946–1953.DOI:10.1016/j.biombioe.2011.01.035 |
| Zhang C, Su H, Tan T. 2013. Batch and semi-continuous anaerobic digestion of food waste in a dual solid-liquid system[J]. Bioresource Technology, 145: 10–16.DOI:10.1016/j.biortech.2013.03.030 |
| Zhang C, Xiao G, Peng L, et al. 2013. The anaerobic co-digestion of food waste and cattle manure[J]. Bioresource Technology, 129: 170–176.DOI:10.1016/j.biortech.2012.10.138 |
