
 , 程霞1,2, 曾旭1,2
, 程霞1,2, 曾旭1,21. 同济大学环境科学与工程学院, 长江水环境教育部重点实验室, 上海 200092;
2. 同济大学生物膜技术研究所, 污染控制与资源化研究国家重点实验室, 上海 200092
收稿日期: 2017-06-26; 修回日期: 2017-09-30; 录用日期: 2017-10-25
基金项目: 国家重点研发计划课题(No.2016YFC0400805);国家水体污染控制与治理科技重大专项课题(No.2017ZX07206-001)
通讯作者(责任作者): 王荣昌(1976-), 男, 副教授(博士), E-mail:wangrongchang@tongji.edu.cn
摘要: 菌藻共生系统不仅能够吸收空气中的CO2,高效去除污水中的氮磷营养物质,而且能够有效去除重金属、抗生素等,因而在污水处理领域日益受到广泛的关注.本文从菌藻之间相互作用关系出发,介绍了用于污水处理时藻类选择的依据,及在污水处理中对N、P营养物质、抗生素、重金属等污染物的去除机理,综述了菌藻系统在污水处理中的应用进展,以期为菌藻共生系统在污水处理中的推广应用提供参考.
关键词:菌藻共生系统菌藻生物膜重金属难降解有机物
Mechanisms and applications of bacterial-algal symbiotic systems for pollutant removal from wastewater
WANG Rongchang1,2

 , CHENG Xia1,2, ZENG Xu1,2
, CHENG Xia1,2, ZENG Xu1,2 1. Key Laboratory of Yangtze Aquatic Environment, Ministry of Education, College of Environmental Science and Engineering, Tongji University, Shanghai 200092;
2. State Key Laboratory of Pollution Control and Resource Reuse, Institute of Biofilm Technology, Tongji University, Shanghai 200092
Received 26 June 2017; received in revised from 30 September 2017; accepted 25 October 2017
Supported by the National Key R & D Program of China (No.2016YFC0400805) and the National Science and Technology Major Project of China on Water Pollution Control and Management (No.2017ZX07206-001)
*Corresponding author: WANG Rongchang(1976—), male, associate professor(Ph.D.), E-mail:wangrongchang@tongji.edu.cn
Abstract: Bacterial-algal symbiotic systems can not only absorb CO2 from the air, efficiently remove nitrogen and phosphorus nutrients from wastewaters, but can also effectively remove heavy metals and antibiotics. Thus, bacterial-algal symbiotic systems have attracted more attention in the field of wastewater treatment. In this paper, we discuss interactions within bacterial-algal symbiotic systems and introduce how to select algae for wastewater treatment and the principle of pollutants removal such as nitrogen and phosphorus, antibiotics, and heavy metals. We also summarize the applications and prospects of bacterial-algal symbiotic systems in wastewater treatment to provide technical support for the popularization of bacterial-algal symbiotic systems.
Key words: bacterial-algal symbiotic systembacterial-algal biofilmheavy metalrefractory organic matter
1 引言(Introduction)随着社会经济的不断发展及人类医用抗生素及个人医疗卫生用品的滥用,富含氮磷、重金属及抗生素的污水不断产生,最终排入污水处理厂.富含这几类污染物的污水利用传统的生物处理工艺较难处理.有研究报道微藻在利用空气中CO2进行光合作用时,能够同时去除N、P营养物质、BOD、重金属、病原体等污染物(Escapa et al., 2015),微藻技术已经成为有毒污染物处理的关键技术之一.污水中存在大量的微生物群落,它们能够与微藻相互作用,促进污水的生物处理.利用菌藻共生系统中藻类的光合作用和微生物的代谢及呼吸作用能协同降解污水中的有机物,并能实现同步脱氮除磷及抗生素、重金属的去除.20世纪50年代末,Oswald等报道了氧化塘中藻菌共生和藻类光合放氧等现象,提出了利用高效藻类塘处理污水的新工艺,随后许多****对菌藻共生系统进行了基础理论和实际应用的研究(牛曼等, 2010).Loutseti等(2009)利用菌藻共生系统处理铜、钙污水,去除效率分别达到80%、100%;Bai和Acharya(2016)采用菌藻共生系统处理磺胺甲恶唑、三氯生污水,处理效率分别达到32%、74%;Hernandeze等(2013)采用菌藻共生系统处理处理高氨氮浓度的养猪污水,N、P的去除效率分别达到82.7%、58.0%.在利用藻类处理污水的技术中,菌藻共生系统具有较强的净化优势(巫小丹等, 2014),但菌藻之间的关系较为复杂,研究菌藻共生系统的构建及其在污水中的应用较有意义.因此,本文主要综述了菌藻之间的相互作用关系及污水处理中微藻的选择,着重介绍了菌藻共生系统去除污染物的机理以及在污水中的应用.
2 菌藻之间的相互作用关系(Interactions between bacteria and algae)微藻与细菌之间的相互作用较为复杂,作用形式多种多样.既包括相互利用代谢产物的互利共生关系,也包括对营养物质的相互竞争和抑制关系,菌藻之间的相互作用关系如图 1所示.
图 1(Fig. 1)
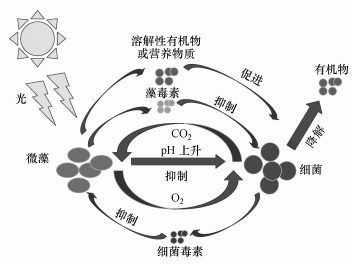 |
| 图 1 菌藻之间作用关系示意图 Fig. 1Schematic of interactions between bacteria and algae |
2.1 互利共生关系通常细菌和微藻的互利共生关系是建立在两者在代谢功能上的互补基础上,主要表现为对氧气和代谢产物的释放和吸收利用上.微藻通过光合作用产生氧气,作为好氧细菌呼吸降解污染物的电子受体去除污染物,同时细菌呼吸产生的二氧化碳也能供微藻进行光合作用(Mu?oz and Guieysse, 2006).在物质代谢方面,在富营养状态下,微藻通过光合作用吸收利用氮磷等元素合成自身物质,同时向环境中释放有机物,微藻细胞分解也是溶解性有机碳的重要来源(Unnithan et al., 2014).而细菌能够利用氧气分解微藻产生的分泌物及死亡的藻细胞,产生的分解产物反过来被微藻吸收利用.细菌和微藻在增殖过程中,会向环境中分泌一些酶物质,如脂肪酶、磷酸酶、硫酸醋酶、葡萄糖昔酶、乳糖昔酶等,这些酶能够将大分子物质如多糖、蛋白质水解成小分子物质,从而被细菌和微藻吸收利用.研究表明与微藻的纯培养相比,菌藻系统能够提高微藻的产量(Amin et al.,2012).在自然环境中,微藻能够与微生物相互作用,为细菌提供栖息地避免不良环境的影响,同时, 细菌能产生生长因子促进微藻生长,使菌藻系统能够回收部分能源(Christenson and Sims, 2011),并且菌、藻产生代谢产物也能被微生物和微藻相互利用,从而减少额外投加能源物质的费用.Crene和Grover等(2010)在研究藻类微环境时,没有投加任何补充物,发现微藻环境中有大量溶解性有机碳,可促进细菌的生长.
2.2 相互竞争关系细菌和微藻在增殖过程中都会吸收利用环境中的营养物质,如氮、磷等,如果环境中的营养物质不能够满足细菌和微藻共同生长需要时,细菌和微藻就会产生对营养物质的相互竞争.同时,在黑暗环境中微藻的呼吸作用也会吸收环境中的氧气,从而与细菌产生对氧气的竞争.有研究表明菌藻系统中,当环境中磷酸盐含量较低时,细菌对磷酸盐的利用效率比微藻对磷酸盐的利用效率更高(Jansson, 1988).此外,微藻能够产生抑制细菌生长或毒害细菌的广谱或特殊抗生物活性物质——藻毒素,1944年Pratt等(1944)首次从小球藻(Chlorella sp.)中分离到有抑菌活性的小球藻素.微藻产生的一些胞外分泌物,如溶解态的氨基酸、抗生素类物质可能对细菌和病原菌也可产生抑制或毒害作用(Schumacher et al., 2003a;Schumacher, 2003b).某些细菌可释放细菌毒素抑制藻细胞生长,甚至裂解藻细胞,表现出杀藻效应.细菌与藻细胞直接接触,释放可溶解纤维素酶溶解藻细胞的细胞壁,然后溶解整个藻细胞,粘细菌是最早被报道和报道较多的溶藻细菌(许丽丽, 2014).细菌在生长过程中可能释放特异性或非特异性化感物质,这些化感物质可通过阻断呼吸链、抑制细胞壁合成等抑制藻细胞的生长,甚至溶解藻细胞.这些化感物质包括多肽类物质、蛋白质、生物碱、抗生素、色素等(邓建明等, 2009).菌藻对营养物质的竞争会改变生物群落组成.同时,由于光合作用引起pH上升对细菌产生危害(李小霞和解庆林, 2006).
3 污水处理中微藻种类的选择(Selection of microalgae for wastewater treatment)污水中存在大量的细菌群落,菌藻之间的相互作用关系复杂,因此如何利用菌藻之间的互利共生关系较好的构建菌藻系统是将其系统应用于污水处理的前提之一.目前,微藻在污水处理中的应用主要有两个目的:其一是利用微藻来净化污水,去除污染物,节约能源,此时,选择微藻应综合考虑微藻对污水中可能存在的污染物(如高氨氮、重金属离子、毒性化合物等)的耐受能力,从高氧气产生速率,高二氧化碳捕获能力,强劲的生长特性方面选择微藻来提高其对环境变化的耐受力;此外,可用污水来培养微藻,收获的微藻作为生物质能源解决能源危机,减少微藻培养过程中的物质(N、P和水等)消耗,考虑选择的微藻应有较高的生长速率,高的油脂含量和产率,以便后续收获微藻作为生物质能源(Wang et al., 2016).针对不同的生活污水和工业废水,表 1列举了污水处理中常用的微藻种类.
表 1(Table 1)
| 表 1 污水处理中常用的微藻种类 Table 1 Microalgal species used in wastewater treatment | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 污水处理中常用的微藻种类 Table 1 Microalgal species used in wastewater treatment
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
在众多的微藻中,常用于污水处理的微藻种类大部分属于光合自养型单细胞绿藻,它们对许多污水都具有耐受性并且有较高的油脂或淀粉生产和积累潜力(Wu et al., 2014).目前,常用来净化污水或污水培养作为生物质能源的微藻有小球藻(Chlorella)、栅藻(Scenedesmus).其适应能力强,易于培养,对富含氮磷的污水具有明显的净化效果,同时有较快的生长速率、较高的环境耐受能力、较高的油脂或淀粉生产和积累潜力(Wang et al., 2016).虽然,微藻油脂和淀粉的积累通常是在营养损耗下增强的,在用于净化高氮磷废水时,微藻细胞内的油脂积累量较低,但微藻生物量增长较快,总的油脂和淀粉积累量较高,可作为生物质能源利用.从表 1可以看出,构建菌藻系统用于处理污水时,对于重金属废水,小球藻具有一定的优势;而对于药物废水,栅藻应用较广.然而,微藻对有毒污染物较敏感,可用作毒性测试或者生态系统改变时的指示生物.Pe?a-Castro等(2004)研究表明,重金属对微生物光合作用有较强的抑制作用,能导致栅藻(Scenedesmus incrassatulus)细胞形态和大小的变化.Mu?oz等(2006)研究发现当铜离子浓度为2 mg·L-1时,小球藻(Chlorella sorokiniana)光合作用产氧去除水杨酸完全被抑制.Chen和Lin(2006)发现在密闭的光生物反应器中,微藻对有机污染物的耐受力较为敏感,此外,在高氨氮和高pH联合作用下,微藻耐受力也较为敏感.因此,应根据污水中污染物的类型及其浓度合理选择菌藻共生系统中微藻的种类.
4 菌藻共生系统去除污染物的机理(Mechanisms of pollutants removal through bacterial-algal symbiotic system)4.1 去除N、P营养元素菌藻共生系统去除N、P营养元素主要有3方面的作用:细菌的氧化降解、藻类的同化吸收和共生环境中pH的变化引起的去除.好氧菌利用微藻产生的O2降解含碳有机物产生CO2,氨化含氮有机物,继而进行硝化,生成氨氮、亚硝酸盐和硝酸盐,同时能将含磷有机物降解为正磷酸盐,供藻类利用(邢丽贞, 2009).藻类利用细菌产生的CO2进行光合作用,同化吸收N、P营养物质.微藻光合作用利用的氮源可以是有机氮也可以是无机氮.有研究表明,微藻对无机氮的吸收利用过程分为3步(Vílchez et al., 1997):①微藻在特定酶的协助下将硝酸盐、亚硝酸盐和氨氮吸收到细胞中;②在相关酶催化作用下,利用ATP将硝酸盐、亚硝酸盐还原成铵;③将还原生成的铵并到碳骨架中.因此相比于硝酸盐和亚硝酸盐,微藻在吸收利用氮源过程中优先利用氨氮,当氨氮消耗完后再消耗其他形态的氮.磷作为核酸、细胞膜及能量储存物的必需元素,也是微藻生长过程中所必需的常量元素.微藻在吸收磷的过程中,常常优先吸收无机离子HPO42-和H2PO4-,吸收的磷合成核酸或能量传递物质等.Stumm提出藻类分子式近似为C106H263O110N16P,微藻在生长过程中主要以CO2为碳源,通过细胞中叶绿素的光合作用把污水中的NH4+、NO3-、NO2-、H2PO4-等无机离子和尿素等有机物质所含有的N、P等元素缔合到碳骨架上,形成藻细胞完成细胞增殖并向水体中释放O2,增加了水体中的溶解氧(DO)含量,有利于其他生物的生长(邢丽贞, 2009).微藻同化NH4+的反应如式(1)所示:
 | (1) |
4.2 去除难降解有机物难降解有机物毒性大、成份复杂,此类污染物包括有机氰化物、有机农药、有机染料、抗生素类药物废水等.一般的生物处理方法很难将其降解,同时此类污染物的存在能对微生物产生毒性作用或者抑制微生物生长,影响污水处理过程.共代谢技术是基于非专一性关键酶的产生和作用生物处理难降解有机物的有效技术之一,但受诱导基质浓度的影响,且难降解有机物浓度高时,也会影响微生物活性(李杰, 2005).藻类可以有效地富集和降解多种难降解有机化合物如抗生素、有机氯、农药、偶氮染料等,Xiong等(2016)研究表明,栅藻能通过生物降解有效降解卡马西平,且当卡马西平浓度达100 mg·L-1时,仅有30%的藻类生长受到抑制,微藻对高浓度难降解有机物有较好地耐受能力.构建结合细菌和微藻降解难降解有机物特点的菌藻共生系统,能实现此类污染物的有效去除.
菌藻系统处理抗生素类难降解有机物时,主要是通过细菌和藻类两方面的作用.细菌能通过生物降解、吸附、挥发、水解和矿化等去除抗生素,但通过吸附、挥发、水解和矿化的量相对较小,主要是通过生物共代谢去除抗生素.有研究发现硝化污泥和Nitrosomonas Europaea可以通过共代谢降解作用来有效降解抗生素这类污染物,根据现阶段国内外研究情况可见有些抗生素只能通过与氨氧化细菌的共代谢作用才能被有效降解(刘婳, 2012).Yin等(2014)实验证明市政污泥系统中浓度为500 μg·L-1的磺胺类抗生素磺胺甲嘧啶经过120 h后可通过生物降解作用完全去除.抗生素对藻类本身有直接的作用,既可能作为毒物抑制藻类的生长,又可能在特定浓度时发生毒物刺激效应,进一步激活蛋白酶,调节合成及诱导基因表达等,从而促进微藻细胞生长,呈现“低促高抑”作用(麻晓霞等, 2012).在低浓度下,抗生素能被藻体吸收富集和生物降解而被去除,Bai和Acharya(2016)研究表明,微球藻能有效去除32%的磺胺甲恶唑.在高浓度下,抗生素可能对微藻的生长产生抑制作用,机制可能包括以下几个方面(Pan et al., 2008):①改变细胞成分,主要表现为影响叶绿素中不同组分的含量、可溶性蛋白质的含量等.②影响基因表达.通过影响某些编码藻类光合作用、氮磷吸收和运输等相关蛋白质和酶基因的复制和转录来影响藻的生长情况.③影响光合作用.主要表现在影响藻细胞对氧的吸收量、叶绿素含量变化、抑制光合作用中电子的传递等.④诱导产生活性氧自由基,引发氧化胁迫,破坏抗氧化酶系统.⑤影响细胞膜.细胞膜的通透性降低.但藻类对抗生素的耐受浓度远高于细菌类微生物,利用菌藻系统处理抗生素类难降解有机物时,菌藻之间的共生关系能增强细菌的活性,提高系统对抗生素的耐受能力.
4.3 菌藻系统去除重金属菌藻共生系统去除重金属污染物主要是通过生物吸附和生物富集过程完成.在低浓度下,微生物对水体中重金属的作用可分为两个阶段(支田田等, 2011):①生物吸附:金属离子通过络合、配位、离子交换等作用附着在微生物细胞表面,该过程的反应时间较短、与代谢无关,且无需提供能量;②生物富集:微生物表面的金属离子在细胞的代谢作用下与质膜上某些酶类结合,转运至细胞内,该过程反应缓慢并且不可逆、与代谢活动有关.
菌藻共生系统能有效去除重金属,主要是因为相比细菌类微生物,微藻对重金属有较高的耐受力,从而能提高该系统对重金属的去除效果.关于重金属对微藻生长繁殖的影响,国内外都有进行大量的研究工作,Cu、Pb、Zn、Cd、Cr、Co、Ni等金属在浓度较低时能促进微藻生长,较高浓度时对微藻生长有抑制作用,这种较低浓度促进、较高浓度抑制的现象被认为是自我平衡效应(Calabrese, 1999; 杨国远, 2013).
微藻吸附重金属常见的机理主要是离子交换机理和络合机理.阳离子可与分子或带有自由电子对的阴离子(碱基对)起络合或螯合反应.络合物则是经过污水中的金属阳离子与细胞里的蛋白质、脂类及多糖中带负电荷的官能团络合而形成的,如—CONH2、R—SH、—NH2、—COOH、咪唑、硫醚、硫酸盐和磷酸盐等.离子交换作用主要是污水中所含有的金属阳离子将藻类细胞壁上的质子置换出,而其他金属离子则通过离子间的静电引力作用或通过配位键吸附在细胞壁表面上(李攀荣等, 2016).Davis(2003)研究表明离子交换机理是最能反映藻类细胞生物吸附重金属离子的实际过程,多糖中的藻酸盐与硫酸盐也被发现具有较为显著的离子交换能力.在高浓度下,重金属对微藻的毒性效应主要表现为:影响藻类的生长代谢、抑制光合作用、减少细胞色素、导致细胞畸变、改变自然环境中的藻种组成等.通常情况下,重金属对微藻的毒性大概是(从强到弱):Hg > Cd ≈ Cu > Zn > Pb > Co > Cr.但并不是所有的微藻都会符合这样的规律,不同的微藻对同种重金属的耐受性可能会存在差异(杨国远, 2013).
5 菌藻共生系统在污水处理中的应用(Application of bacterial-algal symbiotic system in wastewater treatment)自20世纪70年代以来,随着生物技术的迅猛发展,大规模培养应用菌藻系统的技术也得到进一步的完善,菌藻在污水净化方面应用的研究取得了较大进展,先后有****研究使用菌藻系统处理污水的工艺.菌藻系统应用于污水处理主要有3种形式:悬浮菌藻系统、固定化菌藻系统、菌藻生物膜系统.
5.1 悬浮菌藻系统在悬浮生长过程中,细菌附着在藻细胞表面有利于絮凝,提高沉降性能.典型的悬浮菌藻系统有高效藻类塘和活性藻处理系统.高效藻类塘是在传统生物稳定塘的基础上添加细菌、微藻等微生物形成的菌藻共生的复杂生态系统.有研究采用小球藻、光合细菌、乳酸菌、产朊假丝酵母和红酵母菌构成的复杂高效菌藻体系,处理猪场养殖污水,试验结果表明,48 h内氨氮、BOD5去除率分别达到98.7%和96.8%(郑耀通, 2004).活性藻处理系统是利用藻类和活性污泥的特点,将两者结合起来协同处理污水,采用人工强化培养高浓度的藻类,将其与活性污泥混合培养,使藻类与活性污泥一样,具有良好的絮凝沉淀特性.陈志华利用活性污泥-螺旋藻体系处理生活污水在6 d运行时间内实现TP、TN、COD出水处理效率分别达到77.11%、87.82%、76.9%(陈志华, 2010).有研究表明用活性藻系统处理污水,BOD、COD、TN、TP的去除率分别能达到97%、87%、92%、74%(迟堃, 2010).悬浮菌藻系统处理污水能达到较好的效果,然而聚集的微生物可能由于沉积物属性如剪压力、附着细菌的数量和水流速而重新悬浮,导致出水水质受到影响(Pandey et al., 2012),其对污染物的去除仍然是依靠藻类自然生长和半人工控制手段,仍有许多因素限制藻类生长,如光照、生物量、水力停留时间等(Rawat et al., 2011).虽沉降效果好,但需定期排泥,处理效果不稳定,在实际应用中受到限制.
5.2 固定化菌藻系统针对悬浮菌藻系统出水水质易受悬浮菌藻的影响,且分离收获困难,产泥量大等特点,菌藻固定化技术随之发展起来.菌藻固定化技术是在细胞固定化技术基础上发展起来的,利用菌藻之间的协同作用,将细菌和微藻按照一定的比例固定在特定的载体上的技术,其主要目的是提高单位面积的生物量,同时利于微藻的收集,常见的载体材料有海藻酸钙、卡拉胶、琼脂、聚丙烯酰胺、聚乙烯醇等(严清等, 2012).李永华(2010)对比分析了固定化的菌藻体系对污水的处理效果明显好于游离态的菌藻系统.潘辉等(2006)以聚乙烯醇作为包埋剂,将活性污泥与小球藻制成包埋球状颗粒,用于高有机物、低氮磷浓度的市政污水的处理,实现了氨氮高达100%的去除和磷的93.6%的去除效果.牛曼等(2010)设计了一套固定化菌藻小球的流化床光生物反应器和好氧池组成的“菌藻-菌”系统,以避免活性污泥的遮光作用,同时不破坏藻菌之间的共生关系,利用该系统处理碳酸饮料污水,COD、NH4+ -N和PO43-去除率分别达90. 5%、82. 6%和75.8%.虽然固定化技术提高了菌藻系统对污水的处理效果和藻类的生物量,但其在应用过程中还存在一些缺陷,如包埋基质可能会阻碍菌藻代谢产物、氧气和二氧化碳的传递.此外,基质长时间使用会发生降解,产生有毒物质,从而影响菌藻的正常代谢等(王秀和张小平,2009).固定化的成本较高,很难找到无毒、透明、多孔、稳定而不溶解于处理介质或不易被生物分解的载体,限制了其在污水处理中的应用.
5.3 菌藻生物膜系统菌藻生物膜技术是在固定化技术的基础上发展起来的,它与固定化技术不同之处在于它利用微藻本身易于附着的特性,附着在载体表面,在一定条件下培养驯化形成菌藻生物膜中微藻的密度大大提高,并且脱氮除磷效果稳定,且处理效果优于普通悬浮藻系统(邢丽贞等, 2004).相互附着的菌藻群落在固体载体生长形成光合生物膜.光合生物膜的组成和结构根据环境中的非生物和生物因素会有所不同.在生物膜的形成和增长阶段,微藻通过增加或减少特定的启动子的表达影响胞外聚合物(EPS)的产生速率,进而对环境变化做出响应.Shen(2015)等研究表明增加营养物质浓度,尤其是氮浓度,能增加硅藻和绿藻EPS的产量.此外,温度变化和矿物质(Ca2+)积累也能影响藻类的EPS的产生(Schnurr and Allen, 2015).
菌藻生物膜中包括不同的藻类(绿藻、硅藻、丝状藻等)、细菌(异氧细菌、自养细菌)、蓝细菌、原生动物和多细胞微生物等.它们在生物膜内彼此之间形成共生关系.菌藻生物膜的成熟度会影响所存在物种的演替,例如影响藻类、细菌、EPS的丰度和比例.菌藻生物膜的形成与生长主要有4个阶段(Barranguet et al., 2004;Zippel and Neu, 2005;Roberta et al., 2006),其示意图见图 2.在菌藻生物膜中形成的初始阶段,也称为固体载体表面调节阶段(Ⅰ),由细胞分泌的胞外聚合物附着在固体载体上,细菌开始生长,在此阶段生物膜中含有较高的EPS和细菌比例,蓝细菌和藻类相对较少.随后,进入光合生物膜的早期生长阶段(Ⅱ),各类微藻开始附着在固体载体表面的EPS基质中生长.在光合生物膜的发展阶段(Ⅲ),藻类细胞快速生长,与EPS基质中的细菌形成了共生微环境.如果培养液中营养物质充足,光合生物膜将进入成熟阶段(Ⅳ),在EPS基质中有较为丰富的藻类细胞、细菌和营养物质.
图 2(Fig. 2)
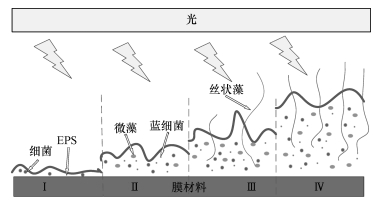 |
| 图 2 菌藻生物膜形成发展阶段示意图 Fig. 2Formation and development of bacterial-algal biofilm |
菌藻生物膜系统典型的有水力藻类床.水力藻类床系统主要由附着在倾斜水渠中的丝状藻、悬浮的微藻和细菌组成,可以认为是强化藻类作用的高效藻类塘.美国帕特森市利用水力藻类塘系统对城市部分处理水进行深度处理,平均磷去除量达到(0.73±0.289) g·m-3·d-1(邢丽贞等, 2004).随着菌藻系统理论的发展,有益于菌藻共生微环境的菌藻生物膜反应器应运而生.Chavan和Mukherji(2008)在生物转盘上接种了细菌和微藻,利用形成的菌藻生物膜处理柴油废水.De Godos等(2009)依据菌藻共生原理,设计并开发出了一种由Chlorella sorokiniana和活性污泥构成的管状菌藻生物膜光反应器,可实现光合作用的O2和CO2、高浓度的氨氮从膜的两边各自扩散,同时高效实现硝化细菌的硝化作用和微藻的光合作用,利用该反应器中处理猪场污水,总碳(TOC)、NH4+-N和PO43-去除量分别达到(80±5)、(89±5)、(13±3) g·m-3·d-1.菌藻生物膜系统处理污水存在一定的优势,能克服悬浮菌藻系统出水含有大量藻类和细菌,影响出水质量的缺点,同时生物膜易于形成,优势菌种和藻类不易流失,菌藻生物膜形成过程中菌藻分泌的EPS能够为菌藻共生体提供一个缓冲的微环境,使菌藻生物膜能在不利的环境中保持较高的活性,并持续去除污水中的污染物(张道勇等, 2004),成本较低,但存在生物膜脱落问题,设计及运行反应器时应综合考虑光照、水力流速等因素,控制生物膜的增殖衰减与平衡.
菌藻共生系统处理污水的几种类型及其应用的优缺点如表 2所示.
表 2(Table 2)
| 表 2 菌藻共生系统在污水处理中的应用及其特点 Table 2 Bacterial-algal symbiotic systems used for wastewater treatment | |||||||||||||||||||
表 2 菌藻共生系统在污水处理中的应用及其特点 Table 2 Bacterial-algal symbiotic systems used for wastewater treatment
| |||||||||||||||||||
6 结论(Conclusions)菌藻系统中菌藻之间的关系相对较为复杂,菌藻系统相对于单独细菌系统和单独藻类系统表现出更高的污染物耐受能力.因此,利用菌藻共生关系处理污水,如含高N、P污水、重金属污水、抗生素污水等时,具有一定的优势,但需依据废水特征合理地选择菌藻种类.用于污水处理的菌藻共生系统主要包括如下类型:悬浮菌藻系统、固定化菌藻系统和菌藻生物膜系统.目前菌藻生物膜系统相比悬浮菌藻系统、固定化菌藻系统更具优势,具有处理效率高、优势菌藻不易流失、处理成本较低等特点.
7 展望(Prospects)菌藻共生系统在污水处理与资源化领域具有广阔的应用前景.但总体来说,在菌藻系统去除污染物的代谢机理、传质过程、工艺动力学模拟、反应器设计等诸多方面仍需加强.
1) 菌藻共生系统对污染物去除有一定优势,但菌藻微环境中菌藻结合的界面作用力以及结合条件仍不清楚,细菌和微藻具体对污染物去除的贡献率尚未探究清楚,因此可通过微观机理研究与污染物去除特性相联系,进一步研究菌藻共生系统去除污染物的机理.
2) 菌藻生物膜系统也存在生物膜脱落等问题,生物膜中微环境的形成与维持、共生传质、菌藻增殖衰减平衡及代谢机理等方面都有待深入的研究.
3) 菌藻共生系统不仅能去除水中污染物,同时也能固定气体中的CO2,如何合理的设计菌藻生物膜光生物反应器同时实现废水和废气同步处理,仍有较大的技术开发和工艺优化的空间.
参考文献
| Abed R, Ster J K. 2005. The direct role of aerobic heterotrophic bacteria associated with cyanobacteria in the degradation of oil compounds[J]. International Biodeterioration & Biodegradation, 55(1): 29–37. |
| Amin S A, Parker M S, Armbrust E V. 2012. Interactions between diatoms and bacteria[J]. Microbiology and Molecular Biology Reviews, 76(3): 667–684.DOI:10.1128/MMBR.00007-12 |
| Bai X, Acharya K. 2016. Removal of trimethoprim, sulfamethoxazole, and triclosan by the green alga Nannochloris sp.[J]. Journal of Hazardous Materials, 315: 70–75.DOI:10.1016/j.jhazmat.2016.04.067 |
| Barranguet C, Van S A M, Manders E M M, et al. 2004. Studying undisturbed autotrophic biofilms:still a technical challenge[J]. Aquatic Microbial Ecology, 1(34): 1–9. |
| 陈志华. 2010. 活性污泥-螺旋藻体系处理污水的研究[D]. 长春: 东北师范大学. 33http://d.wanfangdata.com.cn/Thesis_Y9013027.aspx |
| 迟堃. 2010. 城市污水处理菌藻共生系统中影响藻类生长的因素研究[D]. 哈尔滨: 哈尔滨工业大学. 78http://d.wanfangdata.com.cn/Thesis/D260512 |
| Calabrese E J. 1999. Evidence That hormesis represents an "Overcompensation" response to a disruption in homeostasis[J]. Ecotoxicology and Environmental Safety, 42(2): 135–137.DOI:10.1006/eesa.1998.1729 |
| Chavan A, Mukherji S. 2008. Treatment of hydrocarbon-rich wastewater using oil degrading bacteria and phototrophic microorganisms in rotating biological contactor:Effect of N:P ratio[J]. Journal of Hazardous Materials, 154(1/3): 63–72. |
| Chen C, Lin J. 2006. Toxicity of chlorophenols to Pseudokirchneriella subcapitata under air-tight test environment[J]. Chemosphere, 62(4): 503–509.DOI:10.1016/j.chemosphere.2005.06.060 |
| Chinnasamy S, Bhatnagar A, Hunt R W, et al. 2010. Microalgae cultivation in a wastewater dominated by carpet mill effluents for biofuel applications[J]. Bioresource Technology, 101(9): 3097–3105.DOI:10.1016/j.biortech.2009.12.026 |
| Chu W, See Y, Phang S. 2009. Use of immobilised Chlorella vulgaris for the removal of colour from textile dyes[J]. Journal of Applied Phycology, 21(6): 641–648.DOI:10.1007/s10811-008-9396-3 |
| Christenson L, Sims R. 2011. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts[J]. Biotechnol ADV, 29(6): 686–702.DOI:10.1016/j.biotechadv.2011.05.015 |
| Crane K W, Grover J P. 2010. Coexistence of mixotrophs, autotrophs, and heterotrophs in planktonic microbial communities[J]. Journal of Theoretical Biology, 262(3): 517–527.DOI:10.1016/j.jtbi.2009.10.027 |
| 邓建明, 陶勇, 李大平, 等. 2009. 溶藻细菌及其分子生物学研究进展[J]. 应用与环境生物学报, 2009, 15(6): 895–900. |
| Davis T A, Volesky B, Mucci A. 2003. A review of the biochemistry of heavy metal biosorption by brown algae[J]. Water Research, 37(18): 4311–4330.DOI:10.1016/S0043-1354(03)00293-8 |
| De-Bashan L E, Trejo A, Huss V A R, et al. 2008. Chlorella sorokiniana UTEX 2805, a heat and intense, sunlight-tolerant microalga with potential for removing ammonium from wastewater[J]. Bioresource Technology, 99(11): 4980–4989.DOI:10.1016/j.biortech.2007.09.065 |
| De Godos I, González C, Becares E, et al. 2009. Simultaneous nutrients and carbon removal during pretreated swine slurry degradation in a tubular biofilm photobioreactor[J]. Applied Microbiology and Biotechnology, 82(1): 187–194.DOI:10.1007/s00253-008-1825-3 |
| Escapa C, Coimbra R N, Paniagua S, et al. 2015. Nutrients and pharmaceuticals removal from wastewater by culture and harvesting of Chlorella sorokiniana[J]. Bioresource Technology, 185: 276–284.DOI:10.1016/j.biortech.2015.03.004 |
| Farooq W, Lee Y, Ryu B, et al. 2013. Two-stage cultivation of two Chlorella sp. strains by simultaneous treatment of brewery wastewater and maximizing lipid productivity[J]. Bioresource Technology, 132: 230–238.DOI:10.1016/j.biortech.2013.01.034 |
| Hernández D, Ria?o B, Coca M, et al. 2013. Treatment of agro-industrial wastewater using microalgae-bacteria consortium combined with anaerobic digestion of the produced biomass[J]. Bioresource Technology, 135: 598–603.DOI:10.1016/j.biortech.2012.09.029 |
| Hernandez J, De-Bashan L E, Bashan Y. 2006. Starvation enhances phosphorus removal from wastewater by the microalga Chlorella spp. co-immobilized with Azospirillum brasilense[J]. Enzyme and Microbial Technology, 38(1/2): 190–198. |
| Jansson M. 1988. Phosphate uptake and utilization by bacteria and algae[J]. Hydrobiologia, 170(1): 177–189.DOI:10.1007/BF00024904 |
| Khoshmanesh A, Lawson F, Prince I G. 1996. Cadmium uptake by unicellular green microalgae[J]. Chemical Engineering Journal, 62(1): 81–88. |
| Kim H, Choi W J, Chae A N, et al. 2016. Evaluating integrated strategies for robust treatment of high saline piggery wastewater[J]. Water Research, 89: 222–231.DOI:10.1016/j.watres.2015.11.054 |
| 李杰. 2005. 难降解有机物的生物处理技术进展[J]. 环境科学与技术, 2005, 28: 187–189.DOI:10.3969/j.issn.1003-6504.2005.z1.080 |
| 李小霞, 解庆林. 2006. 菌藻共生系统处理污水的研究及应用前景[J]. 广西民族学院学报(自然科学版), 2006, 12(3): 112–114. |
| 李攀荣, 邹长伟, 万金保, 等. 2016. 微藻在废水处理中的应用研究[J]. 工业水处理, 2016, 36(5): 5–9.DOI:10.11894/1005-829x.2016.36(5).005 |
| 李永华. 2010. 固定化菌-藻体系净化养殖废水协同作用的研究[D]. 北京: 北京交通大学. 65http://d.wanfangdata.com.cn/Thesis/Y1961058 |
| 刘婳. 2012. 氨氮与TMP对氨单加氧酶活性位点的竞争抑制作用的研究[D]. 西安: 西安建筑科技大学. 49http://d.wanfangdata.com.cn/Thesis/D244674 |
| 刘玉环, 史晓洁, 巫小丹, 等. 2014. 螺旋藻和菌-藻共生系统处理啤酒废水[J]. 环境工程学报, 2014, 8(1): 82–86. |
| Loutseti S, Danielidis D, Economouamilli A, et al. 2009. The application of a micro-algal/bacterial biofilter for the detoxification of copper and cadmium metal wastes[J]. Bioresource Technology, 100(7): 2099–2105.DOI:10.1016/j.biortech.2008.11.019 |
| Li X, Hu H Y, Yang J. 2010. Lipid accumulation and nutrient removal properties of a newly isolated freshwater microalga, Scenedesmus sp. LX1, growing in secondary effluent[J]. New Biotechnology, 27(1): 59–63.DOI:10.1016/j.nbt.2009.11.006 |
| 麻晓霞, 马丽萍, 石勋祥, 等. 2012. 微藻对常用抗生素敏感性的研究进展[J]. 微生物学免疫学进展, 2012, 40(1): 83–86. |
| Mata T M, Melo A C, Sim?es M, et al. 2012. Parametric study of a brewery effluent treatment by microalgae Scenedesmus obliquus[J]. Bioresource Technology, 107: 151–158.DOI:10.1016/j.biortech.2011.12.109 |
| Mu?oz R, Alvarez M T, Mu?oz A, et al. 2006. Sequential removal of heavy metals ions and organic pollutants using an algal-bacterial consortium[J]. Chemosphere, 63(6): 903–911.DOI:10.1016/j.chemosphere.2005.09.062 |
| Mu?oz R, Guieysse B. 2006. Algal-bacterial processes for the treatment of hazardous contaminants:A review[J]. Water Research, 40(15): 2799–2815.DOI:10.1016/j.watres.2006.06.011 |
| 牛曼, 张小平, 王秀, 等. 2010. "菌藻-菌"系统处理高浓度有机废水的研究[J]. 环境工程学报, 2010(8): 1819–1822. |
| 潘辉, 熊振湖, 孙炜. 2006. 共固定化菌藻对市政污水中氮磷去除的研究[J]. 环境科学与技术, 2006, 29(1): 14–15. |
| Pan X, Chang F, Kang L, et al. 2008. Effects of gibberellin A3 on growth and microcystin production in Microcystis aeruginosa (cyanophyta)[J]. Journal of Plant Physiology, 165(16): 1691–1697.DOI:10.1016/j.jplph.2007.08.012 |
| Pandey P K, Soupir M L, Rehmann C R. 2012. A model for predicting resuspension of Escherichia coli from streambed sediments[J]. Water Research, 46(1): 115–126.DOI:10.1016/j.watres.2011.10.019 |
| Park K C, Whitney C, Mcnichol J C, et al. 2012. Mixotrophic and photoautotrophic cultivation of 14 microalgae isolates from Saskatchewan, Canada:potential applications for wastewater remediation for biofuel production[J]. Journal of Applied Phycology, 24(3): 339–348.DOI:10.1007/s10811-011-9772-2 |
| Pe?a-Castro J M, Martínez-Jerónimo F, Esparza-García F, et al. 2004. Phenotypic plasticity in Scenedesmus incrassatulus (Chlorophyceae) in response to heavy metals stress[J]. Chemosphere, 57(11): 1629–1636.DOI:10.1016/j.chemosphere.2004.06.041 |
| Pratt R, Daniels T C, Eiler J J, et al. 1944. Chlorella, an antibacterial substance from chlorella.[J]. Science, 99(2574): 351.DOI:10.1126/science.99.2574.351 |
| Rawat I, Kumar R R, Mutanda T, et al. 2011. Dual role of microalgae:Phycoremediation of domestic wastewater and biomass production for sustainable biofuels production[J]. Applied Energy, 88(10): 3411–3424.DOI:10.1016/j.apenergy.2010.11.025 |
| Roberta C, Francesca Di Pippo, Roberto De Philippis, et al. 2006. Seasonal succession of phototrophic biofilms in an Italian wastewater treatment plant:biovolume, spatial structure and exopolysaccharides[J]. Aquatic Microbial Ecology, 45: 301–312.DOI:10.3354/ame045301 |
| Ruiz-Marin A, Mendoza-Espinosa L G, Stephenson T. 2010. Growth and nutrient removal in free and immobilized green algae in batch and semi-continuous cultures treating real wastewater[J]. Bioresource Technology, 101(1): 58–64.DOI:10.1016/j.biortech.2009.02.076 |
| Schnurr P J, Allen D G. 2015. Factors affecting algae biofilm growth and lipid production:A review[J]. Renewable and Sustainable Energy Reviews, 52: 418–429.DOI:10.1016/j.rser.2015.07.090 |
| Schumacher G, Blume T, Sekoulov I. 2003a. Bacteria reduction and nutrient removal in small wastewater treatment plants by an algal biofilm[J]. Water Science & Technology, 47(11): 195–202. |
| Schumacher G. 2003b. Improving the effluent of small wastewater treatment plants by bacteria reduction and nutrient removal with an algal biofilm[J]. Water Science & Technology, 48(2): 373–380. |
| Shen Y, Zhang H, Xu X, et al. 2015. Biofilm formation and lipid accumulation of attached culture of Botryococcus braunii[J]. Bioprocess and Biosystems Engineering, 38(3): 481–488.DOI:10.1007/s00449-014-1287-1 |
| Su Z F, Li X, Hu H Y, et al. 2011. Culture of Scenedesmus sp. LX1 in the modified effluent of a wastewater treatment plant of an electric factory by photo-membrane bioreactor[J]. Bioresource Technology, 102(17): 7627–7632.DOI:10.1016/j.biortech.2011.05.009 |
| Sydney E B, Silva T, Tokarski A, et al. 2011. Screening of microalgae with potential for biodiesel production and nutrient removal from treated domestic sewage[J]. Applied Energy, 88(10): 3291–3294.DOI:10.1016/j.apenergy.2010.11.024 |
| Unnithan V V, Unc A, Smith G B. 2014. Mini-review:A priori considerations for bacteria-algae interactions in algal biofuel systems receiving municipal wastewaters[J]. Algal Research, 4: 35–40.DOI:10.1016/j.algal.2013.11.009 |
| Vanerkar A P, Fulke A B, Lokhande S K, et al. 2015. Recycling and treatment of herbal pharmaceutical wastewater using Scenedesmus quadricuada[J]. Current Science, 108(5): 979–983. |
| Vílchez C, Garbayo I, Lobato M V, et al. 1997. Microalgae-mediated chemicals production and wastes removal[J]. Enzyme & Microbial Technology, 20(8): 562–572. |
| 王秀, 张小平. 2009. 固定化藻菌小球流化床光生物反应处理高浓度有机废水研究[J]. 净水技术, 2009, 28(1): 54–57. |
| 巫小丹, 阮榕生, 王辉, 等. 2014. 菌藻共生系统处理废水研究现状及发展前景[J]. 环境工程, 2014, 32(3): 34–37. |
| Wang Y, Guo W, Yen H, et al. 2015. Cultivation of Chlorella vulgaris JSC-6 with swine wastewater for simultaneous nutrient/COD removal and carbohydrate production[J]. Bioresource Technology, 198: 619–625.DOI:10.1016/j.biortech.2015.09.067 |
| Wang Y, Ho S, Cheng C, et al. 2016. Perspectives on the feasibility of using microalgae for industrial wastewater treatment[J]. Bioresource Technology, 222: 485–497.DOI:10.1016/j.biortech.2016.09.106 |
| Wu Y, Hu H, Yu Y, et al. 2014. Microalgal species for sustainable biomass/lipid production using wastewater as resource:A review[J]. Renewable and Sustainable Energy Reviews, 33: 675–688.DOI:10.1016/j.rser.2014.02.026 |
| 邢丽贞. 2009. 藻类技术在污水深度处理中的应用[J]. 净水技术, 2009, 28(6): 44–49. |
| 邢丽贞, 陈文兵, 孔进. 2004. 藻类在净化污水中的应用-水力藻类床工艺[J]. 净水技术, 2004, 23(2): 18–20. |
| 邢丽贞, 张彦浩, 张志杰, 等. 2004. 藻类膜对城市污水净化能力的研究[J]. 西安建筑科技大学学报(自然科学版), 2004, 36(2): 186–190. |
| 熊云武, 林晓燕, 郭跃华, 等. 2016. 菌藻共生系统净化水质的研究进展[J]. 现代农业科技, 2016(4): 197–198. |
| 许丽丽. 2014. 莱茵衣藻与根瘤菌共培养提高产氢及其生理生态学机理[D]. 上海: 华东师范大学. 106http://cdmd.cnki.com.cn/Article/CDMD-10269-1014318291.htm |
| Xiong J, Kurade M B, Abou-Shanab R A I, et al. 2016. Biodegradation of carbamazepine using freshwater microalgae Chlamydomonas mexicana and Scenedesmus obliquus and the determination of its metabolic fate[J]. Bioresource Technology, 205: 183–190.DOI:10.1016/j.biortech.2016.01.038 |
| 严清, 高旭, 彭绪亚. 2012. 固定化菌藻系统对污水处理厂出水的深度处理[J]. 环境工程学报, 2012, 6(10): 3629–3634. |
| 杨国远. 2013. 斜生栅藻对重金属铅、铬胁迫的生理生化响应及其解毒效应[D]. 广州: 暨南大学. 54http://cdmd.cnki.com.cn/Article/CDMD-10559-1015002633.htm |
| Yin X W, Qiang Z M, Ben W W, et al. 2014. Biodegradation of Sulfamethazine by Activated Sludge:Lab-Scale Study[J]. Journal of Environmental Engineering, 140(7): 345–351. |
| 张道勇, 赵勇胜, 潘响亮. 2004. 胞外聚合物(EPS)在藻菌生物膜去除污水中Cd的作用[J]. 环境科学研究, 2004, 17(5): 52–55. |
| 郑耀通. 2004. 高效菌藻系统资源化处理畜牧养殖废水[J]. 武夷科学, 2004(1): 86–92. |
| 支田田, 程丽华, 徐新华, 等. 2011. 藻类去除水体中重金属的机理及应用[J]. 化学进展, 2011(8): 1782–1794. |
| Zippel B, Neu T R. 2005. Growth and structure of phototrophic biofilms under controlled light conditions[J]. Water Science and Technology, 52(7): 203–209. |
