全文HTML
--> --> --> 厌氧氨氧化作为新型脱氮工艺,因其具有污泥产量少[1]、能耗低[2]以及不需要额外投加碳源[3]等优点,受到广泛关注。但厌氧氨氧化菌(anaerobic ammonium oxidation bacteria,AnAOB)生长缓慢,对环境因素的变化异常敏感[4]。温度下降(≤15 ℃)[5]、pH的变化[6]、COD值均会对其产生不利影响[7]。这些因素导致厌氧氨氧化污泥难以富集培养,限制了该技术的大规模应用[8]。如何快速有效地富集AnAOB是推动该工艺大规模应用的关键,而接种污泥的选择被认为是影响Anammox反应器启动的重要因素之一[9]。目前Anammox反应器的启动多采用厌氧颗粒污泥[10]、厌氧消化污泥[11]以及反硝化污泥[12]作为接种污泥。有大量研究表明,AnAOB广泛存在于江河湖海的底泥中[13-15]。赵折红等[16]在三峡库区香溪河不同季节的沉积物中均发现了AnAOB的存在,且在0~10 cm内AnAOB丰度随着沉积物深度的增长呈现先增加后减少的趋势。秦红益[17]在富营养湖泊太湖的不同断面的沉积物中也都发现了AnAOB的存在,并发现0~5 cm处的沉积物是AnAOB集中分布的区域,且氮素水平会强烈影响沉积物中AnAOB的丰度和垂直分布。沈李东[18]在各种类型的淡水湿地的表层沉积物中均监测到AnAOB的存在,并说明Candidatus Brocadia和Candidatus Kuenenia属是淡水湿地系统中的优势AnAOB。虽然湿地系统广泛存在AnAOB,但截至目前,采用湿地底泥作为接种污泥启动Anammox工艺的研究鲜有报道。
基于上述研究结果,本研究采用UASB反应器,通过接种厌氧颗粒污泥、湿地底泥以及二者的混合物启动Anammox工艺,对各反应器在启动过程中的脱氮性能进行了监控,并利用高通量测序对污泥的微生物群落结构进行了分析,探讨了以湿地底泥为接种物启动Anammox反应器的可行性,以期为Anammox工艺的应用提供参考。
1.1. 实验装置与运行策略
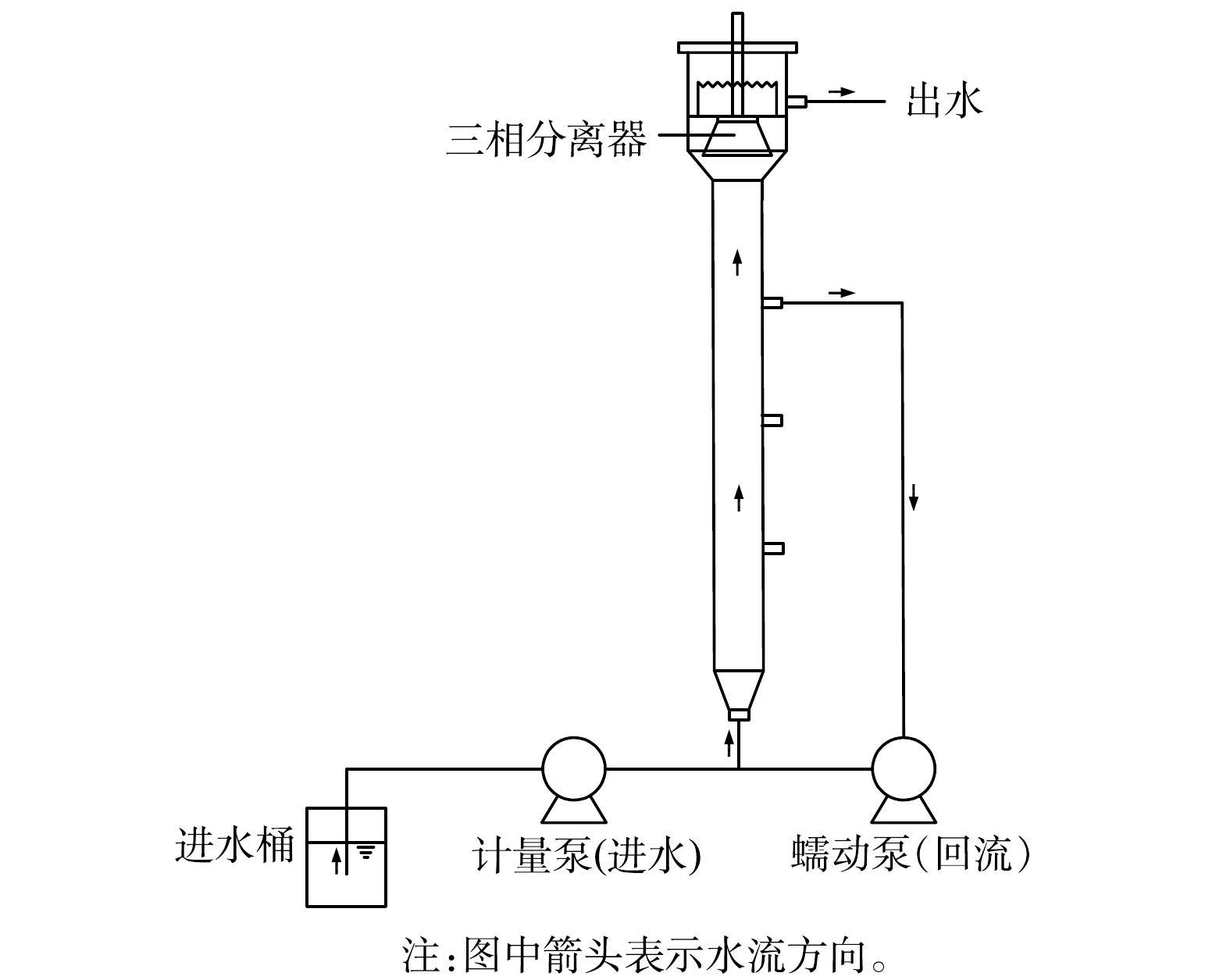
实验设备为有机玻璃制成的UASB反应器(共3台),反应器内径5 cm,高100 cm,有效容积约2 L,流量为0.083 L·h?1,装置外部包裹锡纸以避光,控制运行温度为32~35 ℃,实验装置如图1所示。由于仅靠低溶解氧难以抑制硝化菌的生长[19-20],故运行72 d后提高进水基质浓度;为改善水力条件,使微生物与底物充分接触[21-22],运行112 d后设置回流系统,具体运行策略见表1。1.2. 进水水质
反应器进水采用人工配水,NH4Cl和NaNO2分别提供

1.3. 接种污泥
接种的厌氧颗粒污泥取自处理酶制剂生产废水的厌氧反应器,MLSS为38.0 g·L?1,MLVSS为18.0 g·L?1。湿地底泥取自无锡市太湖边某湿地表层底泥,MLSS为192.6 g·L?1,MLVSS为13.8 g·L?1。R1反应器接种10 g·L?1厌氧颗粒污泥;R2反应器接种10 g·L?1 湿地底泥;R3反应器接种5 g·L?1厌氧颗粒污泥和5 g·L?1湿地底泥。1.4. 测试项目与方法
每2 d采集各反应器出水,水样经过0.45 μm滤膜过滤后根据《水和废水监测分析方法》测定各项水质指标,其中


式中:ηTRE为总氮去除率,%;C(TN)inf为进水总氮质量浓度,mg·L?1;C(TN)eff为出水总氮质量浓度,mg·L?1;NV为总氮容积负荷,kg·(m3·d)?1;Qs为进水流量,m3·d?1;V为有效容积,m3。
1.5. 高通量测序分析
采用16S rDNA高通量测序测定接种污泥和培养后污泥的微生物群落结构。污泥提取DNA后,选取通用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'GGACTACCAGGGTATCTAAT-3')对V3~V4区进行PCR扩增。扩增程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延展45 s),最后72 ℃延展10 min。扩增产物利用Illumina公司Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)测序数据采用FLASH和Trimmomatic软件进行优化,后采用UPARSE软件进行OTU聚类分析。2.1. 不同来源种泥的Anammox反应器启动
1)接种厌氧颗粒污泥的Anammox反应器启动。接种厌氧颗粒污泥的R1反应器运行期间进出水情况如图2所示。在反应器启动初期,出水氨氮及总氮质量浓度不降反升,高于进水。这是由于接种的厌氧颗粒污泥来自处理高浓度有机废水的反应器,其长期处于高COD废水环境中,存在大量异养菌,而进水中未添加有机碳源,异养菌因无法获得生长所需的足够底物而进行内源代谢,利用自身的贮藏物质,如酶等部分原生质的分解来获得营养物质,导致菌体自溶。在菌体自溶过程中,蛋白质等含氮有机物的分解导致了反应器中氨氮及总氮的升高。反应器运行至第13天,氨氮出水质量浓度开始低于进水,出水COD也由最初的425.55 mg·L?1降低至23.42 mg·L?1,标志着菌体自溶阶段结束。随着反应器继续运行,氨氮和亚硝氮去除率虽呈上升趋势,但在进水中残余溶解氧的影响下,氨氧化菌(AOB)和硝化菌(NOB)发挥了主要作用,大部分氮元素被转化为硝态氮,使出水硝态氮质量浓度不断增加。反应器中总氮去除率则呈现下降趋势,于第67天降低至6.51%。这主要是因为:随着菌体自溶现象减弱,水中COD下降,异养反硝化菌因缺少底物活性降低。在第72天增加进水浓度后,出水硝态氮质量浓度依然上升明显,表明NOB活性抑制不明显,AnAOB在竞争过程中仍然处于劣势。在第112天增加回流后,出水氨氮质量浓度下降明显,基本保持在0.51 mg·L?1左右,出水亚硝氮质量浓度则先减后增,虽然出水硝态氮质量浓度呈现先增后减的趋势,但浓度依然较高,最高时达到131.56 mg·L?1;与此同时,总氮去除率也无明显上升,在2.20%~16.14%内波动。这些结果均表明,在R1中 AOB和NOB发挥主要作用,进水中几乎所有氮元素均在它们的共同作用下转化为硝态氮,反应器内无明显的厌氧氨氧化反应。
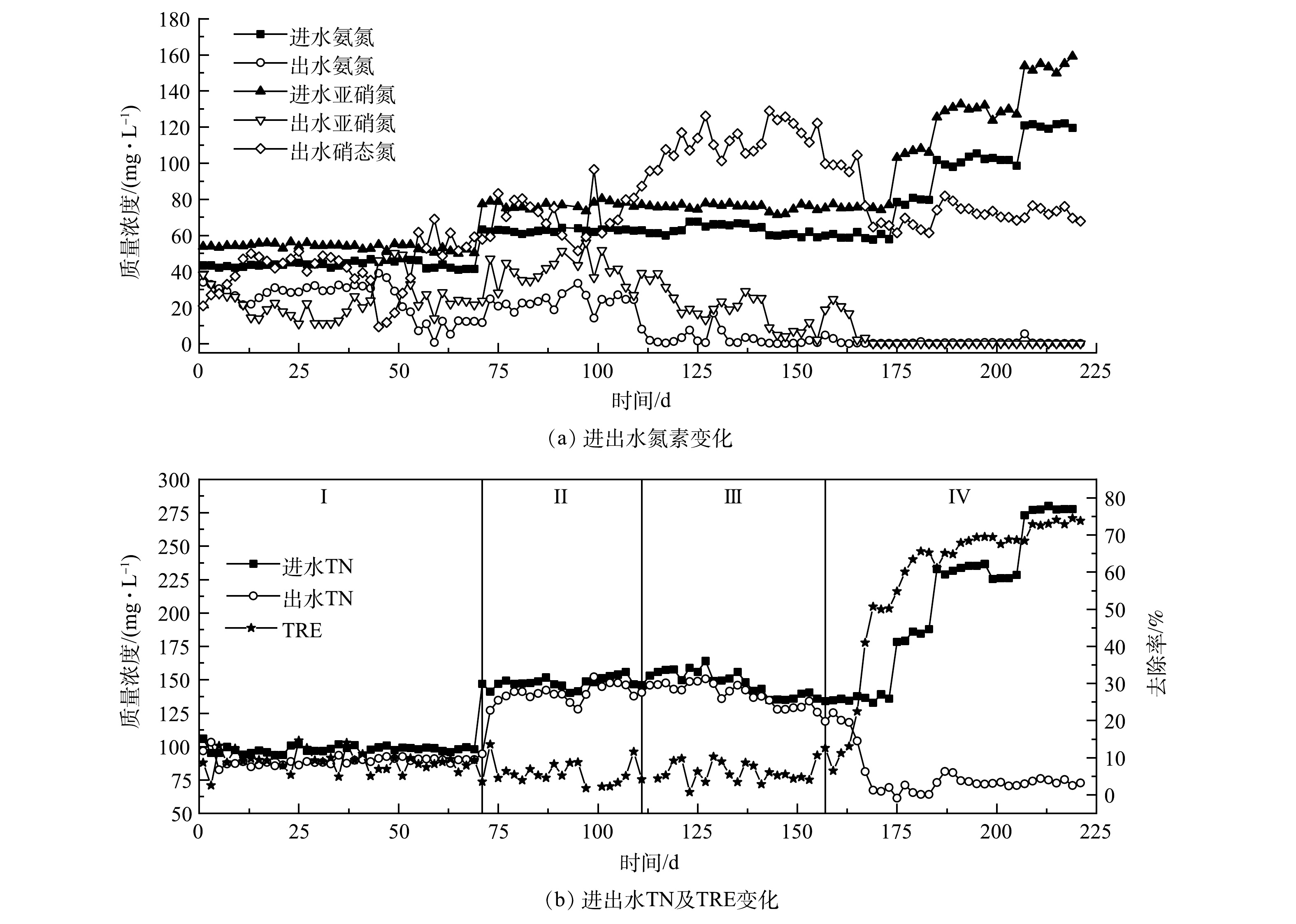
2)接种湿地底泥的Anammox反应器启动。接种湿地底泥的R2反应器运行期间进出水情况如图3所示。由于湿地水体中的COD和氮元素含量处于较低水平,底泥中的微生物能够较好地适应无机环境,故污泥接种进反应器后直接跳过了菌体自溶阶段而进入活性滞留阶段,总氮去除率维持在较低水平且无显著变化。在运行的前71 d,氨氮去除率逐步上升,出水亚硝氮质量浓度先减后增,出水硝态氮质量浓度持续增加,并于第63天达到最高值68.97 mg·L?1;而总氮去除率却无明显变化,一直维持在8.00%左右。可见,反应器内的氮元素大多通过AOB和NOB的作用转化为硝态氮,这与R1情况相似,
在第72天增加进水浓度后,氨氮和亚硝氮去除率均有所降低,出水硝态氮质量浓度也呈现下降趋势,AOB和NOB活性均受到了抑制。但从第95天开始,氨氮和亚硝态氮去除率升高,出水硝态氮质量浓度上升明显,而总氮去除率则无明显上升,表明AOB和NOB适应了环境的改变,受到的抑制效果减弱,AnAOB处于竞争劣势。设置回流系统后的前40 d内,出水氨氮和亚硝氮质量浓度逐渐降低,总氮去除率基本不变,在AOB和NOB的作用下出水硝态氮质量浓度增长迅速,最高时达到128.94 mg·L?1。运行至157 d开始,出水硝态氮质量浓度出现明显下降的趋势,并于第173天降低至65.48 mg·L?1,总氮去除率也迅速上升至50.19%,AnAOB开始展现活性且逐渐取代AOB和NOB成为R2内的优势菌种。由于从第167天起,出水中氨氮和亚硝态氮浓度较低,基本只含有硝态氮,故从第175天起逐步提高进水负荷。随着进水负荷的增加,氨氮和亚硝态氮去除率无明显降低,而出水硝态氮质量浓度却增长不明显,基本保持在70 mg·L?1左右。这是由于进水浓度的增加抑制了硝化菌的活性,同时刺激了AnAOB的增殖。随着负荷的提高,总氮去除率逐步上升,并于第219天开始在进水总氮质量浓度为275.55 mg·L?1,在氮负荷为0.275 kg·(m3·d)?1条件下,去除率稳定达到74.49%。
从R1和R2的启动结果来看,湿地底泥比处理高浓度有机废水的厌氧颗粒污泥更适合作为启动Anammox反应器的种泥。有研究[23]表明,长期较高负荷的有机物冲击会促进反硝化菌的生长,同时抑制AnAOB的生长。当COD>300 mg·L?1时,AnAOB将全部灭活,而酶制剂废水的COD值普遍高于300 mg·L?1,这也导致了接种的厌氧颗粒污泥中几乎不含AnAOB,从而致使反应器启动失败。而有大量研究[18,24]表明,湿地底泥中存在着AnAOB,且是湿地生态系统氮循环的重要组成部分,其产生的氮气可以占到湿地氮气产生总量的1.30%~42.70%,这也是采用湿地底泥为接种物成功启动Anammox反应器的重要原因。
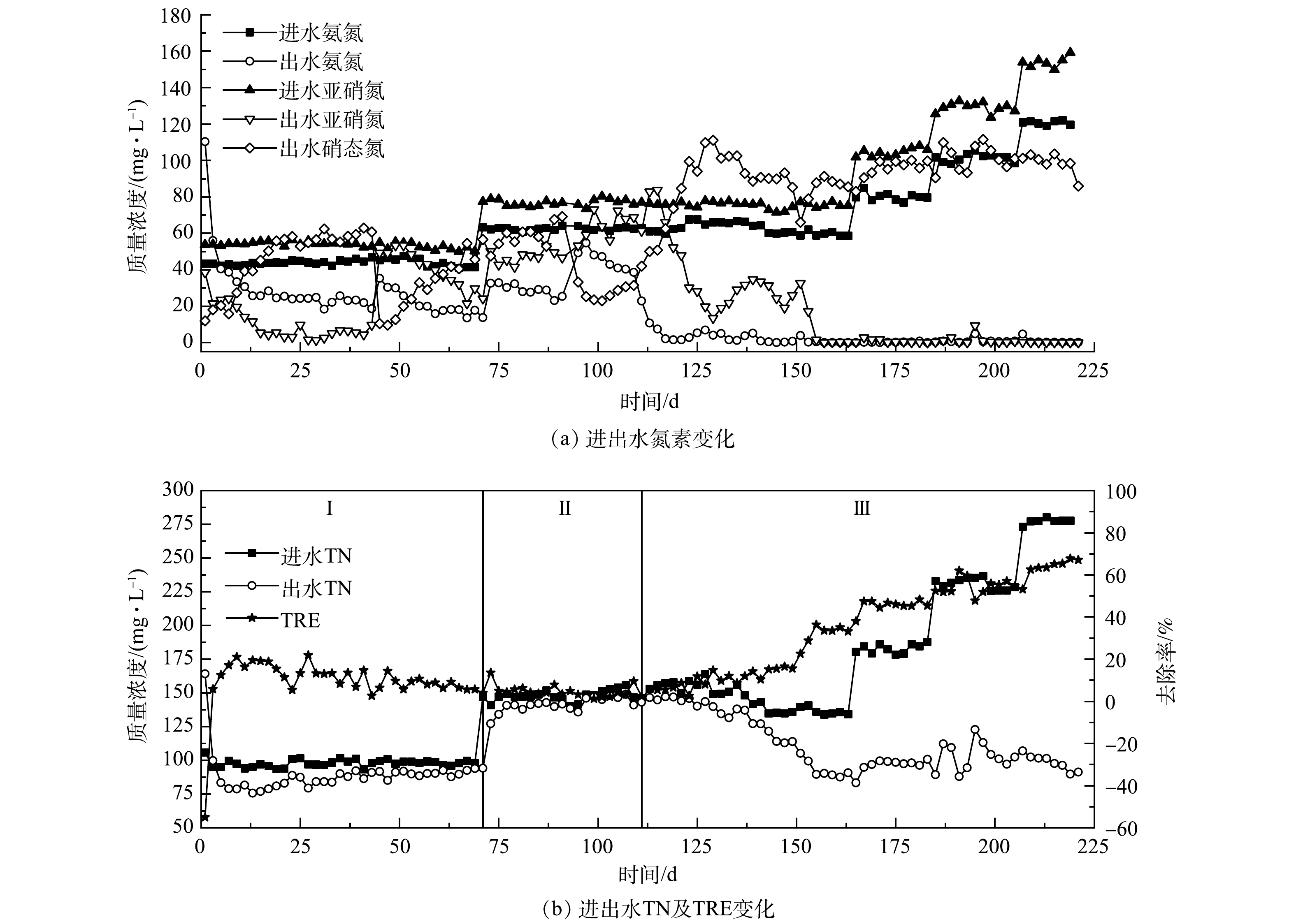
3)接种混合污泥的Anammox反应器启动。接种混合污泥的R3反应器运行效果如图4所示。在反应器启动初期,由于微生物不能适应环境的改变而自溶,出水氨氮质量浓度高于进水;反应器运行至第7天时,出水氨氮质量浓度首次低于进水,出水COD由最初的307.12 mg·L?1降低至19.84 mg·L?1,表明反应器结束菌体自溶阶段。R3菌体自溶的时间要短于R1,这是因为反应器接种的是混合污泥,异养菌含量少于纯种厌氧颗粒污泥导致。与R1、R2运行初期情况相似,R3运行前71 d氨氮去除率逐步上升,出水亚硝氮质量浓度呈现先减后增的趋势,出水硝态氮质量浓度持续增加,最高时达到62.85 mg·L?1。由于反硝化菌逐渐被淘汰,总氮去除率下降明显,并于第71天下降至3.93%,这与R1的趋势相同。
在第72天增加进水浓度后,出水亚硝氮质量浓度缓慢上升,出水硝态氮质量浓度则呈现先增后减的趋势,但总氮去除率却无明显增长,最高也仅达到9.51%。这表明,虽然NOB的活性受到了一定的抑制,但AnAOB仍未展现明显活性。在第112天增加回流后,出水硝态氮质量浓度快速增加并于第129 天达到最高值后开始降低,总氮去除率则自第125天起呈现明显的上升趋势。这表明AnAOB开始展现活性,并逐渐成为优势菌种。由于从第155天开始,出水中几乎只有硝态氮,同时为了进一步提高反应器内的AnAOB丰度,自第165天起逐步提高进水负荷。提高进水负荷后,出水氨氮、亚硝态氮和硝态氮质量浓度均无明显变化,总氮去除率则上升明显,于第219天起在进水总氮质量浓度为275.55 mg·L?1,在氮负荷为0.275 kg·(m3·d)?1条件下,去除率稳定达到67.12%。
从以往****的研究结果来看,接种混合污泥的启动时间均短于接种单一类型污泥。张泽文等[25]分别接种反硝化颗粒污泥和反硝化颗粒污泥与好氧硝化污泥的混合污泥启动Anammox反应器,结果显示,接种混合污泥的启动时间短于接种反硝化颗粒污泥。于德爽等[26]采用好氧硝化污泥和厌氧氨氧化污泥的混合物(比例2∶1)作为接种污泥,较采用好氧硝化污泥作为接种污泥的反应器的启动时间缩短约1/2。在本研究中,R3出现明显厌氧氨氧化反应特性的时间(125 d)要短于R2(155 d),表明混合污泥相较于单一的厌氧颗粒污泥或单一的湿地底泥更适合作为启动种泥,这与之前各****研究的结果相类似。在本研究中出现这一结果的主要原因是,混合污泥中的厌氧颗粒污泥在启动过程中可以作为AnAOB依附的天然载体,又因其良好的沉降性能,使AnAOB不易流失,从而可缩短反应器的启动时间[27]。而对于混合污泥中2种污泥的最佳比例,还有待进一步研究。
2.2. Anammox反应器中微生物群落结构分析
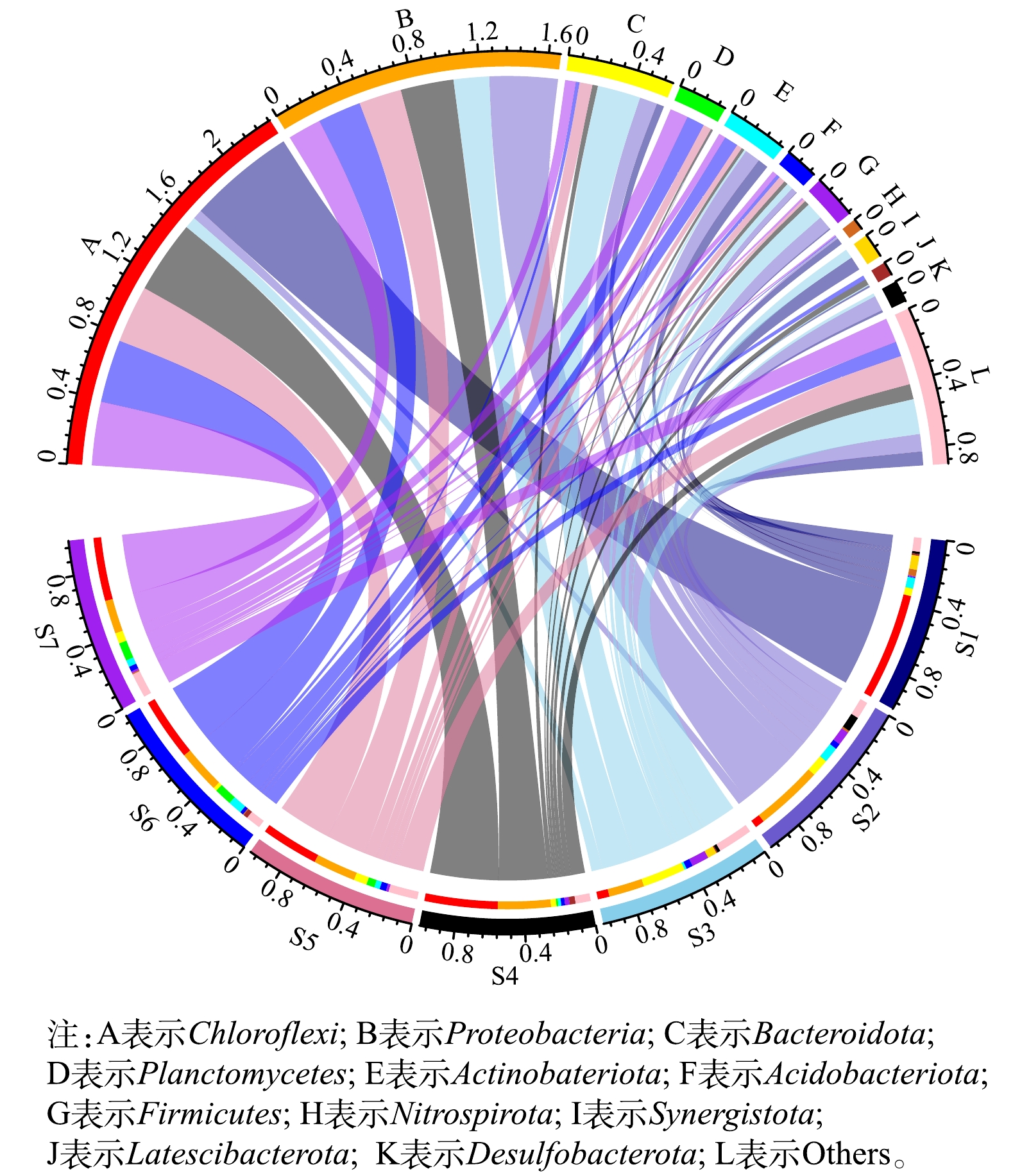
选取接种厌氧污泥(S1)、湿地底泥(S2)、R1183 d污泥(S3)、R2183 d污泥(S4)、R3183 d(S5)污泥、R2221 d污泥(S6)以及R3221 d污泥(S7)进行16S rDNA高通量测序检测微生物群落结构变化。各时期门分类水平上的微生物组成如图5所示。结果表明,S1中微生物所属的门主要为Chloroflexi(64.71%)、Actinobateriota(6.37%)、Synergistota(8.46%)、Bacteroidota(4.49%)、Nitrospirota(4.01%)等。S2中则是由Proteobacteria(41.05%)、Bacteroidota(10.66%)、Actinobateriota(9.44%)、Desulfobacterota(9.31%)、Firmicutes(8.49%)、Chloroflexi(5.75%)等组成,而AnAOB所属的Planctomycetes占比仅为0.07%。经过183 d的培养,S3中Chloroflexi门的丰度明显下降,由64.71%降低至7.12%,而Bacteroidota门和Proteobacteria门的丰度则分别上升至26.15% 和21.50%。有研究[28]表明,Proteobacteria门几乎涵盖了所有类型的AOB。这证实了AOB为R1中的优势菌种。NOB所属的Nitrospirota门在S3中的占比较S1中下降明显,但结合R1的运行状况可知,NOB依然发挥主要作用,氮元素在其和AOB的共同作用下转化为硝态氮。而在S3中未能检测出Planctomycetes门,这也说明R1中不存在厌氧氨氧化过程。S4和S6中Chloroflexi门的丰度相较于S2增长明显, Bacteroidota门的丰度则有一定程度降低,而二者在S4和S6中的丰度则无明显差异。据文献报道,Chloroflexi门常存在于Anammox系统中,其主要作用是作为AnAOB的骨架结构参与生物膜的形成[29],同时还能降解AnAOB死亡后残留下的有机物等物质[30];此外,Chloroflexi门和Bacteroidota门被认为在污泥颗粒化的过程中起着重要作用[31]。S6中Proteobacteria门的丰度相较于S4降低5.75%,而Planctomycetes门的丰度则从1.14%(S4)升高至10.80%(S6),在R3中也有相似的微生物结构变化,S7中Proteobacteria门的丰度相较于S5也下降了5.64%, Planctomycetes门的丰度则从4.99%(S5)升高至11.00%(S7)。这些数据表明,随着反应器的运行,硝化菌逐渐被淘汰,AnAOB成为R2和R3中的优势菌种。各时期属水平上的微生物组成如图6所示。结果显示,norank_f__norank_o__SBR1031在S1中处于显著地位,其丰度达到53.30%,据报道,该菌种属于厌氧微生物具有碳水化合物发酵的能力[32]。由于湿地底泥处于自然环境中,而厌氧颗粒污泥长期处于特定人工环境中,故S2中的微生物种类明显多于S1,其优势菌种为Dechloromonas。值得指出的是,在S1和S2中都未能检测出AnAOB相关菌属,表明AnAOB在接种污泥中的含量低于万分之一,甚至可能不存在AnAOB。S3中norank_f__norank_o__SBR1031的丰度下降至0.31%,这是由于进水中不含有机物,微生物缺少底物而被淘汰。经过183 d的培养,S3中未能检测出AnAOB相关菌属,优势菌种为norank_f__Bacteroidetes_vadinHA17和Limnobacter,其丰度分别达到7.45%和6.00%。其中,前者的主要作用是参与水解酸化[33],而后者属于厌氧菌,据报道,该菌属可与AnAOB共存,可保护AnAOB免受外界干扰[34]。在S4-S7中,也都检测出一定丰度的Limnobacter。
有研究[35]表明,Candidatus Brocadia作为AnAOB的一种菌属经常出现在Anammox反应器中。如图5所示,S4~S7样品中均检测到了Candidatus Brocadia,且其丰度随着反应器的运行时间延长而增加,在R2中S6的丰度比S4增加了9.28%,达到了9.82%;而其在R3中的丰度也由5.07%(S5)增加至10.70%(S7)。这也进一步证明了反应器内的氮元素主要通过AnAOB的作用去除。
R2和R3中的Nitrosomonas的丰度随着反应器的运行逐渐减少,其在S4中的丰度为3.97%,而在S6中丰度仅为0.64%,在S7中更是未检测出该菌属。有研究[36]表明,该菌属为AOB细菌,这说明随着反应器的运行,AOB逐渐被淘汰。反应器内还存在着具有硝化作用的Nitrospira,虽然其丰度随着反应器的运行而增加,但仍处于较低水平。在S4~S7中,Nitrospira在S7中的丰度最高,但也仅为0.77%,这也从生物学角度解释了为何R3出水的硝态氮浓度要高于R2。在R2和R3启动的不同时期均检测到了硝化细菌,这可能是由反应器进水中残留的溶解氧造成的。以往****也均在研究中发现了这一现象。例如,王晓曈等[37]在采用上流式生物滤池启动Anammox反应器的过程中发现反应器中微生物结构分层明显,底层污泥中主要以硝化菌和异养菌为主;吴珊等[38]在Anammox反应器运行过程中也发现体系中存在硝化细菌。与此同时,S4~S7中也均检测到了具有反硝化作用的Denitratisoma[39],且随着反应器的运行呈现出增加的趋势,其丰度在S6和S7中分别达到0.94%和3.04%。这可能是由AOB等微生物死亡后残留的有机物所导致。总的来说,随着反应器的运行,AnAOB逐渐在R2和R3中富集,而不能适应环境的菌种逐渐被淘汰。
根据不同时期的微生物群落结构并结合3台反应器的启动过程,可以看出,进水溶解氧对Anammox反应器的启动有着较大影响。由于AOB和NOB均为自养菌,且两者均能在低溶解氧条件下发挥作用[21],这就导致即使进水中溶解氧浓度处于较低水平,氨氮和亚硝氮仍能在二者的作用下被转化为硝态氮,使得AnAOB缺少营养基质而难以生长,进而加长启动时间。对此,可通过适当提高进水基质浓度来抑制硝化菌的活性,故高基质暴露水平培养方式下更有利于AnAOB的快速富集培养[40]。而在高基质暴露水平下,AOB和NOB活性在较高的FA和低溶解氧的双重作用下受到抑制[19,41],减少二者与AnAOB对基质的竞争,从而缩短启动时间。
2)湿地底泥中的原生AnAOB含量高于处理高浓度有机废水的厌氧颗粒污泥;在接种混合污泥的反应器中,厌氧颗粒污泥可作为AnAOB的载体,又因其良好的沉降性能,故能够减少AnAOB流失,从而缩短Anammox反应器启动时间。
3)培养前后反应器内微生物群落结构发生了较大变化。接种湿地底泥和混合污泥的Anammox反应器中Planctomycetes门的丰度增长明显,Bacteroidota门的丰度则呈现下降趋势,反应器内的AnAOB为Candidatus_Brocadia,其丰度于第221天分别达到9.82%和10.70%。
参考文献

 下载:
下载: 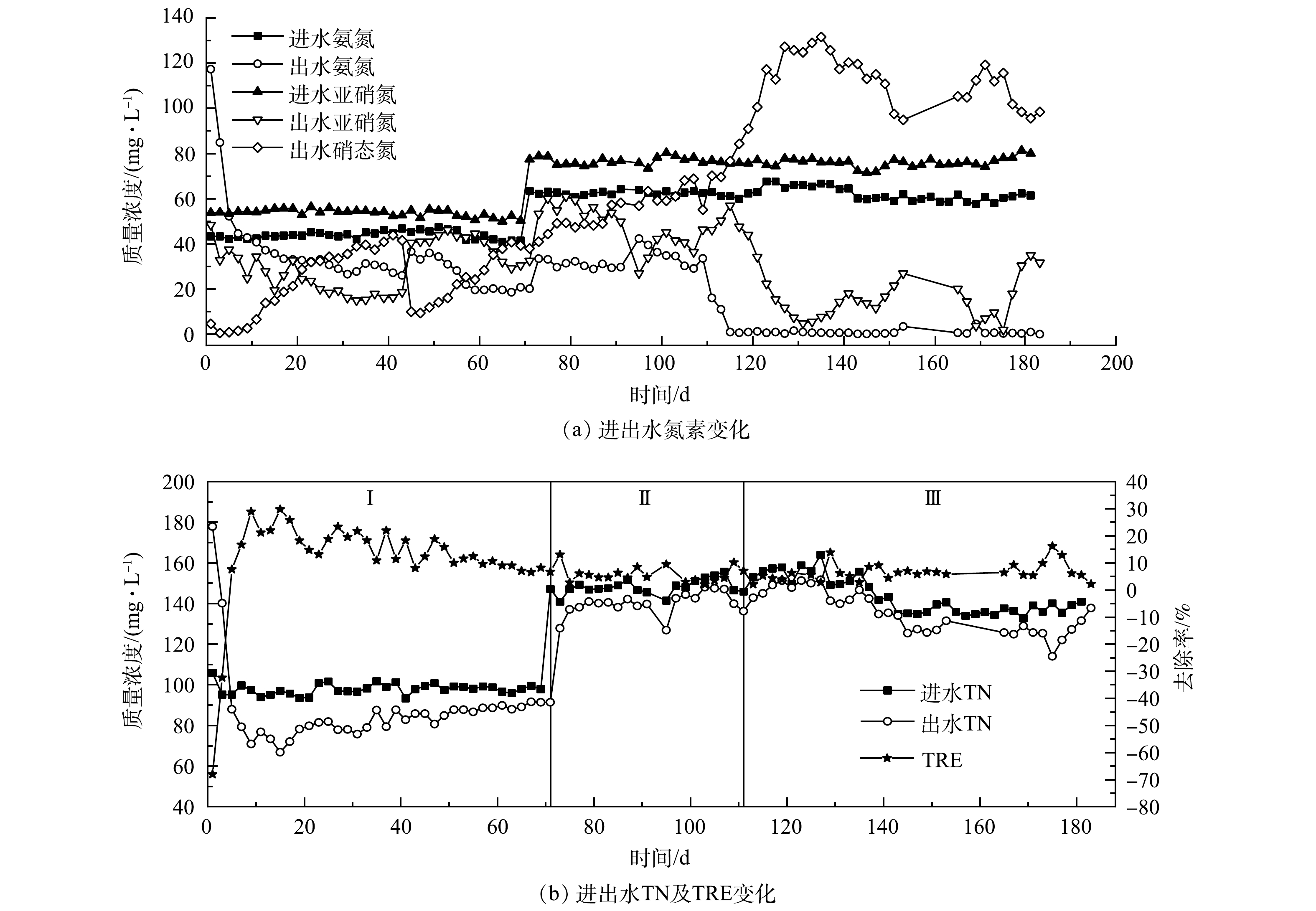

 点击查看大图
点击查看大图