全文HTML
--> --> --> 全球每年铅消费量约为5×106 t,而回收利用的铅约占其25%,故导致大量的铅进入土壤造成污染[1]。2014年发布的《全国土壤污染状况调查公报》[2]显示,有1.5%的点位铅超标。土壤中的铅可通过食物链和接触进入人体,会对神经系统和造血系统等造成危害[3]。铅污染土壤修复技术包括化学、物理、生物和联合修复技术,其中植物修复作为一种有效、经济和绿色的修复技术,并得到了广泛的研究与应用。受植物生长和土壤中铅生物有效性的限制,植物修复存在速度缓慢的问题。铅的生物有效性与铅赋存形态相关。采用BCR连续提取法可以将土壤中铅分为:酸可溶态、可还原态、可氧化态和残渣态。酸可溶态具有生物有效性;可还原态和可氧化态在一定条件下可以转化为酸可溶态,具有潜在的生物有效性;残渣态被认为是比较稳定的状态,在自然条件下难以被植物吸收[4]。将土壤中不稳定的铅转变为酸可溶态,可以有效提高土壤铅的生物有效性,促进植物修复。Thiobacillus(硫杆菌)是一种硫自养细菌。近年来,通过筛选Thiobacillus并促进植物修复铅污染土壤的研究逐步得到了关注[5-8]。然而,相关研究关注外源Thiobacillus的筛选以及对植物富集过程的促进,Thiobacillus对土壤微生物群落影响以及土壤铅的形态的影响机制尚不明确。
生物炭发达的孔隙结构能够为微生物提供生存位点,提高土壤微生物活性,吸附并提供微生物所需的营养物质,为微生物提供有利的生长环境[9-10]。YE等[6]于550 °C下制备改性生物炭,添加3%(质量分数)改性生物炭到铅污染土壤后,生物炭能够有效富集外源Thiobacillus,提高铅的生物有效性。因此,通过硫诱导富集土壤土著Thiobacillus,采用生物炭促进Thiobacillus调控土壤铅形态,提高铅生物有效性具有一定的可行性。
本研究基于Thiobacillus生物特性,通过单质硫诱导土壤中Thiobacillus富集,以调节土壤铅形态;以家具厂废料木屑为原料,制备生物炭,促进Thiobacillus的富集,强化Thiobacillus对土壤铅形态的调节作用。本研究旨在考察生物炭和硫对土壤微生物群落结构和土壤理化特性的影响,探明Thiobacillus对土壤重金属赋存形态作用机理,以期为促进铅污染土壤的植物修复提供参考。
1.1. 模拟铅污染土壤的制备
铅污染土壤取自北京林业大学花棚地表0~20 cm土壤,为北方地区常见的褐土。土壤自然风干后过2 mm尼龙筛,添加乙酸铅后老化1 a后得到模拟铅污染土壤。模拟铅污染土壤性质见表1。1.2. 生物炭的制备
将来源于北京某家具厂废料木屑,过20 目筛后,在管式炉中自室温加热至550 °C,升温速率为10 oC·min?1;恒温热解2 h,热解结束后冷却至室温,即为实验所用生物炭。1.3. 土壤培养实验设计
设计空白组CK,对照组BC(添加质量分数为3%的生物炭)、S组(添加质量分数0.5%的单质硫)和实验组(添加质量分数0.5%的单质硫和3%的生物炭),每组设置3个平行样。每个样本取500 g土壤,与生物炭和单质硫混合均匀,在室温下静置培养60 d。每2 d浇1次水,控制土壤达到田间持水率的70%。每3 d测试土壤的pH和Eh。实验结束后,测试土壤中铅的形态,分析土壤微生物群落结构,测试土壤全氮(TN)、全磷(TP)和总有机碳(SOC)。1.4. 分析方法
土壤pH和Eh分别使用pH计和Eh计测量。土壤铅形态使用改进的BCR连续提取法分析 [11]。土壤TN采用半微量凯氏定氮法测定,SOC采用重铬酸钾氧化-分光光度法测定,TP采用NaOH熔融-钼锑抗比色法测定[6]。生物炭微观形貌使用扫描电镜和X射线能谱分析(SEM-EDS) (MERLINCompact,OPTON NTS LIMITED,德国)分析。土壤官能团使用红外分析仪(VXERTE 70, Germany)分析,扫描范围4 000~400 cm?1,分辨率4 cm?1,扫描累计次数16次。土壤微生物群落结构分析。取0.5 g土壤,用尼龙筛筛去杂物,使用E.Z.N.A. DNA试剂盒对微生物DNA进行提取,采用微生物16S rRNA基因的V4区通用引物对基因组DNA进行扩增,扩增引物的序列为:515F (5'-GTGCCAGCMGCCGCGG-3')和806R:(5'-GGACTACHVGGGTWTCTAAT-3')。PCR扩增产物经纯化和定量操作后,利用Illumina MiSeq PE250平台进行扩增子测序。
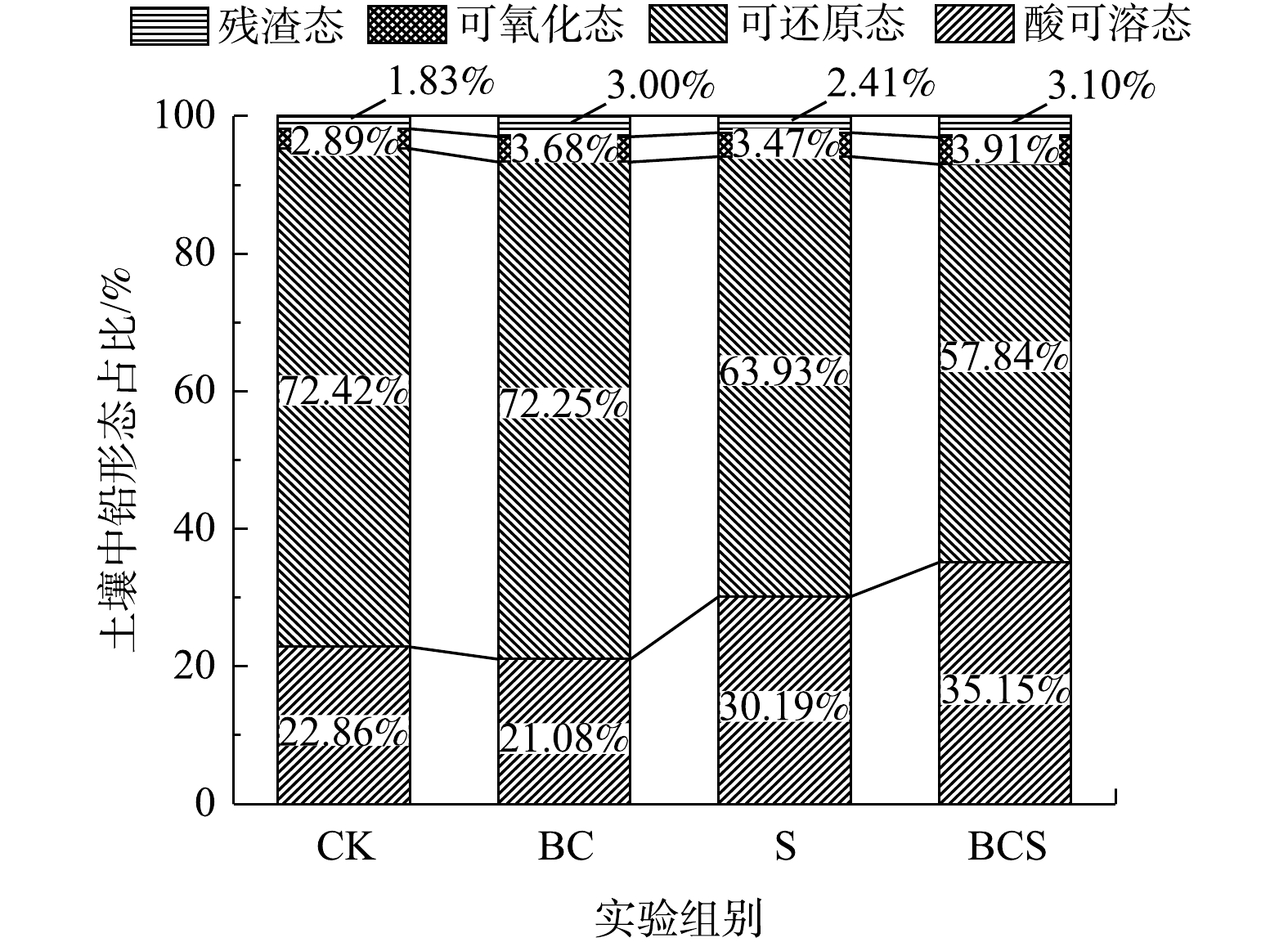
2.1. 生物炭和硫对土壤铅形态的影响
如图1所示,土壤培养60 d后,BC组中酸可溶态比CK组降低了7.79%,单独添加生物炭可以钝化土壤中的铅。安梅等[12]将4种450 °C条件下制备的生物炭,按4%(质量分数)的比例分别进行50 d土培实验,土壤酸可溶态铅下降了2.96%~4.85%。在S组和BCS组中,酸可溶态铅分别增加了30.06%和53.76%,表明添加单质硫可以活化铅并使其向酸可溶态转变,而生物炭能够促进硫对铅的活化。有研究表明,添加负载Fe1-xS的生物炭后,土壤中酸可溶态铅增加了47.77%[6]。S组和BCS组中可氧化态比CK组分别增加了20.07%和35.29%,残渣态分别增加了31.69%和69.40%。添加单质硫可使土壤中可还原态铅向酸可溶态、可氧化态和残渣态转变。土壤中重金属的酸可溶态与生物有效性呈正相关[13],因此,单质硫可以提高铅的生物有效性,促进植物修复铅污染土壤;同时,增加生物有效性较低的可氧化态和残渣态而起到钝化作用。因此,生物炭的添加则促进了硫对土壤铅形态的作用。2.2. 生物炭和硫对土壤硫杆菌的诱导作用
生物炭的微观形貌及表面元素分布见图2。生物炭表面光滑,保存有大量直径约10 μm的管状孔结构,孔径分布均匀紧密,结构发达(图2(a)~2(b))。由EDS图(图2(c)~2(d))可知,生物炭表面分布K和Ca等元素。生物炭的多孔结构能够为微生物提供更多的生存位点和较大的附着空间,并提供必须的营养盐,能够促进土壤中Thiobacillus等微生物的富集。对土壤微生物群落结构进行了分析,土壤样本的微生物多样性指数见表2。CK组、S组和BCS组的Coverage指数均大于0.99,这说明样本中DNA序列检出概率较高,测序深度合适,满足微生物多样性分析的要求。Chao 1和Ace指数表征微生物丰度,Shannon指数反应微生物多样性,Simpson指数反映微生物物种的优势度。S组和BCS组的Chao 1、Ace和Shannon指数均比CK组有所降低,这表明土壤中微生物多样性有所下降。CK组的Simpson指数为0.014,S和BCS组的Simpson指数分别增加至0.021和0.029,这表明施加单质硫和生物炭后,土壤中出现明显的优势物种。
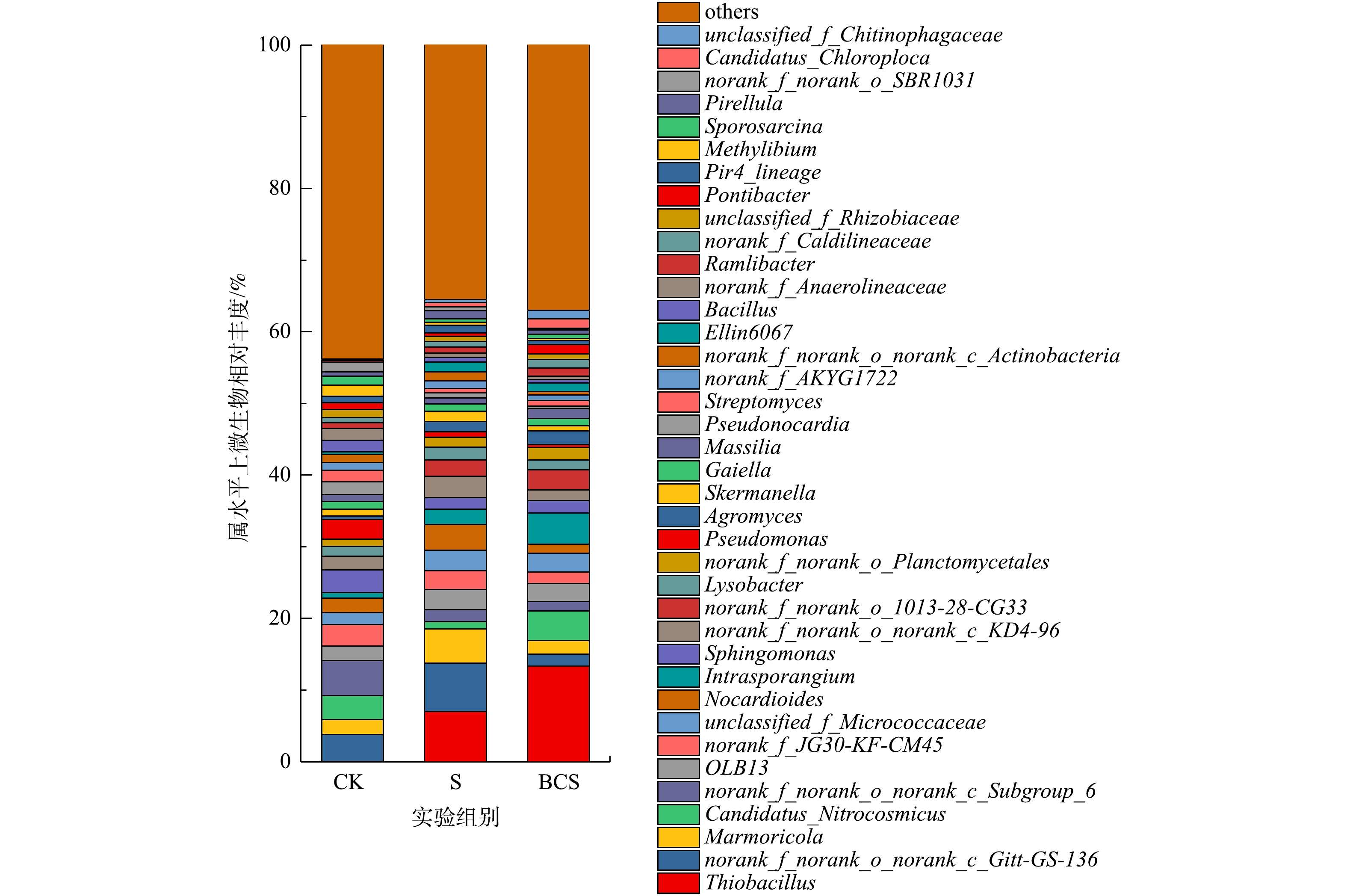
土壤微生物在属水平上的分布见图3。3个样本中共检测出601个属的微生物分类,对其中相对丰度大于1%的属进行统计,小于1%的属归为others。CK组和S组中Thiobacillus的相对丰度分别为0.02%和6.99%。Thiobacillus是化能异养细菌,通过氧化硫和硫化物生长[14]。单质硫能诱导土壤中土著Thiobacillus的富集。Thiobacillus成为土壤中的优势物种,在Thiobacillus的作用下,土壤中酸可溶态铅的增加[5, 7]。Thiobacillus富集过程中的生物成矿作用形成稳定的黄钾铁矾,铅通过共沉淀作用进入黄钾铁矾晶格中,导致土壤残渣态铅的增加(图1)[6]。
BCS组中,Thiobacillus的相对丰度达到了13.33%,比S组中增加了90.70%。生物炭的添加促进了硫对土著Thiobacillus的诱导富集作用。生物炭能够调节土壤微生物丰度,影响微生物群落结构[15],负载Fe1-xS的生物炭能够诱导土壤中Thiobacillus的相对丰度从0.06%增加至25.63%[6]。活性炭能够吸附土壤中的Thiobacillus并促进其富集[16],而生物炭与活性炭多孔结构类似,对Thiobacillus具有吸附富集作用。本研究中制备的木屑生物炭(图2)表面光滑,具有大量分布均匀密集的管状孔隙结构,表面主要元素为K、Ca等,与普通生物炭结构类似。因此,其主要通过为Thiobacillus等微生物提供大量的生存位点和必须的营养盐物质,促进单质硫诱导的Thiobacillus的富集。此外,Candidatus_Chloroploca也是一种硫氧化细菌[17],在CK组、S组和BCS组中相对丰度分别为0.25%、0.62%和1.28%。单质硫和生物炭显著提高了土壤中Candidatus_Chloroploca的相对丰度。因此,单质硫能够诱导土壤硫氧化细菌富集,生物炭则促进了该诱导作用,并且单质硫和生物炭对Thiobacillus的富集作用更显著。
Candidatus_Nitrocosmicus是土壤硝化细菌,具有氨氧化能力[18]。CK组、S组和BCS组中Candidatus_Nitrocosmicus的相对丰度分别为3.34%,1.00%和4.09%。Pseudomonas是异养硝化-好氧反硝化菌[19],Pseudomonas对



CK组中,Agromyces相对丰度为0.49%,S组和BCS组中Agromyces相对丰度分别增加至1.39%和1.90%。CK组中Skermanella的相对丰度为0.95%,S组和BCS组中Skermanella的相对丰度分别为1.43%和0.79%。Agromyces和Skermanella的相对丰度随土壤铅的添加浓度增加而增加[22],添加单质硫后,土壤中酸可溶态铅增加导致生物有效态铅增加,导致Agromyces和Skermanella的相对丰度增加。
CK组中,Sporosarcina相对丰度为1.24%,S组和BCS组中Sporosarcina的相对丰度分别降低至0.49%和0.61%。Sporosarcina能够诱导碳酸钙沉积,提高土壤pH,降低土壤中生物有效态铅[23]。S组和BCS组中酸可溶态铅增加(图1),导致Sporosarcina相对丰度降低。
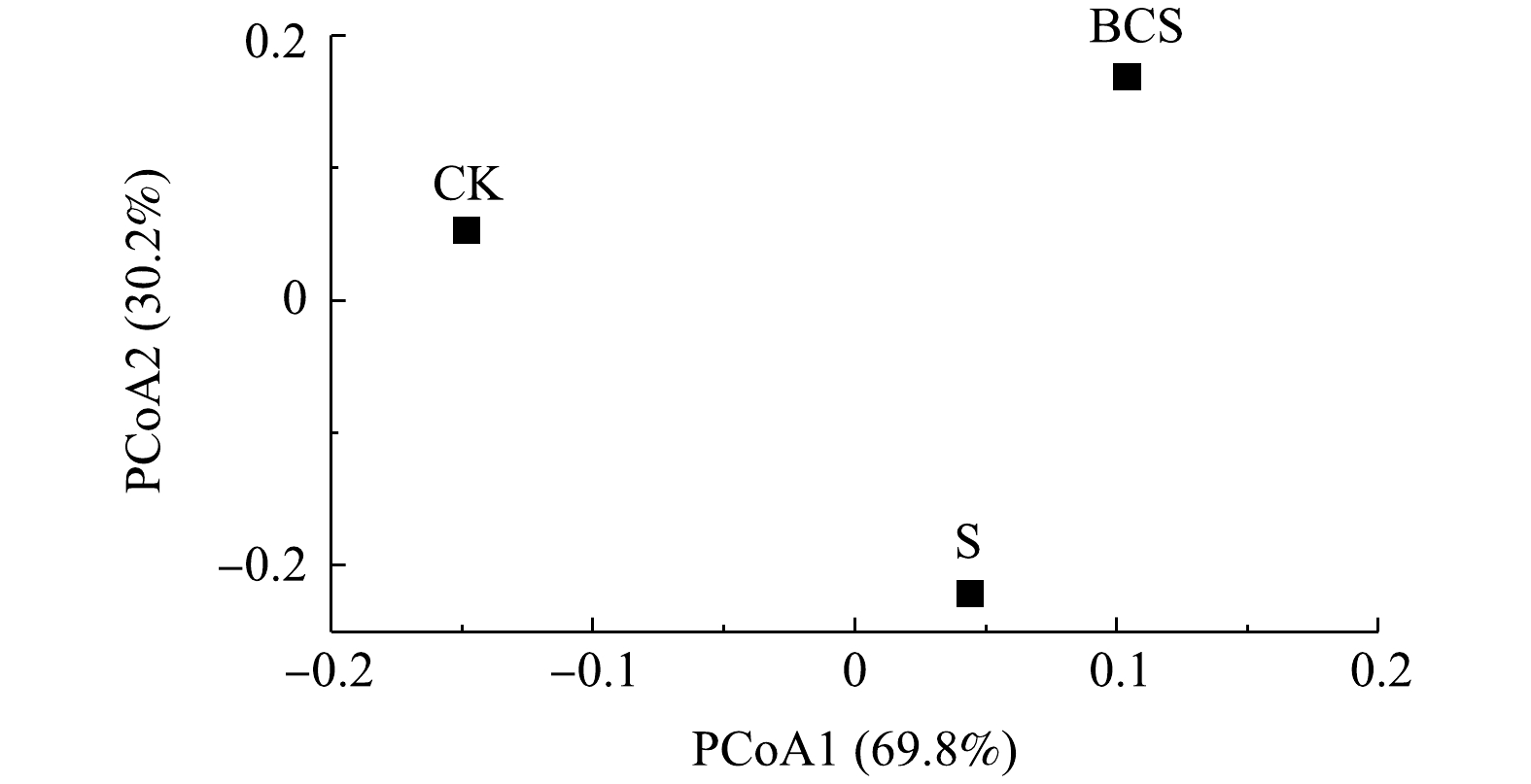
土壤微生物群落PCoA分析结果见图4。可以看出,3个样本的分别聚类于不同象限,这说明单质硫和生物炭对土壤微生物群落结构影响较大。对照处理均处于PCoA1的右侧,PCoA1主坐标成分的影响最大,可解释69.8%的变异。PCoA2的解释方差分别为69.8%和30.2%,累积解释总方差为100%。这说明,硫和生物炭的添加对根际土壤细菌群落结构的主导因子较明显。
2.3. 生物炭和硫对土壤铅形态的作用机理
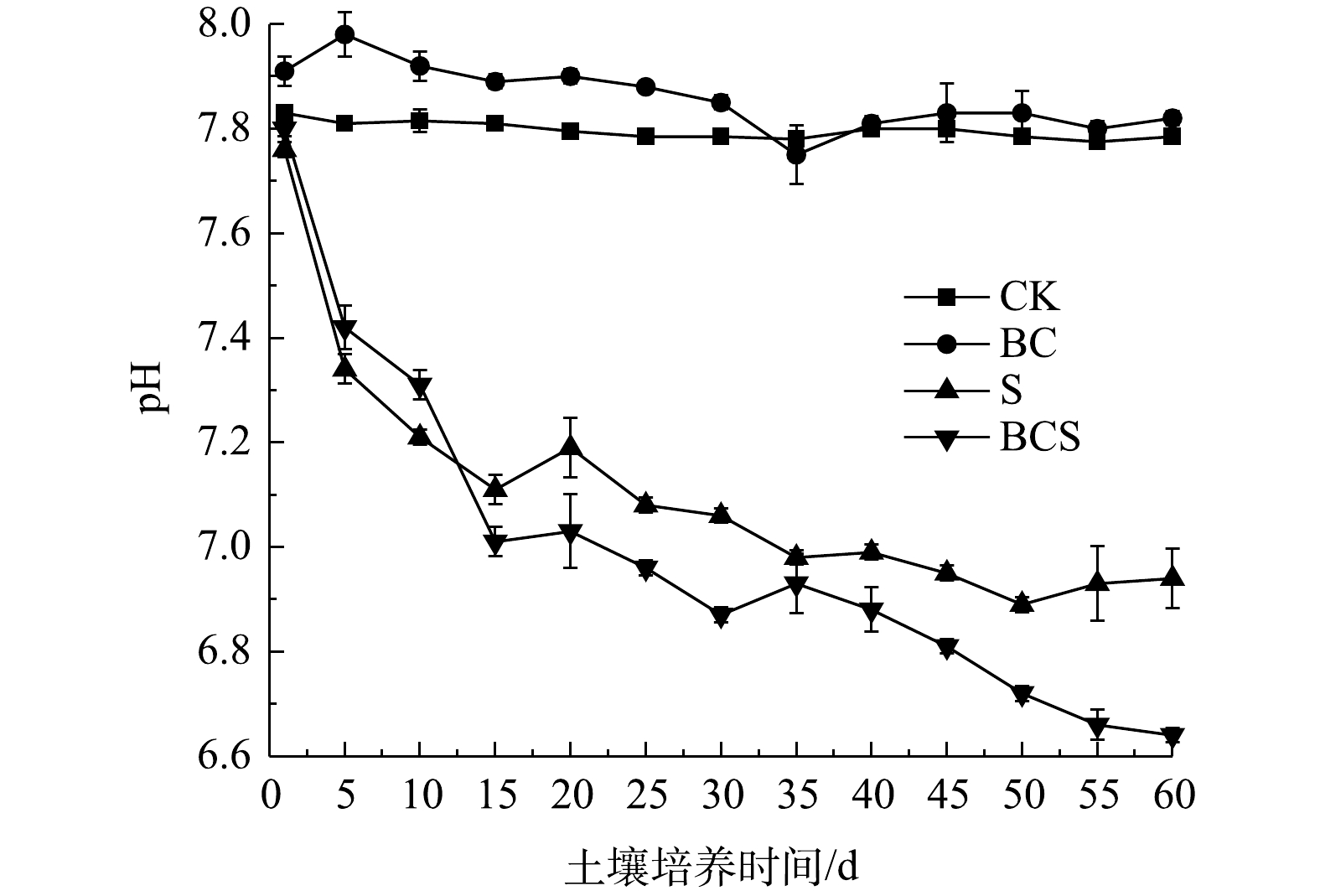
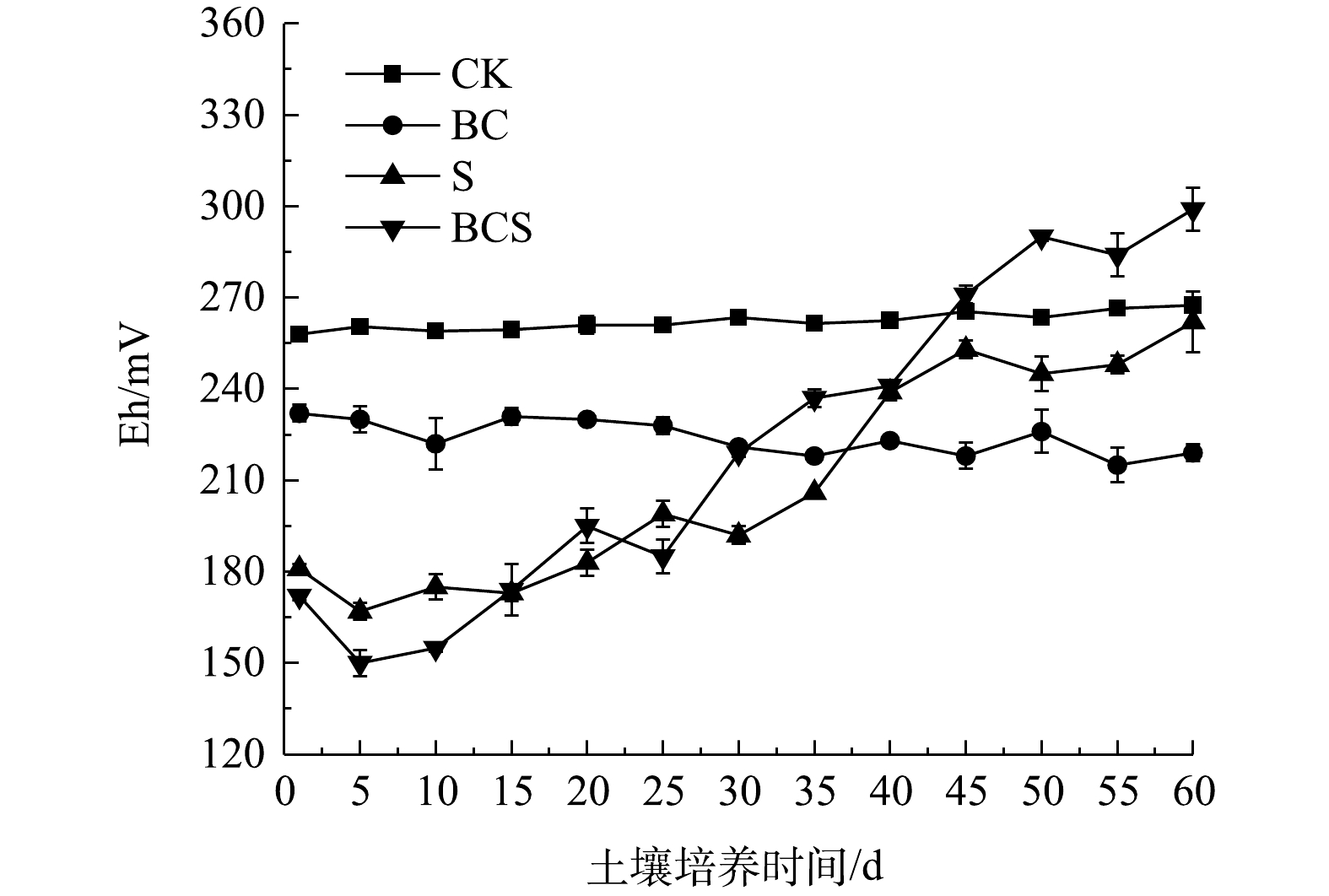
1)土壤pH和Eh。土壤pH变化见图5。CK组仅浇水保持水分,pH保持不变。BC组的pH从7.83增加至7.91,培养第6天后,pH逐渐降低并保持稳定。生物炭具有较高的pH,能够提高土壤pH[24]。S组和BCS组中,土壤pH在0~9 d迅速降低后,降低趋势减弱并最终趋于稳定,60 d后S组和BCS组的pH分别降低至6.94和6.64。Pb在土壤中酸可溶态和生物有效态都与pH呈负相关[25-26]。H+与土壤中碳酸盐、氢氧化物、黏土矿物和铁锰氧化物等颗粒表面吸附的Pb2+发生竞争吸附,因此,pH的降低导致酸可溶态Pb的增加[27]。单质硫可诱导土壤中硫氧化细菌Thiobacillus和Candidatus_Chloroploca富集(图3)。Thiobacillus对单质硫的氧化过程见式(1)[14],随着单质硫的生物氧化,土壤pH随之降低。生物炭可促进Thiobacillus在土壤中的富集,进而促进了BCS组中硫的氧化与土壤pH的降低,造成酸可溶态铅的增加。同时,单质硫的生物氧化生成SO42?,形成微溶于水的PbSO4,导致B组和BCS组中可氧化态Pb的增加(图1)[28]。土壤Eh直接体现土壤氧化还原能力,土壤Eh变化见图6。CK组的Eh稳定在258~267 mV。BC组的Eh直接降低至230 mV后逐渐降低,60 d后稳定在220 mV。S组和BCS组的Eh在第1天分别降低至180和172 mV,之后Eh逐渐升高。土壤中可还原态铅主要以铁锰氧化物结合态存在,土壤Eh的降低会导致铁锰氧化物的分解,使可还原态降低,酸可溶态增加[27]。Eh升高可导致土壤中以硫化物和有机结合态存在的可氧化态铅的释放[29]。土壤Eh降低与升高导致河滩、潮滩等土壤中多种重金属的迁移与释放[30-31]。单质硫和生物炭的添加,直接降低了土壤Eh,导致可还原态铅的减少和酸可溶态铅的增加。单质硫可诱导Thiobacillus和Candidatus_Chloroploca富集,生物炭促进了Thiobacillus的富集作用。Thiobacillus对硫的氧化作用会造成土壤Eh升高[6]。因此,单质硫和生物炭的共同作用,导致土壤Eh的先降低后升高,造成土壤中可还原态铅的减少,酸可溶态和可氧化态铅的增加。
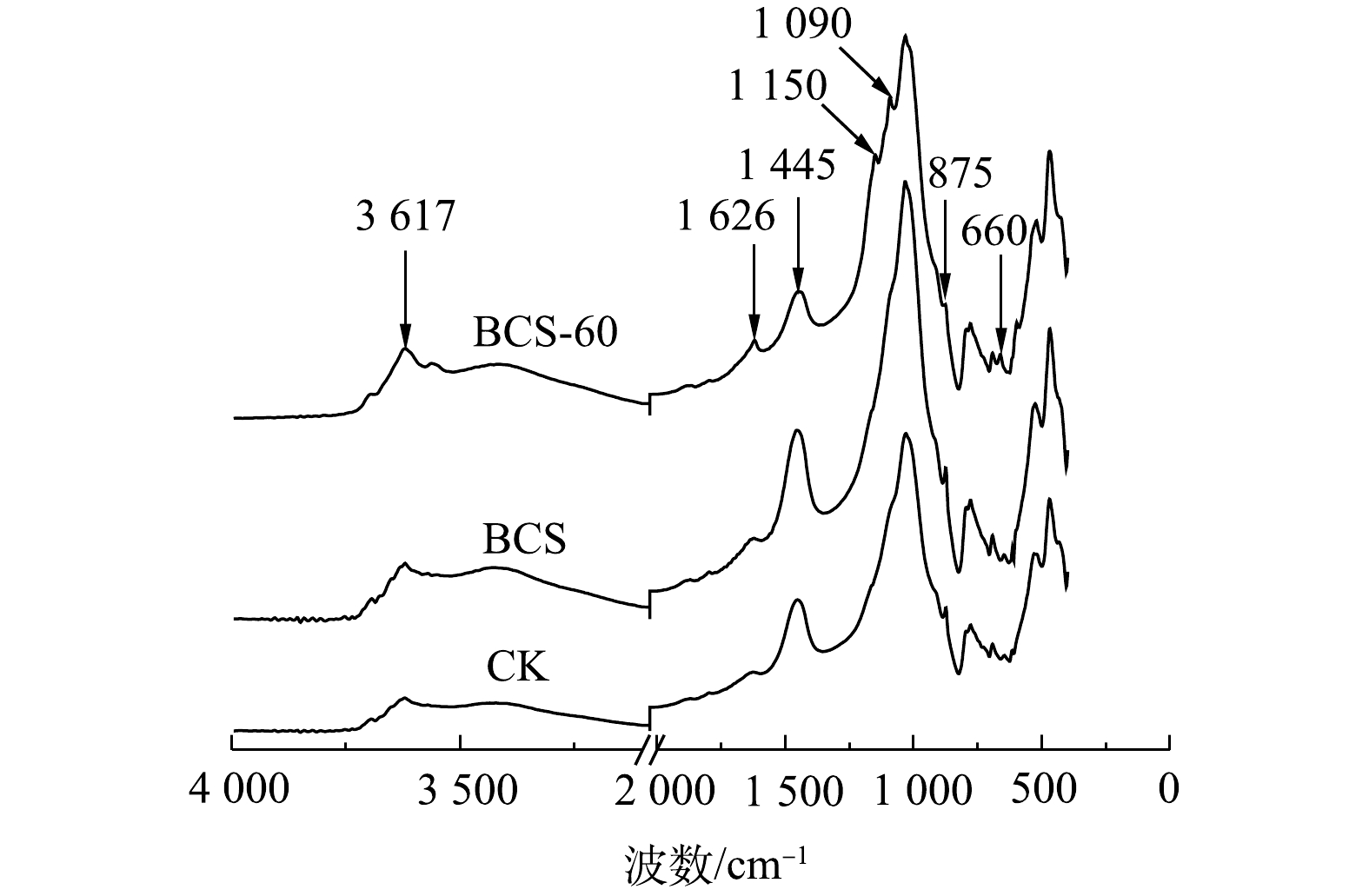
2)土壤FT-IR光谱分析。BCS组土培实验前后的土壤和CK组土壤红外光谱见图7。1 626 cm?1处的吸收峰归属于土壤有机质[32],土培实验60 d后,BCS-60中1 626 cm?1处吸收峰增强,表明土壤有机质增加。土壤有机质与可氧化态铅呈正相关[11],生物炭和硫的添加导致土壤有机质增加,造成可氧化态铅从2.89%增加至3.91%(图1)。1 445和875 cm?1处吸收峰归属于CO32-的反对称伸缩振动峰[33],对比CK和BCS,土培实验60 d后,BCS-60中这2处吸收峰降低,这说明土壤碳酸盐减少。土培实验过程中,单质硫和生物炭富集了土壤中土著Thiobacillus(图3),而Thiobacillus是以CO2和

















3)土壤营养成分变化。土培实验60 d后,土壤SOC、TN和TP的质量分数见表3。CK组中TN、SOC和TP基本保持不变。BC组的TN和TP对比CK基本保持不变,SOC增加了46.17%。生物炭含有丰富的有机质,添加生物炭可以增加土壤有机碳 [36]。单质硫的添加可促进土壤SOC的增加,S组中SOC增加了5.50%。水稻田中添加单质硫后,土壤可溶性有机碳增加了6.20%~14.23%[37]。Thiobacillus以CO2等为碳源,单质硫可诱导Thiobacillus富集,相对丰度从0.02%增加至6.99%(图3),这可能导致土壤SOC增加。在BCS组中,SOC增加了46.05%。添加硫和生物炭能够提高土壤SOC质量,土壤有机质能通过吸附、螯合等作用降低土壤铅的生物有效性,增加可氧化态铅含量[38],因此,BC组和BCS组中可氧化态铅分别增加了27.34%和35.29%。
添加生物炭后,BC组和BCS组中TN分别增加了10.78%和11.22%,而添加单质硫对土壤总氮影响不大。BC组和BCS组中总磷分别增加了9.52%和10.48%。生物炭中含有磷,能够吸附和缓释氮和磷,能够提高土壤肥力和减少氮磷淋失[39]。
2)在单质硫和生物炭的作用下,土壤中铅分别从可还原态向生物有效性高的酸可溶态转变,以及向生物有效性低的可氧化态和残渣态转变。铅形态的变化,能够在促进植物修复的同时,对部分铅进行稳定化,提高修复效率。
3)添加生物炭和硫后,土壤pH降低,Eh先降低后逐渐升高,土壤有机质增加了46.17%,pH、Eh、有机碳以及Thiobacillus的协同作用改变了土壤中的铅形态。
参考文献

 下载:
下载: 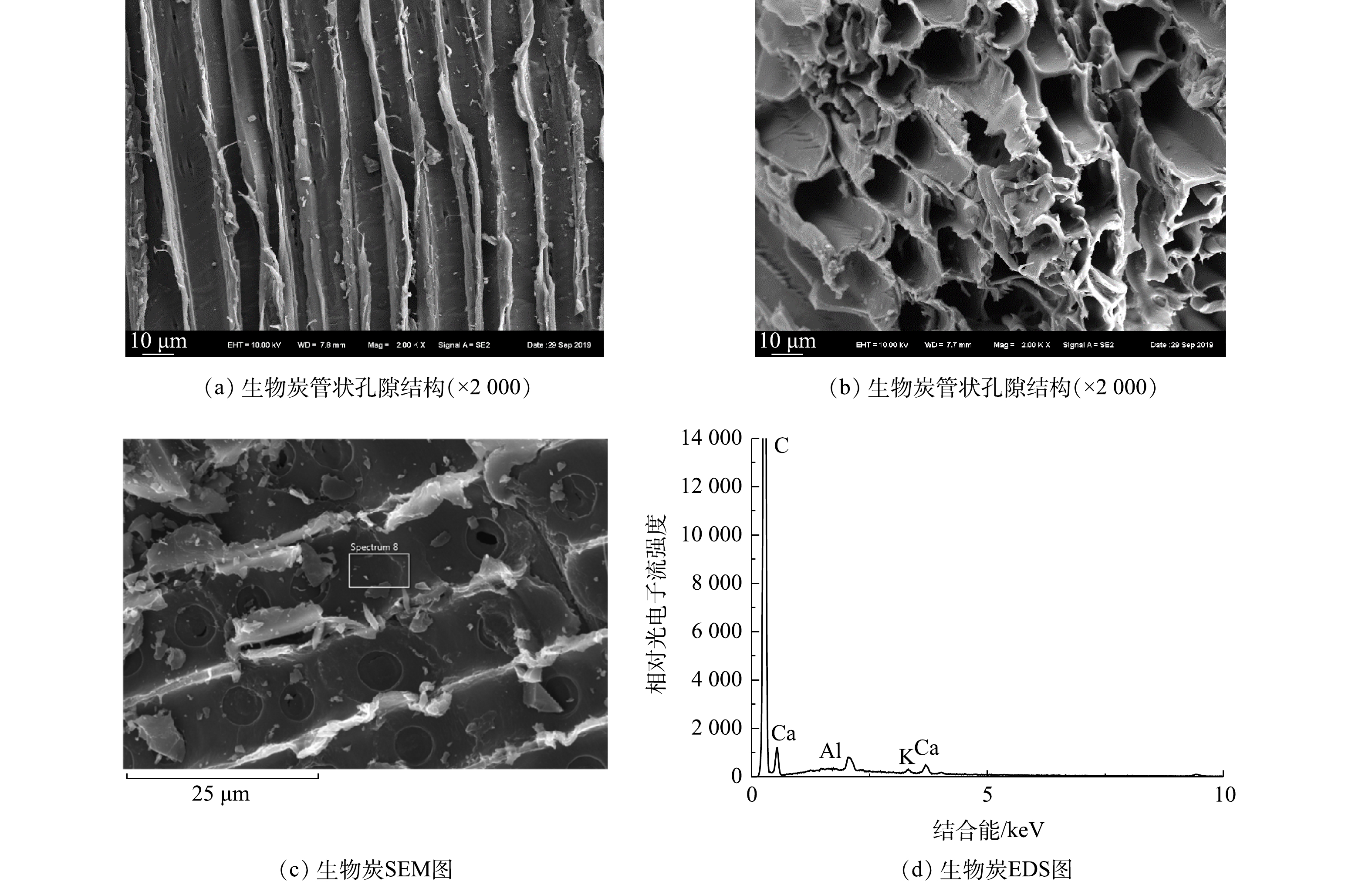
 点击查看大图
点击查看大图