3.集美大学,厦门市滨海城市污染控制与生态建设重点实验室,厦门 361021
1.School of Food and Biological Engineering, Jimei University, Xiamen 361021, China
2.School of Harbour and Environmental Engineering, Jimei University, Xiamen 361021, China
3.Municipal Key Laboratory of Pollution Control and Ecological Construction of Coastal City, Jimei University, Xiamen 361021, China
为了解决高盐废水生物脱氮效能低的问题,利用异养硝化型曝气生物滤池(heterotrophic nitrification biological aeration filter,HNBAF)处理不同氮源模拟高盐废水,研究了HNBAF系统的脱氮性能,并采用
-N之间均可以相互转化。
In order to solve the problem that the efficiency of biological nitrogen removal from high salinity wastewater is poor, a biological aeration filter system capable of heterotrophic nitrification (HNBAF) was used to treat simulated high salinity wastewater with different nitrogen source. Nitrogen removal performance of the HNBAF system was studied, and the corresponding gaseous products(N
N isotope tracer method to reveal the denitrification pathway of the HNBAF system. The results showed when NH
-N was detected.
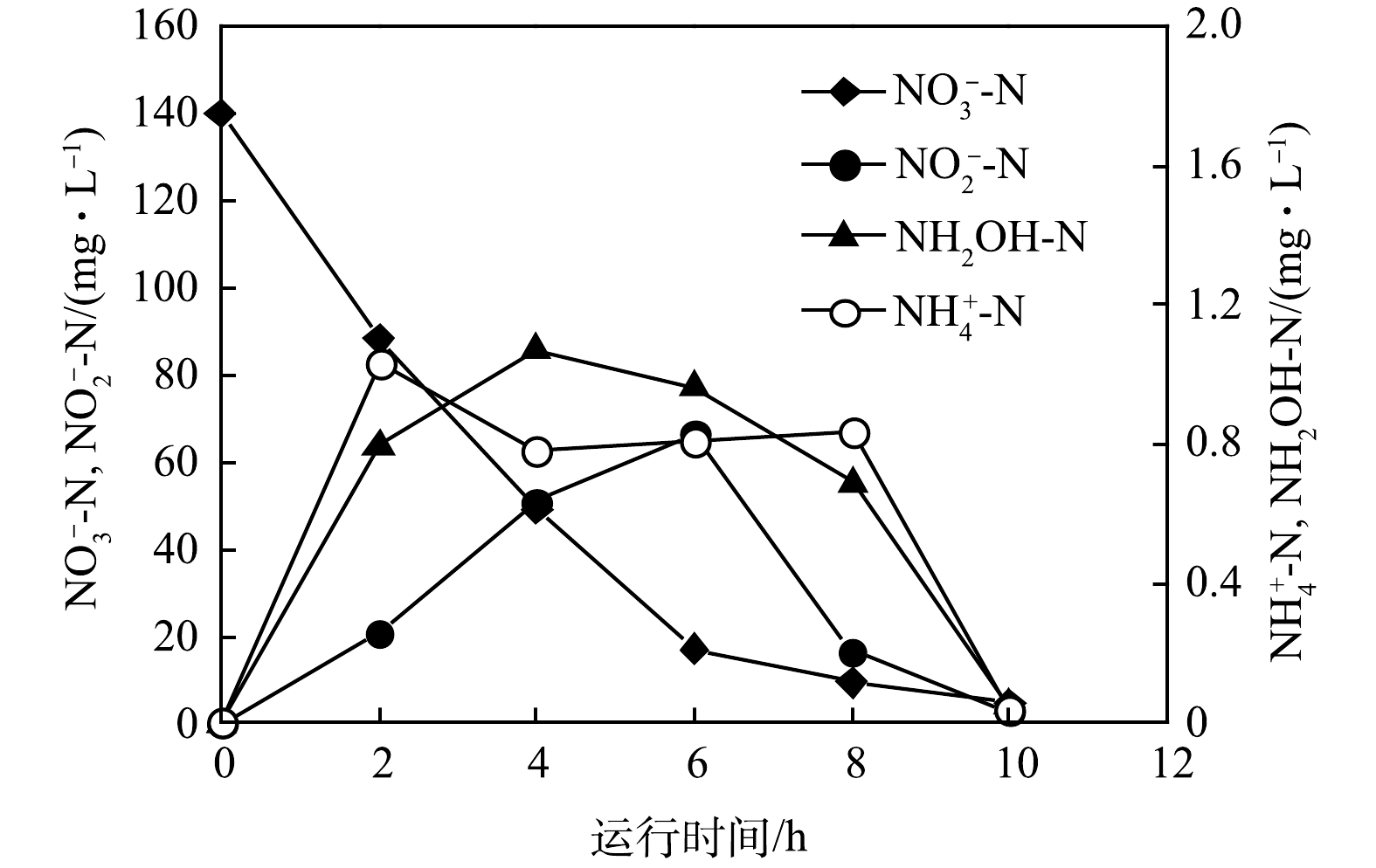
-N. When KNO
-N were all low. Both
served as the N-resource, respectively. The removal of
OH-N by the HNBAF system mainly included nitrification, aerobic denitrification and assimilation, and the main pathway of nitrogen removal was
. Meanwhile, both the conversions between NH
-N occurred.
.
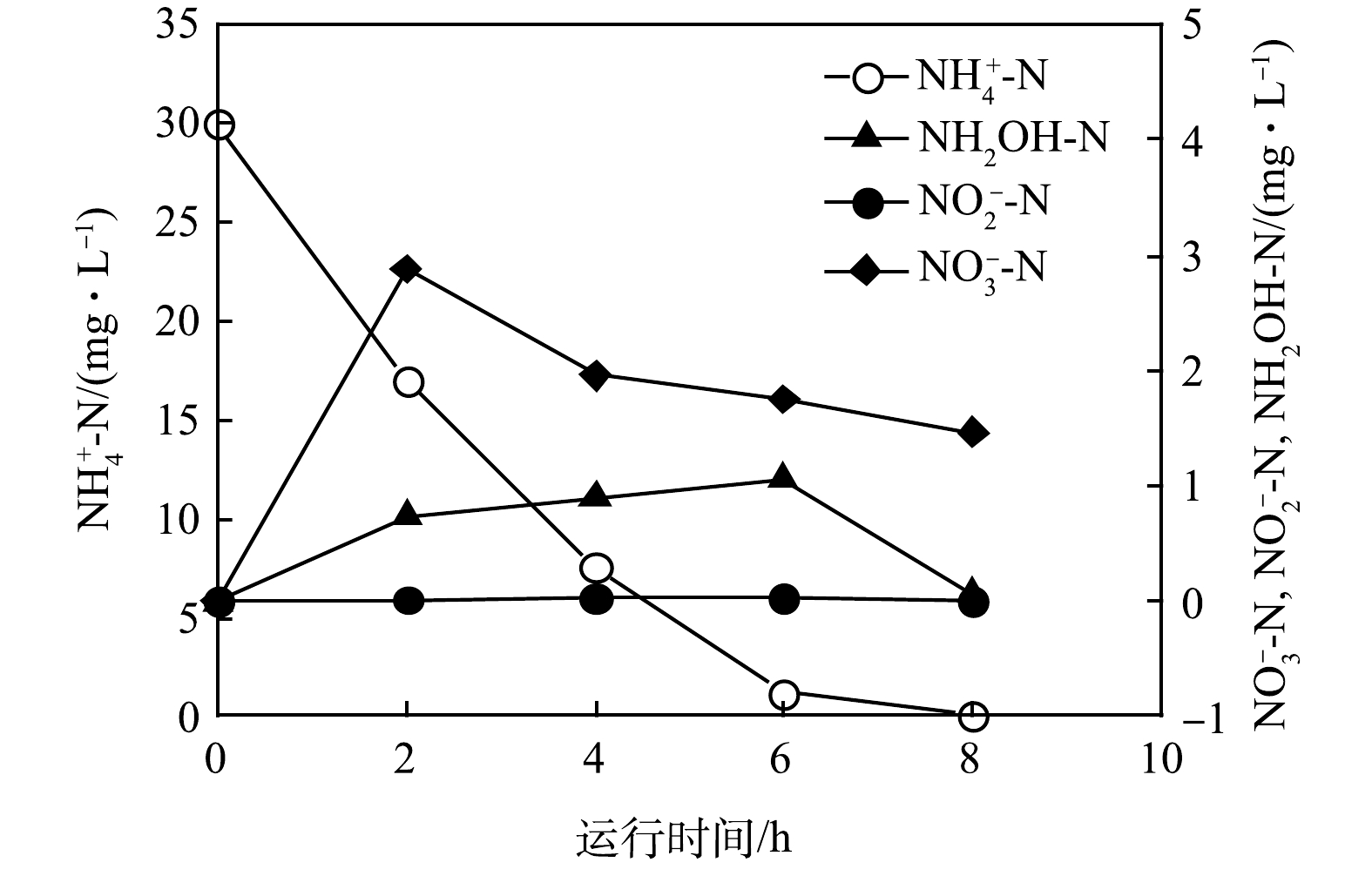
-N as the sole N-source
OH-N addition on nitrogen removal of HNBAF system
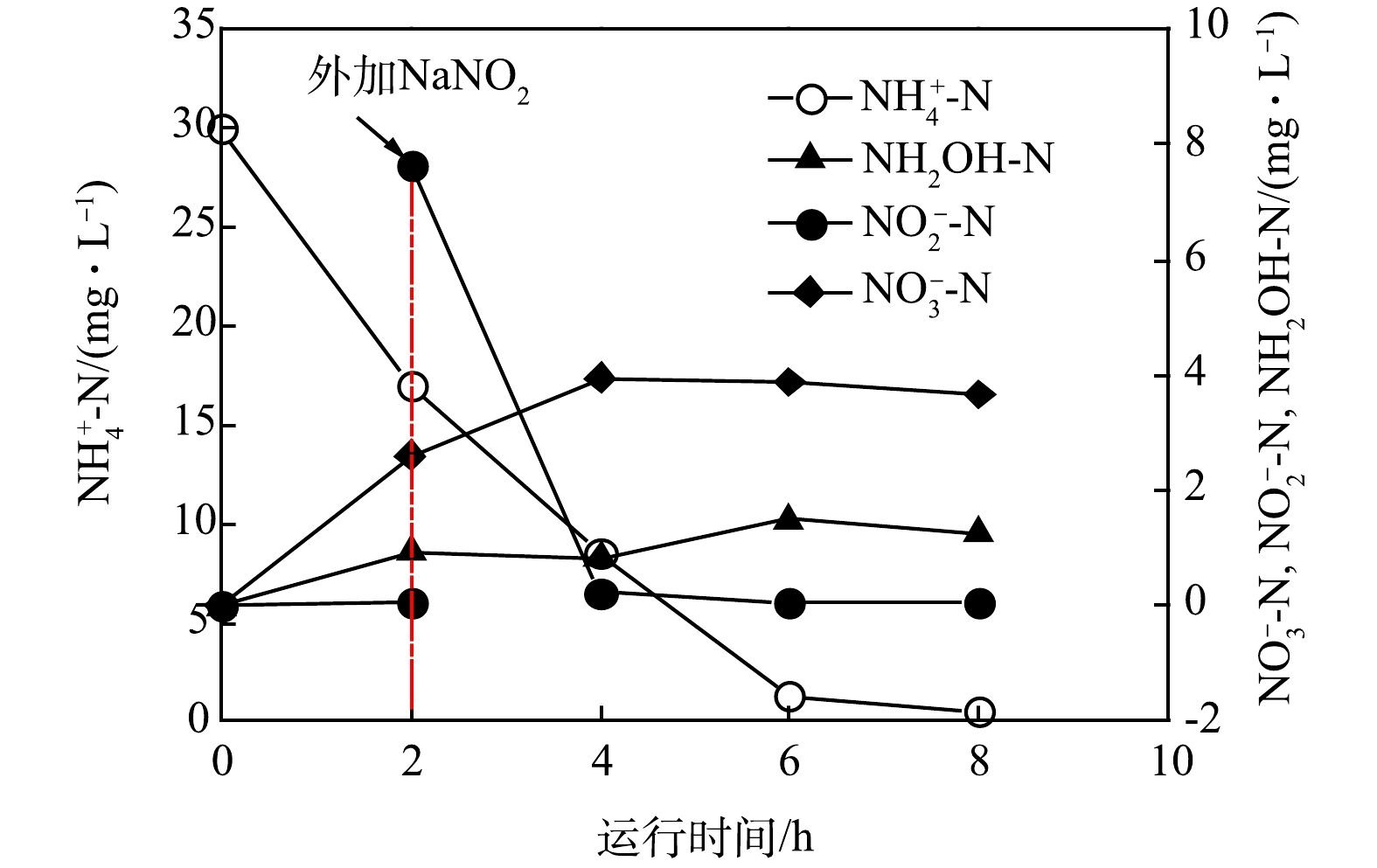
-N addition on nitrogen removal of HNBAF system
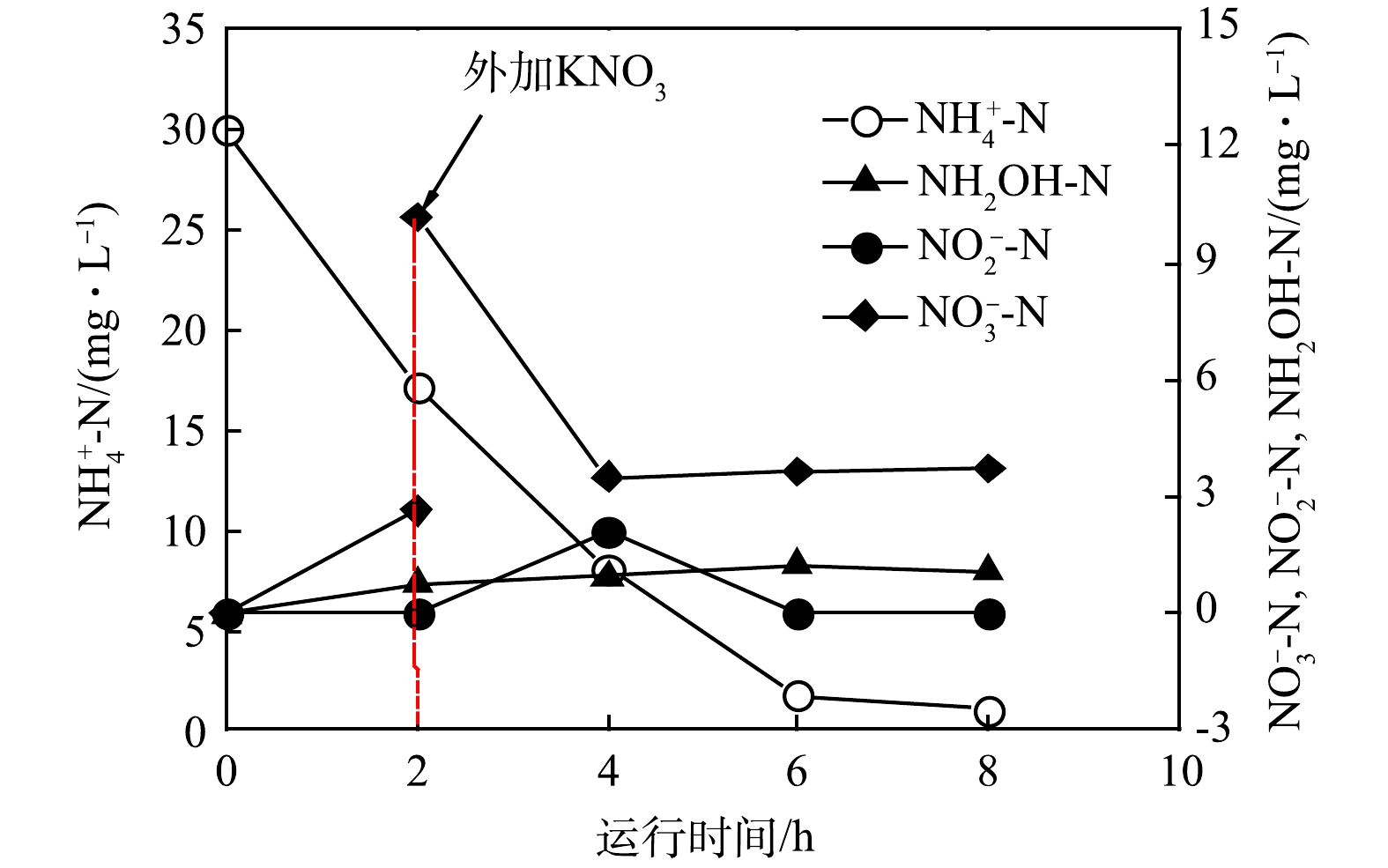
-N addition on nitrogen removal of HNBAF system
-N as the sole N-source
| [1] | 张延青, 徐洋, 高喜燕, 等. 生物滤器处理海水养殖水过程中亚氮积累与影响因素[J]. 中国环境科学, 2010, 30(10): 1323-1332. |
| [2] | SUDARNO U, WINTER J, GALLERT C, et al. Effect of varying salinity, temperature, ammonia and nitrous acid concentrations on nitrification of saline wastewater in fixed-bed reactors[J]. Bioresource Technology, 2011, 102: 5665-5673. doi: 10.1016/j.biortech.2011.02.078 |
| [3] | 罗国芝, 陈家捷, 于文杰, 等. 一株新型异养硝化细菌处理养殖水的效果[J]. 环境工程学报, 2016, 10(8): 4206-4212. doi: 10.12030/j.cjee.201503070 |
| [4] | MARIA J, PAULA M M, ALEJANDRO G M, et al. Performance and bacterial community structure in three autotrophic submerged biofilters operated under different conditions[J]. Journal of Chemical Technology and Biotechnology, 2018, 93: 2429-2439. doi: 10.1002/jctb.5598 |
| [5] | KHARDENAVIS A A, KAPLEY A, PUROHIT H J. Simultaneous nitrification and denitrification by diverse Diaphorobacter sp[J]. Applied Microbiology and Biotechnology, 2007, 77: 403-409. doi: 10.1007/s00253-007-1176-5 |
| [6] | SARIOGLU O F, SULUYAYLA R, TEKINAY T. Heterotrophic ammonium removal by a novel hatchery isolate Acinetobacter calcoaceticus STB1[J]. International Biodeterioration & Biodegradation, 2012, 71: 67-71. |
| [7] | PADHI S K, TRIPATHY S, SEN R, et al. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater[J]. International Biodeterioration & Biodegradation, 2013, 78: 67-73. |
| [8] | HUANG F, PAN L Q, LV N, et al. Characterization of novel Bacillus strain N31 from mariculture water capable of halophilic heterotrophic nitrification-aerobic denitrification[J]. Journal of Bioscience and Bioengineering, 2017, 124: 564-571. doi: 10.1016/j.jbiosc.2017.06.008 |
| [9] | 汪旭晖, 杨垒, 任勇翔, 等. 异养硝化细菌Pseudomonas putida YH 的脱氮特性及降解动力学[J]. 环境科学, 2019, 40(4): 1892-1899. |
| [10] | ZHAO B, He Y L, HUANG J, et al. Heterotrophic nitrogen removal by Providencia rettgeri strain YL[J]. Journal of Industrial Microbiology and Biotechology, 2010, 37: 609-616. doi: 10.1007/s10295-010-0708-7 |
| [11] | SHODA M, ISHIKAWA Y. Heterotrophic nitrification and aerobic denitrification of high-strength ammonium in anaerobically digested sludge by Alcaligenes faecalis strain No. 4[J]. Journal of Bioscience and Bioengineering, 2014, 117: 737-741. doi: 10.1016/j.jbiosc.2013.11.018 |
| [12] | QIAO Z X, SUN P, WU Y G, et al. Characteristics and metabolic pathway of the bacteria for heterotrophic nitrification and aerobic denitrification in aquatic ecosystems[J]. Environmental Research, 2020, 191: 110069. doi: 10.1016/j.envres.2020.110069 |
| [13] | XIA L, LI X M, FAN W H, et al. Heterotrophic nitrification and aerobic denitrification by a novel Acinetobacter sp. ND7 isolated from municipal activated sludge[J]. Bioresource Technology, 2020, 301: 122749. doi: 10.1016/j.biortech.2020.122749 |
| [14] | XIE F X, THIRI M, WANG H. Simultaneous heterotrophic nitrification and aerobic denitrification by a novel isolated Pseudomonas mendocina X49[J]. Bioresource Technology, 2021, 319: 124198. doi: 10.1016/j.biortech.2020.124198 |
| [15] | PENG Y Z, ZHU G B. Biological nitrogen removal with nitrificationand denitrification via nitrite pathway[J]. Applied Microbiology and Biotechnology, 2006, 73: 15-26. doi: 10.1007/s00253-006-0534-z |
| [16] | ROUT P R, BHUNIA P, DASH R R. Simultaneous removal of nitrogen and phosphorous from domestic wastewater using Bacillus cereus GS-5 strain exhibiting heterotrophic nitrification, aerobic denitrification and denitrifying phosphorous removal[J]. Bioresource Technology, 2017, 244: 484-495. doi: 10.1016/j.biortech.2017.07.186 |
| [17] | JOO H S, HIRAI M, SHODA M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis no. 4[J]. Journal of Bioscience and Bioengineering, 2005, 10: 184-191. |
| [18] | 张培玉, 曲洋, 于德爽, 等. 菌株qy37的异养硝化/好氧反硝化机制比较及氨氮加速降解特性研究[J]. 环境科学, 2010, 31(8): 1819-1825. |
| [19] | QIAN C, NI J. Heterotrophic nitrification-aerobic denitrification by novel isolated bacteria[J]. Journal of Industrial Microbiology and Biotechology, 2011, 38: 1305-1310. doi: 10.1007/s10295-010-0911-6 |
| [20] | PADHI S K, TRIPATHY S, MOHANTY S, et al. Aerobic and heterotrophic nitrogen removal by Enterobacter cloacae CF-S27 with efficient utilization of hydroxylamine[J]. Bioresource Technology, 2017, 232: 285-296. doi: 10.1016/j.biortech.2017.02.049 |
| [21] | WANG Q K, HE J Z. Complete nitrogen removal via simultaneous nitrification and denitrification by a novel phosphate accumulating Thauera sp. strain SND5[J]. Water Research, 2020, 185: 116300. doi: 10.1016/j.watres.2020.116300 |
| [22] | STEIN L Y, KLOTZ M G. Nitrifying and denitrifying pathways of methanotrophic bacteria[J]. Biochemical Society Transactions, 2011, 39: 1826-1831. doi: 10.1042/BST20110712 |
| [23] | ZHANG Q L, LIU Y, AI G M, et al. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7[J]. Bioresource Technology, 2012, 108: 35-44. doi: 10.1016/j.biortech.2011.12.139 |
| [24] | THWAITES B J, STUETZ R, SHORT M, et al. Analysis of nitrous oxide emissions from aerobic granular sludge treating high saline municipal wastewater[J]. Science of the Total Enivronment, 2021, 756: 143653. doi: 10.1016/j.scitotenv.2020.143653 |
| [25] | DUAN J M, FANG H D, SU B, et al. Characterization of a halophilic heterotrophic nitrification-aerobic denitrification bacterium and its application on treatment of saline wastewater[J]. Bioresource Technology, 2015, 179: 421-428. doi: 10.1016/j.biortech.2014.12.057 |
| [26] | 段金明, 苏兵, 林锦美, 等. 嗜盐好氧反硝化菌SF16的脱氮特性[J]. 环境工程学报, 2016, 10(9): 5275-5280. doi: 10.12030/j.cjee.201504157 |
| [27] | 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. |
| [28] | WEHRFRITZ J M, REILLY A, SPIRO S, et al. Purification of hydroxylamine oxidase from Thiosphaera pantotropha, identification of electron acceptors that couple heterotrophic nitrification to aerobic denitrification[J]. FEBS Letters, 1993, 335: 246-250. |
| [29] | RICHARDSON D J, WEHRFRITZ J M, KEECH A, et al. The diversity of redox proteins involved in bacterial heterotrophic nitrification and aerobic denitrification[J]. Biochemical Society Transactions, 1998, 26: 401-408. doi: 10.1042/bst0260401 |
| [30] | LI J, ZHANG Q, LI X Y, et al. Rapid start-up and stable maintenance of domestic wastewater nitritation through short-term hydroxylamine addition[J]. Bioresource Technology, 2019, 278: 468-472. doi: 10.1016/j.biortech.2019.01.056 |
| [31] | 乔昕, 王博, 郭媛媛, 等. 羟胺对氨氧化菌和亚硝酸盐氧化菌的竞争性选择[J]. 环境科学, 2020, 41(8): 3765-3772. |
| [32] | HUANG X F, LI W G, ZHANG D Y, et al. Ammonium removal by a novel oligotrophic Acinetobacter sp. Y16 capable of heterotrophic nitrification-aerobic denitrification at low temperature[J]. Bioresource Technology, 2013, 146: 44-50. doi: 10.1016/j.biortech.2013.07.046 |
| [33] | KRAFT B, STROUS M, TEGETMEVER H E. Microbial nitrate respiration-genes, enzymes and environmental distribution[J]. Journal of Biotechnology, 2011, 155: 104-117. doi: 10.1016/j.jbiotec.2010.12.025 |
| [34] | JI B, YANG K, ZHU L, et al. Aerobic denitrification: A review of important advances of the last 30 years[J]. Biotechnology and Bioprocess Engineering, 2015, 20: 643-651. doi: 10.1007/s12257-015-0009-0 |






































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































 下载:
下载: 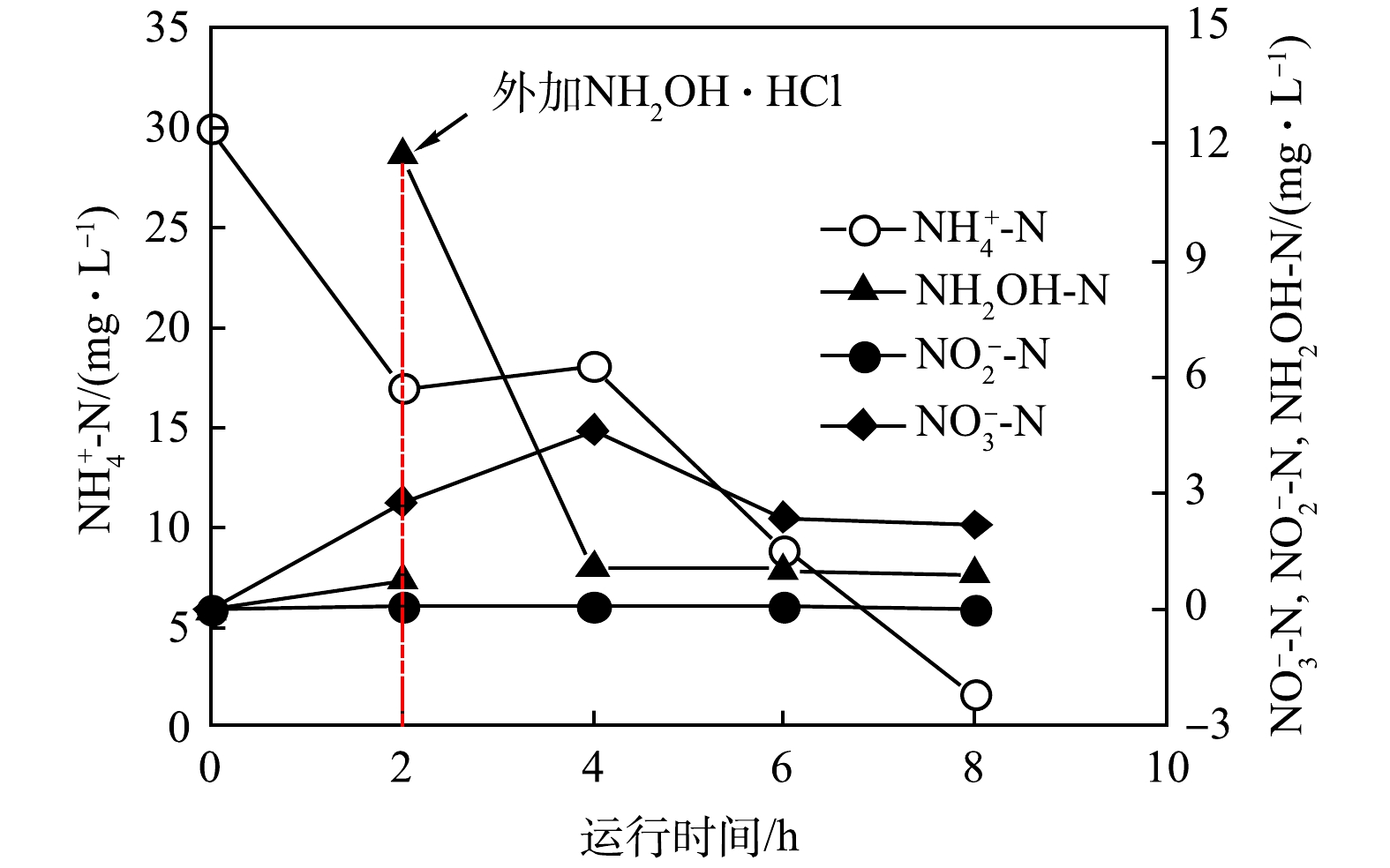






 点击查看大图
点击查看大图