2.西南石油大学工业危废处置与资源化利用研究院,成都 610500
1.College of Chemistry and Chemical Engineering, Southwest Petroleum University, Chengdu 610500, China
2.Institute of Industrial Hazardous Waste Disposal and Utilization, Southwest Petroleum University, Chengdu 610500, China
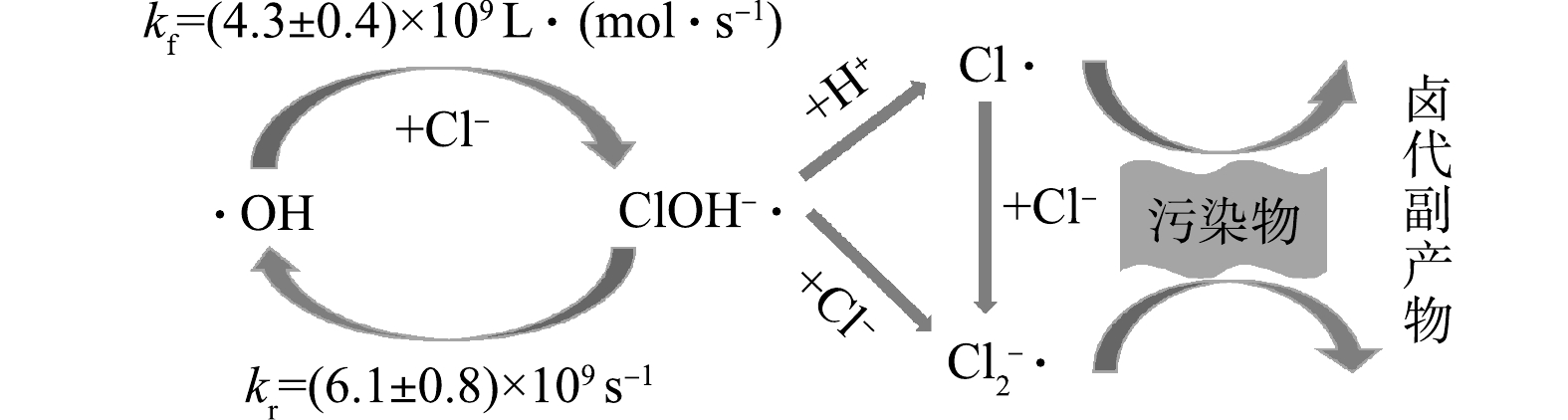
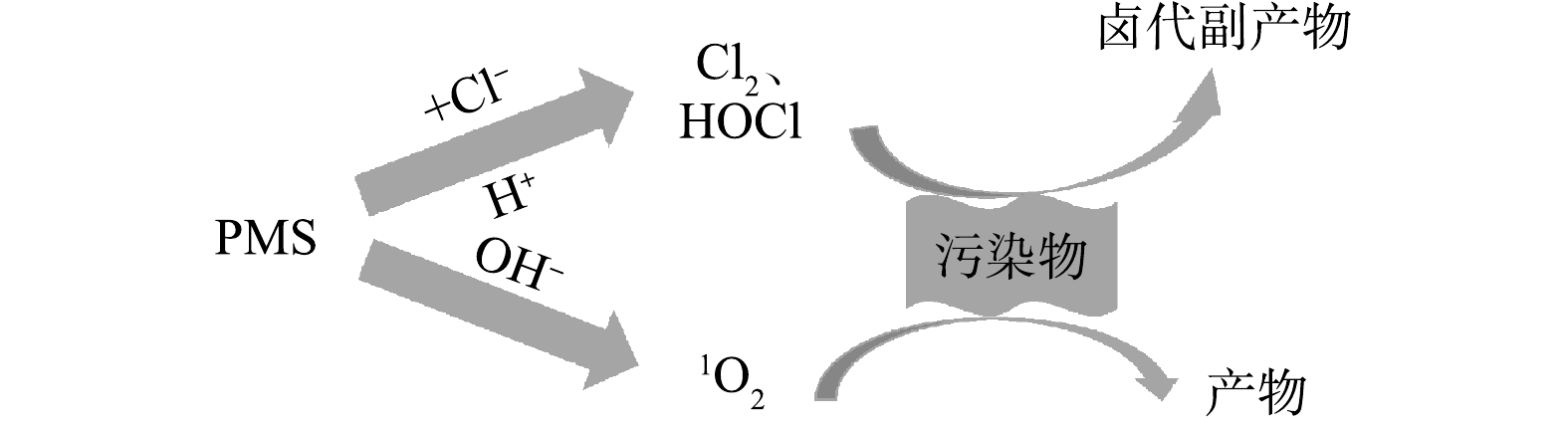
对有机物去除效率的抑制、减少卤代有机副产物的生成,以期为AOPs工艺处理含盐废水的应用和相关研究提供参考。
Advanced oxidation processes (AOPs) have been widely applied in industrial wastewater treatment for organic compounds removal. Chloride ion (Cl
) is the main anion in most salt-containing industrial wastewater. Studies have shown that Cl
has a significant impact on the removal efficiency and the formation of halogenated organic by-products in the treatment of organic pollutants by AOPs, yet it is often overlooked in practice. This review focuses on three different types of AOPs based on hydroxyl radicals (·OH), sulfate radicals (
), and non-radical pathways. The effects and mechanism of Cl
on the removal of organic compounds from wastewater by these three kinds of AOPs were discussed based on a series of reactions and forward/reverse reaction rate constants between Cl
concentration and pH condition. The differences of theoretically appropriate Cl
concentration ranges for AOPs applied to treat saline wastewater were compared. Regulating pH conditions to change the main reactive oxidant species and choosing different oxidation methods are proposed to reduce the inhibition of Cl
on organic compound removal efficiency and decrease the generation of halogenated organic by-products. This review provides theoretical support for the application and related research of AOPs in the treatment of salt containing wastewater.
.
and pH on the non-radical based AOPs with PMS
| [1] | 张统,李志颖,董春宏,等. 我国工业废水处理现状及污染防治对策[J]. 给水排水, 2020, 56(24): 1-3. |
| [2] | JANG D, HWANG Y, SHIN H, et al. Effects of salinity on the characteristics of biomass and membrane fouling in membrane bioreactors[J]. Bioresource Technology, 2013, 141: 50-56. doi: 10.1016/j.biortech.2013.02.062 |
| [3] | LEFEBVRE O, MOLETTA R. Treatment of organic pollution in industrial saline wastewater: A literature review[J]. Water Research, 2006, 40(20): 3671-3682. doi: 10.1016/j.watres.2006.08.027 |
| [4] | PANSWAD T, ANAN C. Impact of high chloride wastewater on an anaerobic/anoxic/aerobic process with and without inoculation of chloride acclimated seeds[J]. Water Research, 1999, 33(5): 1172. |
| [5] | LIN Y, ZHONG L, DOU S, et al. Facile synthesis of electrospun carbon nanofiber/graphene oxide composite aerogels for high efficiency oils absorption[J]. Environment International, 2019, 128: 37-45. doi: 10.1016/j.envint.2019.04.019 |
| [6] | TIAN S, JIANG P, PING N, et al. Enhanced adsorption removal of phosphate from water by mixed lanthanum/aluminum pillared montmorillonite[J]. Chemical Engineering Journal, 2009, 151(1/2/3): 141-148. doi: 10.1016/j.cej.2009.02.006 |
| [7] | 李肖琳, 谢陈鑫, 秦微, 等. 膜分离-光电催化深度处理高盐含聚污水[J]. 环境工程学报, 2016, 10(8): 4141-4146. doi: 10.12030/j.cjee.201503192 |
| [8] | PIERRE B, JEAN-PAUL A. The biological degradation of cellulose[J]. FEMS Microbiology Reviews, 1994(1): 1. |
| [9] | HUANG J, DAI Y, SINGEWALD K, et al. Effects of MnO2 of different structures on activation of peroxymonosulfate for bisphenol A degradation under acidic conditions[J]. Chemical Engineering Journal, 2019, 370: 906-915. doi: 10.1016/j.cej.2019.03.238 |
| [10] | ZHANG H C, LEMLEY A T. Reaction mechanism and kinetic modeling of DEET degradation by flow-through anodic Fenton treatment (FAFT)[J]. Environmental Science & Technology, 2006, 40(14): 4488-4494. |
| [11] | GHAUCH A, TUQAN A M, KIBBI N, et al. Methylene blue discoloration by heated persulfate in aqueous solution[J]. Chemical Engineering Journal, 2012, 213: 259-271. doi: 10.1016/j.cej.2012.09.122 |
| [12] | KABDASLI I, ECER ?, OLMEZ-HANCI T, et al. A comparative study of ·OH and $ {\rm{SO}}_4^{{ \cdot ^ - }} $ based AOPs for the degradation of non-ionic surfactant Brij30[J]. Water Science & Technology, 2015, 72(2): 194-202. based AOPs for the degradation of non-ionic surfactant Brij30[J]. Water Science & Technology, 2015, 72(2): 194-202. |
| [13] | RUBIO-CLEMENTE A, TORRES-PALMA R A, PE UELA G A. Removal of polycyclic aromatic hydrocarbons in aqueous environment by chemical treatments: A review[J]. Science of the Total Environment, 2014, 478: 201-225. doi: 10.1016/j.scitotenv.2013.12.126 |
| [14] | GALBI?KOVá B, BLINOVá L, SOLDáN M. Using of AOP Process for Phenol Removal from Wastewater[[J]. Environmental Engineering, 2013, 864-867: 1690-1693. |
| [15] | GHAUCH A, BAYDOUN H, DERMESROPIAN P. Degradation of aqueous carbamazepine in ultrasonic/Fe0/H2O2 systems[J]. Chemical Engineering Journal, 2011, 172(1): 18-27. doi: 10.1016/j.cej.2011.04.002 |
| [16] | CHAN K H, CHU W. Atrazine removal by catalytic oxidation processes with or without UV irradiation: Part II: An analysis of the reaction mechanisms using LC/ESI-tandem mass spectrometry[J]. Applied Catalysis B: Environmental, 2005, 58(3/4): 157-163. |
| [17] | BABUPONNUSAMI A, MUTHUKUMAR K. Advanced oxidation of phenol: A comparison between Fenton, electro-Fenton, sono-electro-Fenton and photo-electro-Fenton processes[J]. Chemical Engineering Journal, 2012, 183: 1-9. doi: 10.1016/j.cej.2011.12.010 |
| [18] | KARCI A, ARSLAN-ALATON I, OLMEZ-HANCI T, et al. Transformation of 2,4-dichlorophenol by H2O2/UV-C, Fenton and photo-Fenton processes: Oxidation products and toxicity evolution[J]. Journal of Photochemistry & Photobiology A: Chemistry, 2012, 230(1): 65-73. |
| [19] | MéNDEZ-DíAZ J, SáNCHEZ-POLO M, RIVERA-UTRILLA J, et al. Advanced oxidation of the surfactant SDBS by means of hydroxyl and sulphate radicals[J]. Chemical Engineering Journal, 2010, 163(3): 300-306. doi: 10.1016/j.cej.2010.08.002 |
| [20] | 杨伟, 袁珊珊, 宋震宇, 等. Fenton氧化与活性炭吸附深度处理高含盐难降解海上采油废水的研究[J]. 应用化工, 2014, 43(11): 2060-2064. |
| [21] | 时钰, 杨晓芳, 杨招艺, 等. 可用于去除高盐废水中有机污染物的混凝-Fenton氧化联合工艺[J]. 环境工程学报, 2017, 11(9): 4958-4964. doi: 10.12030/j.cjee.201701090 |
| [22] | 李根. 催化臭氧氧化技术在煤化工废水深度处理中的应用研究[D]. 武汉: 武汉科技大学, 2018. |
| [23] | 任明, 孙淑英, 金艳, 等. 催化臭氧氧化法处理煤化工高盐废水[J]. 环境工程, 2018, 36(8): 54-59. |
| [24] | 耿翠玉, 杨映, 乔瑞平, 等. O3/H2O2协同氧化石油化工行业反渗透浓水[J]. 环境污染与防治, 2016, 38(11): 56-59. |
| [25] | 王少雄, 俞彬, 张彦海, 等. 臭氧及双氧水处理高盐有机废水的工程应用[J]. 工业用水与废水, 2018, 49(5): 74-76. doi: 10.3969/j.issn.1009-2455.2018.05.018 |
| [26] | 李春立. 蒸发-过硫酸盐高级氧化法一体化技术处理高盐挥发性有机废水[D]. 新乡: 河南师范大学, 2017. |
| [27] | 陈希, 纪志永, 黄智辉, 等. 电化学协同过硫酸盐氧化法处理含盐有机废水[J]. 化工进展, 2019, 38(12): 5572-5577. |
| [28] | GREENLEE L F, LAWLER D F, FREEMAN B D, et al. Reverse osmosis desalination: Water sources, technology, and today's challenges[J]. Water Research, 2009, 43(9): 2317-2348. doi: 10.1016/j.watres.2009.03.010 |
| [29] | YANG Y, PIGNATELLO J J, MA J, et al. Effect of matrix components on UV/H2O2 and ${\rm{UV}}/{{\rm{S}}_2}{\rm{O}}_8^{2 - } $ advanced oxidation processes for trace organic degradation in reverse osmosis brines from municipal wastewater reuse facilities[J]. Water Research, 2016, 89: 192-200. doi: 10.1016/j.watres.2015.11.049 advanced oxidation processes for trace organic degradation in reverse osmosis brines from municipal wastewater reuse facilities[J]. Water Research, 2016, 89: 192-200. doi: 10.1016/j.watres.2015.11.049 |
| [30] | OH W, DONG Z, LIM T. Generation of sulfate radical through heterogeneous catalysis for organic contaminants removal: Current development, challenges and prospects[J]. Applied Catalysis B: Environmental, 2016, 194: 169-201. doi: 10.1016/j.apcatb.2016.04.003 |
| [31] | PIGNATELLO J J, OLIVEROS E, MACKAY A. Advanced oxidation processes for organic contaminant destruction based on the Fenton reaction and related chemistry[J]. Critical Reviews in Environmental Science & Technology, 2006, 36(1): 1-84. |
| [32] | GREBEI J E, PIGNATELLO J I, MITCH W A. Effect of halide ions and carbonates on organic contaminant degradation by hydroxyl radical-based advanced oxidation processes in saline waters[J]. Environmental Science & Technology, 2010, 44(17): 6822-6828. |
| [33] | YU X, BAO Z, BARKER J R. Free radical reactions involving Cl·, ${\rm{Cl}}_2^{{ \cdot ^ - }}$ , and $ {\rm{SO}}_4^{{ \cdot ^ - }} $ , and $ {\rm{SO}}_4^{{ \cdot ^ - }} $ in the 248 nm photolysis of aqueous solutions containing ${{\rm{S}}_2}{\rm{O}}_8^{2 - }$ in the 248 nm photolysis of aqueous solutions containing ${{\rm{S}}_2}{\rm{O}}_8^{2 - }$ and Cl?[J]. The Journal of Physical Chemistry A, 2004, 108(2): 295-308. doi: 10.1021/jp036211i and Cl?[J]. The Journal of Physical Chemistry A, 2004, 108(2): 295-308. doi: 10.1021/jp036211i |
| [34] | BUXTON G V, BYDDER M, ARTHUR SALMON G. The reactivity of chlorine atoms in aqueous solution Part II. The equilibrium ${\rm{SO}}_4^ - $ +Cl-ClNsbd+ ${\rm{SO}}_4^{2 - }$ +Cl-ClNsbd+ ${\rm{SO}}_4^{2 - }$ [J]. Physical Chemistry Chemical Physics, 1999, 1(2): 269-273. doi: 10.1039/a807808d [J]. Physical Chemistry Chemical Physics, 1999, 1(2): 269-273. doi: 10.1039/a807808d |
| [35] | YU X Y. Critical evaluation of rate constants and equilibrium constants of hydrogen peroxide photolysis in acidic aqueous solutions containing chloride ions[J]. Journal of Physical & Chemical Reference Data, 2004, 33(3): 747-763. |
| [36] | YU X Y, BARKER J R. Hydrogen peroxide photolysis in acidic aqueous solutions containing chloride ions. I. Chemical mechanism[J]. Journal of Physical Chemistry A, 2003, 107(9): 1313-1324. doi: 10.1021/jp0266648 |
| [37] | YANG Y, PIGNATELLO J J, MA J, et al. Comparison of halide impacts on the efficiency of contaminant degradation by sulfate and hydroxyl radical-based advanced oxidation processes (AOPs)[J]. Environmental Science & Technology, 2014, 48(4): 2344-2351. |
| [38] | XIE W, DONG W, KONG D, et al. Formation of halogenated disinfection by-products in cobalt-catalyzed peroxymonosulfate oxidation processes in the presence of halides[J]. Chemosphere, 2016, 154: 613-619. doi: 10.1016/j.chemosphere.2016.04.025 |
| [39] | 袁瑞霞. 基于自由基反应的高盐染料废水降解有机卤代物AOX生成机制研究[D]. 上海: 东华大学, 2012. |
| [40] | TONY M A, ZHAO Y Q, EL-SHERBINY M F. Fenton and Fenton-like AOPs for alum sludge conditioning: Effectiveness comparison with different Fe2+ and Fe3+ salts[J]. Chemical Engineering Communications, 2010, 198(3): 442-452. doi: 10.1080/00986445.2010.520235 |
| [41] | WANG N, ZHENG T, ZHANG G, et al. A review on Fenton-like processes for organic wastewater treatment[J]. Journal of Environmental Chemical Engineering, 2016, 4(1): 762-787. doi: 10.1016/j.jece.2015.12.016 |
| [42] | 魏健, 何锦垚, 宋永会, 等. 臭氧催化氧化-BAF深度处理抗生素废水效能及微生物群落结构分析[J]. 环境科学学报, 2020, 40(6): 2090-2100. |
| [43] | MIKLOS D B, HARTL R, MICHEL P, et al. UV/H2O2 process stability and pilot-scale validation for trace organic chemical removal from wastewater treatment plant effluents[J]. Water Research, 2018, 136: 169-179. doi: 10.1016/j.watres.2018.02.044 |
| [44] | LI Z, LIU F, DING Y, et al. Preparation and properties of Cu-Ni bimetallic oxide catalyst supported on activated carbon for microwave assisted catalytic wet hydrogen peroxide oxidation for biologically pretreated coal chemical industry wastewater treatment[J]. Chemosphere, 2019, 214: 17-24. doi: 10.1016/j.chemosphere.2018.09.098 |
| [45] | RAHDAR S, IGWEGBE C A, GHASEMI M, et al. Degradation of aniline by the combined process of ultrasound and hydrogen peroxide (US/H2O2)[J]. MethodsX, 2019, 6: 492-499. doi: 10.1016/j.mex.2019.02.033 |
| [46] | BUXTON G V, GREENSTOCK C L, HELMAN W P, et al. Critical view of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·H/·OH) in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17(2): 513-886. doi: 10.1063/1.555805 |
| [47] | GOLDSTONE J V, PULLIN M J, BERTILSSON S, et al. Reactions of hydroxyl radical with humic substances: Bleaching, mineralization, and production of bioavailable carbon substrates[J]. Environmental Science & Technology, 2002, 36(3): 364-372. |
| [48] | ISSE A A, LIN C Y, COOTE M L, et al. Estimation of standard reduction potentials of halogen atoms and alkyl halides[J]. The Journal of Physical Chemistry B, 2011, 115(4): 678-684. doi: 10.1021/jp109613t |
| [49] | ERSHOV B G, KELM M, GORDEEV A V, et al. A pulse radiolysis study of the oxidation of Br? by ${\rm{Cl}}_2^{{ \cdot ^ - }}$ in aqueous solution: Formation and properties of ClBr·?[J]. Physical Chemistry Chemical Physics, 2002, 4(10): 1872-1875. doi: 10.1039/b110362h in aqueous solution: Formation and properties of ClBr·?[J]. Physical Chemistry Chemical Physics, 2002, 4(10): 1872-1875. doi: 10.1039/b110362h |
| [50] | ZHANG W B, XIAO X M, AN T C, et al. Kinetics, degradation pathway and reaction mechanism of advanced oxidation of 4-nitrophenol in water by a UV/H2O2 process[J]. Journal of Chemical Technology & Biotechnology, 2003, 78: 788-794. |
| [51] | 王广生, 付冬彬, 刘义青, 等. UV/ ${\rm{NO}}_3^ - $ 光化学降解水中的磺胺甲恶唑[J]. 环境科学学报, 2020, 40(4): 1234-1241. 光化学降解水中的磺胺甲恶唑[J]. 环境科学学报, 2020, 40(4): 1234-1241. |
| [52] | 许入义, 李孟, 唐建伟, 等. 光电催化氧化体系降解苯胺类污染物的同步耦合反应机制研究[J]. 环境科学学报, 2019, 39(8): 2525-2534. |
| [53] | 邬莎娜, 孙贤波, 刘勇弟, 等. Fenton法处理DMF废水及无机阴离子对反应的影响[J]. 华东理工大学学报(自然科学版), 2017, 43(1): 70-75. |
| [54] | 吴广宇, 袁向娟, 徐海明, 等. UV/Fenton-Fe0降解水中阿特拉津动力学及影响因素[J]. 水处理技术, 2017, 43(7): 32-38. |
| [55] | BOUTITI A, ZOUAGHI R, BENDJABEUR S E, et al. Photodegradation of 1-hexyl-3-methylimidazolium by UV/H2O2 and UV/TiO2: Influence of pH and chloride[J]. Journal of Photochemistry & Photobiology A: Chemistry, 2016, 336: 164-169. |
| [56] | PIGNATELLO J J. Dark and photoassisted Fe3+-catalyzed degradation of chlorophenoxy herbicides by hydrogen peroxide[J]. Environmental Science & Technology, 1992, 26(5): 944-951. |
| [57] | KIWI J, LOPEZ A, NADTOCHENKO V. Mechanism and kinetics of the OH-radical intervention during Fenton oxidation in the presence of a significant amount of radical scavenger (Cl?)[J]. Environmental Science & Technology, 2000, 34(11): 2162-2168. |
| [58] | HU P, LONG M. Cobalt-catalyzed sulfate radical-based advanced oxidation: A review on heterogeneous catalysts and applications[J]. Applied catalysis B: Environmental, 2016, 181: 103-117. doi: 10.1016/j.apcatb.2015.07.024 |
| [59] | WANG J, WANG S. Activation of persulfate (PS) and peroxymonosulfate (PMS) and application for the degradation of emerging contaminants[J]. Chemical Engineering Journal, 2018, 334: 1502-1517. doi: 10.1016/j.cej.2017.11.059 |
| [60] | CHEN L, HU X, CAI T, et al. Degradation of Triclosan in soils by thermally activated persulfate under conditions representative of in situ chemical oxidation (ISCO)[J]. Chemical Engineering Journal, 2019, 369: 344-352. doi: 10.1016/j.cej.2019.03.084 |
| [61] | ZHANG R C, SUN P Z, BOYER T H, et al. Degradation of pharmaceuticals and metabolite in synthetic human urine by UV, UV/H2O2, and UV/PDS[J]. Environmental Science & Technology, 2015, 49(5): 3056-3066. |
| [62] | 杨晴, 孙昕, 李鹏飞, 等. 超声活化过硫酸盐降解甲基橙的影响因素研究[J]. 环境科学学报, 2020, 40(8): 2715-2721. |
| [63] | DING Y, ZHU L, WANG N, et al. Sulfate radicals induced degradation of tetrabromobisphenol A with nanoscaled magnetic CuFe2O4 as a heterogeneous catalyst of peroxymonosulfate[J]. Applied Catalysis B: Environmental, 2013, 129: 153-162. doi: 10.1016/j.apcatb.2012.09.015 |
| [64] | HUIE R E, CLIFTON C L. Temperature dependence of the rate constants for reactions of the sulfate radical, $ {\rm{SO}}_4^{{ ^ - }} \cdot$ with anions[J]. Journal of Physical Chemistry, 1990, 94(23): 8561-8567. doi: 10.1021/j100386a015 with anions[J]. Journal of Physical Chemistry, 1990, 94(23): 8561-8567. doi: 10.1021/j100386a015 |
| [65] | FENG Y, SONG Q, LV W, et al. Degradation of ketoprofen by sulfate radical-based advanced oxidation processes: Kinetics, mechanisms, and effects of natural water matrices[J]. Chemosphere, 2017, 189: 643-651. doi: 10.1016/j.chemosphere.2017.09.109 |
| [66] | JI Y, DONG C, KONG D, et al. Heat-activated persulfate oxidation of atrazine: Implications for remediation of groundwater contaminated by herbicides[J]. Chemical Engineering Journal, 2015, 263: 45-54. doi: 10.1016/j.cej.2014.10.097 |
| [67] | LIU L, LIN S, ZHANG W, et al. Kinetic and mechanistic investigations of the degradation of sulfachloropyridazine in heat-activated persulfate oxidation process[J]. Chemical Engineering Journal, 2018, 346: 515-524. doi: 10.1016/j.cej.2018.04.068 |
| [68] | XU M, DU H, GU X, et al. Generation and intensity of active oxygen species in thermally activated persulfate systems for the degradation of trichloroethylene[J]. RSC Advances, 2014, 76(4): 40511-40517. doi: 10.1039/C4RA04942J |
| [69] | XU M, GU X, LU S, et al. Degradation of carbon tetrachloride in thermally activated persulfate system in the presence of formic acid[J]. Frontiers of Environmental Science & Engineering, 2016, 10(3): 438-446. |
| [70] | CHAN K H, CHU W. Degradation of atrazine by cobalt-mediated activation of peroxymonosulfate: Different cobalt counteranions in homogenous process and cobalt oxide catalysts in photolytic heterogeneous process[J]. Water Research, 2009, 43(9): 2513-2521. doi: 10.1016/j.watres.2009.02.029 |
| [71] | WANG Z, YUAN R, GUO Y, et al. Effects of chloride ions on bleaching of azo dyes by Co2+/oxone reagent: Kinetic analysis[J]. Journal of Hazardous Materials, 2011, 190(1/2/3): 1083-1087. |
| [72] | 周骏, 肖九花, 方长玲, 等. UV/PMS体系硝基氯酚降解动力学及机理研究[J]. 中国环境科学, 2016, 36(1): 66-73. doi: 10.3969/j.issn.1000-6923.2016.01.011 |
| [73] | GAO H, CHEN J, ZHANG Y, et al. Sulfate radicals induced degradation of Triclosan in thermally activated persulfate system[J]. Chemical Engineering Journal, 2016, 306: 522-530. doi: 10.1016/j.cej.2016.07.080 |
| [74] | QIAN Y, XUE G, CHEN J, et al. Oxidation of cefalexin by thermally activated persulfate: Kinetics, products, and antibacterial activity change[J]. Journal of Hazardous Materials, 2018, 354: 153-160. doi: 10.1016/j.jhazmat.2018.05.004 |
| [75] | LIANG C, WANG Z S, BRUELL C J. Influence of pH on persulfate oxidation of TCE at ambient temperatures[J]. Chemosphere, 2007, 66(1): 106-113. doi: 10.1016/j.chemosphere.2006.05.026 |
| [76] | LIANG C, WANG Z, MOHANTY N. Influences of carbonate and chloride ions on persulfate oxidation of trichloroethylene at 20 ℃[J]. Science of the Total Environment, 2006, 370(2/3): 271-277. |
| [77] | PEYTON G R. The free-radical chemistry of persulfate-based total organic carbon analyzers[J]. Marine Chemistry, 1993, 41(1/2/3): 91-103. |
| [78] | BUXTON G V, BARLOW S, MCGOWAN S, et al. The reaction of the ${\rm{SO}}_3^ - $ radical with FeⅡ in acidic aqueous solution: A pulse radiolysis study[J]. Physical Chemistry Chemical Physics, 1999, 1(13): 3111-3115. doi: 10.1039/a901735f radical with FeⅡ in acidic aqueous solution: A pulse radiolysis study[J]. Physical Chemistry Chemical Physics, 1999, 1(13): 3111-3115. doi: 10.1039/a901735f |
| [79] | HUANG K C, ZHAO Z, HOAG G E, et al. Degradation of volatile organic compounds with thermally activated persulfate oxidation[J]. Chemosphere, 2005, 61(4): 551-560. doi: 10.1016/j.chemosphere.2005.02.032 |
| [80] | FANG G, DIONYSIOU D D, WANG Y, et al. Sulfate radical-based degradation of polychlorinated biphenyls: Effects of chloride ion and reaction kinetics[J]. Journal of Hazardous Materials, 2012, 227-228: 394-401. doi: 10.1016/j.jhazmat.2012.05.074 |
| [81] | WU Y, YANG Y, LIU Y, et al. Modelling study on the effects of chloride on the degradation of bezafibrate and carbamazepine in sulfate radical-based advanced oxidation processes: Conversion of reactive radicals[J]. Chemical Engineering Journal, 2019, 358: 1332-1341. doi: 10.1016/j.cej.2018.10.125 |
| [82] | YUAN R, WANG Z, HU Y, et al. Probing the radical chemistry in UV/persulfate-based saline wastewater treatment: Kinetics modeling and byproducts identification[J]. Chemosphere, 2014, 109: 106-112. doi: 10.1016/j.chemosphere.2014.03.007 |
| [83] | GU X, LU S, QIU Z, et al. Photodegradation performance of 1, 1, 1-trichloroethane in aqueous solution: In the presence and absence of persulfate[J]. Chemical Engineering Journal, 2013, 215-216: 29-35. doi: 10.1016/j.cej.2012.09.132 |
| [84] | MCKENNA J H, DOERING P H. Measurement of dissolved organic carbon by wet chemical oxidation with persulfate: Influence of chloride concentration and reagent volume[J]. Marine Chemistry, 1995, 42(2): 109-114. |
| [85] | WACLAWEK S, LUTZE H V, GRUBEL K, et al. Chemistry of persulfates in water and wastewater treatment: A review[J]. Chemical Engineering Journal, 2017, 330: 44-62. |
| [86] | FANG C, LOU X, HUANG Y, et al. Monochlorophenols degradation by UV/persulfate is immune to the presence of chloride: Illusion or reality?[J]. Chemical Engineering Journal, 2017, 323: 124-133. doi: 10.1016/j.cej.2017.04.094 |
| [87] | 银仁莉. 过硫酸盐的非自由基氧化降解磺胺抗生素的效能及机制[D]. 哈尔滨: 哈尔滨工业大学, 2019. |
| [88] | SONG H, YAN L, WANG Y, et al. Electrochemically activated PMS and PDS: Radical oxidation versus nonradical oxidation[J]. Chemical Engineering Journal, 2020, 391: 123560. doi: 10.1016/j.cej.2019.123560 |
| [89] | ZHOU Y, JIANG J, GAO Y, et al. Activation of peroxymonosulfate by benzoquinone: A novel nonradical oxidation process[J]. Environmental Science & Technology, 2015, 49(21): 12941-12950. |
| [90] | MA W, WANG N, FAN Y, et al. Non-radical-dominated catalytic degradation of bisphenol A by ZIF-67 derived nitrogen-doped carbon nanotubes frameworks in the presence of peroxymonosulfate[J]. Chemical Engineering Journal, 2017, 336: 721-731. |
| [91] | CHEN J B, FANG C, XIA W J, et al. Selective transformation of β-Lactam antibiotics by peroxymonosulfate: Reaction kinetics and nonradical mechanism[J]. Environmental Science & Technology, 2018, 52(3): 1461-1470. |
| [92] | YANG Y, BANERJEE G, BRUDVIG GARY W, et al. Oxidation of organic compounds in water by unactivated peroxymonosulfate[J]. Environmental Science & Technology, 2018, 52(10): 5911-5919. |
| [93] | LEI Y, CHEN C S, AI J, et al. Selective decolorization of cationic dyes by peroxymonosulfate: non-radical mechanism and effect of chloride[J]. RSC Advances, 2015, 6(2): 866-871. |
| [94] | LOU X Y, GUO Y G, XIAO D X, et al. Rapid dye degradation with reactive oxidants generated by chloride-induced peroxymonosulfate activation[J]. Environmental Science & Pollution Research, 2013, 20(9): 6317-6323. |
| [95] | 王海军. 氯水的漂白作用原理探究[J]. 化学教育(中英文), 2018, 39(19): 66-69. |
| [96] | 丁曦, 张学维, 周润生, 等. 非活化单过硫酸盐降解柳氮磺胺吡啶: 动力学及机制[J]. 环境科学, 2020, 41(5): 2310-2319. |
| [97] | 古振川, 高乃云, 安娜, 等. Cl?/PMS体系降解甲氧苄啶的效能与机理[J]. 中国环境科学, 2018, 38(3): 977-984. doi: 10.3969/j.issn.1000-6923.2018.03.022 |
| [98] | ZENG H, ZHAO X, ZHAO F, et al. Oxidation of 2,4-dichlorophenol in saline water by unactivated peroxymonosulfate: Mechanism, kinetics and implication for in situ chemical oxidation[J]. Science of the Total Environment, 2020, 728: 138826. doi: 10.1016/j.scitotenv.2020.138826 |
| [99] | FANG C, LOU X, TANG Y, et al. Dual character of peroxymonosulfate oxidation process to treat salty wastewater containing 2,4, 6-tribromophenol[J]. Journal of Environmental Chemical Engineering, 2020, 8(4): 103998. doi: 10.1016/j.jece.2020.103998 |
| [100] | LI C, CHEN C, WANG Y, et al. Insights on the pH-dependent roles of peroxymonosulfate and chlorine ions in phenol oxidative transformation[J]. Chemical Engineering Journal, 2019, 362: 570-575. doi: 10.1016/j.cej.2019.01.057 |
















































































































































































 下载:
下载: 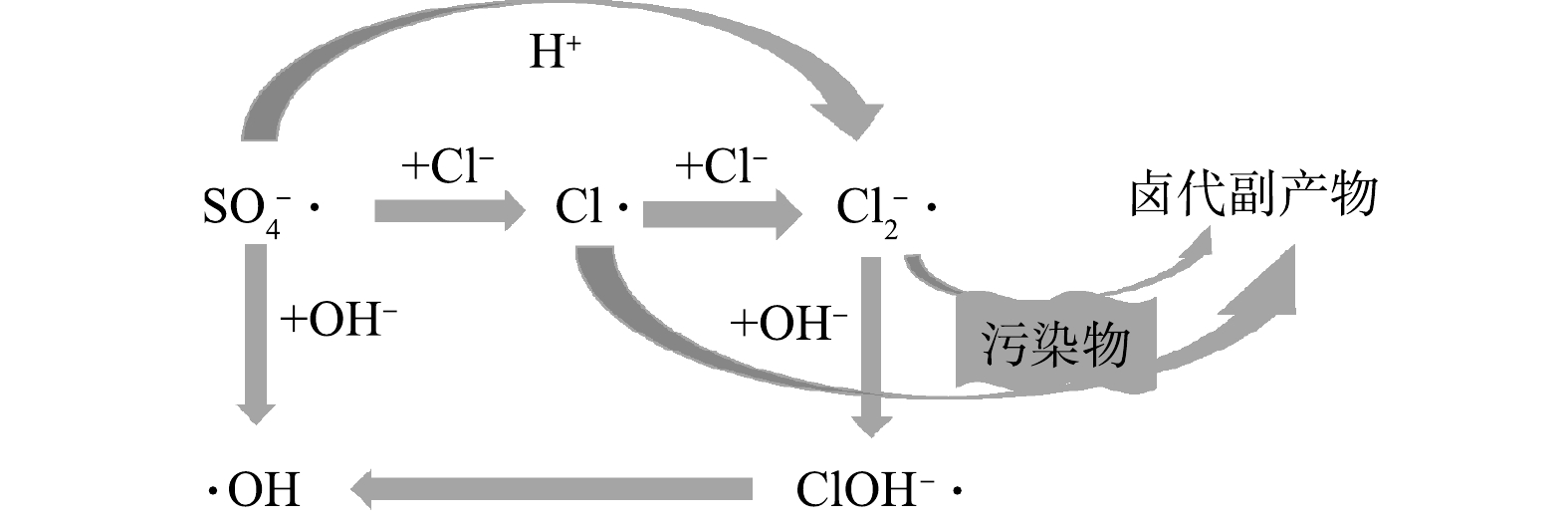











 点击查看大图
点击查看大图