 , 吴晓明1, 蔡东平2, 朱良元3, 闫琼1, 韩文1
, 吴晓明1, 蔡东平2, 朱良元3, 闫琼1, 韩文1 1. 苏州高新区人民医院, 江苏 苏州 215129;
2. 苏州高新区狮山街道社区卫生服务中心, 江苏 苏州 215129;
3. 苏州高新区横塘人民医院, 江苏 苏州 215129
2020-12-15 收稿, 2021-05-12 录用
*通讯作者: 宋晶
摘要: 本研究探讨颈动脉超声筛查脑卒中高危人群颈动脉易损斑块与尿微量白蛋白/肌酐(ACR)、尿微量白蛋白(ALBU)的相关性。选取307例脑卒中高危患者,根据颈动脉超声检查将其分为:无颈动脉斑块组112例、颈动脉稳定斑块组45例和颈动脉易损斑块组150例。研究发现,各组年龄≥60岁占比、有脑卒中家族史占比以及颈动脉内中膜厚度(IMT)、ACR、ALBU水平对比存在明显差异(P < 0.05);脑卒中高危人群IMT与ACR、ALBU呈正相关(P < 0.05);年龄、脑卒中家族史、IMT、ACR、ALBU均为脑卒中高危人群颈动脉斑块发生的影响因素(P < 0.05);IMT、ACR、ALBU联合在颈动脉斑块诊断、易损斑块鉴别诊断方面均具有较高效能。这些结果可以证实,脑卒中高危人群IMT与ACR、ALBU呈正相关,早期联合IMT、ACR、ALBU检查,可辅助临床诊断颈动脉斑块、鉴别诊断易损斑块。
关键词: 脑卒中颈动脉超声易损斑块尿微量白蛋白/肌酐尿微量白蛋白危险因素
Study on the Correlation between Carotid Artery Vulnerable Plaque and ACR and ALBU in High-Risk Population of Stroke Based on Carotid Ultrasound Screening
ZHANG Xiaoyan1, SONG Jing1
 , WU Xiaoming1, CAI Dongping2, ZHU Liangyuan3, YAN Qiong1, HAN Wen1
, WU Xiaoming1, CAI Dongping2, ZHU Liangyuan3, YAN Qiong1, HAN Wen1 1. The People's Hospital of Suzhou New District, Suzhou 215129, Jiangsu, P. R. China;
2. The Healthcare Center for Shishan Street Community of Suzhou New District, Suzhou 215129, Jiangsu, P. R. China;
3. Hengtang People's Hospital of Suzhou New District, Suzhou 215129, Jiangsu, P. R. China
*Corresponding author: SONG Jing
Abstract: The purpose of this study was to explore the correlation between carotid artery ultrasound screening of carotid artery vulnerable plaque and urinary microalbumin/creatinine (ACR) and urinary microalbumin (ALBU) in people at high risk of stroke. According to the carotid ultrasound examination, 307 selected patients with high risk of stroke were divided into: 112 cases without carotid plaque, 45 cases with stable carotid plaque and 150 cases with carotid artery vulnerable plaque. The study found that there were significant differences in the proportions of age ≥ 60 years old, the proportion of family history of stroke, and the comparison of carotid artery intima-media thickness (IMT), ACR, and ALBU levels (P < 0.05). IMT and ACR and ALBU are positively 544 correlated (P < 0.05). Age, family history of stroke, IMT, ACR, and ALBU are all influencing factors of carotid plaque in people at high risk of stroke (P < 0.05). IMT, ACR, and ALBU are combined in the diagnosis of carotid plaque and the differential diagnosis of vulnerable plaque have high efficiency. These results can confirm that IMT is positively correlated with ACR and ALBU in high-risk populations of stroke. Early combined IMT, ACR, and ALBU examination can assist clinical diagnosis of carotid plaque and differential diagnosis of vulnerable plaque.
Key words: strokecarotid ultrasoundvulnerable plaqueACRurine microalbuminrisk factors
脑卒中为临床常见脑血管疾病,具有发病率高、死亡率高和致残率高的特点,资料显示,脑卒中是中国成年人残疾的首要原因[1]。缺血性脑卒中是最常见的脑卒中类型,占全部脑卒中的60%~80%[2]。研究证实,颈内动脉和椎动脉闭塞/狭窄是引起缺血性脑卒中的重要因素,而颈动脉不稳定粥样硬化斑块是引起缺血性脑血管事件的潜在危险因素[3]。颈动脉粥样硬化斑块可以反映全身动脉粥样硬化的程度,因此,积极评估颈动脉斑块情况对预测缺血性脑卒中的发生具有重要意义[4, 5]。近年来,尿微量白蛋白/肌酐(albumin and urinary creatinine ratio,ACR)在反映高血压、脑卒中等血管损伤方面的作用越来越受临床重视,可作为评估早期脑血管损伤的指标[6]。此外,尿微量白蛋白(urine microalbumin,ALBU)被证实可作为血管内皮功能失调以及早期动脉粥样硬化的标志,其水平变化与脑卒中的发病有关[7, 8]。因此,本研究尝试探究基于颈动脉超声筛查脑卒中高危人群颈动脉易损斑块与ACR、ALBU的相关性。
1 资料与方法1.1 一般资料本研究选取2019年1月至2020年1月苏州高新区人民医院心脑血管精细化筛查中307例脑卒中高危患者作为研究对象。其中,男191例、女116例;年龄46~79岁,平均(64.85±7.03)岁。根据颈动脉超声检查分组,无颈动脉斑块组112例,颈动脉稳定斑块组45例与颈动脉易损斑块组150例。
纳入标准:根据中国缺血性脑卒中风险评估量表、体格检查以及实验室检查评估,明确为脑卒中高危患者[9, 10];无认知功能障碍,能够正常沟通交流;自主行为能力良好;能配合完成颈动脉超声检查;患者和家属知晓本研究,已签署同意书。
排除标准:恶性肿瘤患者;凝血功能障碍或有出血倾向者;心肺肝肾等脏器严重病变者;严重感染性疾病患者;有泌尿系感染或其他部位感染等严重应激情况者;应用肾毒性药物者。
1.3 方法超声检查:入院当天,所有研究对象均采用中国迈瑞医疗公司生产的DC-70、DC-N6、M7以及美国GE公司生产的LOGIQ P5彩色多普勒超声系统进行颈动脉超声检查,探头频率8~10 MHz,检查时患者取仰卧位,扫查双侧颈总动脉、颈内动脉颅外段等,检查是否存在斑块。若存在斑块,则进一步检查斑块大小、斑块表面、内部回声,随后测量颈总动脉分叉处近端内中膜厚度(intima-media thickness,IMT)。参照相关文献,对斑块稳定性进行判定[11],分为稳定斑块和易损斑块。上述检查均由2名具有3年以上超声检查经验的医生共同完成。
实验室指标检测:入院第2天清晨,采集患者空腹静脉血3 mL,采用沈阳万泰医疗设备有限责任公司生产的OTA-400型全自动生化分析仪检测空腹血糖、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平。并采集清洁中段尿10 mL,使用长春迪瑞医疗科技股份有限公司生产的H800型全自动尿液分析仪及配套试剂检测ACR水平,采用德国西门子公司生产的BNⅡ特种蛋白分析仪检测ALBU水平。
1.4 观察指标(1) 3组基线资料、颈动脉IMT、ACR、ALBU。基线资料包括性别、年龄、脑卒中家族史、吸烟、饮酒、糖尿病史、高血压史、体质量指数(body mass index,BMI)、空腹血糖、TG、TC、HDL-C、LDL-C;(2)分析IMT与ACR、ALBU的相关性;(3)分析脑卒中高危患者颈动脉斑块发生的危险因素;(4)评价IMT、ACR、ALBU对斑块以及其性质的诊断价值。
1.5 统计学方法数据处理采用SPSS 22.0软件,计数资料以例数描述,采用χ2检验,计量资料以平均数±标准差(x±s)描述,多组间比较采用单因素方差分析,进一步两两组间比较采用SNK-q检验,两组间比较采用独立样本t检验,相关性分析采用Pearson相关系数模型,通过Logistic进行多因素回归分析,诊断效能分析采用受试者工作特征(receiver operating characteristic,ROC)曲线,均采用双侧检验,检验水准α=0.05。
2 结果2.1 3组基线资料3组年龄、脑卒中家族史相比,差异有统计学意义(P<0.05),见表 1。
表1
| 表 1 3组基线资料对比 |
2.2 3组IMT、ACR、ALBU水平3组IMT、ACR、ALBU水平相比,差异有统计学意义(P<0.05),见表 2。
表2
| 表 2 3组IMT、ACR、ALBU水平对比 |
2.3 IMT与ACR、ALBU相关性以颈动脉易损斑块组为例,脑卒中高危人群IMT与ACR、ALBU间均存在正相关关系(r=0.618、0.668,P<0.05)。见图 1和图 2。
图 1
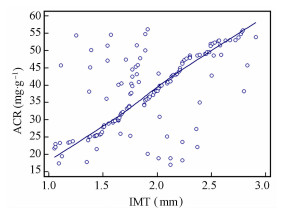 | 图 1 IMT与ACR相关性 |
图 2
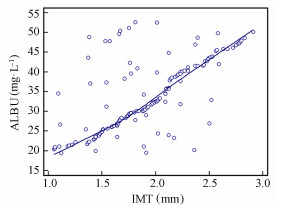 | 图 2 IMT与ALBU相关性 |
2.4 脑卒中高危人群颈动脉斑块发生危险因素分析以脑卒中高危人群颈动脉斑块作为因变量(无颈动脉斑块赋值为0,有颈动脉稳定或易损斑块赋值为1),将表 1和表 2中差异有统计学意义因素作为自变量,纳入Logistic回归分析。结果显示,脑卒中高危患者年龄≥60岁颈动脉斑块发生风险可能是年龄<60岁患者的5.800倍,有脑卒中家族史患者颈动脉斑块发生风险可能是无脑卒中家族史患者的5.598倍,高IMT水平患者颈动脉斑块发生风险可能是低IMT水平患者的6.173倍,高ALBU水平患者颈动脉斑块发生风险可能是低ALBU水平患者的5.829倍,高ACR水平患者颈动脉斑块发生风险可能是低ACR水平患者的6.195倍(P<0.05),具体见表 3。
表3
| 表 3 脑卒中高危人群颈动脉斑块发生危险因素分析 | |||||||||||||||||||||||||||||||||||||||||||||||||
2.5 IMT、ACR、ALBU对颈动脉易损斑块的诊断价值绘制IMT、ACR、ALBU诊断颈动脉斑块、鉴别诊断易损斑块的ROC曲线,显示,各指标联合诊断颈动脉斑块、鉴别诊断易损斑块曲线下面积(AUC)最大,分别为0.880、0.842,最佳敏感度分别为77.44%、76.00%,特异度分别为85.33%、82.22%,见表 4、图 3和图 4。
表4
| 表 4 IMT、ACR、ALBU对颈动脉斑块及斑块性质的诊断价值 |
图 3
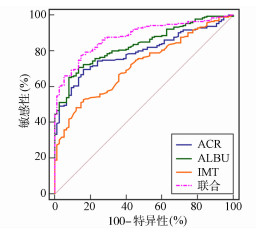 | 图 3 各指标诊断颈动脉斑块的ROC |
图 4
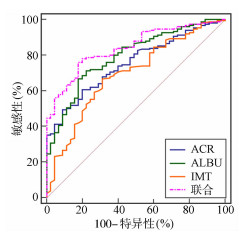 | 图 4 各指标诊断易损斑块的ROC |
3 讨论颈动脉硬化是全身动脉硬化的组成部分,也是脑实质缺血性病变的主要原因之一。目前,临床公认检测颈动脉可作为了解全身动脉硬化的理想、敏感窗口[12, 13]。报道显示,颈动脉狭窄程度超过70%的患者中,脑梗死发病率可高达13%[14]。超声作为筛查和评价颈动脉斑块的首选检查手段,具有无创、操作便捷和可重复性高的特点[15]。因此,本研究采用颈动脉超声对颈动脉斑块发生情况进行评估。
本研究通过对比分析发现,有颈动脉斑块的脑卒中高危患者与无颈动脉斑块的脑卒中高危患者的IMT、ACR、ALBU水平存在明显差异。进一步通过多因素分析发现,随着IMT、ACR、ALBU水平的升高,脑卒中高危患者发生颈动脉斑块的风险越大,故IMT、ACR、ALBU与颈动脉斑块形成密切相关。其中,IMT是反映颈动脉生理结构变化的重要参数,超声测量IMT目前广泛应用于颈动脉粥样硬化的检查,IMT<1.0 mm为正常,在1.0~1.5 mm之间为增厚,>1.5 mm为动脉粥样硬化斑块形成。国内外均有研究[16, 17]证实,随着IMT增大,动脉粥样硬化程度越高,与本研究结果结论相同。白蛋白作为血浆中一种单分子负电荷蛋白质,肾小球基底膜正常情况下仅允许极少量的白蛋白通过,因此,正常人尿液中的白蛋白含量极少,但各种疾病及致病因素如脑卒中,可增加尿液中白蛋白浓度,以致超过肾小球的重吸收能力,导致尿液中白蛋白含量增加,且尿液中白蛋白、肌酐均受个体中相同因素的影响,ACR作为尿液中白蛋白与肌酐含量的比值,可保持相对恒定,目前,临床中多推荐采用ACR评估相关疾病病情[18]。ALBU是反映肾小球损伤及血管内皮功能障碍的一项灵敏指标,常常被视为早期肾脏疾病的标志,近年来,其作为心脑血管疾病独立预测因子已成为临床共识[19]。本研究发现,脑卒中高危人群IMT与ACR、ALBU呈正相关,结合上述结论和分析,推测IMT、ACR、ALBU均可作为评估脑卒中高危患者颈动脉斑块发生风险的敏感性指标。通过ROC分析发现IMT、ACR、ALBU诊断颈动脉斑块的AUC均在0.7以上,具有良好诊断效能,尤其是三项联合诊断的AUC高达0.880,可为临床诊断颈动脉斑块提供重要参考。
已有研究发现,颈动脉斑块的不稳定性是诱发缺血性脑血管疾病的危险因素[20]。本研究颈动脉稳定斑块患者与颈动脉易损斑块患者的IMT、ACR、ALBU水平存在明显差异,提示各指标可能与颈动脉斑块的稳定性有关。通过ROC曲线发现IMT、ACR、ALBU在鉴别诊断易损斑块方面具有一定价值,且各指标联合诊断的AUC为0.842,大于单一诊断,可辅助临床判定颈动脉斑块的稳定性,从而评估脑卒中发生风险。本研究还发现,年龄、脑卒中家族史也是颈动脉斑块发生的影响因素。徐瑞芳等[21]研究发现,脑卒中高危人群颈动脉粥样硬化斑块与年龄有密切关系。张丽等[22]通过对北京市丰台社区脑卒中高危人群开展的一项研究,发现脑卒中家族史可能是影响脑卒中高危人群斑块形成的独立危险因素。上述研究结果表明,对于年龄大于60岁、有脑卒中家族史的脑卒中高危患者,应给予重点关注,加强脑卒中的预防性干预。
综上可知,脑卒中高危人群IMT与ACR、ALBU呈正相关,IMT、ACR、ALBU水平越高,患者发生颈动脉斑块的风险越大,且各指标联合在颈动脉斑块诊断、易损斑块鉴别诊断方面均具有较高诊断效能。本研究不足在于是单中心研究,样本选取范围较狭窄,还需今后通过多中心研究进一步深入探讨。
参考文献
| [1] | 王伊龙, 韩尚容, 曹勇, 等. 中国脑血管病临床管理指南(节选版)——脑血管病高危人群管理[J]. 中国卒中杂志, 2019, 14(7): 700-708. DOI:10.3969/j.issn.1673-5765.2019.07.013 |
| [2] | 朱德生, 管阳太. 急性缺血性脑卒中抗栓治疗策略[J]. 神经病学与神经康复学杂志, 2019, 15(1): 1-8. |
| [3] | Wang L, Wang J, Shen Y, et al. Relationship between internal carotid artery angle and plaque morphology in patients with acute anterior circulation infarction[J]. Chinese Journal of Stroke, 2019, 14(7): 671-676. |
| [4] | Guo L, Cheng L G, He W, et al. X-strain imaging characteristics of carotid atherosclerostic plaques in patients with cerebral infarction[J]. Chinese Journal of Stroke, 2019, 14(1): 38-42. |
| [5] | 许位, 张园园, 高敬华, 等. 急性脑梗死患者血清sdLDL-C与PTX-3水平与颈动脉粥样硬化斑块性质的关系[J]. 中风与神经疾病杂志, 2019, 36(8): 704-707. |
| [6] | Liu R, Zhu H, Yang J H, et al. Can urine albumin/creatinine ratio replace 24 hours urinary albumin[J]. Chinese Journal of Internal Medicine, 2019, 58(5): 377-381. |
| [7] | 陈庆海. 尿微量蛋白检测及临床应用的研究进展[J]. 国外医学. 临床生物化学与检验学分册, 2002, 23(3): 178-180. |
| [8] | 余建华, 焦冬生, 唐永明. 急性缺血性脑卒中患者尿微量白蛋白检测的临床意义[J]. 皖南医学院学报, 2010, 29(6): 441-443. DOI:10.3969/j.issn.1002-0217.2010.06.015 |
| [9] | 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国缺血性脑卒中风险评估量表使用专家共识[J]. 中华神经科杂志, 2016, 49(7): 519-525. DOI:10.3760/cma.j.issn.1006-7876.2016.07.003 |
| [10] | 王新华, 刘恒方. 基于颈动脉超声筛查脑卒中高危人群颈动脉狭窄的危险因素[J]. 中西医结合心脑血管病杂志, 2018, 16(11): 1617-1619. DOI:10.12102/j.issn.1672-1349.2018.11.046 |
| [11] | 戴全, 邱海英, 孙伟薇, 等. 实时三维超声血管斑块定量分析技术检测颈动脉斑块特征的临床价值[J]. 临床超声医学杂志, 2019, 21(8): 589-592. DOI:10.3969/j.issn.1008-6978.2019.08.008 |
| [12] | 肖宇鹏. 彩超检查颈动脉硬化斑块与高血压脑梗死患者的相关性[J]. 糖尿病天地, 2018, 15(12): 143-144. DOI:10.3969/j.issn.1672-7851.2018.12.184 |
| [13] | 韩新生, 张洪阳, 韩苗, 等. 脑梗死患者血清CatS及CysC水平与颈动脉狭窄程度的相关性[J]. 中国临床新医学, 2018, 11(9): 11-14. |
| [14] | Fu H J, Zhao L B, Xue J J, et al. Elevated serum homocys teine (Hcy) levels may contribute to the pathogenesis of cerebral infarction[J]. Journal of Molecular Neuroscience, 2015, 56(3): 553-561. DOI:10.1007/s12031-015-0497-6 |
| [15] | 谭杰. 动脉粥样硬化脑梗死患者颈动脉超声造影参数与神经损害、斑块性质变化的相关性[J]. 海南医学院学报, 2018, 24(19): 1770-1773, 1778. |
| [16] | Parolin M, Dassie F, Martini C, et al. Preclinical markers of atherosclerosis in acromegaly: a systematic review and meta-analysis[J]. Pituitary, 2018, 1(6): 653-662. |
| [17] | 吴立丰, 倪琴, 陈婷, 等. 颈动脉硬化病人颈总动脉硬化度, 颈动脉IMT及其与预后的关系[J]. 中西医结合心脑血管病杂志, 2020, 18(7): 1152-1154. |
| [18] | Chapman D P, Gooding K M, McDonald T J, et al. Stability of urinary albumin and creatinine after 12 months storage at -20 ℃ and -80 ℃[J]. Practical Laboratory Medicine, 2019, 15(1): e00120. |
| [19] | 李肖楠, 孙威, 王越晖. 尿微量白蛋白在心脑血管疾病诊治中的研究进展[J]. 中国实验诊断学, 2019, 23(1): 162-165. DOI:10.3969/j.issn.1007-4287.2019.01.064 |
| [20] | 孙由静, 任俊红. 超声造影对颈动脉粥样硬化斑块稳定性评估的研究进展[J]. 中国心血管杂志, 2018, 23(4): 354-356. DOI:10.3969/j.issn.1007-5410.2018.04.018 |
| [21] | 徐瑞芳, 王森, 叶开友, 等. 脑卒中高危人群颈动脉斑块发病状况及危险因素分析[J]. 健康教育与健康促进, 2019, 14(3): 261-263. |
| [22] | 张丽, 张志辰, 谢淑芸, 等. 北京市丰台社区脑卒中高危人群颈动脉筛查结果分析[J]. 北京中医药, 2016, 35(12): 1121-1124. |
