

同济大学 材料科学与工程学院 高分子系, 上海 201804
2019-06-27 收稿, 2019-05-07 录用
基金项目: 国家自然科学基金面上项目(51873154)资助
*通讯作者: 金明, E-mail: mingjin@tongji.edu.cn
摘要: 本文设计并制备了以香豆素并咔唑为共轭结构的草酸酯类光引发剂(2-OAME和4-OAME),分子中大π-共轭结构的引入实现了分子在LED光域的良好吸收。通过核磁共振谱对目标产物进行了结构验证,通过紫外-可见吸收光谱、荧光光谱和理论计算对分子的光化学及光物理性质进行了表征。研究表明,两个光引发剂在近紫外-可见光范围内均表现出优异的光吸收性质,并且在LED光源激发下具有良好的光引发聚合能力,4-OAME分子较2-OAME在同样的条件下表现出更好的光引发聚合能力,在近紫外-可见LED光聚合领域具有较大的应用潜力。
关键词: 香豆素并咔唑草酸酯光引发剂UV-LED
The Synthesis and Properties of UV-LED Sensitive Coumarin-carbazole-based Oxalate Photoinitiators
ZHOU Ruchun, LIU Yizhuo, CHEN Shixiong, WANG Weijie, CHEN Siqi, JIN Ming


Department of Polymer Materials, School of Materials Science and Engineering, Tongji University, Shanghai 201804, P. R. China
*Corresponding author: JIN Ming, E-mail: mingjin@tongji.edu.cn
Abstract: In this paper, two coumarin-carbazole based oxalate photoinitiators (2-OAME and 4-OAME) were designed and synthesized. By introducing the coumarin into carbazole group, the π-conjugated structure is enlarged, resulting to the good absorption properties in UV-visible light range. The photophysical and photochemical properties were characterized by UV-Vis absorption spectra and FT-RTIR. The two photoinitiators exhibit excellent light absorption properties in the near UV-Vis range and have good photoinitiated polymerization ability under excitation by the LED light source. The 4-OAME molecule exhibited better photoinitiated polymerization ability under the same conditions than 2-OAME. The two photoinitiators have great application potential in the field of near-ultraviolet-visible LED photopolymerization.
Key words: coumarin-carbazoleoxalatephotoinitiatorUV-LED
在全球节能减排大背景的推动下,光固化技术由于具有经济高效、适应性广、节能环保等特点,在胶粘剂、印刷、涂料及生物医用材料等领域得到了前所未有的发展[1]。传统光固化的光源为高压汞灯,存在光谱太宽、能耗较大、寿命短以及臭氧污染等缺点[2],而发光二极管(LED)不仅没有以上缺点,而且成本更低、安全性高,发展前景良好[2-7]。但是,目前市场上的光引发剂大多在300~370nm范围具有较强吸收,在波长超过370nm的范围吸收较差,这限制了UV-LED在光固化体系中的应用[8]。因此,开发一类吸收光谱与UV-LED的发射光谱相匹配的光引发剂,具有非常重要的意义[9]。
目前,提高分子吸收波长的方法主要是在分子内引入助色基团、共轭结构,或是设计具有支化的分子结构[10-13]。香豆素和咔唑都是性能优良的生色团,已被广泛应用于光固化领域[14-19]。其中,香豆素衍生物的吸收波长可红移到近紫外区域甚至可见光区域,已经被作为光敏剂用于光引发剂体系[15],或作为双光子引发剂应用于双光子聚合中[16]。咔唑中良好的刚性共轭平面使其具有较强的分子内电荷转移性能,为其衍生物作为良好的光引发剂提供了有利条件,并且可以通过扩大共轭程度,进一步改善吸收性能和引发活性[17, 18, 20]。
本文设计并制备了以香豆素并咔唑为共轭结构的草酸酯类光引发剂(2-OAME和4-OAME),如图 1所示,在咔唑中引入香豆素扩大分子的共轭结构[20],以实现分子在UV-LED光源的波长范围内的良好吸收。通过核磁共振谱、理论计算、紫外-可见吸收光谱、荧光光谱、稳态光降解和在线红外等,对目标分子的分子结构、光化学及光物理性质、引发聚合能力进行了全面的表征。结果表明,两个光引发剂在近紫外-可见光范围内均表现出优异的光吸收性质,并且在LED光源激发下具有良好的光引发聚合能力。在同样的条件下,4-OAME比2-OAME表现出更好的光引发聚合能力。两种光引发剂在近紫外-可见LED光聚合领域具有较大的应用潜力。
图 1
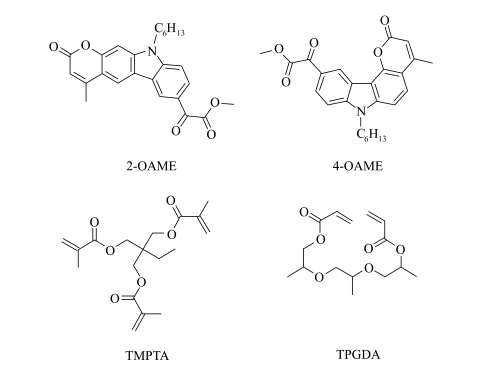 | 图 1 光引发剂分子2-OAME和4-OAME及本文所使用单体TMPTA和TPGDA的分子结构 Molecular structures of photoinitiator molecules: 2-OAME and 4-OAME, and monomers: TMPTA and TPGDA |
1 实验部分1.1 材料与仪器1.1.1 原材料2-溴咔唑,甲醇钠,三溴化硼,碘化亚铜,乙酰乙酸乙酯,溴己烷,叔丁醇钾,草酰氯单甲酯,氯化铋:AR,安耐吉化学; 无水氯化铝:AR,TCI有限公司; 浓盐酸:AR,国药化学试剂有限公司。
1.1.2 仪器ZF-1型三用紫外分析仪(化科,上海);UV-6300型紫外-可见分光光度计(Mapada,上海);荧光光谱仪(Hitachi 7000,日本);Nicolet iD1型傅里叶转换红外光谱仪(Thermo Scientific,美国);Bruker-400M型核磁共振光谱仪(Bruker,美国);GCTTM质谱仪(Micromass,英国);Vario El Ⅲ元素分析仪(Elementar,德国);LED点光源(Uvata,上海);低温浴槽(棱标,上海)。
1.2 2-OAME的合成以2-溴咔唑为原料,进行甲氧基化及去甲基化反应,制备2-羟基咔唑,然后以此制备目标分子2-OAME,其合成路线如图 2所示。
图 2
 | 图 2 2-OAME的合成 Synthesis of 2-OAME |
1.2.1 2-甲氧基咔唑(a)的合成在N2下将2-溴咔唑(10.76g,43.7mmol)置于250mL三口烧瓶中,加入100mLN, N-二甲基甲酰胺作溶剂,然后加入甲醇钠/甲醇(质量浓度40%,100mL)和CuI(8.21g,43.2mmol)。将该混合物加热至120℃,保温反应24h。冷却至室温后过滤以除去无机盐,再将该溶液倒入150mL水中,经二氯甲烷(3×150mL)萃取,无水硫酸钠干燥,利用硅胶短柱提纯粗产物,得到白色固体(a), 7.52g,产率93.9%。
1.2.2 2-羟基咔唑(b)的合成在N2保护下向250mL的三口烧瓶中依次加入2-甲氧基咔唑(a)(3.94g,20.0mmol)和15mL无水二氯甲烷。体系冷却至-78℃,滴加3.77mL三溴化硼溶于10.0mL干燥二氯甲烷的溶液,保持温度搅拌2h后取出,至常温反应3h。随后将反应液倒入水中,过滤得到粗产物,使用乙酸乙酯为溶剂并利用硅胶短柱将粗产物进一步纯化,得到白色固体2-羟基咔唑(b), 3.27g,产率86.8%。
1HNMR(400MHz, d6-DMSO):10.94(s, 1H, NH), 9.41(s, 1H, OH), 7.92(d, J=7.6Hz, 1H, PhH), 7.84(d, J=8.4Hz, 1H, PhH), 7.36(d, J=8.0Hz, 1H, PhH), 7.24(t, J=8.0Hz, 1H, PhH), 7.07(t, J=7.4Hz, 1H, PhH), 6.81(s, 1H, PhH), 6.63(d, J=10.5Hz, 1H, PhH)。
1.2.3 4-甲基吡喃酮[2, 3-b]咔唑-10-己基-2-酮(d)的合成在N2保护下,在圆底烧瓶中加入2-羟基咔唑(b)(2.79g,15.0mmol)、乙酰乙酸乙酯(3.79mL,30.0mmol)和BiCl3(0.47g,1.50mmol),剧烈搅拌下在100℃油浴中反应6h后,加入无水乙醇,超声分散、过滤,滤饼用乙醇洗涤数次,得到灰白色的固体。2-羟基咔唑扣环会产生1-位扣环的副产物和目标产物(c)。这里(c)经TLC分析为主产物,但两者Rf值非常接近,故不分离,直接进行下一步反应。在50mL的圆底烧瓶中加入同分异构体(1.49g,6.0mmol)、叔丁醇钾(2.74g,9.0mmol)及10mL四氢呋喃和20mL乙醇。升温至100℃加热回流后,加入溴己烷(1.98g,12.0mmol),保温反应6h。反应结束后将混合液用二氯甲烷(3×50mL)萃取,无水硫酸钠干燥,压旋转蒸发除去有机溶剂后,将粗产品用硅胶柱色谱纯化(洗脱剂为石油醚:二氯甲烷=8:1),分离得淡黄色固体目标产物(d), 0.35g,产率17.5%。
1HNMR(400MHz, CDCl3):9.00(s, 1H, PhH), 8.12(d, J=8.7Hz, 1H, PhH), 7.63(d, J=8.7Hz, 1H, PhH), 7.42(d, J=8.7Hz, 1H, PhH), 7.30(d, J=8.7Hz, 1H, PhH), 7.24(s, 1H, PhH), 6.17(s, 1H, CH), 4.32(t, J=7.2Hz, 2H, CH2), 4.05(s, 3H, CH3), 1.85(m, 4H, CH2), 1.42~1.17(m, 4H, CH2), 0.83(t, J=7.0Hz, 3H, CH3)。
1.2.4 目标产物2-OAME的制备N2保护下向50mL的双层三口套瓶中依次加入化合物(d)(0.31g,0.85mmol)、AlCl3(0.22g,1.6mmol)和10mL无水二氯甲烷。降温至0℃时,缓慢滴加含1mL草酰氯单甲酯(0.18g,1.5mmol)的二氯甲烷溶液,保持温度在10℃以下,继续搅拌2h。将反应液倒入100g冰与2mL浓盐酸配成的稀盐酸中,二氯甲烷萃取,再用水洗涤至pH值至中性。有机层用无水硫酸钠干燥,减压旋转蒸发除去有机溶剂后,将粗产品倒入石油醚中,抽滤黄色粉末沉淀,于50℃真空烘箱中烘24h,得到最终产物2-OAME(0.31g,88.5%)。
1HNMR(400MHz, CDCl3):8.75(s, 1H, PhH), 8.24(s, 1H, PhH), 8.13(dd, J=8.7, 1.4Hz, 1H, PhH), 7.39(d, J=8.7Hz, 1H, PhH), 7.18(s, 1H, PhH), 6.19(s, 1H, CH), 4.23(t, J=7.2Hz, 2H, CH2), 3.97(s, 3H, CH3), 2.51(s, 3H, CH3), 1.87~1.75(m, 4H, CH2), 1.62~1.08(m, 4H, CH2), 0.78(t, J=6.9Hz, 3H, CH3)。13CNMR(101MHz, CDCl3):185.22, 164.84, 161.29, 153.50, 153.23, 145.65, 143.55, 128.95, 124.89, 123.89, 122.93, 120.36, 117.01, 114.49, 112.66, 109.46, 97.17, 53.06, 44.06, 31.61, 29.89, 28.78, 27.00, 22.64, 19.40, 14.14。MS:m/z420.1735[M+H+](CalcdforC25H25NO5:419.1733)。Anal.calcd for C25H25NO5:C, 71.58;H, 6.01;O, 19.07;found:C71.76;H6.08;O19.21。
1.3 4-OAME的合成以4-羟基咔唑出发,合成目标产物4-OAME,其合成路线如图 3所示。4-甲基吡喃酮[3, 2-c]咔唑-2-酮(e)和4-甲基吡喃酮[3, 2-c]咔唑-7-己基2-酮(f)的合成根据参考文献制备[20]。
图 3
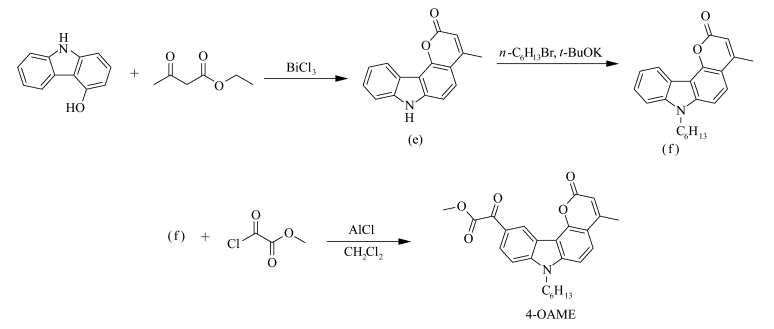 | 图 3 4-OAME的合成 Synthesis of 4-OAME |
利用化合物(f)与草酰氯单甲酯反应,反应过程及处理方法与1.2.4一致,得到产物4-OAME1.58g,产率83.8%。
1HNMR(400MHz, CDCl3):8.97(s, 1H, PhH), 8.10(d, J=8.7Hz, 1H, PhH), 7.61(d, J=8.7Hz, PhH), 7.40(d, J=8.7Hz, 1H, PhH), 7.28(d, J=8.7Hz, 1H, PhH), 6.17(s, 1H, CH), 4.31(t, J=7.3Hz, 2H, CH2), 4.07(s, 3H, CH3), 2.47(s, 3H, CH3), 1.84(m, 2H, CH2), 1.41~1.12(m, 8H, CH2), 0.83(t, J=7.0Hz, 3H, CH3)。13CNMR(101MHz, CDCl3):185.78, 165.15, 160.51, 153.61, 150.01, 143.72, 143.48, 127.65, 127.07, 124.99, 123.10, 120.87, 112.70, 111.73, 110.26, 109.23, 106.26, 52.98, 43.90, 31.58, 29.11, 26.95, 22.65, 19.47, 14.14。MS:m/z420.17[M+H+](Calcd for C25H25NO5:419.17)。Anal.calcd for C25H25NO5:C, 71.58;H, 6.01;O, 19.07;found:C71.76;H6.08;O19.21。MS:m/z420.1734[M+H+](Calcdfor C25H25NO5:419.1733)。Anal.calcd for C25H25NO5:C, 71.58;H, 6.01;O, 19.07;found:C71.67;H6.05;O19.14。
1.4 表征1.4.1 理论计算本文基于密度泛函理论(DFT)对两个光引发剂分子进行理论计算。总体计算策略定义如下:在初始AM1优化计算(在ACN中)之后,使用B3LYP/6-31G(d)基矢进行化合物几何结构的后续优化。所有计算均使用GAUSSIAN 09软件[21]进行,可以提取这些转变中涉及的分子轨道,并且对几何形状进行频率检查。
1.4.2 光物理性质测试紫外可见吸收光谱采用紫外-可见光分光光度计测试,所用溶剂为色谱纯的乙腈;荧光发射光谱测试采用荧光分光光度计测试,所选用溶剂均为HPLC级乙腈。采用参比法计算荧光量子产率[22]。
1.4.3 稳态光降解测试配制两种光引发剂的乙腈溶液及乙腈/TPGDA = 3:1(体积比)的混合溶液,在波长为365 nm、光强约为60 mW·cm-2的LED点光源下曝光监测不同时间对应的紫外吸收光谱的变化。
1.4.4 光聚合性质测试光聚合测试是利用在线红外的方法,通过监测单体的特征吸收峰的变化来推算出相应的聚合转化率。配置样品浓度为0.5%或1%(质量分数),单体分别为TMPTA和TPGDA(单体结构如图 1所示)。照射光源为365~405nm的LED点光源,照射时间200s。
其具体操作过程如下:将配方滴在两片PP薄膜中并用夹片固定在红外光谱仪夹具上,通过不同LED光源照射引发聚合,在线红外光谱实时监测,利用红外光谱监测1580~1660cm-1处C=C基团吸收峰面积降低的情况,换算出单体的转化率(DC)[7, 23, 24]。
2 结果与讨论2.1 光物理性质为了研究两个OAME分子的光物理性质,首先测试了其在乙腈溶液中的紫外-可见吸收光谱,并与理论计算的结果进行了比较,具体如图 4所示。具体的理论计算结果和实验数据见表 1。
图 4
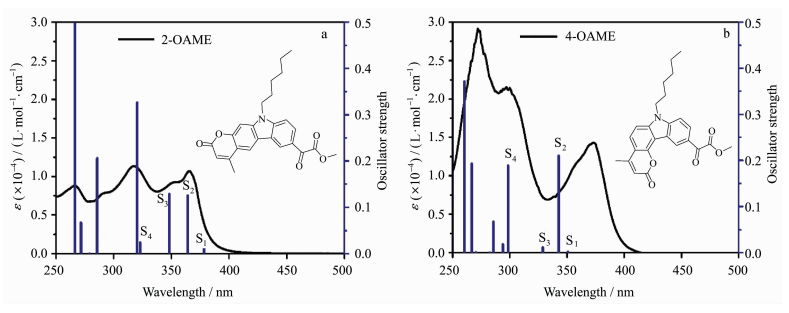 | 图 4 光引发剂2-OAME和4-OAME的实际吸收光谱与理论计算跃迁(B3LYP/6-31G (d))(a) 2-OAME; (b) 4-OAME The actual absorption spectra of photoinitiators 2-OAME (a) and 4-OAME (b) and the theoretical calculation of the transition (B3LYP/6-31G (d)) |
表1
| 表 1 光引发剂OAME的理论计算和实际测试对比数据 Comparison between theoretical calculation and actual test data of OAME | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
图 5
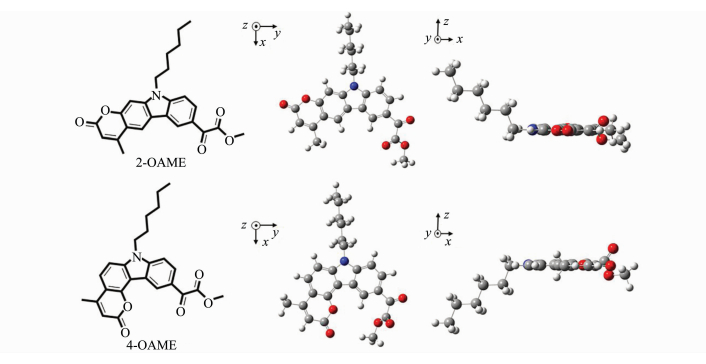 | 图 5 经理论计算(B3LYP/6-31G (d))优化后的分子结构 Molecular structure optimized by theoretical calculation (B3LYP/ 6-31G (d)) |
两个光引发剂分子在紫外光区都有较大吸收且吸收光谱范围均延伸至可见光区,其中4-OAME的最大吸收波长λabs=373nm(摩尔消光系数εmax~14300L·mol-1·cm-1)[20],相较于2-OAME(λabs=366nm, εmax~10600L·mol-1·cm-1)更红移,二者均与商业化的LED光源的发射光谱重合较好,特别是在365~405nm下表现出较好的光吸收性质,在各个波长下的摩尔消光系数如表 2所示,4-OAME在385nm处依然有7400L·mol-1·cm-1。图 5为两个分子利用理论计算优化后的分子结构,可以明显观察到咔唑并香豆素的共轭主体结构部分具有非常好的平面性,π-电子在整个共轭体系中可以发生离域,这是两个分子在近紫外-可见光区有较大吸收的根本原因。但两个同分异构体的平面构型不同是分子之间吸收差异的来源,2-OAME分子基本成线性,而4-OAME分子共轭体系成直角[20]。两个OAME分子的前线轨道的电子云分布和能量最低的两个跃迁的计算结果如图 6所示,具体数据见表 1。从中可以发现S0→S1涉及到的主要是羰基上氧的孤对电子的n→π*跃迁,S0→S2主要是HOMO轨道到LUMO轨道的π→π*跃迁,特别是2-OAME的理论计算的振子强度分布和实际吸收波谱的吸收峰值有很高的吻合度(图 4),进一步说明对其前线轨道推测的性质[25]。虽然两个分子构型不同,当时跃迁的本质是相同的。
表2
| 表 2 光引发剂2-OAME和4-OAME的光学数据 Optical data of photoinitiators 2-OAME and 4-OAME |
图 6
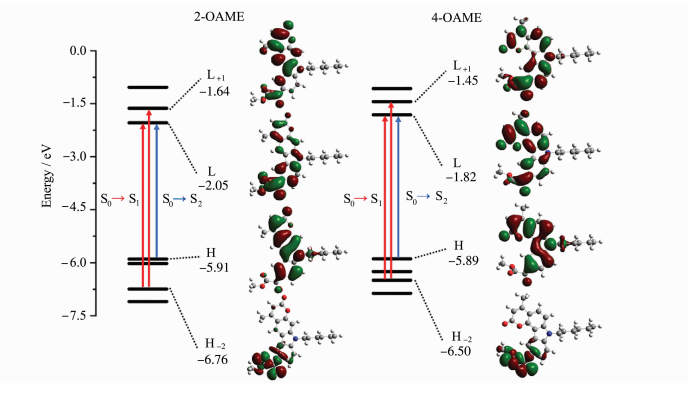 | 图 6 分子2-OAME和4-OAME的前线轨道和能量最低的两种跃迁(S0→S1和S0→S2) Frontier orbital and the two lowest energy transitions of molecules 2-OAME and 4-OAME (S0→S1 and S0→S2) |
两个光引发剂分子归一化的吸收和荧光发射图谱如图 7所示,相应的光谱数据列于表 2中。两个分子的发射波长分别位于438 nm (2-OAME)和477 nm (4-OAME),且4-OAME比2-OAME具有更大的斯托克斯位移(Stokes shift),这说明4-OAME激发态由于分子振动或单键旋转损耗更多的能量导致更低能量荧光的发射。同时,两者较低的荧光量子产率(Φf)说明这类修饰了羰基甲酸酯类[7]的引发剂分子主要通过无辐射跃迁的方式消耗激发态能量,这在光引发剂的应用中是有利的[26]。
图 7
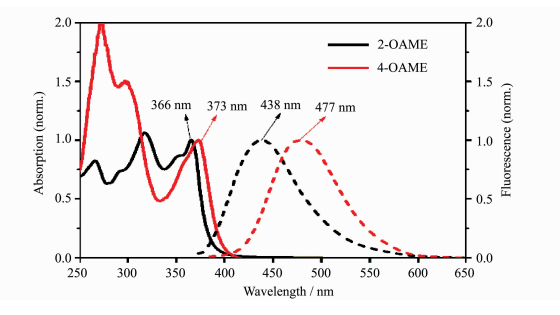 | 图 7 光引发剂OAME分子的吸收光谱(实线)和荧光发射光谱(虚线) Absorption spectrum (solid line) and fluorescence emission spectrum (dotted line) of the photoinitiator OAME molecules |
2.2 光化学性质在波长为365 nm、光强为60 mW·cm-2的LED光源激发下,两个光引发剂分子在ACN和ACN/TPGDA体系中的光谱随辐照时间的变化如图 8所示。从图中可以明显观察到,OAME在纯乙腈溶液中降解速度很慢,而在混合了单体的溶液中呈显著下降趋势。这是由于在乙腈溶液中,光照下产生的自由基对易发生偶联回到初态[7],而在单体TPGDA存在情况下,自由基会被单体中的双键捕获,进而引发双键光聚合反应,促使光解反应的进行[27, 28]。同时,两个分子在单体溶液中的最大吸收波长会发生一定的蓝移,伴随摩尔消光系数的减弱,出现了光漂白现象,随入射光线随辐照时间的增加而穿透至体系深层,让深层的引发剂分子可吸收足够的能量引发聚合,有利于实现厚尺寸材料的光固化[6, 17, 20, 25]。其中2-OAME较4-OAME有更明显的光漂白现象,可见两个同分异构体中,共轭体系的化学键连方式与分子性能也是密切相关的。本文在二苯并噻吩中引入了草酸酯基团,发现草酸酯基团的取代位置也会对分子的光解产生非常大的影响[7]。
图 8
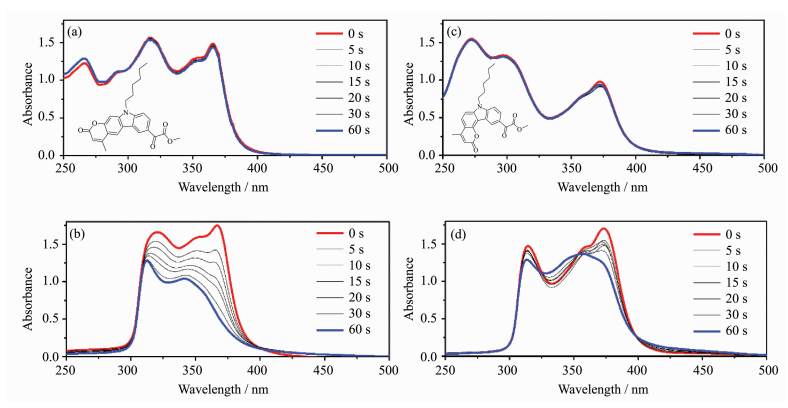 | 图 8 光引发剂2-OAME和4-OAME在溶剂ACN(a)、(c)和ACN/TPGDA(b)、(d)中吸收光谱随光照时间的变化(LED光照条件:λ=365 nm,60 mW·cm-2) Absorption spectra of photoinitiators 2-OAME and 4-OAME in solvent ACN (a, c) and ACN/TPGDA (b, d) dependent on variation of illumination time (conditions: λ=365 nm, 60 mW·cm-2) |
2.3 光聚合实验两个OAME分子在近紫外-可见光范围内具有的较高摩尔消光系数(具体数据见表 2)使其在LED光固化体系中有较好的应用潜力。为此,本文以实时红外作为测试手段,研究了不同条件下两个光引发剂分子引发单体聚合的情况,在不同体系中光照200 s后的单体最终转化率数据见表 3。
表3
| 表 3 不同聚合体系的辐照时间t=200 s时光聚合转化率数据(光照强度:30 mW·cm-2) Polymerization conversion rate data of different polymerization systems at irradiation time t=200 s (illumination intensity: 30 mW·cm-2) | |||||||||||||||||||||||||||||||||||||||||||||||
如图 9(a)和(b)展示了以4-OAME为例的不同引发剂浓度下在两种单体(TMPTA和TPGDA)中的光聚合动力学曲线,可以明显看出TMPTA作为三官能度的单体,其转化率比双官能度的TPGDA低,这是因为TMPTA中双键含量较高,在较低比例的双键发生聚合后整个体系就会玻璃化,从而限制其双键转化率的进一步提高。通过引发剂含量增加(质量浓度从0.5%升至1.0%),可以清晰得出1.0%的引发剂在同种光照条件下引发同样单体聚合的能力要高于0.5%,说明引发剂浓度增加,光照下产生的自由基增多,引发单体聚合的速度和最终转化率均得到提高[29]。
图 9
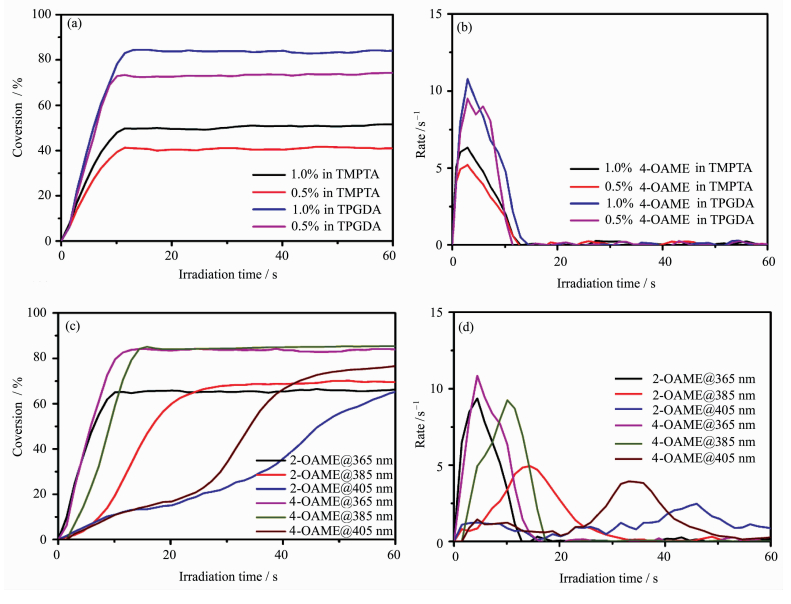 | 图 9 聚合转化率随光照时间的变化(光照条件:λ = 365 nm,光照强度30 mW·cm-2) 不同浓度的4-OAME在两个单体中的引发聚合情况:(a)转化率随时间的变化曲线,(b)聚合速率随时间的变化曲线;在不同波长下,1%质量分数的2-OAME和4-OAME在单体TPGDA中的引发聚合情况:(c)转化率随时间的变化曲线,(d)聚合速率随时间的变化曲线 Variation of polymerization conversion with illumination time (conditions: λ=365 nm, 30 mW·cm-2) The polymerization of 4-OAME at different concentrations in two monomers: curves of (a) monomer conversion vs. time and (b) initiation rate vs. time; polymerization of 2-OAME and 4-OAME at different wavelengths in TPGDA: curves of (c) monomer conversion vs. time and (d) initiation rate vs. time |
图 9(c)和(d)中比较了质量浓度为1.0%时两个引发剂分子在相同光强不同波长下引发单体TPGDA聚合的情况。对于两个OAME分子,在365和385nm的光照下都表现出比405nm光照时明显更快的聚合起始速率,这是因为两者在365nm下均具有较高的摩尔消光系数(表 2),对比其他波长的光的吸收能力更强,产生自由基的数目更多,效率也较高,从而具有更快的起始速率。而在385nm属于带边吸收,Fast等[25]研究表明带边吸收可能具有更高的光子利用率,所以也表现出较好的聚合性质,但在405nm处,两个引发剂分子的吸收都较弱(2-OAME中ε405~200L·mol-1·cm-1,4-OAMEε405~500L·mol-1·cm-1),故表现出较低的聚合效率和较长的诱导期,但随着光照时间的增长,相比于其他波长下引发速率逐渐降低至零,405nm下一直有较低但持续的引发速率,所以在光照200s后405nm下也有不错的聚合转化率(表 3)。对两个分子进行比较,发现4-OAME分子较2-OAME有更优异的聚合表现,包括相同的条件下更快的起始速率和最终转化率。
3 结论本文成功制备了具有两种咔唑并香豆素共轭结构的草酸型的光引发剂2-OAME和4-OAME,并对其光物理化学性质和引发聚合能力进行了测试,发现两者在近紫外-可见光范围内表现出优异的光吸收性质,尤其是在与365 nm LED匹配的发射波长下有较大的摩尔消光系数。两个引发剂分子在纯乙腈溶剂中有很高的稳定性,而在单体溶液中光照下会发生降解,并伴有光漂白现象的出现,并且最大吸收波长随光照时间逐渐蓝移,也使分子在厚膜固化中有值得期待的应用前景。比较不同波长下的光聚合,发现在365 nm和385 nm下聚合表现较好,说明两个OAME分子可以应用于LED激发的光固化体系中。通过比较在同样的条件下两个分子性能的差异,4-OAME分子较2-OAME表现出更好的光引发聚合能力。
致谢 感谢华东理工大学化学与分子工程学院包春燕博士在理论计算上的帮助。
参考文献
| [1] | Fouassier J P, Lalevee J. Photoinitiator for Polymer Synthesis-Scope, Reactivity, and Efficiency[M]. Wiley-VCH Berlag GmbH & Co. KGaA: Weinheim, 2012. |
| [2] | Dietlin C, Schweizer S, Xiao P, Zhang J, Morlet-Savary F, Graff B, Fouassier J P, Lalevee J. Photopolymerization upon LEDs:new photoinitiating systems and strategies[J]. Polymer Chemistry, 2015, 6(21): 3895-3912. DOI:10.1039/C5PY00258C |
| [3] | Xia R J, Malval J P, Jin M, Spangenberg A, Wan D C, Pu H T, Vergote T, Morlet-Savary F, Chaumeil H, Baldeck P, Poizat O, Soppera O. Enhancement of acid photogeneration through a para-to-meta substitution strategy in a sulfonium-based alkoxystilbene designed for two-photon polyme-rization[J]. Chemistry of Materials, 2012, 24(2): 237-244. DOI:10.1021/cm2030075 |
| [4] | Jin M, Xie J, Malval J P, Spangenberg A, Soppera O, Versace D-L, Leclerc T, Pan H, Wan D, Pu H, Baldeck P, Poizat O, Knopf S. Two-photon lithography in visible and NIR ranges using multibranched-based sensitizers for efficient acid generation[J]. Journal of Materials Chemistry C, 2014, 2(35): 7201-7215. DOI:10.1039/C4TC00706A |
| [5] | Wu X Y, Jin M, Xie J C, Malval J P, Wan D C. One/two-photon cationic polymerization in visible and near infrared ranges using two-branched sulfonium salts as efficient photoacid generators[J]. Dyes and Pigments, 2016, 133: 363-371. DOI:10.1016/j.dyepig.2016.06.023 |
| [6] | Wu X, Jin M, Xie J, Malval J P, Wan D. Molecular engineering of UV/Vis light-emitting diode (LED)-sensitive donor——acceptor-type sulfonium salt photoacid generators:design, synthesis, and study of photochemical and photophysical properties[J]. Chemistry-A European Journal, 2017, 23(62): 15783-15789. DOI:10.1002/chem.201703414 |
| [7] | Pan H, Chen S, Jin M, Malval J P, Wan D, Morlet-Savary F. A substituent para-to-ortho positioning effect drives the photoreactivity of a dibenzothiophene-based oxalate series used as LED-excitable free radical photoinitiators[J]. Polymer Chemistry, 2019, 10(13): 1599-1609. DOI:10.1039/C9PY00052F |
| [8] | Cordon C, Miller C. UV-LED:Presented by RadTech-The Association for UV & EB Technology[M]. RadTech International: Bethesda, MD, 2013. |
| [9] | Xiao P, Zhang J, Dumur F, Tehfe M A, Morlet-Savary F, Graff B, Gigmes D, Fouassier J P, Lalevee J. Visible light sensitive photoinitiating systems:recent progress in cationic and radical photopolymerization reactions under soft conditions[J]. Progress in Polymer Science, 2015, 41: 32-66. DOI:10.1016/j.progpolymsci.2014.09.001 |
| [10] | Xiao P, Dumur F, Graff B, Gigmes D, Fouassier J P, Lalevee J. Variations on the benzophenone skeleton:novel nigh performance blue light sensitive photoinitiating systems[J]. Macromolecules, 2013, 46(19): 7661-7667. DOI:10.1021/ma401766v |
| [11] | Xiao P, Dumur F, Graff B, Morlet-Savary F, Gigmes D, Fouassier J P, Lalevee J. Design of high performance photoinitiators at 385-405 nm:search around the naphthalene scaffold[J]. Macromolecules, 2014, 47(3): 973-978. DOI:10.1021/ma402622v |
| [12] | Xiao P, Zhang J, Dumur F, Tehfe M A, Morlet-Savary F, Graff B, Gigmes D, Fouassier J P, Lalevée J. Visible light sensitive photoinitiating systems:recent progress in catio-nic and radical photopolymerization reactions under soft conditions[J]. Progress in Polymer Science, 2015, 41: 32-66. DOI:10.1016/j.progpolymsci.2014.09.001 |
| [13] | Tian Y P, Zhang M L, Yu X Q, Xu G B, Ren Y, Yang J X, Wu J Y, Zhang X J, Tao X T, Zhang S Y, Jiang M H. Two novel two-photon polymerization initiators with extensive application prospects[J]. Chemical Physics Letters, 2004, 388(4/6): 325-329. |
| [14] | Al Mousawi A, Dumur F, Garra P, Toufaily J, Hamieh T, Graff B, Gigmes D, Fouassier J P, Lalevee J. Carba-zole scaffold based photoinitiator/photoredox catalysts:toward new high performance photoinitiating systems and application in LED projector 3D printing resins[J]. Macromolecules, 2017, 50(7): 2747-2758. DOI:10.1021/acs.macromol.7b00210 |
| [15] | Yilmaz G, Tuzun A, Yagci Y. Thioxanthone-carbazole as a visible light photoinitiator for free radical polymerization[J]. Journal of Polymer Science Part a-Polymer Chemistry, 2010, 48(22): 5120-5125. DOI:10.1002/pola.24310 |
| [16] | Nazir R, Danilevicius P, Ciuciu A I, Chatzinikolaidou M, Gray D, Flamigni L, Farsari M, Gryko D T. pi-Expanded ketocoumarins as efficient, biocompatible initiators for two-photon-induced polymerization[J]. Chemistry of Mate-rials, 2014, 26(10): 3175-3184. DOI:10.1021/cm500612w |
| [17] | Xu J, Ma G P, Wang K M, Gu J M, Jiang S, Nie J. Synthesis and photopolymerization kinetics of oxime ester photoinitiators[J]. Journal of Applied Polymer Science, 2012, 123(2): 725-731. DOI:10.1002/app.34551 |
| [18] | Liu Z Z, Liu T, Lin Q N, Bao C Y, Zhu L Y. Photoreleasable thiol chemistry for facile and efficient bioconjugation[J]. Chemical Communications, 2014, 50(10): 1256-1258. DOI:10.1039/C3CC48263D |
| [19] | Zhang X, Xi W, Wang C, Podgorski M, Bowman C N. Visible-light-initiated thiol-michael addition polymerizations with coumarin-based photobase generators:another photoclick reaction strategy[J]. ACS Macro Letters, 2016, 5(2): 229-233. DOI:10.1021/acsmacrolett.5b00923 |
| [20] | Zhou R, Malval J P, Jin M, Spangenberg A, Pan H, Wan D, Morlet-Savary F, Knopf S. A two-photon active chevron-shaped type I photoinitiator designed for 3D stereolithography[J]. Chemical Communications, 2019, 55(44): 6233-6236. DOI:10.1039/C9CC02923K |
| [21] | Frisch M J. Gaussian 09, Revision B.01.[M]. Gaussian, Inc: Wallingford CT. Wallingford CT2009. |
| [22] | Wu X, Jin M, Malval J P, Wan D, Pu H. Visible light-emitting diode-sensitive thioxanthone derivatives used in versatile photoinitiating systems for photopolymerizations[J]. Journal of Polymer Science Part a-Polymer Chemistry, 2017, 55(24): 4037-4045. DOI:10.1002/pola.28871 |
| [23] | Jin M, Wu X Y, Malval J P, Wan D C, Pu H T. Dual roles for promoting monomers to polymers:a conjugated sulfonium salt photoacid generator as photoinitiator and photosensitizer in cationic photopolymerization[J]. Journal of Polymer Science Part a-Polymer Chemistry, 2016, 54(17): 2722-2730. DOI:10.1002/pola.28154 |
| [24] | Zhang J, Xiao P, Dumur F, Guo C, Hong W, Li Y, Gigmes D, Graff B, Fouassier J-P, Lalevee J. Polymeric photoinitiators:a new search toward high performance visible light photoinitiating systems[J]. Macromolecular Chemistry and Physics, 2016, 217(19): 2145-2153. DOI:10.1002/macp.201600260 |
| [25] | Fast D E, Lauer A, Menzel J P, Kelterer A M, Gescheidt G, Barner-Kowollik C. Wavelength-dependent photoche-mistry of oxime ester photoinitiators[J]. Macromolecules, 2017, 50(5): 1815-1823. DOI:10.1021/acs.macromol.7b00089 |
| [26] | Allen N S. Photochemistry and photophysics of polymer materials[M]. Wiley: New York, USA, 2010. |
| [27] | Allonas X, Lalevee J, Fouassier J P, Tachi H, Shirai M, Tsunooka M. Triplet state of O-acyloximes studied by time-resolved absorption spectroscopy[J]. Chemistry Letters, 2000(9): 1090-1091. |
| [28] | Frick E, Schweigert C, Noble B B, Ernst H A, Lauer A, Liang Y, Voll D, Coote M L, Unterreiner A N, Barner-Kowollik C. Toward a quantitative description of radical photoinitiator structure-reactivity correlations[J]. Macromolecules, 2016, 49(1): 80-89. DOI:10.1021/acs.macromol.5b02336 |
| [29] | Jin M, Yu M, Zhang Y, Wan D C, Pu H T. 2, 2, 2-Trif-luoroacetophenone-based D-pi-A type photoinitiators for radical and cationic photopolymerizations under near-UV and visible LEDs[J]. Journal of Polymer Science Part a-Polymer Chemistry, 2016, 54(13): 1945-1954. DOI:10.1002/pola.28053 |
