近期,李卫研究组利用TRF1敲除小鼠模型研究发现TRF1作为端粒保护蛋白的成分之一,直接参与到端粒末端向核膜的锚定以及端粒完整性的保护过程中,在精子发生过程中发挥重要的作用。研究结果显示,Trf1的敲除导致雄性小鼠不育,睾丸变小且几乎没有成熟精子产生,这与临床上的无精子症高度相似。组织学检测发现,Trf1敲除的小鼠睾丸中生殖细胞大量丢失,凋亡细胞明显增多。机制研究发现,TRF1的缺失破坏了端粒末端与核膜的锚定,从而严重影响了程序性DSB的修复,同源染色体的配对、联会以及同源重组过程,使得大量的减数分裂细胞阻滞在减数分裂前期的粗线期;同时TRF1的缺失引起端粒末端的粘连,染色体分离异常,减数分裂进一步阻滞在减数分裂的中期,最终导致生殖细胞大量凋亡。该研究揭示了端粒相关蛋白在减数分裂过程中主要发挥两方面的作用,一是介导端粒向内核膜的锚定,二是发挥端粒末端保护的作用,防止染色体末端黏连的发生。进一步的研究发现TRF1,Speedy A和CDK2都可以同时参与到这两个过程当中。TRF1通过Speedy A这个支架蛋白,与CDK2间接结合,从而将端粒直接锚定在内核膜上,促进减数分裂正常进行,并发挥端粒末端保护的作用。从而揭示了减数分裂过程中花束期这一特定时相端粒保护的独特新机制。
相关研究结果2018年1月8日发表于Cell Death and differentiation杂志(论文链接)。李卫研究组博士生王丽娜和瑞典Gothenburg大学的涂兆伟博士为论文共同第一作者,该研究受到科技部“国家重点研发计划”重点专项(2016YFA0500901)、国家自然科学基金(31471277, 91649202)等项目的资助,由中科院动物所,Gothenburg大学和山东大学生殖医学中心共同完成。
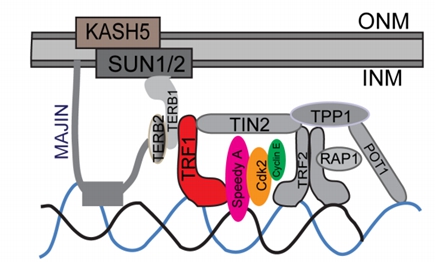
TRF1等蛋白在花束期促进端粒与核膜的锚定并防止他们之间的融合
| 附件下载: | |
