脊椎动物的造血过程分为两个阶段:初级造血和次级造血,其中,造血干细胞产生于次级造血过程。在胚胎期的主动脉-性腺-中肾(AGM)区域,造血干细胞由特化的生血内皮细胞通过内皮-造血转化过程产生,随后迁移至胎肝(人和小鼠)或者尾部造血组织(斑马鱼)进行扩增和分化,部分前体细胞迁移至胸腺,分化成淋巴细胞。最后,造血干细胞迁移至骨髓(人和小鼠)或者肾髓(斑马鱼)维持机体终身造血过程。迄今为止,在造血干细胞产生及分化过程中,已发现诸多信号通路和转录因子具有关键的调控作用。然而,对于表观遗传修饰,尤其是RNA甲基化,调控血液发生的研究却极其有限。
2017年9月6日,中国科学院动物研究所刘峰研究员通过与北京基因组所杨运桂组合作,在国际著名期刊Nature杂志发表重要研究成果,发现mRNA的m6A修饰调控斑马鱼造血干细胞的命运决定。在此基础上,动物所刘峰实验室与周琪院士以及李伟实验室,和北京基因组所杨运桂实验室继续合作,利用条件性敲除系统,进一步揭示m6A在小鼠造血干细胞发育过程中的生物学功能,并深入探索了其作用机制。
首先,利用Vec-Cre在血管内皮细胞中特异性敲除m6A甲基转移酶复合体重要组分Mettl3,发现血管内皮细胞中的m6A水平显著降低。系统的表型分析结果显示:在内皮细胞特异性敲除Mettl3的小鼠胚胎里,造血干细胞的命运决定受到影响,血管动脉内皮特性增强。但是在血细胞中特异性敲除Mettl3,并不影响造血干细胞的产生。其次,通过RNA-seq分析发现,在内皮细胞特异性敲除Mettl3的小鼠AGM组织中,Notch信号通路被过度激活,其中,以Notch1为代表的动脉内皮相关基因的表达量显著上调。同时,m6A-RIP-qPCR结果也表明,Notch1 mRNA的m6A富集程度显著降低。上述结果说明,血管内皮细胞m6A修饰的缺失,影响了Notch1在造血干细胞命运决定过程中的动态平衡。此外,结合已报道的测序数据分析发现,m6A修饰识别蛋白Ythdf2的结合区段与Notch1 mRNA上发生m6A修饰的区段有重叠,这预示着m6A修饰调控Notch1 mRNA可能是通过Ythdf2介导的。
该项工作进一步证明了m6A修饰在脊椎动物造血干细胞发育过程中的关键作用,不仅将前期在斑马鱼中发现的生物学规律推广到更加高等的哺乳动物,更是对造血干细胞产生分子机制的完善与补充。同时,该成果也将为血液器官再造提供理论支持,并推动体外诱导产生造血干细胞这一科学前沿的发展。该文章“Endothelial-specific m6A modulates mouse hematopoietic stem and progenitor cell development via Notch signaling”于2017年11月17日在线发表于国际知名期刊Cell Research。
中国科学院动物研究所吕军华博士、硕士生张一帆、高素伟、张春霞博士和北京基因组所博士生陈宇晟为共同第一作者,刘峰研究员为通讯作者;本研究工作得到了动物所周琪院士、李伟研究员和基因组所杨运桂研究员的大力支持。此外,该课题得到了中科院干细胞与再生医学战略性先导科技专项、国家****科学基金、国家自然科学基金重点项目以及国家重点基础研究发展计划的资助。(文章链接)
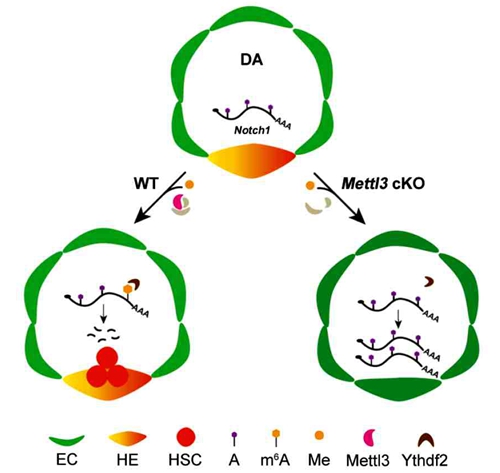
m6A修饰调控哺乳动物造血干细胞发育模式图
| 附件下载: | |
