在脊椎动物中,造血干细胞最初由特化的生血内皮通过内皮-造血转化(EHT)过程产生于胚胎期主动脉-性腺-中肾区,随后向胎肝(小鼠和人)或尾部造血组织(斑马鱼)迁移并进行扩增,向胸腺迁移以便发育为淋系细胞,最后,向骨髓(小鼠和人)或肾髓(斑马鱼)迁移以维持终生造血。经过几十年的研究与探索,我们对于造血干细胞的体内发育和体外诱导分化已有了基本的了解,但对整个过程的动态调控机制的认识仍不完善,尤其对于表观遗传修饰在脊椎动物造血干细胞发育过程中的作用更是知之甚少。
m6A(N6-甲基腺嘌呤)是最常见、最丰富的真核生物mRNA转录后修饰形式之一。该修饰过程是动态可逆的,并由甲基转移酶复合体(METTL3,WTAP和METTL14组成)、去甲基酶(FTO和ALKBH5)和相应的阅读器(YTHDF或YTHDC等)协同调控。目前,m6A的生物学功能已备受关注,并成为生命科学热门研究领域之一,Nature杂志连续发文报道了m6A在斑马鱼早期发育、果蝇性别决定以及T细胞稳态中的功能。自此,我们对于m6A修饰已经有了初步了解和认识,但是,该修饰的生物学功能以及其作用机制仍有待深入探索和挖掘。
中国科学院动物研究所刘峰研究员领导的血液与心血管发育研究组长期以斑马鱼为模式生物研究造血干细胞发育的分子调控机制。前期与北京基因组研究所杨运桂实验室合作研究发现并鉴定了斑马鱼中的m6A甲基转移酶复合体成分(Cell Res, 2014)。在此基础上,研究人员通过m6A测序技术(m6A-Seq)发现,缺失m6A甲基转移酶mettl3后,m6A在胚胎发育相关mRNA中的富集程度显著下降。同时,在斑马鱼的血液-血管系统中,可检测到mettl3的特异性表达。由此推测,m6A修饰与血液发育过程密切相关。系统的表型检测显示,在mettl3缺失的胚胎中,造血干细胞不能正常产生,血管的内皮特性却明显增强,内皮-造血转化过程受到阻断。m6A-Seq和RNA-Seq综合分析发现,在mettl3缺失的胚胎中,一系列动脉内皮发育相关的基因,尤其是notch1a的m6A修饰水平显著降低,而其mRNA水平却显著升高。上述结果证明,m6A修饰与EHT过程中内皮和造血基因表达的平衡调控相关。此外,YTHDF2-RIP-Seq和单碱基分辨率的m6A-miCLIP-Seq发现,m6A通过YTHDF2介导notch1a mRNA的稳定性,以维持EHT过程中内皮细胞和造血细胞基因表达的平衡,进而调控造血干细胞的命运决定。上述结果在小鼠中也得到了验证,证明m6A对造血干细胞命运决定的调控在脊椎动物中是保守的。
该工作首次揭示m6A mRNA甲基化修饰在脊椎动物造血干细胞命运决定中的调控机制,丰富了对m6A mRNA甲基化在正常生理状态下的生物学功能的认识,是该研究领域的重大科研突破。上述成果不仅首次阐释RNA的表观修饰在血液发育中的关键作用,还将为体外诱导扩增造血干细胞提供了理论指导。该文章“m6A modulates haematopoietic stem and progenitor cell specification”于2017年9月6日正式发表于国际著名期刊Nature(Nature, September 6, 2017; doi: 10.1038/nature23883)。
中国科学院动物研究所博士研究生张春霞、王璐副研究员,中国科学院基因组所博士生陈宇晟、孙宝发博士、杨莹博士为共同第一作者,刘峰研究员和中国科学院基因组所杨运桂研究员为共同通讯作者。该课题得到了国家****科学基金、国家自然科学基金重点项目、国家重点基础研究发展计划和中科院干细胞与再生医学战略性先导科技专项的资助。(文章链接)
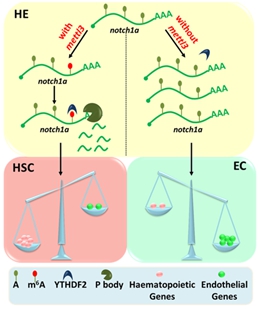
图1:m6A修饰调控造血干细胞产生模式图。甲基转移酶Mettl3通过m6A修饰决定notch1a的mRNA水平,进而调控内皮-造血转化过程。
图2:造血干细胞通过内皮-造血转换方式在主动脉血管底部产生。该研究发现了新型的RNA甲基化修饰(红色)通过调控造血发育重要基因Notch mRNA的稳定性,从而决定内皮细胞(绿色)转变成造血干细胞(蓝色)。
| 附件下载: | |
