 ,东北农业大学生命科学学院,哈尔滨 150030
,东北农业大学生命科学学院,哈尔滨 150030Analysis of SOX2 gene promoter activity in porcine early embryonic development
Jianchao Zhao, Zhuang Chai, Shimeng Guo, Zhonghua Liu ,College of Life Science, Northeast Agricultural University, Harbin 150030, China
,College of Life Science, Northeast Agricultural University, Harbin 150030, China通讯作者:
编委: 李明洲
收稿日期:2019-02-21修回日期:2019-06-17网络出版日期:2019-10-20
| 基金资助: |
Editorial board:
Received:2019-02-21Revised:2019-06-17Online:2019-10-20
| Fund supported: |
作者简介 About authors
赵剑超,硕士研究生,专业方向:发育生物学E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1119KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
赵剑超, 柴壮, 郭诗萌, 刘忠华. 猪早期胚胎发育中SOX2基因启动子活性分析[J]. 遗传, 2019, 41(10): 950-961 doi:10.16288/j.yczz.19-045
Jianchao Zhao, Zhuang Chai, Shimeng Guo, Zhonghua Liu.
SOX2蛋白作为重要的转录因子,广泛表达于胚胎、原始生殖细胞、神经元等多种组织与细胞中。在胚胎发育过程中,SOX2基因的表达是大脑皮层形成和发育所必需的,同时也参与指导食道与前胃的形成[1]。此外,SOX2基因在多种癌细胞与肿瘤干细胞中广泛表达[2,3,4]。近年来,SOX2转录因子在早期胚胎发育和维持干细胞多能性方面的作用受到广泛关注[5,6,7]。
在哺乳动物早期胚胎发育中,第一次谱系分化发生在囊胚腔形成时期,胚胎由全能性的卵裂球分化形成多潜能性的滋养层细胞(trophectoderm, TE)和内细胞团细胞(inner cell mass, ICM)。然而,关于第一次谱系分化形成滋养层和内细胞团细胞的机制目前尚不清楚。SOX2蛋白作为核心多能性转录因子之一,在早期胚胎发育中第一次谱系分化以及内细胞团多能性维持等方面具有重要的作用[8,9]。2003年,Avilion等[10]证实小鼠(Mus musculus)Sox2基因敲除的囊胚中仍存在ICM,但导致其丧失多能性,同时失去产生胚胎干细胞的能力。2014年,Wicklow等[11]发现小鼠中Sox2基因的表达不受CDX2蛋白调控,且Sox2基因在内细胞团中特异性表达并具有重要功能。在猪早期胚胎发育中,SOX2转录因子备受关注。2015年,Liu等[12]研究表明,虽然SOX2基因在猪内细胞团中特异性表达,但表达模式与小鼠不同:(1)在早期囊胚内细胞团前体细胞中即出现SOX2基因特异性表达,但此时CDX2基因尚未表达;(2)在囊胚期,滋养层细胞中SOX2基因表达沉默先于极化的发生,而小鼠中由于细胞的极化导致滋养层细胞中Sox2基因表达沉默。表达模式的差异暗示猪SOX2基因表达上游调控机制不同于小鼠。此外,在猪诱导性多能性干细胞(induced pluripotent stem cells, iPSC)的建系研究中,利用SOX2蛋白在内的经典4因子对体细胞重编程,虽然可以获得具有一定多能性的iPS细胞系[13,14,15,16],但猪iPSC同时具有内源基因不激活、外源基因不沉默以及不具嵌合能力等问题[17]。同时,参考小鼠和人胚胎干细胞系建系的经验,至今仍无法获得猪胚胎干细胞系[18,19]。上述研究表明,猪与小鼠、人等多能性调控网络存在差异,建立猪多能性相关调控网络机制具有重要的科学意义。
本研究通过检测SOX2基因启动子介导的报告基因表达水平评价其启动活性,预测了启动子区域转录因子结合位点,分析了各区域对SOX2基因启动子活性的影响,进而揭示猪早期胚胎发育中SOX2基因表达调控关键因子,为进一步研究猪早期胚胎第一次谱系分化以及多能性干细胞建立提供理论基础[20]。
1 材料与方法
1.1 质粒载体构建
本研究所用的质粒包括:pEGFP-C1 (Clontech,美国),pRL-TK (Promega E2241,美国),FUGW (Addgene 14883,美国)和pLV-mCherry (Addgene 36084,美国)。载体构建中片段克隆所用的DNA聚合酶为PrimeSTAR? Max DNA Polymerase (TaKaRa R045A,日本),反应体系为25 μL,反应条件中退火温度设定为58℃,时间15 s;DNA片段连接所用的试剂盒为NEBuilder?高保真 DNA 组装克隆试剂盒(NEB E2621S,美国),引物重复序列长度25 bp,20 μL反应体系中共加入0.2 pmol DNA片段总量,反应时间15 min。PCR和qRT-PCR所用全部引物信息见表1。Table 1
表1
表1 引物信息
Table 1
| 引物名称 | 引物序列(5'→3') | 用途 |
|---|---|---|
| UBC pro-p* | GATCTGGCCTCCGCGCCGGGTTTTG | 克隆UBC启动子片段 |
| GTCTAACAAAAAAGCCAAAAACG | ||
| CMV pro-p* | CGCGTTACATAACTTACGGTAAA | 克隆CMV启动子片段 |
| AGCTCTGCTTATATAGACCTCCC | ||
| EGFP-p* | ATGGTGAGCAAGGGCGAGGAGCT | 克隆EGFP片段 |
| CACTTGTACAGCTCGTCCATGC | ||
| mCherry-p* | ATGGTGAGCAAGGGCGAGGAGGA | 克隆mCherry片段 |
| CTACTTGTACAGCTCGTCCATGC | ||
| pRL line-p | TTCTAGAGCGGCCGCTTCGAGCA | 线性化pRL-TK质粒 |
| GTCGAGCCATGTGAGCAAAAGGC | ||
| pEGFP line-p | GGTTTAGTGAACCGTCAGATCCG | 线性化pEGFP-C1质粒 |
| GAACTCCATATATGGGCTATGAA | ||
| C1 line-p | CCGGGATCCACCGGATCTAGATA | 线性化pEGFP-C1质粒 |
| TGGGCTATGAACTAATGACCCCG | ||
| sox2+-p | GTGGGAGATCCTTCACAGTCTA | 克隆猪SOX2基因上游序列 |
| GCTTCTCCGTCTCCGACAAA | ||
| sox2-p* | TCTGGAAGTCTTGTGGCATGATC | 克隆sox2 pro 5k片段 |
| GCGGGCGCTGTGCGCGGGCCCGG | ||
| sox2 pro[1]-p* | TCTGGAAGTCTTGTGGCATGATC | 克隆sox2 pro [1]的线性报告载体 |
| CGCCTTTTCGAAGGAAGTGGGTAAAC | ||
| sox2 pro[2]-p* | GCACCACTGAGATCCCTCCTTTA | 克隆sox2 pro [2]的线性报告载体 |
| AACAAAGCCCCGTCTAAGTTTCC | ||
| sox2 pro[3]-p* | ACCTATCGAGTTTGACAAGAACTG | 克隆sox2 pro [3]的线性报告载体 |
| TGGTACTCTTCAAAATAAAGCAGTG | ||
| sox2 pro[4]-p* | ACCATTATCCACACCAACCCCTTG | 克隆sox2 pro [4]的线性报告载体 |
| GCGGGCGCTGTGCGCGGGCCCGG | ||
| sox2-q | GCGGAGTGGAAACTTTTGTCC | 猪SOX2 qRT-PCR扩增引物 |
| GGGAAGCGTGTACTTATCCTTCT | ||
| 18S-q | GATGGGCGGCGGAAAATTG | 猪18S rRNA qRT-PCR扩增引物 |
| TCCTCAACACCACATGAGCA | ||
| EGFP-q | AGTGCTTCAGCCGCTACCC | EGFP qRT-PCR扩增引物 |
| AGTTCACCTTGATGCCGTTCTT | ||
| mCherry-q | CCCGAGGGCTTCAAGTGGGA | mCherry qRT-PCR扩增引物 |
| CCGTCGGAGGGGAAGTTGGT |
新窗口打开|下载CSV
以FUGW质粒为模板,利用引物UBC pro-p克隆得到泛素C (ubiquitin-C, UBC)启动子片段;以pEGFP-C1质粒为基础载体,利用引物pEGFP line-p克隆得到线性化的pEGFP-C1质粒载体;将UBC启动子片段和线性化的pEGFP-C1质粒载体连接,获得pEGFP-UBC质粒。pEGFP-C1和pEGFP-UBC质粒特点:以pEGFP-C1质粒为基础骨架的CMV (cytomegalovirus)或UBC启动子介导的EGFP表达载体(图1,A和B;表2)。
以pEGFP-C1质粒为模板,利用引物CMV pro-p和EGFP-p分别克隆得到CMV启动子片段和增强绿色荧光蛋白(enhanced green fluorescence protein, EGFP)片段;以pRL-TK质粒为基础载体,利用引物pRL line-p克隆得到线性化的pRL-TK质粒载体;将CMV启动子片段、EGFP片段和线性化的pRL-TK质粒载体连接,获得pRL-CMV质粒,将UBC启动子片段、EGFP片段和线性化的pRL-TK质粒载体连接,获得pRL-UBC质粒。其特点为:以pRL-TK质粒为基础骨架的CMV或UBC启动子介导的EGFP表达载体(图1,C~E;表2)。
图1
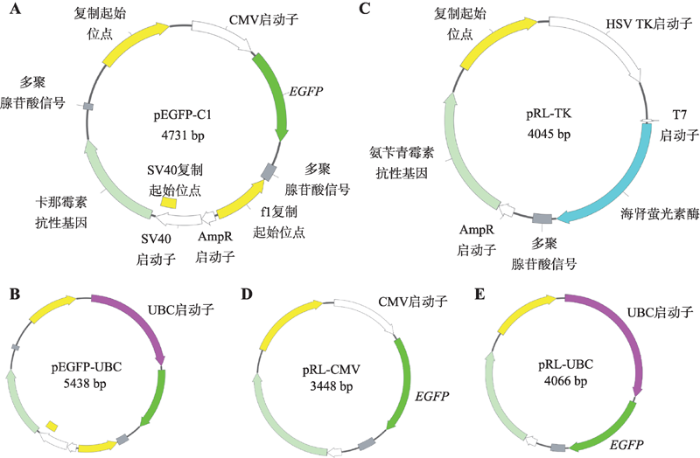 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1报告质粒图谱
A, B:报告质粒pEGFP-C1和pEGFP-UBC构建图谱;C~E:pRL-TK质粒和pRL-CMV、pRL-UBC报告质粒构建图谱。
Fig. 1Map of reporter plasmids
Table 2
表2
表2 报告质粒信息对比
Table 2
| 名称 | 大小(bp) | 质粒骨架 | 启动子 | 报告基因 |
|---|---|---|---|---|
| pEGFP-C1 | 4731 | pEGF-C1 | CMV | EGFP |
| pEGFP-UBC | 5348 | pEGF-C1 | UBC | EGFP |
| pRL-CMV | 3448 | pRL-TK | CMV | EGFP |
| pRL-UBC | 4066 | pRL-TK | UBC | EGFP |
新窗口打开|下载CSV
以猪基因组为模板,利用引物sox2+-p进行克隆;再以克隆产物为模板,利用引物sox2-p克隆得到SOX2翻译起始位点上游5000 bp片段,即本研究中SOX2基因全长启动子,命名为sox2 pro 5k。以pLV-mCherry质粒为模板,利用引物mCherry-p克隆得到mCherry片段;以pEGFP-C1质粒为载体骨架,利用引物C1 line-p克隆得到线性化的载体骨架;将sox2 pro 5k片段、mCherry片段和线性化的载体骨架连接,获得质粒Sp0,其特点为:以pEGFP-C1质粒为基础骨架的5000 bp SOX2基因启动子介导的mCherry表达载体。
以Sp0质粒为模板,分别以sox2 pro[1]-p、sox2 pro[2]-p、sox2 pro[3]-p和sox2 pro[4]-p为引物进行克隆,将得到的克隆产物直接自连,分别获得质粒Sp1、Sp2、Sp3和Sp4,其特点为:分别缺失相应结合位点簇的SOX2基因启动子介导的mCherry表达载体。
构建完成的质粒去内毒素提取后-20℃保存。
1.2 胚胎培养与显微注射
从屠宰场收集猪卵巢,在37℃生理盐水中抽取直径2~8 mm卵泡。将获得的卵泡液静置,弃上清,并用HEPES缓冲液清洗稀释后,在39℃恒温工作台上借助显微镜挑出有3层以上卵丘细胞包裹的卵母细胞,50枚一组培养在500 μL预平衡的成熟培养液(MAT)中,条件为39℃、5%CO2的饱和湿度环境。避光静置培养42 h后,将卵母细胞置于0.5%透明质酸酶中震荡去除卵丘细胞,在39℃恒温工作台上借助显微镜挑出具有第一极体的MII期卵母细胞。将获得的MII期卵母细胞置于细胞融合液(FM)中排成一列,附加两次120 V/mm、30 μs的矩形脉冲以完成孤雌激活,之后50枚一组培养在500 μL预平衡的胚胎培养液(PZM-3),条件为39℃、5% CO2的饱和湿度环境中。显微操作系统为倒置显微镜(Nikon TS-100,日本)、显微注射系统(Nikon IM-9A,日本)及Femtojet Express定量注射系统(Eppendorf,德国)。取100 μL胚胎操作液(MAN)于平皿中央,并用石蜡油覆盖后放置于显微操作仪39℃恒温工作台上,向MAN液滴中加入卵母细胞准备注射。将5 μL质粒溶液通过微量上样枪头加至注射针内进行注射操作。注射系统相关参数为:注射压力(Pi)100 hPa、注射时间(Ti)0.5 s和补偿压力(Pc)40 hPa。显微镜下对猪卵母细胞进行胞质注射,注射量约为30 pL/枚。
1.3 启动子信息获取与预测
在NCBI数据库中获取猪SOX2基因上游序列。选择翻译起始位点上游5000 bp序列,以翻译起始位点第一个腺嘌呤脱氧核糖核苷酸为+1,上游为负进行定位标识。利用LASAGNA-Search 2.0启动子预测数据库(Table 3
表3
表3 sox2 pro 5k片段中预测的转录因子结合位点
Table 3
| 序号 | 名称 | 位置 | 备注 |
|---|---|---|---|
| 1 | NF-AT | -470~-459 | 位于d1区域 |
| 2 | NF-Y | -481~-467 | |
| 3 | NF-Y | -482~-469 | |
| 4 | GC box | -546~-533 | |
| 5 | SREBP-1 | -678~-668 | |
| 6 | NF-AT | -1336~-1325 | 位于d2区域 |
| 7 | C/EBP | -1337~-1325 | |
| 8 | Ik-3 | -1472~-1460 | |
| 9 | STAT5B | -1473~-1461 | |
| 10 | STAT5A | -1473~-1461 | |
| 11 | STAT5A | -1474~-1461 | |
| 12 | AP-2rep | -1496~-1490 | |
| 13 | STAT5A | -1503~-1496 | |
| 14 | Lmo2 complex | -1601~-1591 | |
| 15 | AREB6 | -1601~-1590 | |
| 16 | NF-kappaB | -1654~-1641 | |
| 17 | SOX-9 | -1762~-1749 | |
| 18 | YY1 | -1864~-1848 | |
| 19 | NF-AT | -2271~-2260 | 位于d3区域 |
| 20 | NF-AT | -2432~-2421 | |
| 21 | Tal-1beta:ITF-2 | -3109~-3094 | 位于d4区域 |
| 22 | Tal-1alpha:E47 | -3109~-3094 | |
| 23 | Tal-1alpha:E47 | -3109~-3094 | |
| 24 | TATA | -3194~-3185 | |
| 25 | Freac-7 | -3415~-3400 | |
| 26 | BSAP | -3512~-3485 | |
| 27 | IRF-1 | -3747~-3735 | |
| 28 | c-Ets-1(p54) | -3854~-3845 | |
| 29 | Lhx3 | -4075~-4066 | |
| 30 | FOXO1 | -4235~-4227 | |
| 31 | CHX-10 | -4262~-4252 | |
| 32 | CHX-10 | -4263~-4253 | |
| 33 | MRF-2 | -4288~-4278 | |
| 34 | E4BP4 | -4494~-4483 |
新窗口打开|下载CSV
1.4 启动子活性分析
利用荧光报告基因的平均荧光强度与其mRNA相对含量评估相应启动子活性。对注射后72 h胚胎通过CCD数字成像系统采集荧光镜下图像信息,利用软件Adobe Photoshop CC 2015分析mCherry和EGFP平均荧光强度。各组分别收集EGFP阳性4-细胞和8-细胞胚胎共100枚,利用酸性操作液(1 mL MAN加20 μL浓盐酸)去除透明带后置于RNase-free 1.5 mL离心管,液氮冷冻后-80℃保存。对收集的胚胎样本利用Purelink RNA mini kit (Ambion 12183018A,美国)提取总RNA,利用High Capacity cDNA Reverse Transcription Kit (Applied Biosystems 4368814,美国)进行总RNA反转录,获得cDNA,利用SYBR premix Ex TaqTM (TaKaRa RR420,日本)和引物mCherry-q、EGFP-q、sox2-q、18S-q分别对mCherry、EGFP、SOX2和猪18S rRNA进行qRT-PCR扩增。数据处理时,以猪18S rRNA基因作为内参校正SOX2基因检测结果(ΔSOX2),以EGFP基因校正mCherry基因检测结果(ΔmCherry),再用ΔSOX2对ΔmCherry进行二次校正后作为最终qRT-PCR的检测结果,以此评价各启动子活性。具体qRT-PCR数据处理公式为:相对表达量=${{2}^{-[(\Delta \text{C}{{\text{t}}_{mCherry}}-\Delta \text{C}{{\text{t}}_{SOX2}})-(\Delta \text{C}{{\text{t}}_{mCherry}}-\Delta \text{C}{{\text{t}}_{SOX2}})]}}$,其中$\Delta \text{C}{{\text{t}}_{mCherry}}=\text{C}{{\text{t}}_{mCherry}}-\text{C}{{\text{t}}_{EGFP}}$,$\Delta \text{C}{{\text{t}}_{SOX2}}=\text{C}{{\text{t}}_{SOX2}}-\text{C}{{\text{t}}_{18\text{S}\ \text{rRNA}}}$,Ct为qRT-PCR中的阈值循环。2 结果与分析
2.1 猪胚胎显微注射体系的建立
2.1.1 报告载体的筛选对猪胚胎显微注射体系中报告载体的类型进行筛选,以获得高效表达外源报告基因的载体。选择两种载体骨架以及两种广谱型启动子共计4种载体作为备选报告载体,分别是pEGFP-C1、pEGFP-UBC、pRL-CMV和pRL-UBC (图1)。孤雌激活后4 h用上述4种质粒对胚胎进行显微注射,注射质粒浓度为20 ng/μL。观察EGFP蛋白表达情况以及胚胎发育情况(图2,A和B)。结果表明,注射pEGFP-C1质粒的胚胎EGFP阳性率为39.33% (±1.76%),显著高于其他组(图2,C和D)。由于早期胚胎发育会受外源DNA浓度的影响,因此又分别选择20 ng/μL与100 ng/μL浓度的pEGFP-C1进行显微注射。经观察发现,当注射浓度提高至100 ng/μL时,注射胚胎发育情况与20 ng/μL浓度组无显著差异(图2B),但EGFP表达效果更好(图2,C和D)。因此,在后续研究中选择pEGFP-C1质粒为内参和基本载体骨架,质粒总浓度为100 ng/μL。
图2
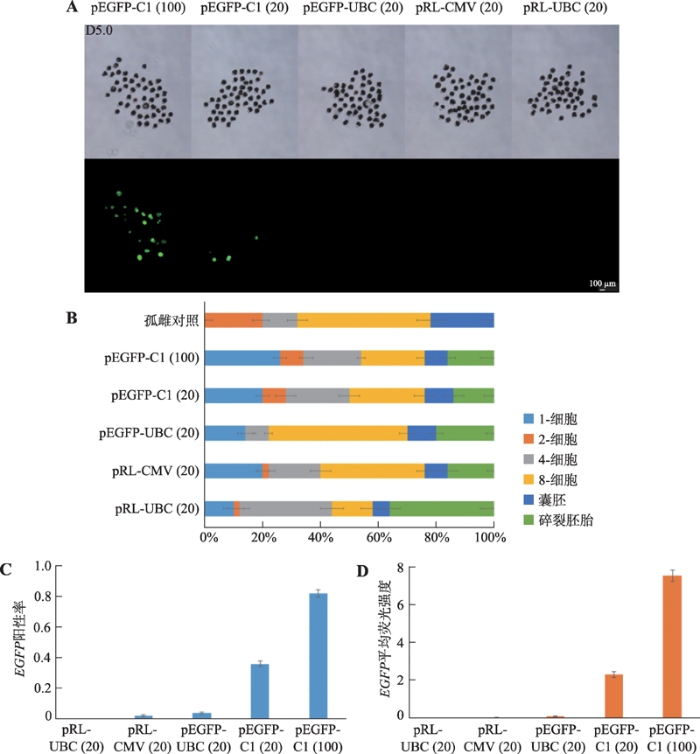 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图24种质粒对胚胎荧光标记的效果
A:用4种质粒分别对孤雌激活4 h后的胚胎进行注射,培养5 d后荧光镜下观察EGFP基因表达情况;B:以孤雌胚胎为对照,各注射组培养5 d内胚胎各阶段发育情况统计;C:各注射组在培养5 d后胚胎EGFP基因表达阳性率;D:各注射组在培养5 d后胚胎EGFP平均荧光强度。括号中20和100分别代表质粒浓度为20 ng/μL和100 ng/μL。
Fig. 2The fluorescent labeling effects of four plasmids on embryos
2.1.2 注射时间选择
为了确定猪胚胎显微注射体系中最佳注射时间,分别针对孤雌前卵母细胞(-0 h)与孤雌激活0 h、2 h、4 h、6 h、8 h、10 h以及11 h后胚胎显微注射pEGFP-C1质粒,观察各组胚胎发育与EGFP蛋白表达情况(图3)。结果表明,不同注射时间对于胚胎发育与EGFP蛋白表达影响较大。其中-0 h组对胚胎发育影响最小,但EGFP蛋白表达水平最低;而2 h、4 h与6 h组对胚胎发育影响较小,同时EGFP蛋白高水平表达(图3,A和B)。综合胚胎发育情况及EGFP蛋白表达水平,选择孤雌后2~6 h作为最佳注射时间。此外,观察发现胚胎在4-细胞期开始表达EGFP蛋白,在8-细胞期EGFP蛋白表达阳性胚胎比例达到最高。因此,在后续SOX2基因启动子活性检测研究中选择孤雌后72 h收集4-细胞和8-细胞胚胎进行检测(图3 C)。
图3
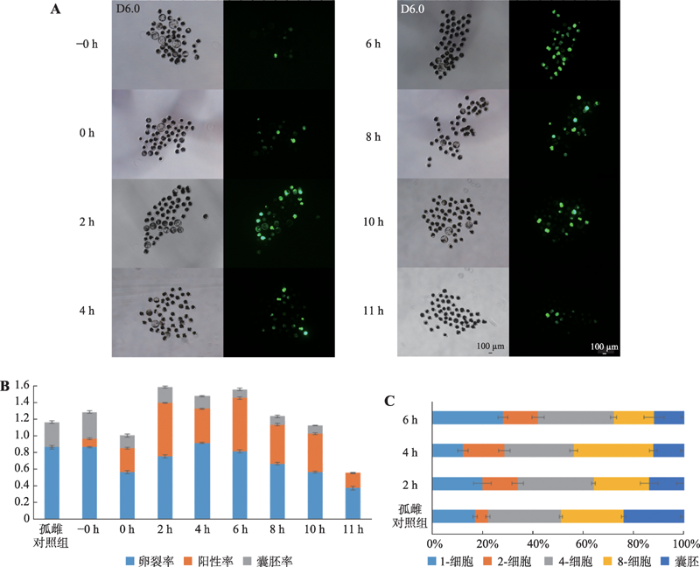 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3孤雌激活前后不同注射时间的荧光标记效果
A:分别在孤雌前(-0 h)和孤雌后0 h、2 h、4 h、6 h、8 h、10 h、11 h注射pEGFP-C1质粒,培养6 d后观察EGFP基因表达情况;B:各注射组胚胎EGFP基因表达阳性率及发育率统计;C:2 h、4 h和6 h注射组在培养6 d时间内胚胎各阶段发育情况统计。
Fig. 3The fluorescent labeling effects of different injection times of parthenogenetic activation
2.2 启动子结构预测分析与报告载体构建
本研究对猪SOX2基因翻译起始位点上游5000 bp序列进行转录因子结合位点预测分析。结果发现,该区域中转录因子结合位点成簇分布于4个区域,以与翻译起始位点的距离分别命名d1~d4(图4 A,表3)。针对4个结合位点簇分别设计并构建相应缺失的SOX2基因启动子报告载体,将构建的启动子片段分别命名为sox2 pro [1~4],构建的质粒分别命名为Sp1~4 (图4,B和C)。同时针对猪SOX2基因翻译起始位点上游5000 bp序列,与小鼠进行相似性比对分析,结果显示,序列相似点的排布近似斜率为1的直线,相似性为71% (图4 D)。因此,小鼠的相关研究结果在猪中具有一定参考价值。图4
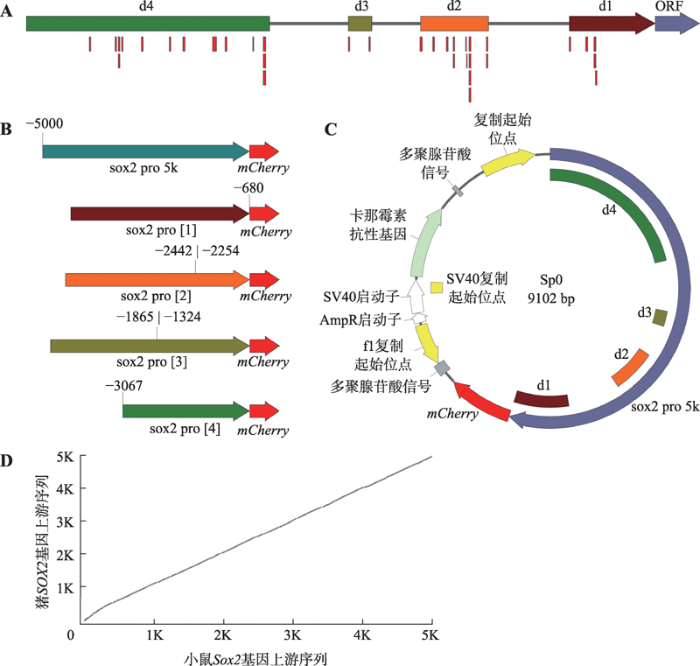 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4猪SOX2翻译起始位点上游5000 bp序列结构分析
A:猪SOX2基因翻译起始位点上游5000 bp序列预测的转录因子结合位点(红色条)以及4个转录因子结合位点成簇分布的区域d1~d4;B:猪SOX2基因翻译起始位点上游5000 bp全长启动子、4个转录因子结合位点成簇分布的区域d1~d4和构建的各区域缺失型启动子sox2 pro [1~4];C:SOX2基因启动子报告载体图谱;D:猪SOX2翻译起始位点上游5000 bp序列与小鼠对应序列相似性比较。
Fig. 4Sequence analysis of 5000 bp upstream of the porcine SOX2 translation initiation site
2.3 启动子活性检测
将质粒Sp0、Sp1、Sp2、Sp3、Sp4与内参质粒pEGFP-C1以4∶1的比例混合,终浓度为100 ng/μL。对猪胚胎进行注射并培养72 h,以检测mCherry以及EGFP蛋白的表达情况(图5 A)。结果显示,与Sp0注射组相比,Sp1注射组胚胎无法检测到mCherry蛋白信号;Sp3与Sp4注射组mCherry蛋白信号显著下降;而Sp2注射组胚胎mCherry蛋白水平与Sp0注射组无显著差异(图5 B)。进一步利用qRT-PCR对各组胚胎的mCherry基因相对表达量进行定量分析。结果显示,相对于Sp0注射组胚胎,各组胚胎mCherry基因相对表达量均有不同程度的下降,但与荧光检测结果不同的是,Sp3注射组胚胎mCherry基因的mRNA表达水平最低,仅为Sp0注射组的0.18(±0.0034) (图5 C)。据此推断,Sp3质粒中缺失的转录因子结合位点簇d3可能为SOX2基因启动子活性关键区域。根据转录因子结合位点预测结果,d3中仅包含两个NF-AT转录因子结合位点,推测NF-AT转录因子家族是调节猪早期胚胎中SOX2基因表达的关键转录因子。图5
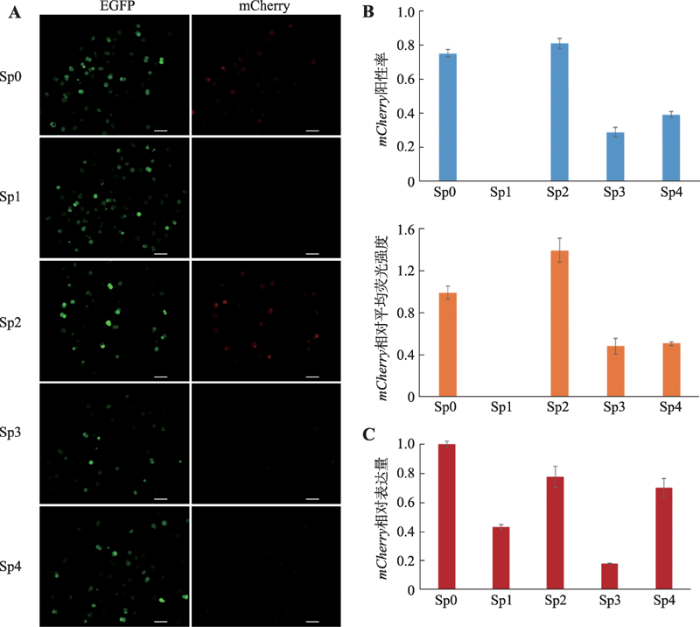 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5各启动子片段的活性分析
A:孤雌胚胎分别注射Sp0~4各组质粒并培养72 h后在荧光镜下观察EGFP和mCherry基因表达情况(Bar=100 μm);B:孤雌胚胎注射并培养72 h后各注射组mCherry基因表达统计;C:孤雌胚胎注射并培养72 h后qRT-PCR检测mCherry相对表达量。
Fig. 5Analysis of each promoter fragment activity
3 讨论
SOX2蛋白是哺乳动物早期胚胎发育中关键转录因子之一,对于SOX2基因上游调控网络的研究可以揭示早期胚胎发育中细胞命运决定、胚胎干细胞多能性维持等相关分子机制[21]。本研究通过对猪早期胚胎中SOX2基因启动子活性分析,发现NF-AT转录因子结合位点是4-细胞与8-细胞胚胎中调控SOX2基因表达的关键顺式调控元件。NF-AT是一个钙离子敏感的转录因子家族,在内皮细胞、骨骼肌细胞、平滑肌细胞和神经元等多种细胞中广泛表达[22]。但是NF-AT转录因子在早期胚胎发育中的作用功能尚不明确,同时NF-AT蛋白调控SOX2基因表达的相关研究尚未报道。因此,研究NF-AT转录因子对于猪早期胚胎发育的调控功能具有重要意义。对Sp1注射组的报告基因检测时发现,其蛋白水平与mRNA水平并不一致。在小鼠中,Sox2基因启动子无“TATA box”核心启动元件,而上游约60 bp处存在倒转的“CCAAT box”元件[23,24],该元件作为Sox2基因启动子的核心启动元件,转录因子NF-Y (nuclear factor-Y)可识别、结合“CCAAT box”并募集RNA聚合酶复合体,启动Sox2基因的转 录[25,26,27]。而Sp1质粒中sox2 pro [1]启动子片段缺失区域d1上存在预测的NF-Y结合位点,且与翻译起始位点的距离同小鼠类似,因此推测d1中包含核心启动元件以及转录起始位点。然而本研究结果显示,Sp1注射组中可以检测到报告基因的mRNA表达。据此推断,在SOX2基因启动子的其他区域中存在第二转录起始位点,由于sox2 pro[1]中并未破坏第二转录起始位点,导致该组中检测到报告基因的mRNA表达,但由于移码突变产生的无义蛋白不具有荧光特性,因此无法检测到报告基因蛋白。预测分析结果显示d2区域包括C/EBP (CCAAT-enhancer-binding protein)结合位点,而C/EBP转录因子家族具有募集RNA聚合酶复合体、启动转录的 能力[28,29,30],因此推测第二转录起始位点位于d2中。在后续研究中,本课题组将针对这两个潜在的转录起始位点进行分析,明确猪SOX2基因转录起始位点 特性。
根据上述结果以及相关分析,可以确定调控SOX2基因启动子的潜在关键因子包括NF-AT[31]、NF-Y[32]、C/EBP[33]和AP-2 rep (Krueppel-like factor 12) 4种转录因子[34]。Cao等[35]对猪早期胚胎发育表达模式进行分析,发现上述4种转录因子在早期胚胎发育中都有表达。其中,NF-Y和C/EBP转录因子可能与猪SOX2基因的转录起始相关;NF-AT转录因子可以增强SOX2基因启动子的启动活性;而AP-2 rep转录因子或对NF-AT转录因子的功能产生影响[36,37]。因此推断这4类转录因子是潜在调节SOX2基因表达的关键因子。
双萤光素酶检测系统[38]虽然是启动子活性检测的常规技术[39],然而受到早期胚胎样品收集困难以及细胞数低的制约,本研究无法采用双萤光素酶检测系统进行SOX2基因启动子活性评价。因此选择报告基因表达水平检测的方式评价启动子活性[40]。通过qRT-PCR检测报告基因mRNA的相对表达水平,避免蛋白降解周期对结果的干扰;利用内参质粒的表达水平检测,排除显微注射体系的系统误差;利用内源SOX2基因的表达水平检测,排除各组间因胚胎状态差异导致的误差,通过计算获得报告基因相对表达水平可以最高程度地体现相应启动子的转录活性。同时,本研究对胚胎显微注射条件进行探索,最终确定孤雌激活2~6 h进行显微注射可以在保证报告基因表达的前提下最小限度地影响胚胎发育。本研究技术体系可以更广泛地应用于猪早期胚胎中启动子活性的研究,筛选分析猪早期胚胎中相关基因调控元件,揭示猪早期胚胎发育特点。
综上所述,本研究利用报告基因表达检测的方法,以pEGFP-C1质粒为内参和启动子报告载体骨架,对孤雌后2~4 h胚胎注射,并在72 h后检测报告基因表达水平,评估启动子活性。分析猪SOX2基因翻译起始位点上游5000 bp,发现4个转录因子结合位点成簇分布的区域,类似于小鼠Sox2基因表达调控中超级增强子(super-enhancer)结构[41,42]。通过分析这4个区域对猪SOX2基因启动子活性的影响,发现存在NF-TA转录因子结合位点簇的关键区域,该区域的缺失导致SOX2基因启动子活性降低。本研究结果为猪SOX2基因启动子结构以及上游调控机制的研究提供了数据支持。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 1]

哺乳动物多能性因子, 主要包括Pou5f1/Oct4、Sox2、Klf4、Nanog等转录因子, 不仅能够维持胚胎干细胞的未分化状态, 同时也参与使分化细胞重编程回多能性状态的过程。目前对脊椎动物多能性因子在体(in vivo)功能研究报道极少。斑马鱼是研究脊椎动物早期发育分化的理想模型, 它能够为多能性相关因子的功能研究提供在体环境, 因而可以更准确地了解多能性因子的作用信息。近年来, 已在斑马鱼中发现了多种哺乳动物多能性因子的同源基因, 如oct4、nanog等。文章主要介绍了斑马鱼中多能性因子的相关研究进展, 并与其它动物中的研究作一比较。
Magsci [本文引用: 1]

哺乳动物多能性因子, 主要包括Pou5f1/Oct4、Sox2、Klf4、Nanog等转录因子, 不仅能够维持胚胎干细胞的未分化状态, 同时也参与使分化细胞重编程回多能性状态的过程。目前对脊椎动物多能性因子在体(in vivo)功能研究报道极少。斑马鱼是研究脊椎动物早期发育分化的理想模型, 它能够为多能性相关因子的功能研究提供在体环境, 因而可以更准确地了解多能性因子的作用信息。近年来, 已在斑马鱼中发现了多种哺乳动物多能性因子的同源基因, 如oct4、nanog等。文章主要介绍了斑马鱼中多能性因子的相关研究进展, 并与其它动物中的研究作一比较。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
