Online:2018-05-20

PDF (1439KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
贾豫, 徐荣刚, 孙锦, 倪建泉. 高效特异的CRISPR/dCas9转录激活系统——flySAM系统. 遗传[J], 2018, 40(5): 425-427 doi:

左起:贾豫(博士研究生),徐荣刚(博士研究生),孙锦(博士后),倪建泉(教授)
随着人类等物种的基因组计划的完成,关于基因组的研究已经从结构基因组学转向了功能基因组学。将基因组的序列信息转化为功能信息,解密生命的密码,完成基因组的功能注释对于全面理解生长发育、疾病衰老、学习记忆等过程具有重大意义。黑腹果蝇(Drosophila melanogaster)具有易于饲养、生命周期短、繁殖能力强、染色体简单等诸多优点,因此成为科研领域最为经典、最为重要的模式生物之一。更为重要的是,果蝇基因高度保守且与人类基因同源性高,80%以上果蝇基因与人类基因同源,60%以上人类致病基因都存在果蝇中。利用果蝇的遗传技术,可以方便地研究基因功能。据文献报道,许多重要基因编码的蛋白质(如polycomb、HP1等)和重要的细胞信号通路(如Hh、Toll等)就是首先在果蝇中发现,随后在其他模式动物和人类中被发现而且发挥同样功能。因此,果蝇上的研究成果可供对人类疾病的相关研究借鉴参考,同时还摆脱了伦理方面的限制。
研究基因的功能主要通过降低基因表达(loss- of-function, LOF)和增强基因表达(gain-of-function, GOF)来实现。对于LOF,本实验室在果蝇中开发并优化了基于CRISPR/Cas9系统的基因组定点编辑技术,构建了在生殖细胞中稳定表达Cas9的转基因果蝇品系,因此直接注射表达sgRNA的质粒就能实现果蝇体内高效的可遗传靶基因突变,该项研究成果分别于2013年11月19日和2014年11月6日发表在Proc Natl Acad Sci USA(doi: 10.1073/pnas. 1318481110)和Cell Reports(doi: 10.1016/j.celrep. 2014.09.044)。此外,果蝇中较为成熟的转基因RNAi技术,具有操作简单、适合大规模筛选、可实现在特定组织器官、发育阶段敲低目的基因表达等优点,是研究基因功能的重要手段。在三代转基因RNAi技术的基础上,本实验室成功开发了新一代的转基因RNAi技术,干扰效率高、特异性强、毒副作用小,能够高效地敲低各种基因,并且首次突破性实现了多个基因的同时干扰,该项技术已获得国家发明专利(专利号:ZL2014103107462.2)。相比于多样的LOF方法,GOF的手段在果蝇中的应用较为有限,主要通过在果蝇体内表达由外源载体携带的目的基因编码序列(cDNA),来实现特定基因的过量表达,但是其目的基因的克隆步骤繁琐,不能模拟基因自身的表达模式,尤其是对多剪切形式的基因,容易出现假阳性结果,而且不能同时过表达多个基因。更为重要的是,这种方式无法实现大规模的构建,阻碍了基因组范围的基因GOF的功能筛选。
CRISPR/Cas9基因编辑系统包括sgRNA和Cas9蛋白两个核心元件,sgRNA可以引导Cas9蛋白到达特定的靶标区域,Cas9具有核酸酶的作用,有两个负责切割DNA双链的结构域:HNH和RuvC,可以切割特定DNA双链。将这两个结构域定点突变(D10A和H480A)后形成dCas9(nuclease-null Cas9),dCas9仍然可以识别并结合双链DNA,但不对其进行切割。如果在dCas9的C端融合适当的转录激活结构域,在特定sgRNA的协助下,dCas9蛋白和转录激活结构域的复合物可以结合到目的基因的启动子区域,从而实现基因原位的转录激活。这种CRISPR/ dCas9转录激活系统仅需在dCas9转录激活复合物背景下,引入一个或几个sgRNA载体即可,因此适合大规模、高通量的操作,而且这种原位激活基因表达的模式更接近自身基因,受空间和时序调控。
为在果蝇体内开发CRISPR/dCas9介导的转录激活系统,本实验室首先在果蝇体内开发了采用dCas9-VPR的转录激活系统,将3个不同转录激活因子串联在dCas9上,在两个或两个以上sgRNA引导下,原位激活果蝇体内目的基因的表达并产生相应的表型,为果蝇体内GOF的研究提供了重要的技术支持。该方法于2017年8月发表于Proc Natl Acad Sci USA (doi: 10.1073/pnas.1707635114)。尽管这一系统可以激活目的基因转录而产生表型,但是其激活效果仍然较低,需要两个或两个以上sgRNA才能实现转录激活,增加了系统的成本和构建载体复杂性。另外,这个系统需要3个独立的元件,Gal4、UAS: dCas9-VPR和sgRNA,使用时需要复杂的遗传整合。
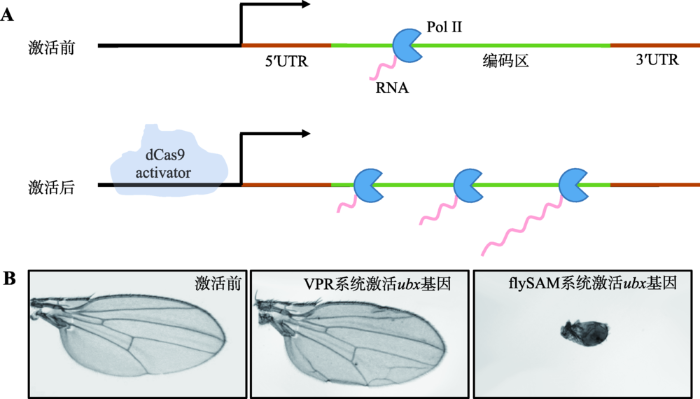
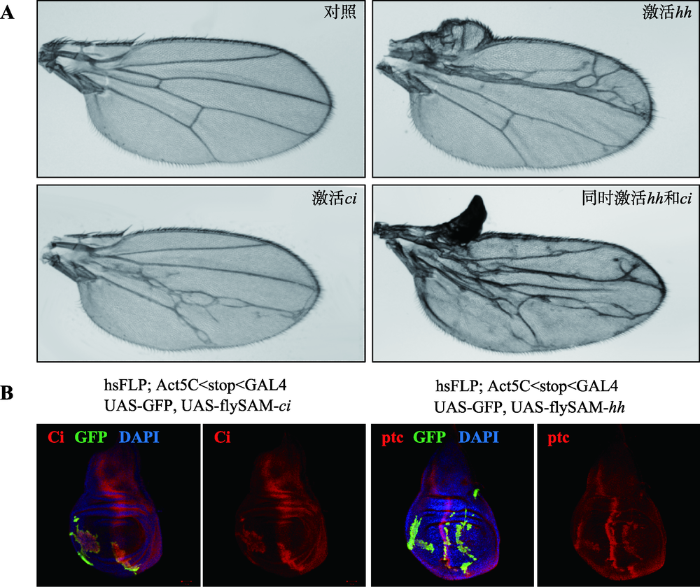
为解决上述问题并进一步提高激活效率,本实验室通过Gal4/UAS系统表达dCas9转录激活复合体,在Cas9的C端融合了转录激活结构域VP64,同时巧妙地利用T2A自剪切多肽介导dCas9-VP64和MCP-p65-HSF1两个转录激活结构域的表达,构建了flySAM系统。结果显示,该系统只需要一个sgRNA就可以特异高效地激活目的基因,产生比dCas9-VPR系统更强的表型(图1:A和B),且与传统UAS-cDNA的方式效率相当。此外,该系统还可以通过同时表达不同的sgRNA来激活多个基因的表达,首次实现了多基因同时显现表型,为研究蛋白质复合物以及功能冗余基因的功能提供了一套强有力的技术手段。与此同时,本实验室将flySAM系统的两个元件:UAS:dCas9-activator和sgRNA整合成为一个载体flySAM2.0。通过验证,flySAM2.0不仅具有flySAM系统的全部优点,而且由于dCas9和sgRNA在一个载体上,效率更高。注射该载体得到的转基因果蝇,只需一步杂交,例如与不同的Gal4工具果蝇进行一次遗传杂交就可以实现对目的基因的转录激活(图2),也可以调控多个基因并进行嵌合体分析(图3),比如一个组织中,只有部分细胞的基因被激活,用来研究基因被激活细胞和野生型细胞之间的相互作用。目前,以flySAM2.0系统为基础的基因组范围的转基因转录激活资源库正在构建中,这将是世界上第一个果蝇转基因过表达资源库,实现全基因组范围的GOF功能筛选,这一品系资源库将为整个果蝇研究领域提供重要的实验材料,推动整个研究领域的快速发展。研究成果于2018年5月1日在线发表于Proc Natl Acad Sci USA(doi:10. 1073/pnas.1800677115)。清华大学医学院倪建泉教授为本文的通讯作者,课题组贾豫博士、徐荣刚博士、孙锦博士后并列该文第一作者。该研究得到了国家自然科学基金(31571320)、国家科技支撑计划(2015BAI09B03)和政府间国际科技创新合作重点专项(2016YFE0113700)等项目的资助。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1flySAM系统激活方式与效果图
A:sgRNA引导dCas9转录激活因子到达目的基因的上游调控区域,大大提高了目的基因的转录;B:flySAM系统在翅膀中的工作效果, flySAM只需要一个sgRNA就可以特异高效地激活目的基因,并产生比dCas9-VPR系统更强的表型。
Fig. 1The mechanism and efficacy of flySAM
图2
 新窗口打开|下载原图ZIP|生成PPT
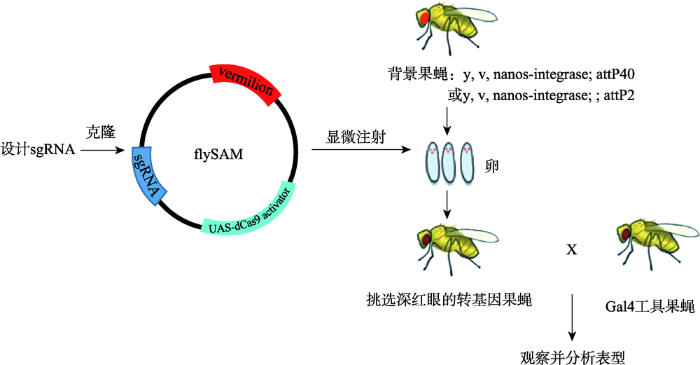
新窗口打开|下载原图ZIP|生成PPT图2flySAM系统构建与激活目的基因流程
首先,针对目的基因设计特异的sgRNA,并将其克隆到flySAM的载体。随后将载体显微注射到背景果蝇的卵中(2号染色体选择attp40,3号染色体选择attp2)。在果蝇羽化之后,挑选深红眼的转基因果蝇。最后通过与组织器官特异的Gal4工具果蝇杂交,观察并分析 表现。
Fig. 2The workflow of flySAM system
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3flySAM系统首次具有同时激活多个基因,构建多基因激活嵌合体的能力
A:flySAM系统同时激活hh和ci并产生相应的表型;B:利用FLP-out Gal4系统在三龄幼虫的翅膀discs中进行ci和hh的嵌合体分析。
Fig. 3flySAM system not only successfully activates multiple genes simultaneously, but also can easily generate mosaic
