0 引言
【研究意义】RNA干扰(RNAi)技术作为高效的反向遗传手段被广泛应用于昆虫学领域[1,2,3],近年来,随着研究工作的不断深入,利用RNAi技术进行害虫防治已成为植保领域的新型策略[4,5]。但在通过饲喂双链RNA(dsRNA)防治农业害虫飞蝗(Locusta migratoria)的过程中,发现虫体中肠内的双链RNA降解酶(dsRNA degrading enzyme,dsRNase)可快速降解dsRNA,导致RNAi效率极低[6]。因此,制备飞蝗dsRNase抗体,并对其进行组织定位,进而从蛋白水平阐释飞蝗dsRNA降解酶的生物学功能及分化机制,对RNAi技术在害虫防治中的应用具有重要的理论与实践意义。【前人研究进展】目前,已有很多证据表明dsRNA在进入细胞前保持完整性是保证RNAi效率的关键因素之一[7,8,9]。ARIMATSU等[10]在鳞翅目昆虫家蚕(Bombyx mori)肠液中纯化得到BmdsRNase蛋白,发现其具有降解dsRNA的活性;GARBUTT等[11]研究发现,烟草天蛾(Manduca sexta)RNAi效率低下的主要原因是虫体血淋巴可以快速降解dsRNA,进一步研究发现其中一个dsRNase在血淋巴和中肠中均表达,另外一个dsRNase只在中肠组织高表达;WYNANT等[12]在沙漠蝗(Schistocerca gregaria)中鉴定出4个肠道高表达的核酸酶基因,经RNAi初步研究表明,只有dsRNase 2具有降解dsRNA的活性;随后,SPIT等[13]在马铃薯甲虫(Leptinotarsa decemlineata)中也鉴定获得两个肠道高表达的dsRNase,同时沉默这两个dsRNase后,提高了饲喂dsRNA介导的RNAi效率;LUO等[14]在烟粉虱(Bemisia tabaci)中也发现存在两个dsRNase基因,一个在中肠高表达,另一个在全身均有表达,同时沉默这两个基因之后可提高烟粉虱的RNAi效率。由此可见,众多****把提高RNAi效率的研究重点聚焦在昆虫dsRNase的分子功能方面。【本研究切入点】虽然越来越多的昆虫双链RNA降解酶被报道,但大多集中于cDNA序列获取、mRNA水平的表达特性以及沉默该基因后对RNAi效率的影响,对其蛋白表达特性以及组织定位仅在家蚕中有报道[7,15]。笔者课题组针对飞蝗饲喂dsRNA干扰无效的分子机制开展了深入研究,发现飞蝗具有4个dsRNase基因,经qPCR检测发现,LmdsRNase2和LmdsRNase3在中肠组织高表达,进一步采用RNAi技术分析发现,LmdsRNase2可导致dsRNA在中肠快速降解,构成飞蝗饲喂dsRNA干扰无效的主要影响因素[6]。然而,LmdsRNase2和LmdsRNase3蛋白在昆虫中肠组织的定位以及表达还未见系统研究。【拟解决的关键问题】分别选取LmdsRNase2和LmdsRNase3特异的抗原序列区进行原核表达并制备多克隆抗体,随后对LmdsRNase2和LmdsRNase3进行组织定位与分析,为进一步阐明飞蝗dsRNA降解酶的功能分化提供蛋白水平的证据,促进RNAi技术在害虫防治中的应用。1 材料与方法
试验于2016—2017年在山西大学应用生物学研究所完成。1.1 材料和试剂
材料:供试飞蝗饲养于山西大学应用生物学研究所养虫室。温度28—30℃,光周期14 L:10 D,相对湿度15%—25%。取飞蝗5龄第3天中肠进行分析。试剂:pET-32a原核表达载体由实验室保存。限制性内切酶BamH I和Hind III购于美国New England Biolabs公司;Taq酶、T4连接酶、DNA Marker均购于TaKaRa公司;胶回收试剂盒、质粒提取试剂盒购于美国OMEGA公司;引物合成和测序由生工生物工程(上海)有限公司完成;IPTG购于索莱宝公司;His单克隆抗体购于美国Santa Cruz公司;羊抗鼠免疫球蛋白G和羊抗兔免疫球蛋白G购于北京中杉金桥公司;标准蛋白Marker和BCIP/NBT-AP显色试剂盒购于碧云天生物公司;SYTOX® Green nucleic acid stain荧光染料购于美国Thermo Fisher公司,驴抗兔Cy3荧光二抗购于美国Jackson ImmunoResearch公司。
1.2 抗原序列的选取以及原核表达载体的构建
用MEGA 5软件对LmdsRNase2和LmdsRNase3的氨基酸序列进行比对,找出差异序列并运用在线软件(http://web.expasy.org/compute_pi/)预测其分子量大小以及等电点等,进而选取特异的抗原序列(R2’和R3’)。LmdsRNase2和LmdsRNase3的编码区已在飞蝗中成功扩增并保存为Blunt-LmdsRNase2/3菌株,提取质粒作为模板。分别设计并合成R2’的正向引物CGCGGATCCGACGGGCAGTCG-TACGAC和R2’的反向引物CCCAAGCTTGCTACGGCGCAGCGTTCA CGTAC;R3’的正向引物CGCGGATCCCGCAAGAGC CTCCGCCGC和R3’的反向引物CCCAAGCTTGCTA GGCTC- CCGTGAGAGCTAC,其中酶切位点BamH I和Hind III用下划线表示,引入终止密码子用粗体标出。PCR扩增得到R2’和R3’抗原序列,用BamH I和Hind III双酶切后连接至pET-32a载体上,送至生工生物工程(上海)有限公司测序。
1.3 R2’/R3’的诱导表达及纯化
将测序正确的重组质粒pET-32a-R2’/R3’以及空载体pET-32a转化至BL21(DE3)感受态中,挑取单克隆,接种到3 mL带氨苄青霉素(50 µg·mL-1)的LB培养基中,37℃下200 r/min振荡培养至OD600为0.6—1,加入IPTG至终浓度为0.5 mmol·L-1,37℃下诱导4 h。12 000×g离心5 min收集菌体,用PBS缓冲液重悬菌体并加入蛋白酶抑制剂(phenylmethanesulfonyl fluoride,PMSF)进行超声破碎,裂解产物在4℃条件下12 000×g离心10 min,分离上清和沉淀。经12%的SDS-PAGE凝胶电泳后,用考马斯亮蓝染色检测。将检测可表达重组蛋白的菌株接种至1 L LB培养基中,采用优化条件进行诱导,8 000×g离心20 min收集菌体,加入Buffer I(20 mmol·L-1 pH 7.4的Tris-HCl缓冲液,10 mmol·L-1咪唑,0.5 mol·L-1 NaCl)进行吹悬,加入PMSF后超声破碎30 min。12 000×g离心30 min后留取沉淀,加入Buffer II(20 mmol·L-1 pH 7.4的Tris-HCl缓冲液,10 mmol·L-1 咪唑,0.5 mol·L-1 NaCl,0.5% Triton-100,0.2 mmol·L-1 EDTA)清洗3次,加入Buffer III(8 mol·L-1尿素,20 mmol·L-1 pH 8.0的Tris-HCl缓冲液,100 mmol·L-1 NaCl,5%甘油)吹悬沉淀后4℃振荡过夜。16 000×g离心30 min后收集上清并用0.45 μm的滤膜过滤。用GE公司的AKTA pure系统以及配套的HisPrep FF 16/20预装柱进行纯化。用Buffer III对柱子进行平衡,用Buffer III-10 mmol·L-1咪唑(Buffer III,10 mmol·L-1咪唑)以及Buffer III-500 mmol·L-1咪唑(Buffer III,500 mmol·L-1咪唑)进行连续梯度洗脱,收集洗脱液共10管(E1—E10),每管5 mL。洗脱组分通过SDS-PAGE检测。
1.4 抗体制备以及效价检测
多克隆抗体的制备以及效价检测委托北京华大蛋白质研发中心完成。取纯化后的目的蛋白400 μg,用生理盐水稀释至200—500 μL,与等体积的弗氏佐剂混合,充分混匀,形成油包水。选取2.0 kg左右的新西兰大白兔进行免疫,将混匀的油包水免疫原对其背部进行皮下注射,完成初次免疫。14 d及26 d后再分别进行一次加强免疫,免疫量为200 μg。36 d时,耳静脉取血检测效价,之后颈动脉取血,5 000×g离心10 min后,收取血清作为多克隆抗体。采用ELISA方法测定制备抗体的效价。包被液(Na2CO3-NaHCO3缓冲液,pH 9.6)稀释重组蛋白抗原至终浓度为2 μg·mL-1,从200倍开始用PBS缓冲液梯度稀释,设置PBS为空白对照,200倍PBS稀释的阴性血清为阴性对照,二抗为稀释20 000倍的山羊抗兔IgG/HRG,显色5 min后加50 μL终止液(2 mol·L-1 H2SO4)终止反应;双波长(450/630 nm)测吸光值。免疫前的血清为对照,其OD值为N;免疫后的血清OD值为P,当P/N≥2.1即认为是阳性[16,17]。
1.5 Western blot检测抗体的特异性
取飞蝗5龄第3天的虫体进行解剖,小心将中肠外面的液体用纸巾吸干,再将中肠内容物以及消化液移入离心管中,加入100 μL PBS缓冲液,16 000×g离心10 min后取上清即为中肠液,将中肠组织放入离心管中,加入PBS提取中肠蛋白。取Sf9细胞-杆状病毒系统表达的His-LmdsRNase2和3全长蛋白[6]作为阳性对照,使用Bradford法[18]测定蛋白浓度。制备12%的SDS-PAGE凝胶进行电泳,上样量为100 μg蛋白。采用湿转法[19]将蛋白转印至硝酸纤维素膜上(100 V,100 min)。用含5% w/v牛血清白蛋白(BSA)的TBST缓冲液(20 mmol·L-1 pH 7.4的Tris-HCl,150 mmol·L-1 NaCl,0.05% Tween-20)在室温下封闭2 h,然后与制备的R2和R3多克隆抗体以及His单克隆抗体4℃孵化过夜。TBST洗膜3次,每次10 min,将膜与碱性磷酸酶共价结合的羊抗兔或羊抗鼠免疫球蛋白G孵育1 h,TBST洗膜3次,每次10 min。使用BCIP/NBT-AP显色试剂盒进行显色。1.6 免疫组化进行组织定位分析
取飞蝗5龄第3天的虫体进行解剖,中肠组织用4%的多聚甲醛固定2 d后,制备石蜡切片,厚度为5 μm,方法参见LIU等[20]对中肠石蜡切片步骤的描述。切片经梯度酒精脱蜡后,用3%双氧水37℃处理10 min,0.01%柠檬酸缓冲液(pH 6.0)煮沸15 min后冷却。用10%羊血清37℃封闭30 min,分别滴加1:500和1:200稀释的R2和R3抗体,37℃孵育2 h。洗涤后滴加驴抗兔Cy3荧光二抗,避光37℃孵育1 h。PBS冲洗3次,每次5 min。滴加SYTOX® Green nucleic acid stain荧光染料(1:1 000稀释),37℃孵育10 min,冲洗,干燥,中性树胶封固后,采用LSM 880(Zeiss,Germany)激光共聚焦显微镜进行观察拍照,Cy3和SYTOX® Green荧光的激发波长分别为561和504 nm。2 结果
2.1 飞蝗LmdsRNase2和LmdsRNase3抗原序列的选取
运用MEGA 5软件对LmdsRNase2和LmdsRNase3(GenBank:ARW74135.1和ARW74134.1)进行比对后,采用GeneDoc软件作图,结果如图1所示。飞蝗LmdsRNase2和LmdsRNase3分别编码405和390个氨基酸,具有37%的序列一致性,仅在序列两端差异明显。图中黑色实线框为选取的LmdsRNase2抗原序列区R2’,以DGQS开始,NAAP结尾,共157个氨基酸残基;黑色虚线框为选取的LmdsRNase3抗原序列区R3’,以RKSL开始,LTGA结尾,共153个氨基酸残基。运用pI/Mw在线软件分析R2’和R3’的理论分子量,分别为17.0和16.8 kD,理论等电点为4.8和8.3。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1LmdsRNase2与LmdsRNase3比对获得特异性抗原序列黑色实线框Black solid box:LmdsRNase2抗原序列The sequences of R2’;黑色虚线框Black dotted box:LmdsRNase3抗原序列The sequences of R3’
-->Fig. 1The alignment of LmdsRNase2/3 and the specific antigen sequences
-->
2.2 pET-32a-R2’/R3’的构建及蛋白诱导表达
以实验室保存的Blunt-LmdsRNase2和LmdsRNase3菌株为模板,设计引物,PCR扩增得到的目的条带约为470 bp,将目的片段双酶切连接至线性化的pET-32a载体上,得到重组质粒pET-32a-R2’/R3’。重组质粒经BamH I和Hind III双酶切鉴定。结果如图2-A所示,pET-32a质粒全长为5 900 bp,R2’以及R3’条带也与图中相应条带位置一致(白色箭头所示),测序结果显示重组质粒构建成功。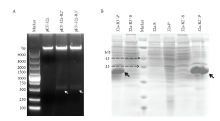 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2重组质粒双酶切鉴定以及目的蛋白的诱导表达检测 A:重组质粒的双酶切鉴定Recombinant plasmids digested with BamH I and Hind III;Marker:DNA分子量标准物 DNA standard size markers。B:目的蛋白诱导表达后SDS-PAGE电泳检测SDS-PAGE analysis of R2’/R3’ proteins induced with IPTG;Marker:标准蛋白Marker Protein standard size markers;32a/-R2’/-R3’-S:上清 Supernatant;32a/-R2’/-R3’-P:沉淀 Precipitate
-->Fig. 2Double digestion analysis of recombinant plasmids and the expression of target proteins
-->
将重组质粒转化至菌株BL21(DE3)中,用0.5 mmol·L-1的IPTG 37℃诱导4 h后提取蛋白,分离上清和沉淀,经SDS-PAE凝胶电泳检测,结果如图2-B所示。R2’和R3’片段均在包涵体中大量表达(黑色箭头所示)。R2’和R3’融合蛋白的理论分子量约为33 kD,图中箭头所示分子量大小符合预期。
2.3 目的蛋白的纯化
目的蛋白R2’以及R3’经扩大培养并诱导表达后,经亲和层析柱纯化后的组分通过12% SDS- PAGE凝胶电泳进行条带分析(图3-A),结果显示,R2’在E2组分中纯度最高,而R3’在E6组分中所获得的量虽较少,但纯度较高。为进一步制备抗原,将样品透析除盐后,检测R2’-E2和R3’-E6的蛋白浓度约为3和1 mg·mL-1,发现只有R2’的纯度达到85%以上(图3-B),故R3’样品进行胶纯化后再开展后续的免疫程序。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3纯化后目的蛋白的SDS-PAGE分析 A:纯化后的R2’/R3’蛋白SDS-PAGE电泳检测 SDS-PAGE analysis of purified protein R2’ and R3’;Marker:标准蛋白Marker Protein standard size markers;R2’/R3’-Bc:柱纯化前的粗蛋白组分 Before column fraction;R2’/R3’-Ft:未与柱结合的组分 Flow through column fraction;R2’/R3’-E1、E2……E6:含不同浓度咪唑的洗脱液对结合有目的蛋白进行洗脱的组分 Eluted fractions washed by different concentrations of imidazole;箭头指示为目的蛋白 The arrow points to the target protein。B:目的蛋白免疫兔子前SDS-PAGE电泳检测 SDS-PAGE analysis of R2’/R3’ proteins which were used for injection
-->Fig. 3The analysis of the purified R2’/R3’ proteins by SDS-PAGE
-->
2.4 抗体效价以及特异性检测
纯化后的R2’和R3’蛋白经两次免疫兔子之后获得多抗血清,用ELISA法对抗体效价进行检测,结果如表1所示,效价达到了1:102 400,显示抗体效果良好。为进一步检测抗体的特异性,取实验室保存的用杆状病毒-昆虫细胞表达系统异源表达的His-LmdsRNase2(R2)和His-LmdsRNase3(R3)全长蛋白作为对照。Western blot检测结果如图4-A所示,R2的抗体只能识别His-LmdsRNase2,大小与图4-B中His抗体检测到的His-LmdsRNase2大小一致,同样R3的抗体只能识别His-LmdsRNase3,抗体特异性良好。此外,提取飞蝗中肠组织蛋白和中肠液后,用R2的抗体检测,可见中肠中LmdsRNase2的表达,但有3条条带,而在中肠液中未检测到蛋白表达。用R3的抗体未检测到中肠和中肠液中LmdsRNase3的表达。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4Western blot检测LmdsRNase2和LmdsRNase3在飞蝗中肠中的表达 A:Western blot检测 LmdsRNase2/3 在飞蝗中肠中的表达 Western blot analysis of LmdsRNase2/3 expression level in L. migratoria midgut;Marker:标准蛋白Marker Protein standard size markers;Control:Sf9细胞裂解上清 Sf9 cells lysate;R2/R3:Sf9细胞中过表达的His-LmdsRNase2/3全长蛋白 Expressed His-LmdsRNase2/3 proteins by Sf9 cell;MG1/2:中肠组织蛋白 Total protein of L. migratoria midgut;MG-F1/2:中肠液 Midgut fluid。B:His抗体检测Sf9 细胞中过表达的His-LmdsRNase2/3 The detection of His-LmdsRNase2/3 by His-tag antibody
-->Fig. 4Western blot analysis of LmdsRNase2 and LmdsRNase3 expression level in L. migratoria midgut
-->
Table 1
表1
表1抗体效价检测
Table 1Detection of antibody titer
| 稀释倍数Dilution ratio | 200 | 400 | 800 | 1600 | 3200 | 6400 | 12800 | 25600 | 51200 | 102400 | 空白 Blank | 阴性Negative |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Anti-R2 | 1.275 | 1.267 | 1.268 | 1.243 | 1.236 | 1.231 | 1.186 | 1.127 | 0.973 | 0.802 | 0.016 | 0.068 |
| Anti-R3 | 1.537 | 1.553 | 1.515 | 1.529 | 1.501 | 1.406 | 1.387 | 1.292 | 1.151 | 0.92 | 0.041 | 0.052 |
| P/N | + | + | + | + | + | + | + | + | + | + | - | - |
新窗口打开
2.5 飞蝗LmdsRNase2和LmdsRNase3的组织定位
为进一步了解LmdsRNase2和LmdsRNase3在飞蝗中肠组织中的表达情况,利用免疫组化方法分析了其在中肠组织中的定位,结果如图5所示。二者均在中肠细胞质中表达,但LmdsRNase3的表达量明显低于LmdsRNase2。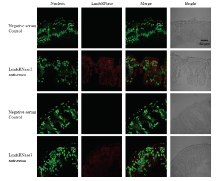 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5飞蝗LmdsRNase2和LmdsRNase3在中肠中的定位绿光指示的为细胞核 Green color indicates the cell nucleus:红光指示的为LmdsRNase2/3 Red color indicates LmdsRNase2/3;阴性血清作为对照Negative serum as the control
-->Fig. 5Localization of LmdsRNase2 and LmdsRNase3 in L. migratoria midgut
-->
3 讨论
RNAi技术自1998年首次在秀丽线虫(Caenorhaditis elegans)中报道[21],目前已广泛应用于多种生物的功能基因研究[22,23]。2007年,BAUM等将该技术应用于转基因玉米中,结果表明经过转基因表达dsV-ATPaseA的玉米植株可以显著抵抗玉米根叶甲(Diabrotica virgifera virgifera)对根部的侵害[24]。随后,由农作物介导表达dsRNA进行害虫防治的方法陆续在水稻(Oryza sativa)[25]、棉花(Anemone vitifolia)[26]、马铃薯(Solanum tuberosum)[27]等作物中得以研究报道。近年来,RNAi技术已被公认为是第4代杀虫剂的核心技术,基于RNAi的害虫防治已逐渐成为一种新型的害虫绿色防控策略[4,5]。但是,目前制约RNAi技术的主要因素是不同昆虫间RNAi效率差异明显,甚至同一种昆虫dsRNA导入方式不同也可导致RNAi效率不同,如飞蝗注射dsRNA后可以出现目的基因的显著沉默[28],但饲喂dsRNA却未出现基因沉默现象[29]。进一步研究发现,飞蝗有4个dsRNase基因,在mRNA水平上LmdsRNase2和LmdsRNase3均在中肠组织高表达[6]。本研究成功获得LmdsRNase2和LmdsRNase3的抗体,特异性良好(图4)。提取中肠组织蛋白和中肠液之后,用R2和R3的抗体分别检测LmdsRNase2和LmdsRNase3的蛋白表达水平,发现R2抗体在中肠组织中可以杂交到3条条带。ARIMATSU等[30]研究发现,在家蚕中肠组织中经分子筛分离得到3条条带,一条是45 kD的BmdsRNase前体,一条是43 kD的切除了信号肽的中间体,还有一条是41 kD的BmdsRNase成熟体。因此,笔者推测本文检测到的3条条带可能是飞蝗dsRNase2的不同剪切体。在中肠组织中并未检测到LmdsRNase3的表达,表明LmdsRNase3的表达量很低,这与笔者课题组前期的转录本检测结果一致,中肠组织中LmdsRNase2的表达丰度是LmdsRNase3的28倍[6]。同时,采用RNAi技术沉默LmdsRNase2后,中肠液不再降解dsRNA,而沉默LmdsRNase3后,中肠液依然可降解dsRNA;用杆状病毒-昆虫细胞表达系统异源表达的LmdsRNas2融合蛋白在体外可以快速降解dsRNA,而LmdsRNase3融合蛋白则不能降解dsRNA。这些结果均表明,在中肠液中发挥降解dsRNA功能并最终导致饲喂飞蝗dsRNA干扰无效的主要因子是LmdsRNase2[6]。本文的结果从蛋白层面为上述结果提供了有力的佐证。
此外,在飞蝗中肠液中未能检测到LmdsRNase2和LmdsRNase3蛋白,分析其原因,可能是分泌至中肠液中的LmdsRNase2蛋白占总蛋白量的比例低,而LmdsRNase3由于缺信号肽,推测可能未分泌到中肠液中。ARIMATSU等[10]从家蚕中肠液中分离提纯得到家蚕dsRNase并对其蛋白降解特性进行了研究,该实验提取了25 mL家蚕中肠液(总蛋白量93.5 mg)经多步纯化后得到了11 μg的dsRNase蛋白。而本研究中每个样品只提取了5头飞蝗的中肠液,总蛋白量只有约400 μg,按照家蚕中肠液中dsRNase的比例计算,用于检测的飞蝗中肠dsRNase仅0.05 μg,这可能是中肠液中抗体未检测到dsRNase的主要原因。目前国际上对昆虫dsRNase蛋白表达特性以及组织定位仅在家蚕中有报道,ARIMATSU等[15]用免疫组化的方法发现家蚕dsRNase定位于家蚕中肠细胞中。本研究中免疫组化分析结果可见,LmdsRNase2在中肠细胞中均有大量表达,而LmdsRNase3的表达量较低,这与家蚕中的报道一致。本研究制备得到的LmdsRNase2和LmdsRNase3的抗体可用于LmdsRNase2蛋白抑制剂的筛选或飞蝗两个中肠特异的核酸酶LmdsRNase2和LmdsRNase3的功能分化等研究,有助于对飞蝗饲喂dsRNA无效的分子机制进行深入解析,促进RNAi技术在飞蝗及其他害虫防治中的应用。
4 结论
成功获得飞蝗LmdsRNase2和LmdsRNase3的特异性抗体,进一步采用Western blot技术进行检测和免疫荧光分析。结果显示,LmdsRase2和LmdsRNase3均在飞蝗中肠细胞中表达,但LmdsRNase3表达量较低。据此分析,在飞蝗中肠中,LmdsRNase3蛋白表达丰度低是该酶不发挥降解dsRNA的另一主要原因。研究结果为解析飞蝗中肠LmdsRNase2和LmdsRNase3两个酶的功能分化提供了蛋白水平的证据。(责任编辑 岳梅)
The authors have declared that no competing interests exist.
