0 引言
【研究意义】桃小食心虫(Carposina sasakii)又叫桃蛀果蛾,简称“桃小”,属鳞翅目蛀果蛾科,我国除华南外,广布于其他地区,是最主要的果实害虫之一,寄主有苹果、梨、桃、李、杏、梅、枣、山楂等果树[1,2]。以幼虫蛀食果实危害,蛀入果内便很难进行药剂防治,导致果实腐烂脱落。据统计,生产上若防治不当,每年造成虫果率高达75%以上,损失高达数十亿元[3,4]。氯虫苯甲酰胺2010年在中国登记并使用,基于氯虫苯甲酰胺对天敌及非靶标生物安全、残留量低、对生态环境友好且与其他杀虫剂无交互抗性的优点,使其成为我国推广应用最早、使用量最大的防治大田作物和蔬菜害虫的二酰胺类杀虫剂,目前在防治桃小食心虫上也开始逐渐使用[5,6,7]。研究发现该类杀虫剂除了对鳞翅目幼虫具有高活性,还可以显著干扰鳞翅目昆虫的交配[8],通过对氯虫苯甲酰胺干扰桃小食心虫交配的转录组分析,可以进一步解析其干扰桃小食心虫的作用机制,进而提高药剂的使用效率。【前人研究进展】近年来,转录组测序技术极大促进了昆虫特别是无参考基因组信息昆虫的组学研究,对阐明昆虫对环境的适应性、昆虫生长、发育、繁殖、进化以及遗传机制等均具有重要意义[9]。在昆虫毒理学方向,国内外****通过转录组测序技术研究了昆虫对杀虫剂代谢、解毒及抗药性机制等,涉及不同种类杀虫剂如有机磷、菊酯类、二酰胺类、苯基吡唑类等,昆虫有疟蚊(Anopheles gambiae)、蝇(Bactrocera dorsalis)、灰飞虱(Laodelphax striatellus)、小菜蛾(Plutella xylostella)、玉米螟(Ostrinia furnacalis)等 [10,11,12,13,14,15,16]。ALFONSO-PARRA等分别通过转录组分析了埃及伊蚊(Aedes aegypti)和地中海实蝇(Ceratitis capitata)在生长发育、交配繁殖中的变化[17,18]。氯虫苯甲酰胺的靶标基因为昆虫鱼尼丁受体(ryanodine receptor,RyR),通过调节钙离子释放,引起肌肉收缩,最终导致害虫死亡[19]。桃小食心虫的求偶交配行为具有节律性,成虫多于下午16:00—20:00羽化,羽化当日便可交配[20]。大量研究表明,雌性产生、释放性激素和雄性接受性激素以及被吸引的行为都是由生物钟控制的,生物钟存在于嗅觉器官对嗅觉敏感的感受器基底上,嗅觉器官的化学受体在化学刺激的感知及识别过程中起了最重要的作用[21,22,23,24]。昆虫的求偶交配行为由此类化学感知所介导,昆虫在气味结合蛋白(OBPs)与气味受体相互作用中去寻求及选择配偶。【本研究切入点】然而,尚未见有关杀虫剂干扰昆虫交配的作用机制的报道。笔者通过药效试验发现,亚致死量氯虫苯甲酰胺对桃小食心虫交配具有明显干扰作用,以此为切入点,桃小食心虫经药剂处理后,通过靶标基因、昆虫交配节律基因及昆虫嗅觉相关基因的变化来开展氯虫苯甲酰胺干扰桃小食心虫的成虫交配的作用机制研究。【拟解决的关键问题】以Illumina HiseqTM2500高通量测序技术对桃小食心虫进行转录组测序研究,获得桃小食心虫的转录本和更为全面的转录组信息,揭示氯虫苯甲酰胺干扰桃小食心虫交配过程中氯虫苯甲酰胺、RyR、交配行为相关基因的相互作用。1 材料与方法
试验于2016—2017年在中国农业科学院果树研究所完成。1.1 试虫来源及饲养
供试虫源采自中国农业科学院果树研究所(辽宁兴城,40.61°N,120.73°E),用未成熟不接触任何杀虫剂的金冠苹果在室温(25±1)℃,相对湿度(70±5)%,光周期L:D=15:9的条件下连续继代饲养备用。1.2 氯虫苯甲酰胺干扰桃小食心虫交配的生物学测定
用微型喷雾器将1 mL 10 mg·L-1氯虫苯甲酰胺(原药由中国农业科学院植物保护研究所馈赠)药液(0.5‰的曲拉通为溶剂)均匀喷洒在每个养虫缸(直径13 cm,高15 cm)内壁及盖子,待养虫缸内壁及盖子干燥后,每缸引入刚羽化的桃小食心虫雌雄虫5对;以0.5%的曲拉通溶液为空白对照。每缸引入成虫后置于黑暗环境(进入黑暗环境4—6 h进入交尾高峰期[20])。自进入黑暗环境2 h后,在0.3 lx的红光灯下观察7 h,记录交配情况、寿命及雌虫产卵量和孵化率[3]。每30对为1次重复,各处理3次重复。用于转录组测序的桃小食心虫处理方法同上,每重复15—20缸,取样分为6组:刚羽化的雌雄虫分别为T1和T2组;羽化后进入黑暗环境4—6 h到达交配高峰期的雌雄虫分别为T3和T4组;羽化后置于10 mg·L-1氯虫苯甲酰胺环境并进入黑暗4—6 h的雌雄虫分别为T5和T6组。每处理取虫20—30头,每处理3次重复,经液氮速冻后转移至-80℃冰箱以备RNA提取。
1.3 RNA提取、cDNA文库构建和Illumina测序
用TRIzol试剂(Invitrogen)分别提取18组冻存的桃小食心虫总RNA,质量检验合格后备用。cDNA文库的建立及测序工作由百迈客有限公司(北京)完成,采用Illumina HiSeq2500TM系统进行测序。1.4 转录组测序数据组装及分析
测序完成后获得原始reads,于http://www. biocloud.net/进行无参转录组分析。采用Trinity v2.3.0软件首先将测序reads打断为较短的片段(K-mer),然后将这些小片段延伸成较长的片段(contig),并利用这些片段之间的重叠,得到片段集合(component),最后利用De Bruijn图的方法和测序read信息,在各个片段集合中分别识别转录本序列,拼接得到的序列称之为unigene。使用Blast2go软件将拼接的unigene与NCBI的NR(非冗余蛋白质数据库)、Swiss-Prot(蛋白质注释信息数据库)、GO(Gene Ontology)、COG(Clusters of Orthologous Groups)、KOG(euKaryotic Orthologous Groups)、KEGG(KyotoEncyclopedia of Genes and Genomes)数据库比对。使用KOBAS2.0得到Unigene在KEGG中的KEGG Orthology结果,预测完unigene的氨基酸序列之后使用HMMER软件与Pfam数据库比对,获得unigene的注释信息。采用Bowtie将测序得到的reads与unigene库进行比对,根据比对结果,结合RSEM进行表达量水平估计,利用FPKM(fragments per kilobase per million reads)值表示对应unigene的表达丰度。根据试验设计,使用EBSeq进行差异表达分析,将FDR(false discovery rate)<0.05且差异倍数FC(fold change)≥2作为筛选标准,获得两个样品之间的差异表达基因集[25]。并对差异基因进行GO功能富集和KEGG代谢通路信息分析。1.5 氯虫苯甲酰胺靶标基因RyR、桃小食心虫转录组差异基因的鉴定及表达分析
根据1.2的设计方法,分别分析药剂处理前后雌虫(比较T1与T3、T1与T5、T3与T5的差异,分别为I、III、V)和雄虫(比较T2与T4、T2与T6、T4与T6的差异,分别为II、IV、VI)及药剂导致的雌雄虫的所有差异基因。筛选与解毒代谢酶羧酸酯酶、细胞色素P450及谷胱甘肽转移酶相关的基因,以及与昆虫交配及生物钟相关的基因。根据已报道的桃小食心虫鱼尼丁受体基因序列(GenBank登录号:KJ135037)进行比对,鉴别本研究转录组中的RyR基因,并根据功能注释鉴别差异基因中与肌肉收缩相关的其他蛋白。按照1.2的处理方法,分别提取桃小食心虫0 h(刚羽化)、2、4、6、8、12和28 h(未交配的成虫第2次进入求偶交配高峰期)成虫的总RNA,分别取500 ng RNA合成cDNA第一链(TaKaRa,大连)。每样品重复3次,以18S作为内标参比基因,各基因引物见表1。试验于CFX96 Real-Time System(BioRad)仪上进行,反应体系为25 μL:2×SYBR Premix Ex TaqⅡ(TliRNaseH Plus)12.5 μL,10 μmol·L-1正反向各引物0.4 μL,1 μL稀释10倍的cDNA,ddH2O 10.7 μL。反应程序:95℃ 30 s;95℃ 5 s,55℃ 30 s,72℃ 30 s,45个循环。用2-ΔΔCt法统计所筛选基因在氯虫苯甲酰胺处理后不同时间的表达量差异[26]。
Table 1
表1
表1qRT-PCR基因及引物
Table 1Genes and the primers of qRT-PCR
| 基因ID Gene ID | 引物序列F Primer sequence (5′-3′) | 引物序列R Primer sequence (5′-3′) |
|---|---|---|
| 18S (c49500.graph_c0) | CAGTGATGGGATGAGTGCTT | CCTTCCTTGGATGTGGTAGC |
| RyR (c64662.graph_c0) | TAGCCCCAGTTTTCAGGAGA | AGATTGGTCAGCAACACAGC |
| c51998.graph_c0 | CGACGCTGAACTTGACCTGA | TCCATTTACGGCCACTGATT |
| c64262.graph_c0 | CTCAGCGTATTCGTGCCATT | CGAGATAGTCAGGTCCGTAA |
| c54944.graph_c0 | GACCTCTTTGGAACGCTGAC | CTCCGTAGTGAAGCCGATAA |
| c57480.graph_c0 | CGGCTTTTACCGATGTTCAC | AAGGCTTCGCATCAGAGGTT |
| c53794.graph_c0 | AGGCTTCTAGCTTCTTCCC | GTATCTTCGCAGTATTGTCG |
| c40709.graph_c0 | CGACTCCTTGAGACACCTAT | CTTTCTGGCAAATACTCGGT |
| c53281.graph_c0 | CGCCGCCATAATAACAAACT | CAATCCTCCACAACCTCACG |
| c47942.graph_c0 | CGGTTACATCCCCACCTCCA | TCCTAATCGCCCGTCATCAT |
| c12249.graph_c0 | GATCTCCACCATCCTCAACAC | GCTTCAGCATCTTCCTCTTCT |
| c46002.graph_c0 | ACAACCGCTCTGGCAGTATC | CTTCCGCATCTTCTTCAACG |
| c60883.graph_c0 | GCGAACAAATGGGGCGTAAC | CGCTTCCTCTTTCAGGTGGT |
| c45675.graph_c0 | TGCGATGACTAGAGCACAACT | ACACTGCGATCCTCCACAAAT |
新窗口打开
2 结果
2.1 氯虫苯甲酰胺对桃小食心虫交配、寿命及繁殖的影响
由表2可知,10 mg·L-1氯虫苯甲酰胺处理桃小食心虫后,交配率降低43.4%,雌雄虫寿命分别缩短1.5 d和1.7 d,单雌产卵量与对照相比减少133粒,后代卵的孵化率由84.3%降至56.6%。可见,氯虫苯甲酰胺对桃小食心虫的交配率、寿命、单雌产卵量和后代卵的孵化率均产生抑制作用。Table 2
表2
表2氯虫苯甲酰胺对桃小食心虫交配、寿命及繁殖的影响
Table 2Effects of chlorantraniliprole on the mating, longevity and fecundity of C. sasakii
| 处理 Treatment | 交配率 Mating rate (%) | 寿命Longevity (d) | 单雌产卵量(粒/雌) Number of eggs laid per female | 后代卵孵化率 Egg hatchability of offspring (%) | |
|---|---|---|---|---|---|
| 雌虫 Female | 雄虫 Male | ||||
| 对照 Control | 87.8 | 7.4±0.2b | 8.6±0.2a | 221±17 | 84.3 |
| 10 mg·L-1 氯虫苯甲酰胺 10 mg·L-1 Chlorantraniliprole | 44.4 | 5.9±0.3c | 6.9±0.6b | 88±10 | 56.6 |
| χ2=26.1292 | P<0.05 | t=5.1664 P=0.0001 | χ2=10.5495 | ||
| P=0 | P=0.00116 | ||||
新窗口打开
2.2 桃小食心虫转录组组装
氯虫苯甲酰胺处理组和对照组桃小食心虫成虫的18个转录组测序结果表明,原始数据(NCBI SRA数据库,登录号:SRP143636)去除其中的接头序列、污染序列及低质量reads,共得到147.64 Gb Clean Data (NCBI TSA数据库,登录号:GGMY00000000),各样品Q30碱基百分比均≥88.43%。最终对所得Clean Data进行拼接共得到225 969条transcript和102 831条unigene,transcript与unigene的N50分别为2 744和1 378 bp,transcript与unigene的平均长度分别为1 408和704 bp。表3所示,长度>1 000 bp的unigene有16 421条,占全部unigene的15.97%。可见,本研究中18组转录组测序结果的组装完整性较高,组装结果和统计结果表明能够进行后续生物信息学分析。Table 3
表3
表3桃小食心虫转录组测序组装结果统计
Table 3Statistics of the de novo assembly of C. sasakii transcriptome
| 长度范围 Length range (bp) | 转录本数量 Transcripts number | 基因数量 Unigenes number |
|---|---|---|
| 200-300 | 53847 (23.83%) | 45349 (44.10%) |
| 300-500 | 38611 (17.09%) | 25528 (24.83%) |
| 500-1000 | 38851 (17.19%) | 15533 (15.11%) |
| 1000-2000 | 41213 (18.24%) | 8366 (8.14%) |
| 2000+ | 53447 (23.65%) | 8055 (7.83%) |
| 总量 Total number | 225969 | 102831 |
| 总长度Total length | 318091653 | 72388878 |
| N50长度 N50 length | 2744 | 1378 |
| 平均长度Mean length | 1408 | 704 |
新窗口打开
2.3 功能注释及序列特征
将组装得到的102 831个unigene序列与NR、Swiss-Prot、GO、COG、KOG、KEGG和Pfam数据库比对,通过选择BLAST参数E-value≤1e-5和HMMER参数E-value≤1e-10,最终获得34 526个有注释信息的unigene(表4),占总unigene数的33.58%。由表4可以明确看出,eggNOG数据库注释成功的unigene数量最多,占总unigene数的31.70%,其后依次是NR、Pfam、KOG、Swiss-Prot、GO、COG和KEGG,分别占总unigene数的24.31%、22.33%、20.52%、14.52%、13.39%、11.92%和11.50%。根据序列同源性比对,在NR数据库中,与家蚕(Bombyx mori)和帝王蝶(Danau splexippus)同源的基因较多,分别为6 221个和4 814个。Table 4
表4
表4Unigene注释统计表
Table 4Annotation of unigene
| 注释数据库 Annotated database | 注释数量 Annotated number | 300 nt≤长度<1000 nt 300 nt≤length<1000 nt | 长度≥1000 nt Length≥1000 nt |
|---|---|---|---|
| COG_Annotation | 12262 | 4326 | 4524 |
| GO_Annotation | 13766 | 4211 | 6660 |
| KEGG_Annotation | 11828 | 4104 | 5130 |
| KOG_Annotation | 21101 | 6844 | 8509 |
| Pfam_Annotation | 22964 | 7842 | 10015 |
| Swissprot_Annotation | 14933 | 4670 | 7488 |
| eggNOG_Annotation | 32602 | 10916 | 11749 |
| nr_Annotation | 25002 | 8179 | 11863 |
| All_Annotated | 34526 | 11746 | 12161 |
新窗口打开
2.4 氯虫苯甲酰胺影响桃小交配的差异基因及功能注释
根据筛选标准,两两比较药剂对雌雄虫的差异基因,结果如图1所示。分析发现,氯虫苯甲酰胺处理过程中,雌雄虫中分别有122个和147个基因发生变化,共有234个基因发生变化,同时在雌雄体内存在的有31个差异基因。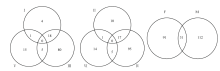 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1氯虫苯甲酰胺干扰桃小食心虫交配过程中雌雄虫分别存在的差异表达基因韦恩图I:T1与T3相比存在的差异基因Different unigenes between T1 & T3;III:T1与T5相比存在的差异基因Different unigenes between T1 & T5;V:T3与T5相比存在的差异基因Different unigenes between T3 & T5;II:T2与T4相比存在的差异基因Different unigenes between T2 & T4;IV:T2与T6相比存在的差异基因Different unigenes between T2 & T6;VI:T4与T6相比存在的差异基因Different unigenes between T4 & T6;F:雌虫间的差异基因Different genes in female;M:雄虫间的差异基因Different genes in male
-->Fig. 1Venn diagram of the differentially expressed unigenes in C. sasakii transcriptome during mating period
-->
对氯虫苯甲酰胺干扰桃小交配的所有差异基因进行功能注释和富集分析,GO分类结果如图2所示,共将其分为3大类,分别是分子功能(molecular function)、细胞组分(cellular component)和生物学过程(biological process),主要描述了基因产物可能行使的分子功能,以及所处的细胞环境和参与的生物学过程,分别分8小类、8小类和14小类。其中分子功能过程中的催化活性和结合及生物学过程中的代谢过程、单一生物体过程和细胞过程5类占主导地位。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2差异表达基因GO功能分类图 M1:催化活性Catalytic activity;M2:结合Binding;M3:运输活性Transporter activity;M4:结构分子活性Structural molecule activity;M5:电子载体Electron carrier activity;M6:受体活性Receptor activity;M7:核酸结合转录因子Nucleic acid binding transcription factor activity;M8:分子转导活性Molecular transducer activity;C1:细胞Cell;C2:细胞组分Cell part;C3:膜Membrane;C4:细胞器Organelle;C5:膜部分Membrane part;C6:细胞外区域Extracellular region;C7:细胞外区域部分Organelle part;C8:高分子复合物Macromolecular complex;B1:代谢过程Metabolic process;B2:单一生物体过程Single-organism process;B3:细胞过程Cellular process;B4:定位Localization;B5:多细胞器进程Multicellular organismal process;B6:生长过程Developmental process;B7:生物调控Biological regulation;B8:刺激响应Response to stimulus;B9:细胞组分及起源Cellular component organization or biogenesis;B10:繁殖Reproduction;B11:信号Signaling;B12:复制Reproductive process;B13:多有机体过程Multi-organism process;B14:移动 Locomotion
-->Fig. 2Go function classification of differentially expressed genes
-->
KEGG分类结果显示,富集到30个KEGG途径,其中富集到代谢通路的最多,有25个,分别为嘌呤代谢、酪氨酸代谢、磷酸戊糖途径、碳代谢、氨基酸生物合成、氨糖和核糖代谢、赖氨酸降解、昆虫激素合成、药物代谢、脂肪酸合成、代谢及降解等;遗传信息过程的剪接体、环境信息过程的MAPK信号途径-飞行Jak-STAT信号途径、FOXO信号途径和细胞过程的内噬作用。
2.5 RyR基因及差异基因的鉴定
经过BLASTx分析,鉴定转录组中c64662. graph_c0为桃小食心虫RyR,其长度为15 637 bp,与已报道桃小食心虫CsRyR的一致性为99.0%。根据Pfam、Swissprot和NR数据库的功能注释,分别鉴定到羧酸酯酶unigene 3个(c51998.graph_c0、c64262. graph_c0、c54944.graph_c0)、细胞色素P450 unigene 4个(c57480.graph_c0、c53794.graph_c0、c40709. graph_c0、c53281.graph_c0)、肌钙蛋白unigene 3个(c47942.graph_c0、c12249.graph_c0、c46002. graph_c0)、气味结合蛋白unigene 1个(c45675. graph_c0)和生物钟unigene 1个(c60883.graph_c0)。并且根据KEGG代谢途径分析,c40709.graph_c0为昆虫激素生物合成途径中的重要基因。2.6 差异表达基因的qRT-PCR分析
据转录组中的count及FPKM值分析,羽化后4—6 h,雌虫有17个基因上调,9个下调;雄虫有16个上调,12个下调。但氯虫苯甲酰胺处理组与刚羽化的处女蛾相比,雌雄虫上调基因分别为33个和32个,下调基因为69个和82个。然而,与4—6 h的对照比,雌虫中16个基因上调,5个下调,而雄虫中只存在20个下调基因。根据2.5中靶基因和差异基因鉴定,分析氯虫苯甲酰胺处理前后,13个基因的表达变化,如图3所示,基因在雌雄虫中的表达均出现不同变化趋势。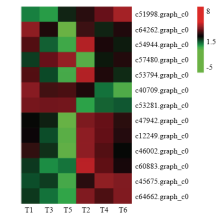 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3靶基因和差异基因表达热图
-->Fig. 3Heat map of RyR and 12 DEGs genes expression
-->
qRT-PCR结果显示,氯虫苯甲酰胺处理过程中,12个差异基因及靶标基因RyR均表现不同的变化趋势(图4)。3个羧酸酯酶家族基因雄虫中的表达量均显著高于雌虫,且氯虫苯甲酰胺诱导c51998.graph_c0基因上调,对雄虫c64262.graph_c0的表达变化不明显,雌虫中c64262.graph_c0略有下调。进入暗期后,氯虫苯甲酰胺显著地刺激c54944.graph_c0下调。氯虫苯甲酰胺对桃小食心虫成虫细胞色素P450 unigene未表现出相同的作用趋势,药剂处理后,雌雄虫的c57480.graph_c0和c53794.graph_c0表达分别呈现显著的上调和下调变化,而c40709.graph_c0基因仅在雄虫中显著下调,处理6 h后c53281.graph_c0只在雌虫中表达上调。氯虫苯甲酰胺处理后3个肌钙蛋白基因(c47942.graph_c0、c12249.graph_c0、c46002.graph_c0)在整个试验阶段均表现明显的下调趋势,且雄虫中的表达也高于雌虫。经过暗期进入光照时即12 h时,c54944.graph_c0的表达由暗期的下调转为上调,雄虫中的生物钟基因c60883.graph_c0在交替环境下也发生了相似的变化。并且雄虫中的c60883.graph_c0表达量是雌虫的2.58倍。同样气味结合蛋白unigene c45675.graph_c0雄虫中的表达是雌虫的6.07倍,雌虫体内该基因表达较为稳定,而进入暗期后该基因在雄虫体内立即上调,从黑暗转至光照环境后,表达则迅速下调,再进入暗期其表达仍上调,但受氯虫苯甲酰胺的抑制。
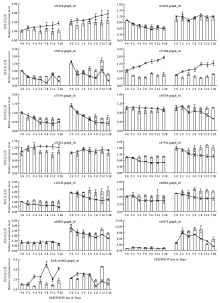 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4靶标基因及差异基因的qRT-PCR相对表达水平柱状图:对照;折线:氯虫苯甲酰胺处理
-->Fig. 4Relative expression level of RyR and some DEGs by qRT-PCR Histogram: Control blank; Line chart: treatment with chlorantraniliprole
-->
3 讨论
3.1 桃小食心虫响应氯虫苯甲酰胺的转录组差异表达基因的GO富集
通过GO功能注释,桃小食心虫到达求偶高峰期时所有差异表达基因主要富集至催化活性、结合、代谢过程、单一生物体过程和细胞过程。崔丽[27]研究发现二酰胺药剂氟苯虫酰胺处理玉米螟幼虫后,信号基因略有增加,与结构分子活性及蛋白结合转录因子活性相关的基因数量减少。小菜蛾抗氯虫苯甲酰胺种群转录组的结果显示主要富集至结合、催化活性、细胞组分、细胞、代谢过程和细胞过程等[12]。烟粉虱抗噻虫嗪种群转录组GO富集与小菜蛾极为相似[28]。SHI等[29]研究表明,亚致死浓度噻虫嗪使蜜蜂转录组基因主要富集至细胞组分、生物学过程和代谢过程。蠕虫对有机磷杀虫剂抗性品系中,雌雄转录组在GO功能注释也与其他研究相似[30]。昆虫发育过程研究发现,未成熟的地中海实蝇雌蝇unigene GO功能富集于生物学过程的发育、生长调节、形态发生、神经系统发育和激活、对刺激物的响应、运动、卵形成和免疫效应过程,而打破成熟期时富集于脂肪、糖及氨基酸的代谢过程、激素及信息素的合成与调控、以及对化学刺激的感知[18]。雄蝇则从免疫效应响应、肌肉收缩和飞行行为的过程转至富集到以代谢和生物合成过程,如激素及信息素的合成与调控、免疫响应过程为主[18]。桃小食心虫求偶交配时,首先雄虫通过短距离飞翔或者迅速爬行来引诱雌虫,而后活动减少,雌虫开始短距离飞行振翅后静止,翘翅,尾端向上。此时雄虫再次飞行,寻找翘翅的雌虫即成一字型交配[20]。可见求偶交配行为与桃小食心虫雌雄成虫转录组基因富集的GO功能差异存在必然联系,氯虫苯甲酰胺干扰桃小食心虫交配的作用机制或许更为复杂,还有待深入研究。3.2 桃小食心虫响应氯虫苯甲酰胺的转录组差异表达基因的KEGG富集
LIN等[12]研究发现,小菜蛾与氯虫苯甲酰胺抗性相关的KEGG通路主要为嘌呤代谢、肌肉收缩、药物代谢、Ca2+信号通路、细胞色素P450代谢等。本研究尽管未发现与Ca2+信号及肌肉收缩相关的途径,但发现了可以调节肌肉收缩的肌动蛋白。可能由于处理时间较短、桃小食心虫接触到的药剂较少引起。此外,在其余差异基因中,参与KEGG途径最多的为嘌呤代谢,有研究发现嘌呤代谢与能量代谢也存在直接关系,并有研究表明昆虫飞行过程中能量代谢最活跃的组织是飞行肌[31]。而氯虫苯甲酰胺作用于昆虫RyR,Ca2+浓度升高,继而引起肌肉的收缩反应[32]。故氯虫苯甲酰胺处理后,桃小食心虫成虫的飞行肌收缩,飞行能量降低,导致求偶行为受阻。基于KEGG数据库进一步了解氯虫苯甲酰胺干扰桃小食心虫交配的相关基因的功能联系及其参与的生物学通路,分析发现12个差异基因中,1个富集到了昆虫激素生物合成途径,该基因为细胞色素P450 c40709.graph_c0,是蜕皮激素20E生物合成过程中相关的5个Halloween基因之一,为调控蜕皮激素合成的最后一个基因[33,34]。研究发现,球菜夜蛾(Agrotis ipsilon)20E可影响雄虫对雌虫所发出的性信息素的应答,增加或减少交配行为[35]。故推测氯虫苯甲酰胺导致c40709.graph_c0的表达量下调致使雄虫对雌虫的性信息素应答行为减弱,干扰其交配。
3.3 氯虫苯甲酰胺干扰桃小食心虫交配中差异基因表达分析
笔者前期研究发现,氯虫苯甲酰胺处理小菜蛾幼虫和甜菜夜蛾细胞后,RyR表达量上调;而小菜蛾和甜菜夜蛾细胞由氯虫苯甲酰胺环境转至无药环境后,RyR表达量又降低[36,37]。与之不同的是,经氯虫苯甲酰胺处理后,雌虫中RyR的表达量显著上调,而雄虫中在第一个黑暗期的表达量变化不明显,再经历第一个交配高峰期后,氯虫苯甲酰胺处理的雄虫RyR表达量显著下调。LIN等[12]通过分析对氯虫苯甲酰胺具有抗性的小菜蛾转录组发现,RyR表达量降低。二酰胺类化合物NK130102和氟苯虫酰胺导致亚洲玉米螟鱼尼丁受体基因的表达量分别上调3.7和4.2倍。并发现钙信号通路中的部分基因以及与肌肉收缩相关的一些基因(如Ca2+ATPase、肌球蛋白、肌动蛋白、M-线蛋白等)的表达量也明显上调2.5—30倍[27]。与本研究略有差异,本研究发现3个与肌肉收缩相关的肌钙蛋白表达量均下调。氯虫苯甲酰胺处理后,基因在相同的时间表现不同的变化趋势,可能与昆虫求偶交配的高峰期持续时间不同有关。timeless为生物钟基因之一,桃小食心虫的求偶交配行为具有明显的昼夜节律。美国俄勒冈州立大学的研究发现,昆虫因其生物钟使其在一天的特定时间对农药更具易感性[38]。本研究结果表明,氯虫苯甲酰胺处理后雄虫的timeless基因下调是该类药剂干扰桃小食心虫交配的影响因素之一。杀虫剂对昆虫的作用机制研究中,大多研究发现抗性品系中或者亚致死剂量胁迫后,昆虫解毒酶、代谢酶如CYP、CCE和GST的表达上调,CSPs、卵黄蛋白、防御素等表达下调[10-15,23-25,39]。经氯虫苯甲酰胺胁迫的桃小食心虫雄虫触角酯酶c54944.graph_c0基因和气味结合蛋白c45675.graph_c0均发生相同变化。而昆虫的任何一种生理现象,都由多个基因或者各个信号通路之间互作才能完成。氯虫苯甲酰胺干扰桃小食心虫的交配,RyR、CYP314A1、OBP、timeless等基因是如何相互作用的?要阐明此机制,还需更深入的研究。
4 结论
通过转录组测序发现氯虫苯甲酰胺干扰桃小食心虫交配的作用机制是由靶标基因、嗅觉相关基因、代谢基因、生物钟基因等相互作用引起的,然而仍需增加这些基因的功能及互作研究才可进一步探析氯虫苯甲酰胺干扰桃小食心虫交配的作用机制。(责任编辑 岳梅)
The authors have declared that no competing interests exist.
