0 引言
【研究意义】植物bZIP类转录因子参与植物的生长发育、激素信号、抗病性及抗逆性等多种生物过程[1]。bZIP基因的启动子序列包含多种胁迫响应相关的顺式作用元件,可与胁迫应答基因启动子的顺式作用元件结合,从而作出调节反应。通过突变和转基因技术创造bZIP突变体,明确bZIP转录因子对植物抗病性的调控机理,有助于通过基因工程手段提高植物的抗病性。【前人研究进展】高温、干旱、盐害等逆境胁迫及细菌和病毒入侵均导致内质网中未/错折叠蛋白积累,产生内质网应激(ER stress)。植物中已知3类ER应激感知因子:RNA剪切因子IRE1、膜相关的亮氨酸拉链bZIP转录因子和NAC转录因子。拟南芥在发生应激时,细胞首先启动未折叠蛋白应答(unfolded protein response,UPR)。通过bZIP28途径启动UPR信号,上调分子伴侣(BiP、PDI、CAM)促进蛋白折叠;通过bZIP60途径持续UPR,且bZIP60能通过调控NAC103放大UPR信号;通过IRE1依赖性降解(regulated IRE1α-dependent degradation,RIDD)途径降解分泌蛋白的mRNA,控制蛋白合成[2,3,4,5,6]。不能正确折叠的蛋白进入内质网相关降解(ER-associated degradation,ERAD)途径被降解。目前,bZIP28是最清楚的非生物胁迫响应通路[7,8,9,10],bZIP60在细菌、病毒侵染胁迫响应中发挥作用[11,12,13]。UPR是细胞检测到内质网中的未/错误折叠蛋白而作出的适应性反应。但持续过强的胁迫会引起细胞程序性死亡(programmed cell death,PCD),通过bZIP28/bZIP60调控NAC089通路,激活下游的PCD基因(NAC094、MC5、BAG6),主动杀死一些感染细胞而保护其他细胞[14,15,16]。PCD作为生物体的防御保护机制,其最终结果是细胞凋亡。显然,寄主细胞的过早死亡不利于病毒复制和建立持续感染,因此病毒会利用寄主的UPR,抑制PCD,建立一种在存活细胞中复制病毒蛋白的平衡关系。如马铃薯X病毒(Potato virus X,PVX)侵染本氏烟(Nicotiana benthamiana)3 d,UPR基因(BiP、bZIP60和SKP1)转录水平提高3倍,过表达BiP能缓解内质网应激相关的PCD症状[17];水稻黑条矮缩病毒(Rice black-streaked dwarf virus,RBSDV)侵染本氏烟原生质体2 d,诱导BiP、bZIP60、PDI、CAM表达上调2.5—3.5倍[18];大蒜X病毒(Garlic virus X,GarVX)侵染本氏烟3 d,诱导bZIP60和BiP表达上调9.5—10.6倍,且产生与UPR相关的PCD[19];烟草花叶病毒(Tobacco mosaic virus,TMV)和黄瓜花叶病毒(Cucumber mosaic virus,CMV)侵染本氏烟2 d,内质网应激相关的UPR基因BiP、PDI、CAM、bZIP28、bZIP60及PCD基因NAC089显著上调[20,21]。上述研究显示内质网应激相关的UPR及其PCD是植物响应病毒侵染胁迫的信号。【本研究切入点】前期研究表明,转录因子NbbZIP28其前体蛋白定位于内质网膜,去跨膜域(transmembrane domain,TMD)及其后的C端序列的截短蛋白定位于细胞核。本氏烟接种TMV或CMV后2 d,NbbZIP28的转录水平显著提高。NbbZIP28沉默导致UPR相关基因的表达显著被抑制,病毒的积累量显著提高[21]。显示NbbZIP28为病毒侵染胁迫下的内质网应激因子,但病毒对NbbZIP28的诱导激活及其在病毒侵染中的调控作用仍需验证。CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats)是一种由RNA指导的Cas9核酸酶对靶基因进行编辑的技术,用这一系统来定点敲除植物的一些基因,便于研究这些基因的生物学功能[22]。【拟解决的关键问题】为验证UPR因子NbbZIP28对病毒侵染胁迫的响应机制,基于CRISPR/Cas9技术创建NbbZIP28基因敲除突变体,植株接种病毒后采用qRT-PCR检测病毒外壳蛋白(coat protein,CP)基因和寄主UPR基因的表达,用Western blot检测融合蛋白NbbZIP28-GFP的水解激活,揭示NbbZIP28通过上调UPR信号和提高寄主防卫反应而抑制病毒侵染增殖的作用。1 材料与方法
试验于2015—2017年在中国农业科学院烟草研究所病毒实验室完成。1.1 材料
1.1.1 菌株与质粒 供试毒株CMV-IB株系、TMV-GFP侵染性克隆、NbbZIP28-GFP由笔者实验室保存;pORE-Cas9质粒由西南大学夏庆友老师惠赠[23];供试大肠杆菌DH5α购自北京全式金生物技术有限公司;供试农杆菌LBA4404购自北京博迈德生物技术有限公司;供试本氏烟在温室育苗盆中播种,26℃,16 h光照/8 h黑暗条件下培养至4—5叶期备用。1.1.2 试剂与引物 PCR产物胶回收试剂盒、质粒小提试剂盒和RNA提取试剂盒购自北京全式金生物技术有限公司;In-Fusion PCR Cloning Kits、RNA反转录试剂盒和一步法荧光定量PCR试剂盒购自大连TaKaRa公司;蛋白提取试剂盒购自Solarbio公司。
1.2 方法
1.2.1 sgRNA表达载体的构建及转化农杆菌[24] 根据NbbZIP28基因序列(GenBank登录号:KX457971)设计并合成一对sgRNA寡聚核苷酸单链DNA,序列如表1,于PCR仪上退火延伸成DNA双链,反应体系:5×Annealing Buffer for DNA Oligos 10 μL,上下游引物各10 μL,Nuclease-Free Water 20 μL。反应程序:95℃ 2 min,充分变性;然后每8 s下降0.1℃,降至25℃;4℃保存。用Bsa І酶切表达载体pORE-Cas9,酶切产物凝胶回收,获得线性化表达载体。将退火的sgRNA经T4连接酶连接入线性化表达载体[23],反应体系:退火的双链DNA 2 μL,酶切产物5 μL,10×T4 DNA Ligase Buffer 2 μL,T4 DNA Ligase 1 μL,Nuclease-Free Water 10 μL。连接产物转化感受态细胞DH5α,菌液涂板(卡那霉素抗性)培养过夜。挑取单克隆为模板,以载体上的引物JC-F和靶位点的下游引物bZIP28-R(序列见表1)进行菌落PCR,1%琼脂糖凝胶电泳检测后测序验证。序列正确的克隆,提取质粒并转化农杆菌LBA4404,筛选阳性菌。Table 1
表1
表1本研究所用引物序列
Table 1Sequences of primers used in this study
| 引物名称 Primer name | 引物序列 Primer sequence | |
|---|---|---|
| sgRNA | bZIP28-F bZIP28-R | GATTGCAGATCAAGGAAAAATCGA AAACTCGATTTTTCCTTGATCTGC |
| 阳性克隆检测 Positive clone detection | JC-F bZIP28-R | TTAGGTTTACCCGCCAATA AAACTCGATTTTTCCTTGATCTGC |
| 阳性植株检测 Positive plant detection | mbZIP28-F mbZIP28-R | TCTGAAGCGGCAAATCCCAC TCAGTTGATTCCCAGGTAGA |
新窗口打开
1.2.2 遗传转化烟草及转基因植株检测 将测序正确的农杆菌菌液扩繁,离心收集菌体,用MS0重悬菌体,加入终浓度为20 μmol·L-1的乙酰丁香酮(AS)。无菌条件下侵染本氏烟叶盘,将被侵染的叶盘置于含有NAA、6-BA和卡那霉素的MS培养基上,筛选阳性小芽,将其移栽到含50 mg·L-1 Kan的培养基上进行生根培养。取叶片组织提取基因组DNA,以引物mbZIP28-F/R(表1)扩增靶位点上下游共400 bp的片断,将扩增片断连接到pEASY-T1载体上,挑取单克隆测序并分析突变位点。T0代阳性植株经套袋留种、检测,收获T3代。与野生型比较,记录发芽率、生育期和植株生物学性状。
1.2.3 突变体对病毒侵染胁迫的敏感性及对UPR信号的调控 4—5叶期突变体和野生型盆栽苗,分别于2片展开叶上浸润或摩擦接种TMV-GFP。于紫外灯下观察病毒的初侵染和系统扩展症状。摩擦接种CMV-IB后0 h(未接种)、12、24、48 h取接种叶(每株仅取同叶位一片,每时间点3—4次重复)提取RNA,反转录成cDNA,采用qRT-PCR检测UPR基因BiP、PDI、CAM、NF-YC2的表达;5—7 d检测接种叶中病毒CP的表达。以Actin为内参,以各时间点上野生型中基因的Ct值为标准1,采用2-△△C计算突变体中基因的相对RQ值[20,21]。
1.2.4 序列比对分析NbbZIP28 用在线搜索工具PlantCARE(http://bioinformatics.psb.ugent.be/ webtools/ plantcare/html/)在NbbZIP28启动子区域寻找可能存在的顺式作用调节元件[25,26]。根据拟南芥AtbZIP28序列中bZIP和TMD结构域、S1P和S2P酶切位点,比对分析烟草NbbZIP28序列中的功能位点[8]。
1.2.5 病毒侵染对NbbZIP28水解激活的诱导 为明确病毒侵染对NbbZIP28水解激活的诱导,提前24 h摩擦接种TMV,提前48 h接种CMV,对照组接种无菌水,然后在接种叶上浸润转染NbbZIP28-GFP。48 h后提取转染叶全蛋白进行Western blot检测[20]。植物全蛋白提取采用Solarbio试剂盒。保持上样蛋白浓度一致,进行聚丙烯酰胺凝胶电泳和转膜。取出PVDF膜封闭1 h,一抗(Anti-GFP antibody-ChIP Grade ab290)按1﹕2 000稀释,4℃过夜孵育,二抗(Goat Anti-Rabbit IgG H&L (HRP) ab205718)按1﹕5 000稀释,室温孵育1 h。用TBST缓冲液洗膜后置于化学发光成像分析仪中,滴入600 μL ECL发光液(SuperSignal West Pico Trial Kit),进行化学发光拍照。
2 结果
2.1 NbbZIP28基因敲除突变体的创建
表达载体pORE-Cas9经Bsa І酶切产生线性化表达载体后,与目的基因NbbZIP28的sgRNA片段连接,电泳检测到450 bp的目的片段,显示sgRNA表达载体构建成功(图1-A)。测序结果显示插入目的片段中含有靶位点20 bp的核苷酸序列,表明sgRNA成功连接到pORE-Cas9/gRNA载体中(图1-B)。采用农杆菌介导的植物转化技术,获得了9株T0代阳性转化苗。以阳性苗基因组DNA为模板,用mbZIP28-F/R引物扩增含有NbbZIP28的靶位点片段,电泳结果显示预期大小的400 bp片段,表明NbbZIP28敲除载体已成功转入到烟草植株中(图1-C)。测序显示Cas9蛋白预期切割区域丢失10个碱基(图1-D),导致翻译错误、蛋白功能变化。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1NbbZIP28基因敲除突变体的创建
A:NbbZIP28目的片断连接表达载体PCR电泳图 Clone of 450 bp sgRNA for link action;B:表达载体构建测序结果(红色碱基为靶位点序列)Sequence of vector construction (red base is target sequence);C:转基因植株DNA水平上的鉴定(1—5:转基因植株;6、7:野生型)Identification of transgenic plants by genomic PCR (1-5: Transgenic plant; 6, 7: Wild type);D:突变体对比野生型丢失10个碱基 The mutant lose 10 bases compared with wild type
-->Fig. 1The construction of knockout mutant of NbbZIP28 by CRISPR/Cas9
-->
测序筛选至T3代纯合转基因植株,命名为mNbbZIP28。采用无菌土播种培养至现蕾期,突变体与野生型种子的发芽率和植株表型无显著差异。说明NbbZIP28突变未导致可见的植株生物学性状变化,转录因子NbbZIP28可能在植物的抗逆反应中发挥作用。
2.2 突变体mNbbZIP28对病毒侵染胁迫的敏感性
突变体mNbbZIP28与野生型(WT)植株浸润接种TMV-GFP后4 d,紫外灯下统计显示突变体植株的浸润斑绿色荧光显著明亮于野生型植株,第5—6天病毒扩展至上部叶片,扩展速度显著快于野生型植株。摩擦接种TMV-GFP后4 d,突变体植株接种叶上的初侵染点显著多于野生型植株;第5天病毒扩展至上部新叶,扩展速度显著快于野生型植株;到第8天新叶上布满病毒,差异逐渐缩小(图2)。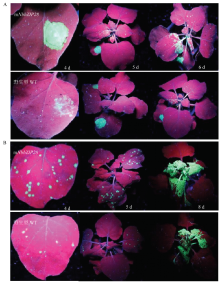 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2突变体和野生型植株浸润(A)或摩擦(B)接种TMV-GFP的症状
-->Fig. 2The symptom of TMV-GFP by infiltrate- (A) or rub-inoculation (B) on mNbbZIP28 and wild type
-->
摩擦接种CMV后4—6 d,突变体mNbbZIP28植株接种叶和新叶上的花叶和卷曲症状较野生型植株明显严重,第8天两者的花叶症状均更加明显,但随后差异逐渐缩小(图3-A)。qRT-PCR检测5—7 d接种叶中病毒含量,突变体中CMV的积累量显著高于野生型(图3-B)。上述结果同之前沉默植株上的表现相同,即与野生型相比,沉默或敲除NbbZIP28后植株对病毒的敏感性上升,说明在病毒侵染早期,NbbZIP28有提高寄主基础防卫反应,抑制和延缓病毒侵染的作用。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3突变体和野生型植株接种CMV的症状(A)及接种叶中病毒RNA相对含量(B)
-->Fig. 3The symptom of inoculation CMV (A) and mRNA accumulation levels (B) in mNbbZIP28 or wild type
-->
2.3 NbbZIP28对病毒诱导的UPR途径的调控
野生型和突变体mNbbZIP28接种CMV后0 h(未接种)、12、24、48 h,以野生型为对照,采用qRT-PCR检测突变体中UPR基因NF-YC2、BiP、CAM、PDI的表达。将mNbbZIP28植株各时间点基因的转录水平分别与野生型植株相应时间点做比较,结果显示不接种病毒0 h时,相对于野生型中各基因的表达,突变体中NF-YC2、BiP、CAM、PDI的表达量分别为1.021、1.037、1.038、0.997,野生型和突变体中各UPR基因的表达量在不接种0 h时无显著差异。接种后12 h,突变体中NbbZIP28的下游基因NF-YC2的表达量显著低于野生型,说明NbbZIP28突变后抑制了下游NF-YC2的转录;此外,BiP、CAM、PDI的转录水平在12 h均被极显著抑制,随后24—48 h逐渐恢复,甚至显著提高,PDI在48 h的表达极显著提高(图4)。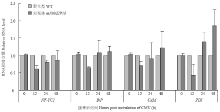 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4敲除NbZIP28对CMV引起的UPR相关基因表达的影响
Actin为内参基因
-->Fig. 4Knock-out NbbZIP28 responses to the expression of UPR-related genes upon CMV infection stress
Actin used as the internal reference gene
-->
2.4 NbbZIP28的序列分析及病毒侵染诱导NbbZIP28水解
NbbZIP28启动子序列经分析,其中包含5个参与热应激反应的顺式作用元件(heat stress response element,HSE)、3个参与低温反应的顺式作用元件(low temperature response element,LTR)、1个参与防卫和应激反应的顺式作用元件(TC-rich repeats),见表2。这些胁迫相关的顺式作用元件可能调节bZIP28在胁迫条件下的表达。例如,NbbZIP28的启动子中含有防卫和应激反应的顺式作用元件,因此病毒侵染诱导NbbZIP28上调表达,基因敲除突变体对病毒的敏感性上升。Table 2
表2
表2NbbZIP28启动子区域参与应激反应的顺式作用元件
Table 2Stress-related cis-acting regulatory elements identified in the promoter region of NbbZIP28
| 位点名称 Site name | 物种 Species | 位置 Position (bp) | 链 Strand | 矩阵得分 Matrix score | 序列 Sequence | 功能 Function |
|---|---|---|---|---|---|---|
| HSE | 芸苔 Brassica oleracea | 77 | - | 9 | AAAAAATTTC | 参与热应激反应的顺式作用元件 Cis-acting element involved in heat stress responsiveness |
| 1166 | + | 9 | AAAAAATTTC | |||
| 292 | - | 10 | AAAAAATTTC | |||
| 251 | - | 9 | AAAAAATTTC | |||
| 802 | - | 10 | AAAAAATTTC | |||
| LTR | 大麦 Hordeum vulgare | 268 | - | 6 | CCGAAA | 参与低温反应的顺式作用元件 Cis-acting element involved in low-temperature responsiveness |
| 300 | - | 6 | CCGAAA | |||
| 902 | - | 6 | CCGAAA | |||
| TC-rich repeats | 烟草 Nicotiana tabacum | 1239 | + | 9 | ATTTTCTTCA | 参与防御和应激反应的顺式作用元件 Cis-acting element involved in defense and stress responsiveness |
新窗口打开
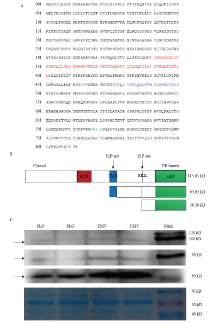
NbbZIP28的结构分析显示,朝向胞质的N端含bZIP结构域,朝向ER腔的C端含TMD结构域。存在S1P识别区(RRIL)、VASI序列和螺旋断裂G残基以及参与Sar1b绑定和Golgi移位的成对赖氨酸(图5-A)。预示烟草NbbZIP28与AtbZIP28具有相同的水解激活和移位机制。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5NbbZIP28的结构及Western blot检测病毒侵染激活NbbZIP28-GFP
A:红色表示bZIP结构域;橙色表示参与Sar1b绑定和Golgi移位的成对赖氨酸;蓝色表示TMD;下划线表示其内的VASI序列和螺旋断裂G残基;绿色表示S1P识别区(RRIL) The amino acid sequence of bZIP domain (red), paired lysines involved in Sar1b binding and Golgi re-localization (orange), the TMD (blue) in which the VASI sequence and helix-breaking G residue (both underlined), the locations of the canonical S1P recognition site (RRIL) region in the lumenal domain (green);B:NbbZIP28-GFP融合蛋白结构 The structure of fusion protein NbbZIP28-GFP;C:病毒侵染促进NbbZIP28-GFP水解激活 Virus infection promotes the hydrolyzation of NbbZIP28-GFP
-->Fig. 5Map of NbbZIP28 and Western blot analysis of the processing of NbbZIP28-GFP by virus infection
-->
野生型本氏烟植株分别摩擦接种H2O 24 h、H2O 48 h、TMV 24 h、CMV 48 h,在接种叶上浸润融合蛋白NbbZIP28-GFP(图5-B)后48 h,Western blot检测显示融合蛋白NbbZIP28-GFP的条带大小约为115.61 kD。接种H2O、TMV或CMV后,一条约63.03 kD的条带和一条约36.30 kD的条带被诱导,其分子质量分别与S1P和S2P位点水解产生的条带大小相对应。与H2O处理相比,TMV或CMV处理的条带显著清晰(图5-C),表明相对于机械摩擦无菌水,TMV或CMV侵染显著促进了NbbZIP28的水解激活。
3 讨论
NbbZIP28基因敲除突变体对病毒的敏感性与沉默植株的表现相同,即沉默或敲除NbbZIP28后,在早期病毒的积累量显著高于野生型,后期无显著差异。这显示NbbZIP28为植物抵抗病毒侵染胁迫的早期防卫信号,具有抑制和延缓病毒扩展的作用。那么内质网应激因子NbbZIP28是如何负调控病毒侵染和增殖的?首先,NbbZIP28为植物bZIP家族成员,其N末端有保守的bZIP结构域,也是DNA结合区,C末端的转录调控区保守性较低,含有跨膜域(TMD)和核定位(NLSs);具有参与Sar1b绑定和Golgi移位的成对的赖氨酸,以及S1P识别区(RRIL)。预测NbbZIP28具有与AtbZIP28相同的激活转移机制,即应激时前体蛋白脱离内质网膜转移至Golgi,经S1P和S2P蛋白酶裂解,产生活性形式进入细胞核发挥作用。前期研究表明NbbZIP28-GFP定位在内质网上,去掉跨膜区及其后C端序列的NbbZIP28∆C-GFP定位在细胞核内[21]。这一结果在本文的研究中进一步得到证实,即TMV或CMV侵染,诱导全长的NbbZIP28- GFP在S1P和S2P蛋白酶位点发生裂解,产生约63.03和36.30 kD的两条带。但尚未证实NbbZIP28转移至Golgi的过程,通过顺面高尔基体小泡Marker(ERD2- GFP)及反面高尔基体Marker(ST-GFP)与RFP- NbbZIP28蛋白的共定位可以验证。
其次,病毒侵染后检测UPR基因的表达,发现与野生型相比,突变体中UPR基因(BiP、PDI、CAM、NF-YC2)的表达在侵染前期12 h显著被抑制。BiP、PDI、CAM的表达在24—48 h逐渐恢复甚至提高。这与之前沉默植株上的表现一致,即病毒侵染前期12 h,NbbZIP28沉默或敲除导致UPR基因的表达显著被抑制,显示NbbZIP28是UPR途径的正调控因子;但BiP、CAM、PDI的这种转录抑制在后期逐渐恢复,甚至提高,暗示还有其他的UPR途径补充NbbZIP28的作用,NbbZIP28不是唯一的UPR调控因子。这一结果与拟南芥中衣霉素诱导BiP在2—4 h上调表达、在bZIP28突变体中先被抑制后逐渐恢复的趋势[27]相一致。这一现象说明基因的功能可能为:病毒侵染复制产生的大量病毒蛋白导致内质网应激,寄主细胞首先启动UPR防卫反应,上调伴侣蛋白的表达,抑制病毒蛋白的复制。但NbbZIP28并非寄主的抗病毒基因,不能持续抑制病毒的复制和转运。相反,病毒会利用寄主的UPR,最终建立一种在存活细胞中复制病毒蛋白的平衡关系。显然,病毒在特定宿主内调节和利用UPR的能力强烈影响其致病力,阐释这一机制是控制病毒侵染与致病的关键。
此外,研究表明bZIP家族转录因子与植物的抗病和逆境胁迫应答密切相关。目前,信号转导通路研究较清楚的是拟南芥,AtbZIP17响应高盐胁迫,能提高植物的耐盐性[27];AtbZIP60响应内质网应激诱导剂衣霉素或二硫苏糖醇及高温胁迫[4];AtbZIP28除被内质网应激诱导剂诱导外,还在42℃高温胁迫响应和激素信号转导中起调控作用[27]。作物中的研究则集中于抗病和抗逆[28],例如,烟草NtbZIP60是精胺信号的重要原件,抑制野火病菌侵染[11];水稻OsbZIP23能提高幼苗的耐盐性和抗旱性[29];玉米ZmbZIP72能提高作物对盐害的耐受能力;ZmbZIP28能响应圆斑病菌胁迫并提高作物抗性[10]。谷子在干旱或盐害胁迫时,有近1/2或1/3的bZIP基因的表达量发生显著变化,其中盐胁迫诱导SibZIP28下调表达[30]。NbbZIP28启动子序列包括热应激响应元件(HSE)、低温响应元件(LTR)、防御和应激响应元件(TC-rich repeats);且NbbZIP28基因沉默或敲除引起了对病毒敏感性的上升,普通烟中也存在同源基因NtbZIP28,因此后期可以做过表达分析,即完整验证基因的功能,也有望利用植物bZIP转录因子提高寄主基础抗病性。
4 结论
通过CRISPR/Cas9技术和烟草遗传转染获得NbbZIP28敲除突变体。正常生长条件下,突变体与野生型无显著差异,但对TMV或CMV侵染胁迫的敏感性上升,病毒诱导的UPR基因表达被抑制。TMV或CMV侵染诱导NbbZIP28-GFP在S1P和S2P蛋白酶位点发生裂解。内质网应激因子NbbZIP28在病毒侵染早期能激活UPR信号以提高寄主防卫反应,从而延缓病毒的侵染和增殖。The authors have declared that no competing interests exist.
