0 引言
【研究意义】葡萄(Vitis vinifera L.)属于葡萄科葡萄属浆果,是中国第二大栽培果树,可以广泛应用于酿酒、鲜食、制汁、制干[1]等工艺。在鲜食葡萄中,无核化已经成为消费者最喜爱的特性之一。无核葡萄果汁丰富,含糖量高,食用方便,品质优良,深受广大消费者喜爱。在发达国家,消费的鲜食和制干葡萄超过50%为无核葡萄[2,3]。在中国,新疆是葡萄主产区,且大部分是无核葡萄品种[4],无核葡萄育种成为葡萄育种的主要目标之一。在无核葡萄育种过程中,使用最多的是常规杂交育种,通常使用有核品种做母本,无核品种做父本的杂交组合[5]。但是常规杂交育种周期长、后代选育率低,极大阻碍了无核葡萄的育种进程。近几年,分子标记的不断发展,给无核葡萄选育提供了便利[6,7]。利用分子标记对杂种后代进行早期的无核性状鉴定,极大地加速了无核葡萄的育种进程[8]。【前人研究进展】目前,有关分子辅助育种在葡萄上的应用已有部分研究。EMANUELLI等[9]利用SSR标记找到了与葡萄中的玫瑰香味相关联的一个候选基因,并将其命名为VvDXS。CONSTANTINI[10]、MEJIA[11]等在两个鲜食葡萄品种的163株杂交个体中筛选到了与果粒大小、成熟期、种子数分别相关的基因。FISCHER等[12]在‘Regent’בLemberger’的153株杂交个体中定位到与葡萄真菌抗性连锁的QTL位点。HANANIA等[13]在有核与无核白系的葡萄花朵基因不同表达的转录分析中识别到一个叶绿素伴侣蛋白(ch-Cpn21),其沉默表达导致了烟草与西红柿种子的败育,泛激素延伸蛋白(S27a)在控制葡萄组织发育过程中可能存在某种角色[14],然而这些基因均不是控制葡萄无核性状的基因。CABEZAS等[15]在‘赤霞珠’ב秋无核’的118株杂交子代中定位到了与葡萄无核性状相关联的QTL位点SDI(seed development inhibitor),该位点位于葡萄chr18染色体,与该位点紧密连锁的VMC7F2在198 bp等位点上能对后代的无核性状进行有效的分离,表型变异解释率为50%。MEJIA等[16]研究发现在SDI位点存在一个VvAGL11(MADS5[17]、VvAG3[18]),该基因位于VMC7F2下游463 bp处。葡萄MADS5与拟南芥MADS5的序列同源性较高,拟南芥MADS-box家族中的MADS5参与调控种子的生长发育[19,20]。【本研究切入点】目前,VMC7F2在葡萄无核育种中被广泛应用。然而,VMC7F2在本研究的F1代杂交群体中的分型正确率只有45%,不能作为辅助育种的有效工具。基于RAD-seq测序利用高密度连锁图谱,较为准确地定位到了无核性状的QTL,并结合高分辨率熔解曲线(HRM)开发了一个新的用于葡萄无核性状的SSR分子标记VvSD10,该标记位于葡萄MADS5内部,能够更好地连锁基因MADS5的分离。【拟解决的关键问题】本研究在前人研究结果基础上,在母本‘红地球’与父本‘森田尼无核’两亲本及F1代杂交群体中又重新筛选到了与葡萄无核性状相关联的SSR分子标记VvSD10。用分子标记VvSD10在F1代杂交群体以及从中国农业科学院郑州果树研究所的国家葡萄品种资源圃随机选择的葡萄自然群体中进行鉴定,检测该分子标记在杂交子代及自然群体无核性状中的分型率及保持率,进一步提高和补充前人研究结果。1 材料与方法
田间试验于2015—2016年在中国农业科学院郑州果树研究所国家葡萄品种资源圃进行,其他试验于中国农业科学院郑州果树研究所果树基因资源实验室进行。1.1 试验材料
以母本‘红地球’与父本‘森田尼无核’两亲本和131株F1代杂交群体,以及从中国农业科学院郑州果树研究所国家葡萄品种资源圃随机选取的65个葡萄品种的自然群体为试验材料(表1)。Table 1
表1
表1自然群体葡萄品种信息
Table 1Grape variety information in natural population
| 编号 Number | 品种(系)名 Variety (line) name | 性状 Traits | 编号 Number | 品种(系)名 Variety (line) name | 性状 Traits | |
|---|---|---|---|---|---|---|
| 1 | 巧尼克 Qiaonike | 有核 Seed | 32 | 康能无核 Kangnengwuhe | 无核 Seedless | |
| 2 | 驴奶 Lvnai | 有核 Seed | 33 | 大无核 Dawuhe | 无核 Seedless | |
| 3 | 珂达乌尔波 Kedawuerbo | 有核 Seed | 34 | 皇家无核 Huangjiawuhe | 无核 Seedless | |
| 4 | 基姆拉 Jimula | 有核 Seed | 35 | 蒙丽莎无核 Menglishawuhe | 无核 Seedless | |
| 5 | 琼尾 Qiongwei | 有核 Seed | 36 | 无核紫露1N-2-9 Wuhezilu 1N-2-9 | 无核 Seedless | |
| 6 | 花泽2号 Huaze 2 hao | 有核 Seed | 37 | Black Seedless (Chile) | 无核 Seedless | |
| 7 | 花泽1号 Huaze 1 hao | 有核 Seed | 38 | 紧穗无紫露 Jinsuiwuzilu | 无核 Seedless | |
| 8 | 琥珀 Hupo | 有核 Seed | 39 | 优无核 Youwuhe | 无核 Seedless | |
| 9 | Jode seedless (Chile) | 有核 Seed | 40 | Midnight Beauty (TS) | 无核Seedless | |
| 10 | 意大利玫瑰 Yidalimeigui | 有核 Seed | 41 | 大无核紫(红)Dawuhezi (hong) | 无核 Seedless | |
| 11 | 朗利霍多 Langlihuoduo | 有核 Seed | 42 | 金星无核(venus)Jinxingwuhe | 无核 Seedless | |
| 12 | 哈特巴尔 Hatebaer | 有核 Seed | 43 | Crimson seedless | 无核 Seedless | |
| 13 | 郑果28号 Zhengguo 28 hao | 有核Seed | 44 | 无核蜜 Wuhemi | 无核 Seedless | |
| 14 | 巧吾什 Qiaowushen | 有核 Seed | 45 | 贵州水晶 Guizhoushuijing | 无核 Seedless | |
| 15 | 阿布交西 Abujiaoxi | 有核 Seed | 46 | 粉红无核 Fenhongwuhe | 无核 Seedless | |
| 16 | 黑贝蒂 Heibeidi | 有核 Seed | 47 | 火星无核(玛尔斯)Huoyanwuhe (maersi) | 无核 Seedless | |
| 17 | 白夏尼 Baixiani | 有核 Seed | 48 | 保一 Baoyi | 无核 Seedless | |
| 18 | 凯番西亚 Kaifanxiya | 有核 Seed | 49 | 碧香无核 Bixiangwuhe | 无核 Seedless | |
| 19 | 卡它库尔干 Katakuergan | 有核 Seed | 50 | 美丽无核 Meiliwuhe | 无核 Seedless | |
| 20 | 克里木考尼松 Kelimukaonisong | 有核 Seed | 51 | 红脸无核 Honglianwuhe | 无核 Seedless | |
| 21 | 齐基斯特娃拉 Qijisitewala | 有核 Seed | 52 | 立川无核3X Lichuanwuhe 3X | 无核 Seedless | |
| 22 | 圆粒巧无什 Yuanliqiaowushen | 有核 Seed | 53 | 无核白 Wuhebai | 无核 Seedless | |
| 23 | 蔓瓦吉 Manwaji | 有核 Seed | 54 | 无核白1号 Wuhebai 1 hao | 无核 Seedless | |
| 24 | 平顶黑 Pingdinghei | 有核 Seed | 55 | 郑果大无核Zhengguodawuhe | 无核 Seedless | |
| 25 | 大无核紫(黑) Dawuhezi(hei) | 有核 Seed | 56 | 无核翠宝 Wuhecuibao | 无核 Seedless | |
| 26 | 超保尔加尔 Chaobaoerjiaer | 有核 Seed | 57 | 无核白3号 Wuhebai 3 hao | 无核 Seedless | |
| 27 | 恰齐瓦赫 Qiaqiwahe | 有核 Seed | 58 | 瓦特康 Watekang | 无核 Seedless | |
| 28 | 奇妙无核 Qimiaowuhe | 有核 Seed | 59 | 黑爱默无核(TS) Heiaimowuhe (TS) | 无核 Seedless | |
| 29 | 考兹乌苏姆 Kaoziwusumu | 有核 Seed | 60 | 白无核Baiwuhe | 无核 Seedless | |
| 30 | 黄蜜斯 Huangmisi | 有核 Seed | 61 | 秋无核 Qiuwuhe | 无核 Seedless | |
| 31 | 特别黑大粒 Tebieheidali | 有核 Seed | 62 | 无核蜜 Wuhemi | 无核 Seedless | |
| 63 | 红无核紫露6-5-1 Hongwuhezilu6-5-1 | 无核 Seedless | ||||
| 64 | 无核白(阿富汗)Wuhebai (Afghanistan) | 无核 Seedless | ||||
| 65 | 无核白鸡心 Wuhebaijixin | 无核 Seedless |
新窗口打开
1.2 试验方法
1.2.1 无核性状的调查 葡萄成熟期,调查F1代杂交群体每个单株的有无核性状,以种子的有或无作为评价标准,有种子且发育良好的单株属于有核,无核、残核与软核的单株均属于无核。1.2.2 指标的测定方法
无核分型正确率(%)=存在111 bp等位点且表型为无核的葡萄植株个数/表型为无核的葡萄植株总数×100;
无核保持率(%)=存在111 bp等位点的植株个数/葡萄植株总个数×100;
无核检测率(%)=存在111 bp等位点且表型为无核的葡萄植株个数/存在111 bp等位点的葡萄植株个数×100。
1.2.3 葡萄叶片DNA的提取 采摘F1代杂交群体以及自然群体的无病害的鲜嫩叶片,采用植物基因组DNA提取试剂盒(由洛阳爱森AScend生物科技有限公司提供)提取叶片基因组DNA,浓度用NanoDrop1000检测(Thermo Scientific),DNA样本浓度用无菌水统一稀释至10 ng∙µL-1。
1.2.4 分子标记遗传连锁图谱的构建 对两亲本及已排除假杂交情况的131株F1代杂交群体进行RAD-seq,运用SOAP比对软件将测序序列比对到参考基因组序列上(NCBI-GCF-000003745.3-12X);根据比对结果,运用SAMtools软件生成CaSFS软件所需的pileup和glf文件,鉴定群体中每个位点的情况,过滤获得亲本之间的有效SNP集;由于SNPs数量多,采用窗口滑动的方法,选择以每15个SNP为一个窗口,每次滑动一个SNP,确定每个窗口的基因型,得到每个个体的基因型并生成bin图;对生成的bin采用拟测交的方式,利用Joinmap软件进行连锁分析,构建‘红地球’与‘森田尼无核’遗传连锁图谱。
1.2.5 QTL定位 结合遗传连锁图谱与无核性状的调查数据,用WindowQTLCartographer2.0软件进行QTL定位。
1.2.6 SSR分子标记引物对的设计 在QTL定位区间,用Perl程序语言找到了符合SSR序列特征的35个SSR分子标记,利用Primer premier5.0软件设计35个SSR分子标记的引物对(引物由上海生工生物有限公司合成)。
1.2.7 SSR分子标记的分型与检测 以两亲本和131株F1代杂交群体以及自然群体的65个葡萄品种的基因组DNA为模板,利用筛选到的分子标记引物通过HRM技术进行基因分型分析,以两亲本作为对照样本,与母本分为一组的样本为有核,与父本分为一组的样本为无核。
HRM分析仪器为罗氏Light Cycler®480Ⅱ,试剂为Light Cycler®480 High Resolution Melting Master。反应体系为15 µL:1.6 µL浓度为3 µmol∙L-1的MgCl2,7.5 µL 2×HRM Master Mix,SSR上、下游引物各0.8 µL(浓度为10 µmol∙L-1),1 µL模板DNA,无菌蒸馏水3.3 µL。
HRM技术包括PCR和HRM分析过程。PCR反应条件为:95℃预变性3 min;95℃变性10 s,62℃复性15 s,72℃延伸10 s,共48个循环;升温和降温过程温度变化率分别为4.4和2.2℃∙s-1。HRM分析过程为:95℃变性1 min,40℃杂交1 min;65—95℃读取熔解曲线,温度变化率为1℃∙s-1
2 结果
2.1 葡萄无核性状的QTL定位
通过形成的bin图构建‘红地球’与‘森田尼无核’遗传连锁图谱,并结合无核性状调查数据,将葡萄无核性状定位在chr18号染色体上,定位区间26 835 846—26 960 426,对无核表型的贡献率为77.9%,LOD阈值为26.3(表2,图1)。Table 2
表2
表2葡萄无核性状的QTL定位分析
Table 2QTL mapping analysis of seedless traits in Vitis vinifera L.
| 性状 Trait | 染色体 Chr | 定位区间 Mapping interval | LOD | 贡献率 R2 |
|---|---|---|---|---|
| 无核 Seedless | 18 | 26835846—26960426 | 26.3 | 77.9% |
新窗口打开
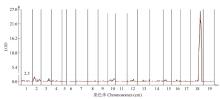 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1葡萄无核性状定位图
-->Fig. 1Mapping of seedless traits in grape
-->
2.2 SSR分子标记引物对的筛选
根据已设计的35对SSR分子标记引物对,在母本‘红地球’与父本‘森田尼无核’两个亲本中通过HRM技术筛选亲本之间在有无核性状上存在差异的分子标记引物对,命名为VvSD10,其正向引物序列为5′-AGAGCTCATTTGGATTAAGAGCG AGTAATTATATTGT-3′,反向引物序列为3′-GGAA AAATCCATCGCTAACAAAGTATTAATTCTCTTCA-5′。同时,用含有6-FAM荧光标记的PCR产物进行毛细管电泳(图2)。结果显示,分子标记VvSD10在父本‘森田尼无核’中出现了111 bp等位点,在母本‘红地球’中出现了99 bp与120 bp两个等位点。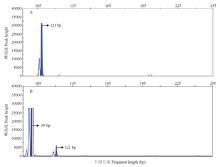 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2分子标记VvSD10在母本‘红地球’(A)与父本‘森田尼无核’(B)中的毛细管电泳
-->Fig. 2Capillary electrophoresis of the molecular marker VvSD10 in the female parent ‘Red Globe’ (A) and the male parent ‘Centennial Seedless’(B)
-->
2.3 分子标记VvSD10在不同葡萄群体无核性状中的分析
基于分子标记VvSD10中存在的111 bp等位点(即与父本分为一组)对葡萄F1代杂交群体及自然群体的无核性状进行鉴定,结果显示,在被检测的131株F1代杂交群体中,无核性状的植株有59个,其中存在111 bp等位点且表现无核性状的植株有57个。由此可知,分子标记VvSD10在F1代杂交群体中的无核分型正确率为97%,无核保持率为77%,无核检测率为56%。在65个葡萄品种的自然群体中,有33株为无核植株,其中存在111 bp且表现无核性状的有31株。由此可知,分子标记VvSD10在自然群体中的无核分型正确率、无核保持率、无核检测率分别为94%、85%、56%(表3,图3)。Table 3
表3
表3分子标记VvSD10在不同葡萄群体无核性状中的分析
Table 3Analysis of molecular marker VvSD10 for seedless traits in different grape populations
| 群体 Populations | 种子数 Seed number (%) | 111 bp | 无核分型正确率 Correct typing rate | 无核保持率 Holding rate | 无核检测率 Detection rate | ||
|---|---|---|---|---|---|---|---|
| + | - | ||||||
| F1代 F1 progeny | 无核 Seedless | 59(45%) | 57 | 2 | 57(97%) | 101(77%) | 57(56%) |
| 有核 Seed | 72(55%) | 44 | 28 | ||||
| 自然群体 Natural population | 无核 Seedless | 33(51%) | 31 | 2 | 31(94%) | 55(85%) | 31(56%) |
| 有核 Seed | 32(49%) | 24 | 8 | ||||
新窗口打开
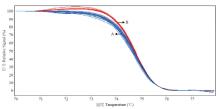 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3分子标记VvSD10在葡萄群体中的HRM分型结果
A:重叠区域代表样本分型结果为有核(与母本归为一组);B:重叠区域代表样本分型结果为无核(与父本归为一组)
-->Fig. 3HRM typing result of molecular marker VvSD10 in grape populations
A: The overlap region represents the sample typing seed (with the female parent as a group); B: The overlap region represents the sample typing seedless (with the male parent as a group)
-->
3 讨论
3.1 HRM技术在科学研究中的应用
高分辨率熔解曲线(High-Resolution Melting,HRM)技术,是国际上发展起来的一种基于单核苷酸熔解温度不同而形成不同熔解曲线的突变扫描和基因分型新技术。该技术的原理是利用饱和的荧光染料对PCR产物进行熔解曲线分析,根据熔解曲线的形状进行基因分型[21,22,23,24]。本研究使用了HRM技术,它是一种有效的、高分辨率的DNA差异检测技术,因操作简便迅速,使用成本低,结果准确,实现了真正的闭关操作,而受到普遍关注。目前可以应用于基因突变扫描[25]、基因分型[26]、甲基化分析[27]、法医学鉴定[28]等方面。曹春鸽等[29]应用HRM技术对CYP2C19*2和CYP2C19*3进行了双重SNP分型,结果显示,64个随机DNA样本的HRM分型结果与测序结果一致性达到100%,与邓建强等[28]应用HRM技术进行法医昆虫种属鉴定研究中的结果相似。嘎利兵嘎[30]利用HRM技术在动物病毒基因分型中的研究及应用中,建立了6种常见动物病毒的PCR-HRM检测方法,成功对6种动物病毒进行了基因分型,为动物传染病分子诊断提供了一种快速、简单、成本低廉的PCR-HRM检测方法。在本研究中,应用HRM技术对葡萄无核性状进行基因分型鉴定,筛选出了能检测葡萄无核性状的标记VvSD10,同时该标记在F1代杂交群体及自然群体中的无核分型正确率分别为97%、94%,提供了较高的准确信息。3.2 SSR标记在葡萄分子辅助育种中的应用
SSR(simple sequence repeats)标记是近些年发展起来的一种以特异引物PCR为基础的分子标记技术,是一类由几个核苷酸为重复单位组成的串联重复序列,因其具有高多态性、多等位基因、共显性遗传等优势而被广泛应用[31,32]。CABEZAS等[15]利用SSR标记方法定位到了与葡萄无核性状紧密连锁的VMC7F2,与MEJIA等[11]的研究结果相似。在CABEZAS等[15]的研究中,VMC7F2在无核葡萄品种‘森田尼无核’中检测到198 bp与200 bp两个等位点,在有核葡萄品种‘红地球’中检测到200 bp与202 bp两个等位点。并且,在‘Dona Maria’与‘Muscat of Alexandria’2个有核葡萄品种中也检测到198 bp等位点。类似报道中,VMC7F2在‘红地球’中仅检测到200 bp一个等位点[33]。本研究中,用VMC7F2在母本‘红地球’中检测到200 bp与202 bp两个等位点,在父本‘森田尼无核’中检测到200 bp与205 bp两个等位点,但并未检测到VMC7F2中的典型等位点198 bp。KARAAGAC等[33]利用VMC7F2的198 bp等位点对‘Red Globe’בCrimson Seedless’224株杂交个体的有无核性状进行检测,存在198 bp等位点的有112株,无核保持率为50%;在‘96-71-7’בCrimson Seedless’的126株杂交个体中,存在198 bp等位点的有96株,无核保持率为76%。本研究中,VMC7F2在‘红地球’ב森田尼无核’F1代杂交群体中的分型正确率仅有45%,远不能达到检测该群体无核性状的目的。本研究基于SSR分子标记筛选到了与葡萄无核性状紧密连锁的SSR分子标记VvSD10,其在无核性状上的典型等位点为111 bp。并且在131株F1代群体中有101株可以检测到111 bp等位点,保持了77%的无核率,在分子标记辅助育种中可以提前舍去23%个体。由于不同遗传背景的差异,本研究中的分子标记VvSD10在不同杂交群体的无核分型率、无核保持率等会有不同。
4 结论
本研究基于RAD-seq测序方法对葡萄无核性状进行QTL定位,将葡萄无核性状定位在葡萄Chr18染色体上,定位区间位于26 835 846—26 960 426,约124 kb。在定位区间设计35对SSR分子标记引物,通过高分辨率熔解曲线(HRM)与毛细管电泳结合的方法,筛选到了能检测葡萄无核性状的SSR分子标记VvSD10,该标记具有分型明确,表现稳定的特点,在遗传群体和自然群体中的无核分型均能提供较高的准确信息,可以在育种中提供辅助信息。The authors have declared that no competing interests exist.
