0 引言
【研究意义】苹果褪绿叶斑病毒(Apple chlorotic leaf spot virus,ACLSV)是一种重要的落叶果树病毒病原,在世界各地水果产区广泛分布[1],可侵染苹果[2]、梨[3]、杏[4]、桃[5]、樱桃[6]、李子[7]等多种果树,对果树生长和果实产量、品质造成一定的影响。高效灵敏的检测技术是病毒病防控的基础,可为无毒苗木培育和推广提供重要保障[8]。【前人研究进展】在ACLSV检测技术中,指示植物法费时费工[9];酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法简单低廉[10],但ELISA检测效果受抗体质量限制[11];目前,PCR技术应用最为广泛,但RT-PCR的灵敏性受到限制[12];RT-nested PCR检测敏感性和特异性较高,但需要进行两轮PCR,操作较为繁琐、耗时较长[13,14];real-time RT-PCR比RT-nested PCR的检测敏感性和特异性更高,且后续不需要电泳检测,但需较为昂贵的荧光定量PCR仪,实验及仪器操作也需要专业指导,不利于广泛应用[15,16]。ACLSV在大多数寄主植物中潜伏侵染,在寄主叶片和果实上不表现明显症状[17,18],所以无法通过症状观察进行初步诊断,而且病毒在树体中的含量一般很低,有时会出现假阴性结果[19]。因此,开发一种更加灵敏、简便的ACLSV检测方法十分必要。LAMP是一种新型的核酸扩增技术,该技术采用4条特异性引物识别靶序列上的6个特异区,利用DNA置换聚合酶(Bst DNA polymerase)在恒温条件下对靶基因扩增[20],RT-LAMP是在LAMP的基础上加入反转录酶,使得反转录和核酸扩增同时进行[21]。LAMP反应产物可以进行电泳检测(阳性出现瀑布状条带,阴性样品无条带),也可在反应产物中加入SYBR GreenⅠ核酸染料直接观察颜色变化(阳性为绿色,阴性为橙色)或LAMP反应也可以在实时浊度仪(扩增超过阈值为阳性(有核酸扩增),未超过阈值为阴性(无核酸扩增))[22]和实时荧光定量PCR仪(若有“S”型扩增曲线,则判断为阳性(有核酸扩增),若无“S”型扩增曲线,则判断为阴性(无核酸扩增))中进行,直接根据扩增曲线判断反应结果,此方法适用于有条件的实验室。近年来,LAMP方法已逐渐应用于各种动物、植物体的病原微生物以及外源基因的检测中[23,24,25,26,27]。【本研究切入点】使用荧光定量PCR仪,对ACLSV RT-LAMP反应体系和反应条件进行优化,并对此方法的灵敏性、特异性和应用特点进行评价。【拟解决的关键问题】建立ACLSV的RT-LAMP检测方法,以期为该病毒的田间检测和防控提供更好的技术支持,同时也可在开展无病毒苗木培育和生产的科研单位及企业推广应用。1 材料与方法
试验于2017年在中国农业科学院果树研究所国家落叶果树脱毒中心实验室完成。1.1 试验材料
1.1.1 生物材料 用于LAMP反应体系和条件优化的植株样品为实验室保存的经RT-PCR和ELISA鉴定为ACLSV阳性的富士苹果组培苗;在特异性反应中,感染苹果茎沟病毒(Apple stem grooving virus,ASGV)、苹果茎痘病毒(Apple stem pitting virus,ASPV)、苹果花叶病毒(Apple mosaic virus,ApMV)样品和健康植株均为实验室保存的经RT-PCR和ELISA鉴定的富士苹果组培苗;田间样品采自辽宁省兴城市的果园。1.1.2 主要试剂和器材 BIO-RAD实时荧光定量PCR仪(型号:CFX ConnectTM Optics Module);Bst DNA聚合酶购自NEB公司,随酶提供100 mmol·L-1 MgSO4和10×等温缓冲液(20 mmol·L-1 Tris-HCl,10 mmol·L-1 (NH4)2SO4,50 mmol·L-1 KCl,2 mmol·L-1 MgSO4,0.1% Tween-20,pH 8.8);M-MLV反转录酶购自Promega公司,10 mmol·L-1 dNTP购自TaKaRa公司,Betaine购自Sigma-Aldrich公司,荧光试剂购自广州迪澳生物公司,DL2000 Plus DNA Marker购自近岸蛋白质科技有限公司,DEPC处理水购自生工生物工程(上海)股份有限公司。
1.2 试验方法
1.2.1 总RNA提取 称取苹果叶片样品50 mg,采用柱式法从采集的苹果叶片样品中提取总RNA。采用Eppendorf BioPhotometer D30核酸蛋白测定仪测定提取总RNA的浓度,通过琼脂糖凝胶电泳检测提取总RNA的完整性,于-80℃保存备用。1.2.2 引物设计和合成 根据GenBank公布的18条ACLSV基因组序列,通过Vector NTI软件进行同源性分析,分别在3个相对保守的区域设计3组RT-LAMP检测引物(Ⅰ、Ⅱ、Ⅲ),并设计一对RT-PCR检测引物(表1)。上述引物由上海生工生物公司合成。
Table 1
表1
表1RT-LAMP和RT-PCR检测ACLSV所用引物
Table 1Primers used for ACLSV detection by RT-LAMP and RT-PCR
| 引物名称Primer name | 序列Sequence (5′-3′) | 引物位置Primer location | 用途Application | |
|---|---|---|---|---|
| Ⅰ | T1FIP | GTCAAAACCTGATGATAATTCA GCCTACAAATTAGGTGAGA | 5651-5672, 5602-5620 | RT-LAMP |
| T1F3 | TTTTCTGGAATTTTCATT | 5583-5600 | RT-LAMP | |
| T1BIP | GATGGCGATGATGATAAGGGGTC TTTTCACCCCAGCAATTGG | 5755-5777, 5807-5825 | RT-LAMP | |
| T1B3 | TCAGAATAAATTCTGGAG | 5827-5844 | RT-LAMP | |
| Ⅱ | T2FIP | TAAACACCCGACTTAGTGAACCA GAGAAGAAGGTGGAAAACT | 247-265 270-288 | RT-LAMP |
| T2F3 | ATGAACGCATTCAAAAGGA | 321-343 | RT-LAMP | |
| T2BIP | CTGGAGAACCACCTTTTATTTAA TTACTAATATAACTAGCTAC | 369-391 420-439 | RT-LAMP | |
| T2B3 | TACTAAGACATGCTACATA | 447-464 | RT-LAMP | |
| Ⅲ | T3FIP | AGAACTGCTGCCATCCTCCTTC GATAACATTTCTGCAAGAGA | 6740-6757, 6767-6786 | RT-LAMP |
| T3F3 | TCCATTGCTTCAGAAGGG | 6814-6835 | RT-LAMP | |
| T3BIP | GTGGACGCAGATCTGAAAGCGT TTGCCCCTGTCTTTCCATG | 6852-6873, 6900-6918 | RT-LAMP | |
| T3B3 | GACTCCAGTATCTGTTCCA | 6922-6940 | RT-LAMP | |
| ACLSV7 | CAGACCYCTTCATGGAAAGACAG | 6834-6959 | RT-PCR | |
| ACLSV8 | GTAGTAAAATATTTAAAAGTCTAC | 7537-7557 | RT-PCR | |
新窗口打开
1.2.3 RT-PCR检测 反转录体系为1.0 ng RNA、1.0 µL 2 µmol·L-1 oligod (T)18 、DEPC水补至10 µL,65℃ 5 min;体系中加入4.0 µL M-MLV 5×buffer、4.0 µL 2.5 mmol·L-1 dNTPs、1.0 µL M-MLV,42℃ 60 min,70℃ 15 min。合成的cDNA于-20℃保存备用。
PCR反应体系为2.0 µL cDNA模板、2.5 µL 10×PCR buffer、2.0 µL 2.5 mmol·L-1 dNTPs、1.0 µL rTaq、10 µmol·L-1上下游引物各1.0 µL、DEPC水补至25 µL。PCR反应条件为94℃预变性4 min;90℃变性30 s,60℃退火30 s,72℃延伸1 min,进行35次循环;72℃延伸10 min。
1.2.4 RT-LAMP检测方法建立 RT-LAMP基本检测体系以100—200 ng·µL-1的RNA为模板进行,各成分含量如下:10×Isothermal Amplification Buffer、6.0 mmol·L-1 MgSO4、1.4 mmol·L-1 dNTPs、1.6 µmol·L-1 FIP/BIP Primers、0.2 µmol·L-1 F3/B3 Primers、320 U·mL-1 Bst DNA聚合酶、40 U M-MLV、荧光染料、1.0 µL模板RNA、DEPC水补至25 µL。反应体系如下:2.5 µL 10×Isothermal Amplification Buffer,1.0 µL 100 mmol·L-1 MgSO4,3.5 µL 10 mmol·L-1 dNTPs,1.0 µL 40 µmol·L-1 FIP/BIP Primers,1.0 µL 5 µmol·L-1 F3/B3 Primers,1.0 µL Bst DNA聚合酶,0.2 µL M-MLV,0.5 µL荧光染料,1 µL RNA模板,DEPC补至25 µL。反应条件为63℃,70 min。
采用表1中3组引物(Ⅰ、Ⅱ、Ⅲ)用于上述RT-LAMP基本反应体系进行反应,确定适宜的引物。
RT-LAMP反应体系优化,Mg2+浓度梯度设置为0、2.0、4.0、6.0、8.0、10.0、12.0 mmol·L-1,其余组分按RT-LAMP基本反应体系添加,DEPC补至25 µL(下同);采用最适Mg2+浓度,dNTPs浓度梯度设置为0.6、0.8、1.0、1.2、1.4、1.6、1.8 mmol·L-1;采用最适Mg2+浓度和dNTPs浓度,Betaine浓度梯度设置为0、0.2、0.4、0.6、0.8、1.0、1.2 mol·L-1;采用最适Mg2+浓度、dNTPs浓度和Betaine浓度,FIP/BIP浓度梯度设置为0.8、1.2、1.6、2.0、2.4 µmol·L-1;采用最适Mg2+浓度、dNTPs浓度、Betaine浓度和FIP/BIP浓度,F3/B3浓度梯度设置为0、0.1、0.2、0.3、0.4 µmol·L-1。
RT-LAMP反应条件优化,采用已优化的反应体系,设置65、63、61、59、57℃ 5个不同的反应温度,反应时间设定为90 min。
以上RT-LAMP反应均以实验室保存的ACLSV阳性组培苗为样品,在实时荧光定量PCR仪中进行,根据扩增曲线出峰快慢和曲线的光滑程度确定最适反应条件。
1.2.5 RT-LAMP特异性验证 采用优化好的反应体系和反应条件,对常见的苹果病毒进行检测。以感染ASGV、ASPV、ApMV、ACLSV、健康植株叶片的RNA为模板,以无菌水为空白对照进行RT-LAMP特异性检测。通过观察实时荧光定量扩增曲线,肉眼观察加入2.0 µL 1 000×SYBR GreenⅠ后反应液颜色变化(绿色为阳性,橙色为阴性)、琼脂糖凝胶电泳(出现特征性梯状条带为阳性,否则为阴性)等方法判定结果。
1.2.6 RT-PCR和RT-LAMP灵敏性检测 提取感染ACLSV叶片总RNA,浓度为408 ng·µL-1,10倍浓度梯度稀释至10-6,以无菌水为空白对照采用RT-LAMP和RT-RCR进行检测灵敏度对比试验。采用肉眼观察加入2.0 µL 1 000×SYBR GreenⅠ后反应液颜色变化和琼脂糖凝胶电泳分析判定结果。
1.2.7 ACLSV田间样品检测 在辽宁省兴城市的果园中随机采集23个苹果植株叶片,分别进行RT-LAMP和RT-PCR检测,采用琼脂糖凝胶电泳、反应液加入2.0 µL 1 000×SYBR GreenⅠ观察颜色变化分析判定结果。
2 结果
2.1 RT-LAMP引物筛选
用3组引物分别对ACLSV阳性样品进行RT-LAMP扩增,每组引物设3个重复,结果如图1所示。Ⅲ组引物扩增效果最好,出峰最早且曲线光滑;Ⅱ组引物在出峰时间和曲线的光滑度上都不及Ⅲ组引物;Ⅰ组引物没有扩增出“S”型曲线。所以采用Ⅲ引物作为ACLSV RT-LAMP的检测引物。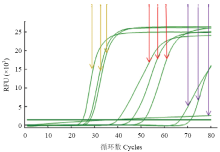 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同引物ACLSV RT-LAMP扩增
紫色Purple:Ⅰ组引物扩增曲线Amplification curves of group I primers;红色Red:Ⅱ组引物扩增曲线Amplification curves of group Ⅱ primers;黄色Yellow:Ⅲ引物扩增曲线Amplification curves of group Ⅲ primers
-->Fig. 1The RT-LAMP amplification using different primers
-->
2.2 RT-LAMP反应体系优化
2.2.1 最适Mg2+浓度 随Mg2+浓度的增加RT-LAMP反应出峰时间越早,当Mg2+浓度到达6.0 mmol·L-1时,出峰时间最早且扩增曲线较光滑,当浓度超过6.0 mmol·L-1后,随Mg2+增加反应效果越来越差。故选择6.0 mmol·L-1 Mg2+作为ACLSV RT-LAMP检测的最佳浓度(图2)。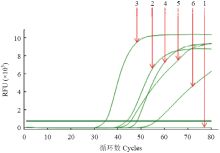 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2Mg2+浓度对RT-LAMP影响的实时荧光定量扩增曲线
-->Fig. 2The real-time amplification curves of effect of Mg2+ concentrations on the RT-LAMP reaction
1: 2.0 mmol·L-1; 2: 4.0 mmol·L-1; 3: 6.0 mmol·L-1; 4: 8.0 mmol·L-1; 5: 10.0 mmol·L-1; 6: 12.0 mmol·L-1
-->
2.2.2 最适dNTPs浓度 随着dNTPs浓度的增加,其反应规律同Mg2+反应规律,dNTPs浓度为1.2 mmol·L-1时扩增曲线光滑出峰时间早,故1.2 mmol·L-1 dNTPs为ACLSV RT-LAMP检测最适反应浓度(图3)。
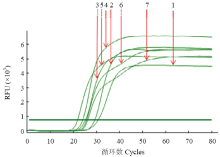 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3dNTPs浓度对RT-LAMP影响的实时荧光定量扩增曲线
-->Fig. 3The real-time amplification curves of effect of dNTPs concentrations on the RT-LAMP reaction
1: 0.6 mmol·L-1; 2: 0.8 mmol·L-1; 3: 1.0 mmol·L-1; 4: 1.2 mmol·L-1; 5: 1.4 mmol·L-1; 6: 1.6 mmol·L-1; 7: 1.8 mmol·L-1
-->
2.2.3 最适甜菜碱浓度 加入甜菜碱后扩增效果明显较好,甜菜碱浓度在0.2—0.8 mol·L-1时对RT-LAMP扩增效果影响差异不大且效果好,所以综合考虑成本因素,选择0.2 mol·L-1甜菜碱为最适反应浓度(图4)。
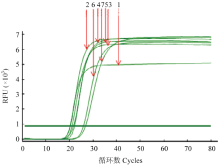 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4甜菜碱浓度对RT-LAMP影响的实时荧光定量扩增曲线
-->Fig. 4The real-time amplification curves of effect of betaine concentrations on the RT-LAMP reaction
1: 0 mol·L-1; 2: 0.2 mol·L-1; 3: 0.4 mol·L-1; 4: 0.6 mol·L-1; 5: 0.8 mol·L-1; 6: 1.0 mol·L-1; 7: 1.2 mol·L-1
-->
2.2.4 最适FIP/BIP浓度 当FIP/BIP浓度为1.6—2.0 µmol·L-1时反应,出峰时间早且曲线光滑,当FIP/BIP浓度高于或低于这个范围时,出峰时间均较晚且曲线不够光滑,故选择1.6 µmol·L-1为FIP/BIP最适反应温度(图5)。
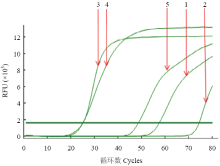 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5FIP/BIP浓度对RT-LAMP影响的实时荧光定量扩增曲线
-->Fig. 5The real-time amplification curves of effect of FIP/BIP concentrations on the RT-LAMP reaction
1: 0.8 µmol·L-1; 2: 1.2 µmol·L-1; 3: 1.6 µmol·L-1; 4: 2.0 µmol·L-1; 5: 2.4 µmol·L-1
-->
2.2.5 最适F3/B3浓度 当F3/B3浓度为0.2 µmol·L-1时,出峰时间最早且曲线光,当F3/B3浓度高于或低于0.2 µmol·L-1,出峰时间均较晚,且曲线不够光滑,所以选择0.2 µmol·L-1为F3/B3最适反应浓度(图6)。
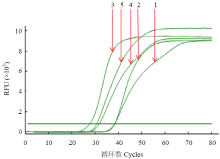 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6F3/B3浓度对RT-LAMP影响的实时荧光定量扩增曲线
-->Fig. 6The real-time amplification curves of effect of F3/B3 concentrations on the RT-LAMP reaction
1: 0 µmol·L-1; 2: 0.1 µmol·L-1; 3: 0.2 µmol·L-1; 4: 0.3 µmol·L-1; 5: 0.4 µmol·L-1
-->
2.3 最适反应条件
在所设置的4个不同反应温度下,65℃ RT- LAMP反应不能进行,63、61℃出峰较晚,59℃时出峰时间最早,且曲线光滑,故选择59℃为RT-LAMP最适反应温度;从在59℃下扩增的两条曲线来看,当反应时间到达60 min时,反应的扩增量已经达到最大值,故选择60 min为反应最适时间(图7)。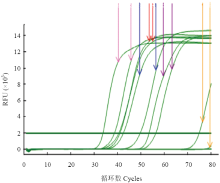 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7反应温度和反应时间对RT-LAMP影响的实时荧光定量扩增曲线
黄色Yellow:65℃;紫色Purple:63℃;蓝色Blue:61℃;粉色Pink:59℃;红色Red:57℃
-->Fig. 7The real-time amplification curves of effect of time and temperature on the RT-LAMP reaction
-->
2.4 特异性检测
以感染ASGV、ASPV、ApMV、ACLSV和健康植株叶片的RNA为模板,以无菌水为空白对照进行RT-LAMP特异性检测。RT-LAMP扩增产物经2%琼脂糖凝胶电泳,仅ACLSV阳性样品呈现特征性梯状条带,其他样品均未见特征性扩增条带(图8-A);各管中加入2.0 µL 1 000×SYBR GreenⅠ后,仅有ACLSV阳性样品反应液颜色变绿,其他各管均为橙色(图8-B);实时荧光定量PCR仪观测结果同样,ACLSV阳性样品扩增曲线为光滑的“S”型,其他3个病毒阳性样品未形成“S”型曲线(图8-C)。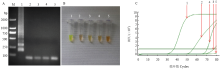 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8RT-LAMP特异性反应
A:电泳检测Detection by electrophoresis;B:肉眼观察加入SYBR GreenⅠ后反应液颜色变化Observation of the color change of the reaction liquid after adding SYBR Green I;C:实时荧光定量扩增曲线判断The judgement curves of real-time amplification。1:ACLSV;2:ApMV;3:ASGV;4:ASPV;5:清水对照Water control
-->Fig. 8The LAMP specificity test
-->
2.5 RT-PCR和RT-LAMP灵敏性检测
将ACLSV阳性样品总核酸进行10倍梯度浓度稀释至10-6,分别进行RT-LAMP和RT-PCR反应。各管中加入2.0 µL 1 000×SYBR GreenⅠ结果显示总核酸稀释至10-3时,RT-LAMP仍能检测出ACLSV(图9-A、9-B),RT-PCR检测ACLSV的总核酸最大稀释倍数为10-1(图9-C),表明RT-LAMP检测ACLSV的灵敏度是RT-PCR的100倍。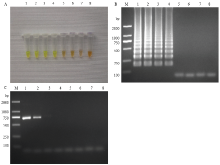 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9RT-LAMP与RT-PCR检测ACLSV灵敏度比较
A:肉眼观察加入SYBR GreenⅠ后RT-LAMP 反应液颜色变化Observation of the color change of the RT-LAMP reaction liquid after adding SYBR Green I;B:RT-LAMP电泳检测Electrophoresis detection of RT-LAMP;C:RT-PCR电泳检测Electrophoresis detection of RT-PCR。M:2000 bp DNA marker;1—7:RNA原液100—10-6稀释液 100-10-6 diluents of original RNA;8:清水对照Water control
-->Fig. 9Comparison of sensitivity of RT-LAMP and RT-PCR for detection of ACLSV
-->
2.6 田间疑似病株检测
将田间随机采集的23个ACLSV疑似感染植株,进行RT-PCR和RT-LAMP检测。结果23个疑似感染植株RT-LAMP检测出15个阳性样品(图10-A、10-B),检出率为65.2%;RT-PCR检测出12个阳性样品(图10-C),检出率为52.2%。RT-LAMP检测出ACLSV阳性样品多于RT-PCR,表明RT-LAMP较高的灵敏性。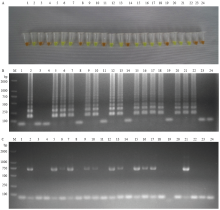 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图10RT-PCR和RT-LAMP方法检测田间样品
A:RT-LAMP产物加入SYBR GreenⅠ SYBR Green Ⅰdye result of RT-LAMP product;B:RT-LAMP产物电泳检测Electrophoresis detection of RT-LAMP product;C:RT-PCR电泳检测Electrophoresis detection of RT-PCR product。M:2000 bp DNA marker;1—23:待测样品Samples;24:清水对照Water control
-->Fig. 10Field-infected samples detected by RT-PCR and RT-LAMP
-->
3 讨论
在RT-LAMP反应体系和反应条件的优化试验中笔者采用了实时荧光定量PCR仪对结果进行了实时观测,保证了试验结果更为精确和客观,同时也可避免RT-LAMP产物对实验室造成污染的威胁。实时荧光定量PCR仪在反应体系中加入荧光基团,反应体系中荧光显色物质的参与,使得扩增过程中的荧光强度和产物之间建立对应的线性关系,最终通过电脑分析收集的信号形成扩增曲线。理想状态下扩增曲线符合2N方程(N为循环次数),线型应为“J”型,但本研究中扩增曲线通常表现为“S”型。在PCR扩增曲线初期信号的背景值与产生的荧光值不能明显区分,荧光信号随着PCR的产物扩增进入指数期、线性期和最终的平台期后,PCR产物的量就可以在指数期的线型上被检测出来[28]。本试验正是利用了这一原理,在反应体系中加入荧光染料,实时监测扩增过程,后通过扩增曲线确定反应的扩增效果。引物在整个反应中起着重要的作用,不同引物其退火温度及引物间序列碱基大小的不同,直接影响RT-LAMP反应中茎环结构的形成[29],从而影响RT-LAMP反应。本试验依据RT-LAMP反应原理,在18条已报道的ACLSV基因组保守区域设计了3组引物。3组引物设计过程中,在满足反应原理的基础上,尽量将引物位置定位在保守区域,再通过试验验证引物的可用性。由图1可得出的第3组引物效果最好,原因应该是该组引物与ACLSV基因组匹配度更高,其余两组引物可能是不符合RT-LAMP的反应要求。
本试验对RT-LAMP反应体系,即Mg2+、dNTPs、Betaine、FIP/BIP、F3/B3浓度,反应时间和反应温度均进行了优化,确保了反应在最佳的条件下进行,节省了材料和时间。对4种常见的苹果病毒病原进行了RT-LAMP特异性研究,结果表明RT-LAMP检测ACLSV具有很高的特异性。2016年,卢永灿[30]针对梨寄主建立了ACLSV RT-LAMP检测方法。本研究针对苹果寄主,进一步完善了用RT-LAMP法检测不同寄主感染ACLSV的情况,而且通过实时荧光定量PCR仪进行实时监测,试验结果更精确更具有说服力。
高效灵敏是LAMP反应的一大优点,本研究表明RT-LAMP的确具有很高的特异性,RT-LAMP的灵敏度是RT-PCR的100倍。周彤等[21]利用RT-LAMP方法检测水稻黑条矮缩病毒(Rice black-streaked dwarf virus,RBSDV),结果表明RT-LAMP检测方法可特异地检测植物和飞虱体内的RBSDV,与RT-PCR灵敏度基本一致;刘科宏等[24]研究表明,RT-LAMP方法检测柑橘黄化脉明病毒(Citrus yellow vein clearing virus)灵敏度是RT-PCR方法的10倍;王永江等[31]研究表明,RT-LAMP方法检测柑橘衰退病毒(Ctrus tristeza virus,CTV)灵敏度是RT-PCR的100倍;JU[32]利用RT-LAMP技术检测马铃薯卷叶病毒(Potato leafroll virus)的灵敏度是RT-PCR技术的2000倍;姜珊珊等[33]研究表明,RT-LAMP检测甘薯羽状斑驳病毒(Sweet potato feathery mottle virus,SPFMV)灵敏度是RT-PCR的10倍。由此可见,不同的RT-LAMP反应中,RT-LAMP的灵敏度差异较大,原因可能是在不同的反应中设计的引物长度、引物间距离、引物溶解温度、引物末端稳定性、GC含量与二级结构不同,引物和模板的结合率受到了不同的影响,也可能与反应中酶活性、化学试剂、人为操作有关。
目前世界上报道的苹果病毒有39种之多[1],培育无毒苗木以及开展苹果病毒种类调查均需要对病毒进行检测。RT-LAMP作为一种敏感、特异、简便、快速的新型检测技术,具有一定的优越性,已经广泛应用于医学、农业等各个领域。本研究建立的RT-LAMP检测方法,无需专门的仪器,直接以待测样品RNA为模板,一步反应即可完成检测,反应仅需1 h,更适合基层单位对大量样品进行ACLSV检测。
4 结论
成功建立了苹果褪绿叶斑病毒(ACLSV)RT-LAMP检测方法,该方法具有较好的特异性、灵敏性,可以快速地通过肉眼观察试验结果,适合基层单位大量检测ACLSV。The authors have declared that no competing interests exist.
