0 引言
【研究意义】 二氢吡啶类药物属于钙通道阻滞剂类(calcium channel blocker)降血压药,是能够在通道水平上选择性地阻滞钙离子进入细胞内,进而减少细胞内钙离子浓度的一类具有广泛心血管药理作用的药物,目前在医学临床上主要用于治疗高血压、心律失常、心绞痛、心力衰竭等心脑血管疾病[1,2,3]。20世纪70年代前苏联科学家KLUSA等发现二氢吡啶具有促进畜禽生长的作用,此后世界各国相继展开了相关研究[4,5,6]。需要注意的是,各大媒体及文献资料中普遍使用的“二氢吡啶(diludine)”其化学名称实际为“2,6-二甲基-3,5-二乙酯基-1,4-二氢吡啶(2,6-dimethyl-3,5-dicarboxy-1,4-dihydropyridine)”,本文研究的即为该物质。由于其化学名称较为冗长,因此媒体往往简称其为“二氢吡啶”,但二者其实是完全不同的两种化学物质(表1)。二氢吡啶的生理作用主要表现在抗氧化、促进动物消化吸收、调节动物内分泌、增强免疫力等方面[7,8,9]。目前,二氢吡啶已作为一种新型的饲料添加剂在畜牧生产中广泛用于改善肉质、促进动物生长、提高饲料利用率、提高家禽产蛋率、增强动物繁殖性能、抗应激等方面,还可用于防治奶牛乳房炎、脂肪肝等疾病[10,11,12,13,14,15,16,17,18]。此外,二氢吡啶能够有效降低饲料中维生素A、维生素E、胡萝卜素等营养物质的氧化损失,显著提高其利用率[19,20,21,22]。然而,经查询“二氢吡啶”并未列入农业部规定的允许使用物质三大目录——《饲料原料目录》、《饲料添加剂品种目录》和《药物饲料添加剂品种目录》,因此其在饲料中添加使用属于违法行为。且二氢吡啶的添加浓度往往较高,如在育肥猪饲料中推荐添加量为50 mg·kg -1时可显著促进育肥猪的生长发育,如此高水平的添加所带来的畜产品中二氢吡啶残留可能引起敏感人群严重的低血压反应。央视3.15晚会曝光了部分饲料企业违规使用二氢吡啶、硫酸黏杆菌素、喹乙醇等药物,引起社会的广泛关注和政府的高度重视,然而目前尚无二氢吡啶的检测方法标准,难以对其进行有效监管。【前人研究进展】目前,国内外关于二氢吡啶的检测方法鲜有报道。经查询仅金瓯等[23]建立了二氢吡啶及其杂质含量的高效液相色谱测定方法,以优化二氢吡啶的生产工艺。该方法仅可用于纯品的检测,并不适用于饲料等复杂基质中二氢吡啶的测定。【本研究切入点】目前,关于饲料中二氢吡啶的检测方法尚未见报道,这在一定程度上制约了饲料企业合理使用药物饲料添加剂,也限制了政府部门对其进行有效监管,尤其是在3.15晚会曝光之后,亟需饲料中二氢吡啶的检测方法。【拟解决的关键问题】本研究旨在建立一种准确、快速、灵敏测定饲料中二氢吡啶的UPLC-MS/MS方法,为饲料企业合理使用药物饲料添加剂以及为政府监管提供必要的技术支撑。Table 1
表1
表1二氢吡啶的化学结构式
Table 1Chemical structures of diludine
| 化合物 Compounds | CAS号 CAS number | 分子式 Formula | 分子量 Molecular weight | 结构式 Structure |
|---|---|---|---|---|
| 吡啶 Pyridine | 110-86-1 | C5H5N | 79.10 | 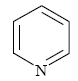 |
| 二氢吡啶 Dihydropyridine | 27790-75-6 | C5H7N | 81.12 | 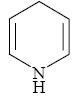 |
| 2,6-二甲基-3,5-二乙酯基-l,4-二氢吡啶 Diludine | 1149-23-1 | C13H19NO4 | 253.29 | 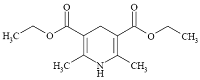 |
新窗口打开
1 材料与方法
试验于2017年3—6月在中国农业科学院农业质量标准与检测技术研究所 国家饲料质量监督检验中心(北京)进行。1.1 仪器与试剂
Waters Acquity超高效液相色谱仪-串联XEVO TQ质谱仪,配备电喷雾离子源(ESI),Masslynx 4.1工作站(美国Waters公司);3K15高速冷冻离心机(德国Sigma公司);氮吹仪(日本EYELA公司);Milli-Q超纯水仪(美国Milli-Q公司);BS 210S 分析天平(德国Sartorius 公司);ZM 100旋风磨(德国Retsch公司);MS2 Minishaker旋涡振荡器(德国IKA公司);超声波清洗仪(美国Crest公司);台式摇床(上海智城分析仪器制造有限公司)。2,6-二甲基-3,5-二乙酯基-l,4-二氢吡啶标准品(纯度≥99%,上海安谱实验科技股份有限公司);乙腈、甲醇和甲酸均为色谱纯,购自美国Fisher公司;试验用水为Milli-Q制备的超纯水;Oasis HLB固相萃取柱(60 mg/3cc,美国Waters公司);饲料样品由国家饲料质量监督检验中心(北京)提供。
1.2 标准溶液
精确称取适量二氢吡啶标准品,用乙腈溶解并定容,配置成浓度为1 000 μg·mL -1的标准储备溶液,置于-20℃冰箱避光保存,有效期6个月;准确移取1.0 mL标准储备液于100 mL棕色容量瓶中,用乙腈定容,配置成10 μg·mL -1的标准工作液,4℃冰箱避光保存,有效期1个月。使用时用流动相(0.1%甲酸-乙腈,90﹕10,v/v)逐级稀释,配置成浓度为10—500 μg·L-1的系列标准溶液,该标准系列溶液需现用现配。1.3 样品前处理
样品提取:准确称取经粉碎过40目筛(0.45 mm孔径)的配合料、浓缩料、精料补充料、添加剂预混料等饲料样品2.0 g(精确至0.001 g)于50 mL离心管中,加入乙腈20 mL,旋涡混匀30 s,置于超声波水浴中超声提取15 min。取出4℃下10 000 r/min离心5 min,取10 mL上清液在氮吹仪上60℃下吹干,残余物用3 mL乙腈﹕水(1﹕9,v/v)复溶,旋涡1 min使其充分溶解,备用。净化:HLB SPE柱预先用3 mL乙腈、3 mL乙腈﹕水(1﹕9,v/v)活化,取备用液过柱,用3 mL乙腈﹕水(1﹕9,v/v)淋洗,减压抽干,用2 mL乙腈﹕水(9﹕1,v/v)洗脱,收集洗脱液,过0.22 μm有机滤膜后供UPLC-MS/MS测定。
1.4 仪器分析
色谱条件:Waters ACQUITY BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);柱温35℃;进样室温度4℃;进样体积10 μL;流动相A为0.1%甲酸溶液,流动相B为乙腈,流速0.3 mL·min-1,梯度洗脱条件见表2。Table 2
表2
表2流动相梯度洗脱条件
Table 2Gradient program of the mobile phase
| 时间 Time (min) | 流速 Flow rate (mL·min-1) | 流动相A (0.1%甲酸溶液) Mobile phase A (0.1% Formic acid) | 流动相B (乙腈) Mobile phase B (Acetonitrile) | 切换模式 Curve |
|---|---|---|---|---|
| 0 | 0.3 | 95% | 5% | 6 |
| 2 | 0.3 | 95% | 5% | 6 |
| 3 | 0.3 | 20% | 80% | 6 |
| 4 | 0.3 | 5% | 95% | 6 |
| 7.5 | 0.3 | 5% | 95% | 6 |
| 8 | 0.3 | 95% | 5% | 6 |
| 10 | 0.3 | 95% | 5% | 6 |
新窗口打开
质谱条件:电喷雾离子源,正离子扫描(ESI+),多反应监测模式(MRM);脱溶剂气为高纯氮气,流速800 L·h-1;碰撞气为高纯氩气,流速0.13 mL·min-1,使用前调节各气体流量以使质谱灵敏度达到最优状态。二氢吡啶的定量离子对为m/z 254>208,锥孔电压15 V,碰撞能量为10 eV;定性离子对为m/z 254>180,锥孔电压15 V,碰撞能量为15 eV,驻留时间(Dwell time)均为0.1 s。
2 结果
2.1 基质添加标准曲线
取空白饲料样品按照1.3所述方法进行样品提取和净化,用洗脱液配制二氢吡啶标准曲线,使其浓度分别为0、10、20、50、100、500 μg·L-1,进UPLC-MS/MS测定。以基质添加标准工作液的浓度为横坐标,定量离子的峰面积为纵坐标绘制标准曲线。各饲料样品的基质匹配标准曲线见表3,相关系数均大于0.999,表明方法线性关系良好。Table 3
表3
表3基质添加标准曲线的线性方程和相关系数
Table 3Linear equations and regression coefficients of the matrix-matched standard calibration curves
| 饲料基质 Feed matrix | 线性范围 Concentration range (μg·L-1) | 线性方程 Linear equations | 相关系数 R2 Regression coefficient | 检出限 LOD (μg·kg-1) | 定量限 LOQ (μg·kg-1) |
|---|---|---|---|---|---|
| 猪配合饲料 Swine formula feed | 0-500 | y = 85.134x + 1450.1 | 0.9999 | 10 | 50 |
| 猪浓缩饲料 Swine concentrated feed | 0-500 | y = 85.299x + 718.6 | 0.9992 | 10 | 50 |
| 牛精料补充料 Bovine concentrate supplement | 0-500 | y = 118.98x - 246.56 | 0.9998 | 10 | 50 |
| 添加剂预混料Feed additive | 0-500 | y = 110.99x - 467.83 | 0.9997 | 10 | 50 |
新窗口打开
2.2 方法的选择性、检出限和定量限
随机抽取不同来源的20份饲料样品(包括猪配合料5份、鸡配合料2份、鱼配合料2份、猪浓缩料5份、牛精料补充料2份、羊精料补充料1份、添加剂预混料3份),按照1.3和1.4所述方法进行样品处理和测定,代表性的空白及添加样品色谱图如图1所示,在目标化合物提取离子的保留时间内没有干扰峰的出现,表明该方法的选择性良好。根据20个空白样品的基线噪音,取其平均值,以信噪比(S/N)=3为检出限(limits of detection,LOD),S/N=10为定量限(limits of quantification,LOQ),二氢吡啶的LOD、LOQ分别为10和50 μg·kg-1(表3)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1添加饲料样品(A,50 μg·kg-1)及空白样品(B)色谱图
-->Fig. 1Typical chromatograms of the fortified feed sample (A, 50 μg·kg-1) and the control feed sample (B)
-->
2.3 准确度、精密度和重现性
选择具有代表性的饲料样品,包括猪配合料、猪浓缩料、牛精料补充料和添加剂预混料进行添加回收试验,按照1.3和1.4所述方法进行样品处理和测定,方法的准确度、精密度和重现性见表4,代表性的空白和添加样品色谱图见图1。由表4可知,对于饲料样品,二氢吡啶的平均回收率在82.6%—101.0%之间,日内变异系数在0.8%—6.7%之间,日间变异系数在4.7%—9.2%之间。Table 4
表4
表4饲料样品添加二氢吡啶的回收率和变异系数
Table 4Recoveries and coefficient variations of diludine from fortified feed samples
| 饲料样品 Feed samples | 添加浓度 Fortified levels (μg·kg-1) | 回收率 Recoveries (%) | 日内变异系数 Intra-day CV (%, n=6) | 日间变异系数 Inter-day CV (%, n=18) |
|---|---|---|---|---|
| 猪配合饲料 Pig formula feed | 10 | 86.6 | 3.3 | 8.3 |
| 50 | 101.0 | 5.9 | 7.5 | |
| 100 | 96.8 | 5.4 | 7.7 | |
| 猪浓缩饲料 Pig concentrated feed | 10 | 84.2 | 6.7 | 9.2 |
| 50 | 83.9 | 3.2 | 7.9 | |
| 100 | 84.4 | 2.1 | 7.5 | |
| 牛精料补充料 Cattle concentrate supplement | 10 | 82.6 | 5.4 | 8.3 |
| 50 | 86.8 | 3.2 | 4.7 | |
| 100 | 85.8 | 3.0 | 5.6 | |
| 添加剂预混料 Feed additive | 10 | 90.0 | 3.9 | 8.9 |
| 50 | 98.4 | 0.8 | 6.0 | |
| 100 | 99.6 | 1.2 | 5.8 |
新窗口打开
3 讨论
3.1 UPLC-MS/MS条件优化
本研究使用UPLC上常用的BEH C18色谱柱,分别采用甲醇-水、乙腈-水、甲醇-0.1%甲酸、乙腈-0.1%甲酸作为流动相,考察不同组成和比例流动相对色谱分离和质谱电离的影响。结果表明,流动相中添加甲酸后二氢吡啶的信号强度明显提高,甲醇和乙腈作为流动相对信号强度的影响并不大,但采用乙腈作为流动相时二氢吡啶的峰形更加尖锐。质谱条件优化过程中,本研究首先采用浓度为1.0 μg·L-1的二氢吡啶标准溶液上UPLC-MS/MS测定,在正离子模式下进行母离子扫描,确定准分子离子,优化仪器毛细管电压、锥孔电压、雾化器流速等参数。然后进行子离子扫描,优化碰撞能量、驻留时间等参数,确定丰度较高的两个子离子作为定性离子,并选择其中丰度最高的作为定量离子。
3.2 二氢吡啶的MS/MS裂解规律
二氢吡啶在正离子模式下的灵敏度最高,在ESI离子源电离后,获得了质子化的准分子离子,即[M+H]+,准分子离子在碰撞室发生裂解,图2展示了二氢吡啶的主要碎片离子质谱图及可能的裂解途径。二氢吡啶的[M+H]+为m/z 254,失去乙氧基(CH3-CH2-O+,46 Da)后产生主要的的碎片离子m/z 208,m/z 208脱掉碳氧基(C=O,28 Da)产生碎片离子m/z 180,m/z 180进一步脱去乙酯基(CO-O-CH2- CH3,73 Da)后得到碎片离子m/z 108。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2二氢吡啶的子离子扫描色谱图及可能的裂解途径
-->Fig. 2Product ion spectra and the proposed fragmentation pathways of diludine
-->
3.3 样品前处理条件的优化
在药物残留分析中甲醇、乙腈是最为常用的提取溶剂,因此本研究首先对甲醇、乙腈的提取效果进行了比较,结果显示二者提取效率相当,均能够有效提取饲料中的二氢吡啶。但由于饲料样品含有大量豆粕、玉米、棉粕、鱼粉等蛋白质原料,考虑到乙腈具有较好的沉淀蛋白效果,因此本研究最终使用乙腈作为提取溶剂。饲料样品基质极其复杂,添加有大量蛋白质、维生素、氨基酸、矿物质等原料,选择合适的净化方式是确保检测方法稳定可靠的前提[24]。固相萃取(solid phase extraction,SPE)是目前最为常用的净化方法,与传统液-液萃取相比,SPE具有净化效果好、回收率高、重现性好、所需有机试剂少等优点[25,26,27]。本研究比较了药物检测中常用的C18、HLB、MCX和碱性氧化铝SPE柱,最终选择了具有双亲性的Oasis HLB柱。HLB使用亲水-亲酯的共聚物作为填料,载样量是普通C18的3倍左右,并且具有极好的重现性。一般的C18 SPE柱在上样和淋洗的过程中必须保持湿润,不能干涸,否则柱填料容易出现细微的不易察觉的裂痕,会严重影响目标化合物的回收率和重现性,而Oasis HLB柱的双亲性共聚物填料克服了这个问题,使用起来更为方便[28]。
本研究首先采用Waters推荐的处理方法,即用乙腈/水(5﹕95,v/v)为上样液,100%乙腈为洗脱液。采用此法基质干扰较为严重,UPLC-MS/MS质量离子色谱图上出现了杂质干扰峰。为了排除基质干扰,本法在推荐方法的基础上进一步进行了优化,对二氢吡啶在HLB柱上的洗脱曲线进行了研究。取空白样品按照1.3进行提取,提取液加入适量二氢吡啶标准工作液,然后加入到经过活化的HLB柱上,待自然流干后用纯水淋洗,分别以10%—100%乙腈/水溶液洗脱并收集,将所得的洗脱液过有机滤膜后进UPLC-MS/MS分析,根据所得数据绘制洗脱曲线(图3)。从图3可以看出,二氢吡啶在HLB SPE柱上具有较好的保留,只有在乙腈的比例达到80%以上时才能获得较为理想的回收率。因此,本研究选择90%乙腈/水作为洗脱溶液,以尽可能减少杂质的共洗脱,从而降低基质效应对灵敏度的影响。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3二氢吡啶在HLB柱上的洗脱曲线
-->Fig. 3Elution profile of diludine from HLB cartridges
-->
3.4 基质效应
基质效应是LC-MS/MS联用ESI接口最常见的问题,基质效应以离子抑制现象居多,离子增强则较为少见。样品前处理难以把基质完全去除,因而在上机液中往往还存在大量的杂质,且其含量要远大于目标化合物的量。在ESI电离时,这些杂质与目标化合物竞争电荷,使得目标物不能完全电离,甚至被基质所淹没而完全没有信号,导致提取液中目标物的响应值与标准溶液相比明显降低,从而影响方法的定量。降低基质效应对定量结果影响的方法有内标法、标准添加法、基质添加法等[29,30,31],其中标准添加法操作繁琐,应用较少。通过比较二氢吡啶在UPLC-MS/MS上的相对响应值(基质添加标准溶液值/标准溶液值)可以看出,相对响应值约为80%左右,说明离子抑制现象的存在。由于缺乏商品化的氘代内标,本研究采用基质添加标准曲线来定量以弥补离子抑制造成的损失。3.5 实际样品测定
采用本方法对收集的18份饲料样品(仔猪配合料2份、育肥猪配合料3份、鱼配合料3份、猪浓缩料5份、牛精料补充料2份、羊精料补充料1份、添加剂预混料3份)进行了检测,所有样品中均未检出二氢吡啶。为进一步验证方法的准确性,对该18份饲料样品进行了添加回收试验,添加二氢吡啶的浓度均为100 μg·kg -1,检测结果在87.5—99.8 μg·kg -1之间,平均回收率为92.6%。4 结论
建立了超高效液相色谱-串联质谱(UPLC-MS/MS)测定饲料中二氢吡啶的分析方法,该方法在0—500 μg·L-1浓度范围内呈现良好的线性关系,二氢吡啶的检出限为10 μg·kg -1,定量限为50 μg·kg -1,3个添加水平下的平均回收率为82.6%—101.0%,日内变异系数小于6.7%,日间变异系数小于9.2%。该方法操作简便、快速、稳定,适用于饲料中二氢吡啶的测定。The authors have declared that no competing interests exist.
