0 引言
【研究意义】小麦赤霉病(Fusarium head blight,FHB)近年来已成为世界性病害,造成小麦大面积减产[1]。小麦赤霉病的主要致病菌为禾谷镰孢(Fusarium graminearum)[2,3,4],其不仅可以影响小麦产量,还可产生真菌毒素脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)和玉米烯酮(zearalenone,ZEA)等 [5,6],严重影响小麦的品质。近年来,禾谷镰孢全基因组测序的工作已经完成[7],目前已经开始进行基因组[8]、蛋白质组[9]、转录组[10,11]和代谢组学[12]等方面的研究。碳源代谢作为真菌生长发育重要的代谢途径之一,其代谢机制对于生长发育、次生代谢产物、抗病性等方面都具有重要作用[13]。研究禾谷镰孢碳源代谢调控因子基因的功能,明确其在生长发育阶段和致病力方面的作用,对于研究禾谷镰孢中碳源代谢机制具有至关重要的意义。【前人研究进展】微生物可以利用多种碳源物质,但当生长环境中存在碳源葡萄糖时,真菌会首先使用葡萄糖作为碳源,因此葡萄糖被称为优先碳源。当生长环境中缺少葡萄糖时,其他碳源如半乳糖、蔗糖、麦芽糖和木聚糖等就会被吸收和利用,这些碳源被称为次级碳源[14]。在酵母和丝状真菌中,优先碳源葡萄糖的存在会抑制吸收次级碳源的相关结构基因转录和表达,故葡萄糖抑制也被称为碳代谢抑制(carbon catabolite repression,CCR)[13]。碳源代谢调节机制就是使葡萄糖在生长环境中能够被优先吸收和利用,如果生长环境中没有葡萄糖,酵母和丝状真菌就可以选择性地吸收和利用次级碳源。这种调节机制可以确保许多编码酶类和通透酶类的结构基因能够被激活表达以吸收和利用次级碳源[15]。在酵母和丝状真菌中,碳源代谢受Mig/CreA转录因子调控,多数结构基因的转录可被Mig/CreA转录因子激活。Mig/CreA转录因子含有两个Cys2/Cys2-锌指结构,能够识别目标基因启动子序列中DNA序列5′-SYGGRG-3′(其中,S代表C、G,Y代表C、T,R代表A、G)[16]。酿酒酵母(Saccharomyces cerevisiae)中,葡萄糖抑制可被碳源代谢调节因子Mig1和Mig2调控,当有葡萄糖存在时,与碳源代谢相关的结构基因,如GAL、SUC2、MAL和STA1等,其转录水平都会受到抑制[17,18]。Mig1能够结合碳源代谢相关结构基因的启动子区,与碳源共抑制因子Ssn6和Tup1形成复合体抑制碳源代谢相关基因的转录[19,20,21]。Mig1的活性受到蛋白激酶Snf1/Snf4的调节,当环境中葡萄糖含量较高时,Mig1蛋白会被去磷酸化且定位于细胞核,抑制其他结构基因的转录。当葡萄糖含量较低时,Mig1蛋白会被迅速磷酸化并转移至细胞质中[22]。然而MIG1的缺失,并没有完全消除葡萄糖抑制机制,例如SAT1转录水平依然被抑制。现已研究发现,Mig2作为另一碳源代谢因子也参与了调节,起着次要作用[23]。博伊丁假丝酵母(Candida boidinii)中,葡萄糖能够完全抑制甲醇诱导基因的表达,但CbMIG1基因敲除突变体却能加强甲醇诱导的编码醇氧化酶AOD1的表达,不过CbMIG1基因敲除突变体在各种碳源培养基中并没有生长变化[24]。尖镰孢(Fusarium oxysporum)中,CreA同源蛋白Cre1能够抑制细胞壁降解酶CWDEs和吸收C2关键酶ICL1的转录水平[25]。构巢曲霉(Aspergillus nidulans)中,CCR同样可被转录因子CreA调控。在葡萄糖存在的情况下,编码木聚糖酶、纤维素酶和阿拉伯糖酶等酶类的结构基因会被抑制转录。CreA能够直接结合木聚糖酶编码基因XLNA和XLND启动子区来调节其表达[26]。此外,碳源代谢因子还参可与次生代谢产物的合成[27,28]。构巢曲霉中,青霉素合成相关基因IPNA能够被CreA抑制[27]。在藤仓赤霉(Gibberella fujikuroi)中,许多赤霉素相关基因中都能找到潜在的CreA结合位点。说明CREA可能参与了额外的激素水平的调节[28]。【本研究切入点】禾谷镰孢中碳源代谢调控因子编码基因为FgCREA(FGSG_09715)。碳源代谢是微生物生长的重要代谢途径,但在禾谷镰孢中尚未报道过碳源代谢调控因子的功能研究。【拟解决的关键问题】利用同源重组和原生质体转化等手段,获得禾谷镰孢FgCREA的敲除突变体Fgcrea,鉴定该基因可参与调控禾谷镰孢的营养生长、有性生殖和致病力等方面,为禾谷镰孢中碳源代谢机制的研究提供理论依据。1 材料与方法
试验于2014—2016年在西北农林科技大学西农普度联合中心完成。1.1 材料
1.1.1 菌株和试剂 禾谷镰孢野生型PH-1菌株[29]、突变体Fgcrea菌株、质粒pCB1003、载体PFL2和菌株DH10B等均保存于西北农林科技大学西农普度联合中心实验室。Tap酶和限制性内切酶购于Fermentas公司,DNA胶回收试剂盒购于Bio-Teke公司,小量质粒提取试剂盒购于OMEGA公司,DNA poly I klenow试剂盒购于Promega公司,其他常用试剂均为国内采购。1.1.2 培养基和溶液 马铃薯葡萄糖琼脂培养基(PDA)培养基:PDA粉(国产)38 g·L-1;羟甲基化纤维素(carboxymethylcellulose,CMC)培养基:羟甲基化纤维素(低黏度,Sigma公司)15 g·L-1,硝酸铵1g·L-1,磷酸二氢钾1 g·L-1,七水硫酸镁0.5 g·L-1,酵母提取物1g·L-1; YEPD(yeast extract peptone dextrose)液体培养基:酵母提取物3 g·L-1,蛋白栋10 g·L-1,葡萄糖20 g·L-1;胡萝卜培养基:100 g·L-1胡萝卜(用榨汁机榨成汁),琼脂粉10 g。保存于室温。
1×STC缓冲液、PTC缓冲液、TB3液体培养基、Bottom培养基/Top培养基、燕麦培养基、LB液体/固体培养基等具体配方详见文献[29]。1.2 mol·L-1 KCl溶液、原生质体缓冲液(酶解液)、CTAB抽提液、Southern变性转移液、Southern中和液,20×SSC、50% PEG3350等主要溶液配方详见文献[30]。
1.2 氨基酸序列获得与分析、结构域预测及结合位点位置查找
从酵母数据库(SGD: http://www.yeastgenome. org/)中得到酿酒酵母的Mig1蛋白序列,然后利用NCBI数据库进行蛋白序列比对,找到禾谷镰孢中Mig1/CreA蛋白同源序列,之后进行反向查找,最终确定禾谷镰孢中CreA同源蛋白基因号和氨基酸序列。从NCBI数据库或者真菌数据库中获得酿酒酵母、裂殖酵母(Schizosaccharomyces pombe)、玉米黑粉菌(Ustilago maydis)、粗糙脉孢(Neurospora crassa)、稻瘟菌(Magnaporthe oryzae)、构巢曲霉、米曲霉(Aspergillus oryzae)、棒曲霉(Aspergillus clavatus)、禾谷镰孢、拟轮枝镰孢(Fusarium verticilloides)、尖镰孢等碳源代谢调节因子蛋白序列,利用MEGA软件进行病原真菌碳源代谢调节因子蛋白的系统进化树构建。并用InterProScan(http://www.ebi.ac.uk/interpro/)数据库对其结构域进行预测。通过NCBI数据库查找禾谷镰孢真菌毒素DON生物合成相关基因TRI家族主要基因和碳源吸收相关基因ICL1和SUC2以及CWDEs基因XYL2/ARA1/PG1。下载相关基因启动子区1 000 bp,查找FgCREA基因结合位点5′-SYGGRG-3′(其中,S代表C、G,Y代表C、T,R代表A、G)。1.3 重组片段的扩增和转化子的筛选
利用Split-PCR的方法进行基因序列重组,之后进行禾谷镰孢野生型PH-1原生质体转化,用潮霉素(HPH)抗性进行初步筛选,提取初步筛选的转化子DNA,利用4对引物进行PCR验证,分别为1:H852-F+H850-R,2:FgCREA-JF+H855-R,3:H856- F+FgCREA-JR以及4:FgCREA-OF+FgCREA-OR,获得PCR验证的敲除转化子。根据目的基因FgCREA的DNA序列以及敲除后的FgCREA预设DNA序列选取限制性内切酶KpnⅠ进行Southern blot验证。Split-PCR和Southern blot的具体试验方法参照文献[31]。将含有FgCREA的互补载体转入PCR验证的敲除转化子原生质体中,利用新潮霉素(G418)抗性进行初步筛选,观察表型是否能够恢复(表1)。Table 1
表1
表1禾谷镰孢FgCREA基因敲除和互补所用引物
Table 1Primers used for FgCREA knock-out and complementation
| 引物 Primer | 序列 Sequence (5′→3′) |
|---|---|
| FgCREA-AF | TTGTGACTCTTCATCTTGCTCGCC |
| FgCREA-AR | TTGACCTCCACTAGCTCCAGCCAAGCCGAAGGTGCACTGCGACATCAAGG |
| FgCREA-BF | GAATAGAGTAGATGCCGACCGCGGGTTGTCTTCAGCCGAATGACCGACGT |
| FgCREA-BR | GAGTGTGTGCGTGTTCAGTAGCC |
| FgCREA-OF | CGGCTGAAAAGGAAATCG |
| FgCREA-OR | TGGTGGCGGTTGTTATTG |
| FgCREA-JF | CGCATTGAGCATAAGACAAC |
| FgCREA-JR | AGTATCCGTAGCGAACCGAATC |
| Com-F | CGACTCACTATAGGGCGAATTGGGTACTCAAATTGGTAAGACAACTGTCCCTTCCTC |
| Com-R | CACCACCCCGGTGAACAGCTCCTCGCCCTTGCTCACTCAACTCCCATCAAGGCC |
| YG-F | GATGTAGGAGGGCGTGGATATGTCCT |
| HY-R | GTATTGACCGATTCCTTGCGGTCCGAA |
| HYG-F | GGCTTGGCTGGAGCTAGTGGAGGTCAA |
| HYG-R | AACCCGCGGTCGGCATCTACTCTATTC |
| H850-F | TTCCTCCCTTTATTTCAGATTCAA |
| H852-R | ATGTTGGCGACCTCGTATTGG |
| H855-F | GTCGATGCGACGCAATCGT |
| H856-R | GCTGATCTGACCAGTTGC |
新窗口打开
1.4 禾谷镰孢相关菌株表型分析
生长速率测定:将活化相同天数的野生型菌株和突变体菌株的菌饼接种至PDA固体培养基中,将菌饼正面朝下接到90 mm培养皿中心位置,各做5个重复。倒置培养皿于25℃恒温培养箱中培养3 d,测量菌落半径并拍照。菌落边缘菌丝形态的观察:将15 mL 1/2 CM固体培养基倒至装有载玻片的90 mm无菌玻璃皿内。接种小块菌株于凝固载玻片的两端。各做5个重复。25℃恒温培养16—24 h(根据菌株的生长速度决定),使菌丝刚好长到载玻片的边缘位置。用无菌刀片将载玻片周围培养基划掉,将载玻片取出。在显微镜下进行观察,微分干涉照相。
产孢量测定:将活化相同天数的野生型菌株和突变体菌株用打孔器在菌落边缘打孔。转移一块菌饼至装有50 mL CMC培养基的150 mL三角瓶中。各做5个重复。在25℃恒温摇床中,175 r/min培养5 d,收集滤液用血球计数板计数CMC滤液中分生孢子的浓度。
分生孢子、分生孢子萌发形态观察:分生孢子观察时,直接吸取菌株CMC培养液,置于显微镜下观察分生孢子形态并进行微分干涉照相。分生孢子萌发观察时,首先收集CMC培养液中的分生孢子,然后转移分生孢子至150 mL三角瓶(内含50 mL YEPD)中。在25℃恒温摇床中,175 r/min培养12 h后用显微镜观察并进行微分干涉照相。
有性生殖检测:将活化相同天数野生型菌株、突变体菌株的菌落边缘菌饼接种至胡萝卜培养基的中心位置,各做5个重复。在25℃恒温培养箱培养7 d后加入0.1% Tween-20湿润气生菌丝,使其贴伏于培养基表面,晾干。在黑光灯﹕黑暗=12 h﹕12 h,25℃条件下继续诱导培养,如果培养皿中有气生菌丝生长出来则要及时压(操作同上一步)。4周后对培养皿进行拍照,在显微镜下观察压开的子囊壳内的子囊及子囊孢子形态。
过氧化氢和氯化钠压力筛选:分别将活化相同天数的野生型菌株和突变体菌株的菌饼接到含0.03% H2O2、0.7 mol·L-1 NaCl的PDA平板两侧,各做5个重复。25℃恒温培养6 d后,观察菌落生长情况,并照相。
致病力检测:分别收集野生型菌株和突变体菌株的分生孢子悬浮液,然后将分生孢子悬浮液浓度调制(1.5—2.0)×105个孢子/mL,接种扬花期小麦感病品种Norm,各做15个重复,保湿48 h,两周后观察致病情况。
2 结果
2.1 禾谷镰孢FgCreA序列分析和相关基因启动子区FgCREA结构位点预测
从酵母数据库中获得已经报道的酿酒酵母碳源代谢因子Mig1的氨基酸序列,利用NCBI BLASTP数据库(https://www.ncbi.nlm.nih.gov/)选定生物名称为禾谷镰孢PH-1(taxid:569360),得到一个同源性最高(73%)的基因FGSG_09715(XP_011327987),氨基酸序列416 aa。对预测的禾谷镰孢FgCreA转录因子FGSG_09715基因蛋白序列进行结构域分析(http://www.ebi.ac.uk/interpro/),发现FgCREA具有两个锌指结构(IPR013087,66-86;IPR013087,94-116)(图1-a)。利用MEGA软件进行碳源代谢调节因子在真菌中的同源性分析。通过比对结果可以看出,碳源代谢调节因子在各类真菌中存在较高程度的同源性(图1-b)。同时,预测了FgCREA在禾谷镰孢真菌毒素DON生物合成TRI家族和碳源吸收相关结构基因启动子区的DNA结合位点,结果表明相关基因启动子区域均有潜在的FgCREA结合位点(表2)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1锌指结构示意图及进化树分析
-->Fig. 1The zinc finger structure and phylogenetic comparison of FgCreA among different species
-->
Table 2
表2
表2 FgCREA在DON生物合成TRI家族主要基因及碳源吸收相关基因启动子区潜在结合位点
Table 2Putative FgCreA binding sites in the promoter regions (within 1 000 bp) of TRI genes for DON biosynthesis and the carbon source absorbing related genes
| 基因Gene | Broad number | 结合位点位置和序列Position of binding site and sequence | 基因功能Gene function |
|---|---|---|---|
| TRI1 | FGSG_00071 | -265, -459, -977 GTGGGG/-917 GGCCTC | 细胞色素P450加氧酶P450 oxygenase[32] |
| TRI3 | FGSG _03534 | -228, -641, -837 GTGGGG | 碳15乙酰转移酶C-15 acetyltransferase[33] |
| TRI4 | FGSG _03535 | -145 GCGGGG/-349, -460 GACCCC | 细胞色素P450加氧酶P450 oxygenase[34] |
| TRI5 | FGSG _03537 | -890 CGCCCC | 单端孢霉烯合成酶Trichodiene synthase[35] |
| TRI6 | FGSG _03536 | -999 CGCCTC | 调节基因Regulatory gene[36] |
| TRI7 | FGSG _03533 | -22 CACCCC /-207 CTGGGG /-541 GACCTC/-686 GGCCCC | 碳4乙酰转移酶C-4 acetyltransferase[37] |
| TRI8 | FGSG _03532 | -120 CACCCC/-128 GACCCC/-516 GGCCTC | 碳3脱乙酰基C-3 deacetylation[38] |
| TRI10 | FGSG _03538 | -11 CACCCC/-640 CTGGGG/-994 GGCCTC | 调节基因Regulatory gene[36] |
| TRI12 | FGSG _03541 | -90 CACCCC/-216 CTGGAG/-557 GGCCTC | 外排泵Efflux pump[39] |
| TRI101 | FGSG _07896 | -45 GGCCTC/-319 GTGGGG | 碳3乙酰转移酶C-3 acetyltransferase[40] |
| XYL2 | FGSG_04922 | -290 CACCCC | D-木桐糖还原酶同源基因D-xylulose reductase homology |
| ARA1 | FGSG_07908 | -204 CACCTC/-239, -333 CGCCTC/-801 GTGGAG/-850 GACCCC | D-阿拉伯糖1-脱氢酶同源基因 D-arabinose1-dehydrogenase (NAD(P)(+)) homology |
| ICL1 | FGSG_09896 | -415 GTGGAG/-782 CCGGAG | 异柠檬酸裂合酶Isocitrate lyase[41] |
| PG1 | FGSG_11011 | -223 GTGGAG | 多聚半乳糖醛酸内切酶1前体 Endopolygalacturonase 1 precursor[42] |
| SUC2 | FGSG_02339 | -99 GTGGAG/-145 GCGGGG | 蔗糖酶同源基因Invertase homology |
新窗口打开
2.2 FgCREA基因敲除转化子与互补菌株的筛选和验证
通过Split-PCR的方法构建FgCREA的重组片段,然后转入禾谷镰孢野生型菌株PH-1的原生质体中,通过潮霉素(HPH)抗性筛选得到转化子。对筛选得到的转化子进行分子水平验证(图2-b),同时利用Southern blot对PCR验证获得的敲除转化子进一步验证,获得2个FgCREA基因敲除突变体Fgcrea(图2-d)。同时,克隆并构建互补载体Com-CREA,转化到Southern blot验证后的敲除突变体原生质体中,但由于敲除突变体生长速率太慢,得到的原生质体数量太少,目前并没有得到互补菌株。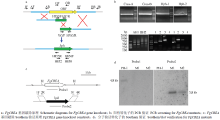 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2FgCREA基因敲除突变体的鉴定和相关突变体的验证
-->Fig. 2Identification of FgCREA gene knockout mutants and verification of related mutants
-->
2.3 FgCREA的缺失对营养生长的影响
FgCREA基因敲除突变体Fgcrea在PDA培养基上培养3 d后,发现突变体菌落生长速率比野生型PH-1菌株减慢了90%左右(图3-a、表3)。菌落边缘观察发现,突变体Fgcrea在72 h时气生菌丝相比野生型变得致密且分枝变多(图3-b)。结果表明,FgCREA对菌丝的正常生长是必需的,但应该只是严重影响生长速率,并不影响菌丝的形态。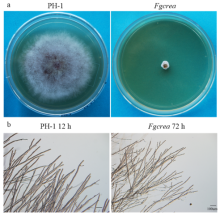 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3FgCREA基因敲除突变体的菌落形态和菌丝生长
-->Fig. 3Colony morphology and hyphal growth of the FgCREA gene knockout mutant
-->
Table 3
表3
表3FgCREA基因敲除突变体的生长速率及产孢量
Table 3Growth rate and conidiation of the FgCREA knockout mutant
| 菌株 Strain | 生长速率 Growth rate (mm·d-1) | 产孢量 Conidiation (×106 conidia/mL) |
|---|---|---|
| PH-1 | 12.50±0.13a | 1.25±0.11a |
| Fgcrea | 1.24±0.03b | 0.15±0.02b |
新窗口打开
2.4 FgCREA基因缺失对孢子萌发速率的影响
血球计数板统计发现,突变体Fgcrea分生孢子的产量大约为野生型PH-1菌株的12%(表3)。观察Fgcrea突变体分生孢子产生过程,发现FgCREA的缺失并未使产孢结构受到影响,产孢量下降应该是由于突变体生长缓慢造成的。观察还发现突变体Fgcrea分生孢子形态与野生型PH-1菌株的基本一致。对突变体Fgcrea分生孢子萌发12 h的菌丝形态观察发现,虽然其萌发速率降低,但孢子顶端、基部和中间的细胞也均会形成芽管(图4)。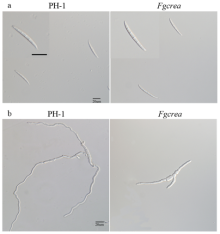 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4FgCREA基因敲除突变体分生孢子形态(a)和分生孢子萌发形态(b)
-->Fig. 4Conidium morphology (a) and germination (b) of the FgCREA gene knockout mutant
-->
2.5 FgCREA基因缺失对有性生殖的影响
将活化好的突变体Fgcrea和野生型PH-1菌株接种于胡萝卜培养基25℃恒温培养10 d后(突变体生长速率过慢),使用0.1%的tween-20处理菌丝,之后以12 h黑光灯﹕12 h黑暗25℃诱导培养28 d,观察并照相。结果发现突变体Fgcrea只能产生较少数量的子囊壳(图5-a)。压开子囊壳,观察子囊以及子囊孢子的形态,发现FgCREA的缺失并未影响子囊和子囊孢子的形成(图5-b)。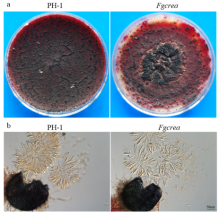 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5FgCREA基因敲除突变体子囊壳、子囊和子囊孢子形态
-->Fig. 5Perithecia, asci and ascospore morphology of the FgCREA gene knockout mutant
-->
2.6 FgCREA基因缺失对细胞渗透压的影响
通过压力筛选(图6),发现H2O2压力胁迫对于突变体Fgcrea的相对抑制率为1%,说明FgCREA的缺失对氧化还原通路没有影响。但突变体Fgcrea对0.7 mol·L-1的NaCl表现敏感,几乎停止生长,相对抑制率为95%。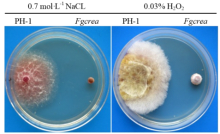 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6FgCREA基因敲除突变体的压力筛选
-->Fig. 6Stress assay of FgCREA gene knockout mutant
-->
2.7 FgCREA基因缺失对致病力的影响
利用分生孢子悬浮液接种扬花期小麦穗部,发现突变体Fgcrea侵染小麦穗的致病力严重下降,仅在小麦穗接种点发病(图7)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7FgCREA基因敲除突变体对小麦穗部的致病力
-->Fig. 7Infection assay of the FgCREA gene knockout mutant on wheat spikes
-->
3 讨论
利用生物信息学方法,发现禾谷镰孢中碳源代谢调节因子只有一个FgCREA,即FGSG_09715。FgCREA与丝状真菌和酵母中碳源代谢调节因子结构类似,均具有两个C2H2锌指结构,能够结合启动子区DNA序列5′-SYGGRG-3′。通过构建进化树,发现CREA同源基因的进化关系与物种进化趋势一致,说明FgCREA应为酿酒酵母碳源代谢因子MIG1的直系同源基因。因此,FgCREA的功能应与碳源代谢相关。FgCREA在细胞壁降解酶CWDEs基因XYL2、ARA1、PG1,异柠檬酸裂解酶基因ICL1,蔗糖酶基因SUC2启动子区均有DNA结合位点,这些碳源吸收结构基因在酿酒酵母和尖镰孢中均已报道能够与MIG1/ CREA互作或者可受到MIG1/CREA基因调控[43]。突变体Fgcrea在生长速率、产孢量、分生孢子萌发速率和有性生殖方面均存在严重缺陷,应该是由于FgCREA基因缺失导致利用次级碳源的相关结构基因转录水平下降所致[44]。酿酒酵母中,Mig1和Kin2互作[45],Kin2和Ssk2互作[46],而Ssk2蛋白是真菌渗透压调控Hog1信号通路中的MAPKKK(mitogen activated protein kinase kinase kinase)[47]。突变体Fgcrea对渗透压的敏感性表明在禾谷镰孢中,FgCREA可能也通过与FgSsk2(FGSG_00408)互作而参与调控渗透压信号通路。突变体Fgcrea侵染小麦穗部仅在接种点发病,表明致病力下降的主要原因是受到生长速率和分生孢子萌发率的影响。因为侵染试验中接种的孢子数量是相同的,所以产孢量对致病性的影响并没有作为考虑因素。另外,突变体Fgcrea对渗透压敏感,可能会通过Hog1途径而影响致病力[48]。因此,突变体Fgcrea致病力下降的主要原因应该是生长速率减慢、分生孢子萌发率下降和渗透压敏感。
禾谷镰孢中葡萄糖不能抑制真菌毒素DON生物合成家族TRI4/TRI5的表达以及DON的生物合成,但蔗糖却能够强烈诱导。在用蔗糖作为唯一碳源的培养基中额外加入葡萄糖,也不能够抑制DON生物合成,说明碳源代谢抑制CCR应该是没有参与DON生物合成系统[49]。但FgCREA在DON生物合成TRI家族主要基因启动子区均有DNA结合位点,表明FgCreA应该是与DON生物合成相关。研究已发现,酿酒酵母中Mig1蛋白能够和促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路中Pmk1途径中心激酶Set7互作[50]。敲除禾谷镰孢中的激酶基因FgSte7(FGSG_09903)可导致DON生物合成量急剧降低且影响病原菌在小麦穗部的定殖和扩展[48,51]。Mig1蛋白同时还可与环腺苷酸单磷酸-蛋白激酶A(cyclic adenosine phosphate-protein kinase A,cAMP-PKA)通路中的cAMP磷酸二酯酶基因PDE2互作[52]。敲除FgPDE2可以激活PKA活性并增加DON的合成[53]。禾谷镰孢中FgCREA是否可与FgSte7和FgPde2蛋白互作,是否可参与调控DON生物合成还需进一步验证。白色念珠菌(Candida albicans)中,CaMig1蛋白缺乏潜在的激酶Snf1磷酸化位点[54]。子囊菌红褐肉座菌(Hypocrea jecorina)中,Cre1虽然具有潜在的激酶Snf1磷酸化位点,但激酶Snf1并不能够磷酸化碳源代谢调节因子Cre1[55],通过生物信息学方法预测到禾谷镰孢中CreA蛋白具有磷酸化位点,接下来将会进一步验证CreA蛋白是否能够被激酶Snf1磷酸化。
4 结论
利用Split-PCR和Southern blot等方法得到禾谷镰孢中碳源代谢调节因子FgCREA基因缺失突变体。FgCREA能够影响营养生长、产孢量、孢子萌发速率、有性生殖、致病力和对钠盐的渗透压敏感度,但是否参与了碳源代谢抑制和DON生物合成还需后期验证。The authors have declared that no competing interests exist.
