0 引言
【研究意义】稻瘟病是由稻瘟病菌(Magnaporthe oryzae)引起的全球性真菌性病害,目前世界上有85个国家已出现该病害,每年减产10%—35%[1]。实践证明,选育和使用水稻抗病品种是控制稻瘟病最为经济有效的措施。植物瞬时表达系统以宿主单个细胞为基础,转入外源的DNA在短时间内进行蛋白质高水平表达。由于水稻原生质体的生物功能在一定程度上与完整的细胞相似,为研究植物细胞内信号转导提供了非常有利的细胞环境[2]。利用水稻叶鞘原生质体瞬时表达系统表达Pik1-H4、Pik2-H4及AvrPik-H4蛋白并进行亚细胞定位,有助于目的基因分子功能及抗病基因和无毒基因互作机制的研究。【前人研究进展】水稻抗稻瘟病蛋白基因Pik-H4由Pik1-H4和Pik2-H4组成,属于典型的NBS-LRR类基因,对广东的稻瘟病菌生理小种大多表现出高抗[3]。AvrPik-H4为编码113 aa的小分子分泌蛋白,不含有保守区域,容易发生突变。相较稳定的转基因表达系统,瞬时表达体系具有宿主范围广、周期短、检测快速及高通量的特点,已被广泛应用于分子生物学研究领域,如启动子活性分析[4]、Cas9编辑效率检测[5-6]、mRNA衰变[7]、microRNAs对靶基因的调控[8]、蛋白功能研究[9]、信号转导[10-11]等。目前主要通过基因枪法、农杆菌渗透法、聚乙二醇(PEG)介导法、电击法及植物病毒载体介导对目标基因进行转化[12],在小麦[5]、葡萄[9]、玉米[10]、水稻[13]、拟南芥[14]、樱桃[15]、莴苣[16]、马铃薯[6,17]、烟草[18]等都有应用。水稻叶表面具有蜡质层,不利于原生质体的游离,如鹿连明等[19]利用烟草的瞬时表达体系研究水稻条纹病毒(Rice stripe virus,RSV)的相关蛋白互作,但基因产物的正确折叠、亚细胞精细定位都依赖于宿主特异性表达系统[20]。近几年,有关水稻原生质体瞬时表达系统已经有相关报道,转化效率也相对提高[21],如利用Co-IP技术验证互作蛋白[13],探索ABA信号通路[22],邻近生物素(BioID)技术筛选近端蛋白[23]等。【本研究切入点】尽管对水稻原生质体瞬时表达系统的应用已经有少量报道,但原生质体游离转化效率限制了该技术的应用,利用该技术进行抗稻瘟病基因蛋白的表达还未见报道。【拟解决的关键问题】探索原生质体游离及转化的最佳时间,通过将目的片段融合绿色荧光蛋白(GFP)构建载体,利用水稻叶鞘原生质体瞬时表达体系成功表达目标蛋白,在激光共聚焦扫描显微镜下观察蛋白在细胞内的表达部位,并且利用Western blot技术验证结论的真实性,为水稻原生质体瞬时表达系统的推广应用提供依据,为水稻抗病相关基因的功能性研究及互作蛋白的筛选打下基础。1 材料与方法
试验于2016年10月至2017年3月在华南农业大学国家植物航天育种技术工程研究中心完成。1.1 试验材料
水稻材料为H4以及中二软占,H4是经过空间搭载诱变的中二软占突变体经地面选育的广谱、高抗的水稻优质种质资源。1.2 载体构建
试验中所有的瞬时表达载体均以pYL322d1- eGFPn为骨架,如图1所示,由花椰菜花叶病毒(CaMV)35S启动子、绿色荧光蛋白(GFP)片段和NOS终止子组成。目标基因Pik1-H4、Pik2-H4克隆于高抗稻瘟病水稻品种H4的cDNA,AvrPik克隆于稻瘟病菌GD0193,利用CE Design V1.03软件设计引物,如表1所示,去除开放阅读框架片段终止密码子,利用同源重组方法构建p35S-Pik1-H4/Pik2-H4/ AvrPik- H4-GFP载体。载体骨架由亚热带农业生物资源保护与利用国家重点实验室刘耀光研究员惠赠。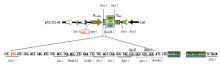 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1322-d1-eGFPn载体结构图
-->Fig. 1Maps of 322-d1-eGFPn vector
-->
Table 1
表1
表1引物寡核苷酸序列
Table 1The oligonucleotide sequences of primer
| 引物名称 Primer name | 核苷酸序列 Oligonucleotide sequence |
|---|---|
| Pik1-H4-GFP-F | tcgagctcaagcttcgaattcATGGAGGCGGCTGCCATG |
| Pik1-H4-GFP-R | gctcaccatcaggatcccgggGCTAGTAGTTTCTGTTTGAATTTCAATA |
| Pik2-H4-GFP-F | tcgagctcaagcttcgaattcATGGAGTTGGTGGTAGGTGCTT |
| Pik2-H4-GFP-R | gctcaccatcaggatcccgggTGCAGTGACGATGCCATCAA |
| AvrPik-GFP-F | tcgagctcaagcttcgaattcATGCGTGTTACCACTTTTAACACAT |
| AvrPik-GFP-R | gctcaccatcaggatcccgggAAAGCCGGGCCTTTTTTTC |
新窗口打开
1.3 水稻幼苗种植
挑选饱满的H4水稻种子,去壳,75%乙醇消毒2 min,2%的次氯酸钠150 r/min消毒30 min。在超净工作台中用灭菌水洗净残留的次氯酸钠后,将种子接种到1/2 MS培养基中,放到恒温培养箱,25℃,光周期为12 h光照/12 h黑暗培养10 d左右。1.4 水稻原生质体制备
参照YANG等[13]的原生质体游离方法,沿根部将水稻幼苗剪下,用锋利的刀片将水稻叶鞘切割成0.5—1 mm的片段,放到0.6 mol·L-1甘露醇中,室温预质壁分离30 min,吸干残留的甘露醇,用W5(154 mmol·L-1 NaCl,125 mmol·L-1 CaCl2,5 mmol·L-1 KCl,2 mmol·L-1 MES,pH 5.7)溶液稍清洗后加入现配酶液(0.5 mol·L-1甘露醇,10 mmol·L-1 MES,1.5%纤维素酶,0.75%离析酶,10 mmol·L-1 CaCl2,0.1% BSA),30℃,60 r/min,酶解4—6 h。在普通光学显微镜40×物镜下观察细胞,视野中有20—40个完整的细胞即可。用200目筛子过滤酶液,加入10 mL预冷的W5溶液于酶解的残渣快速手摇1 min,再次过滤,合并滤液,300×g,离心5 min,吸出上清液。向BD管中加入2 mL预冷的W5溶液,让原生质体重新悬浮,200×g,离心3 min,重复此步骤一次。用500 μL W5重悬沉淀,置于冰上30 min后,150×g,离心2 min,去除上清,用1 mL MMg悬浮细胞(使终浓度约为107个/mL)。1.5 PEG介导水稻原生质体转化
在100 μL原生质体中,加入高纯度10 μg(约10 μL)质粒,再加入110 μL 40% PEG(40% PEG4000,0.3 mol·L-1甘露醇,0.1 mol·L-1 CaCl2),混匀后,28℃黑暗中横放15 min。加入500 μL的W5溶液终止反应,充分混匀,300×g离心5 min,去除上清,加入600 μL WI溶液(4 mmol·L-1 MES,pH 5.7,0.5 mol·L-1甘露醇,20 mmol·L-1 KCl),28℃黑暗中培养14—16 h。1.6 亚细胞定位
使用激光扫描共聚焦显微镜(LSM 7 DUO)观察转化后含有GFP蛋白以及GFP融合蛋白的原生质体,GFP、mCherry的激发波长分别为488、561 nm,发射波长分别为530—560、580—620 nm。叶绿体自发荧光的激发波长为488 nm,发射波长为650—750 nm。1.7 Western验证
收集转化后的原生质体,300×g,离心6 min,尽量去除上清。加入20 μL的SDS-PAGE样品缓冲液(50 mmol·L-1 Tris-HCl,2% SDS,0.1%溴酚蓝,10%甘油,1%巯基乙醇)100℃煮沸5 min,提取原生质体中的总蛋白。室温离心1 min,吸取上清,用10%的SDS-聚丙烯凝胶(Bio-Rad)200 V 35 min分离样品的蛋白,300 mA 3 h将蛋白转到硝酸纤维素膜上,使用一抗Anti-GFP温室孵育1 h,二抗Anti-Mouse温室孵育1 h,使用化学发光试剂(Thermo Scientific)温室孵育5 min后,进行观察。1.8 实时荧光定量PCR分析
为确定转化的最佳时间,在原生质体中转入GFP载体,分别提取转化10、12、14、16、18、20、22、24 h的产物,300×g离心5 min,弃上清,加入500 μL TRIzol,涡旋15 s,温室静置3 min。加入150 μL氯仿,涡旋15 s,静置2 min,4℃,12 000×g离心5 min,吸取水相到新的离心管,加入250 μL预冷的异丙醇,混匀后温室放置3 min,4℃,12 000×g离心5 min,弃上清,加入1 mL 75%乙醇,简单混匀后4℃,12 000×g离心2 min,去除残留酒精,加入20 μL RNase水溶解沉淀。分别取1 μg RNA用SMARTScribeTM Reverse Transcriptase试剂盒(TaKaRa Clontech)进行逆转录,反应条件:30℃ 10 min,42℃ 20 min,99℃ 5 min,4℃ 5 min,瞬间离心后,将样品浓度稀释至300—500 ng,以此为模板做qPCR定量分析,设计PCR引物GFP-F:GACGACGGCAACTACAAGAC、GFP-R:TCGGCCATGATATA GACGTT,产物为163 bp,UBQ管家基因作为对照。使用AceQ qPCR SYBR@Green MasterMix试剂盒(Vazyme),反应条件:95℃ 5 min,95℃ 10 s,60℃ 30 s,40个循环。
2 结果
2.1 瞬时表达载体的鉴定
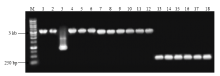
将目的片段分别与GFP进行组装,如图2所示,选用EcoRⅠ、SmaⅠ两个限制性内切酶将载体线性化,选用这两个酶切位点插入目的片段不会导致移码,保证目标蛋白的正确表达。经PCR检测后结果如图3所示,除了Pik1-H4-GFP有一个扩增片段不正确以外,其余都正确,挑取PCR结果正确质粒送去公司测序,结果表明组装成功。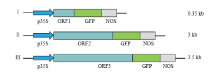 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2瞬时表达载体组装图
-->Fig. 2Schematic representation of transient expression constructsⅠ: AvrPik; Ⅱ: Pik1-H4; Ⅲ: Pik2-H4
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3瞬时表达载体PCR检测图
-->Fig. 3Identification of the transient expression plasmid detected by PCR M: 1 kb Marker; 1-6: Pik1-H4-GFP; 7-12: Pik2-H4-GFP; 13-18: AvrPik-GFP
-->
2.2 水稻原生质体游离
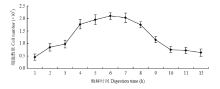
选取茁壮、叶鞘较硬的幼苗,用手术刀片将叶鞘切割成小段(图4)。通过血球计数板统计获得不同游离时间细胞的数目,游离的最佳时间为4—6 h,在3—4 h细胞游离数目增长速度最快,4—6 h细胞数量趋于平稳,6 h以后细胞总量呈现下降趋势,特别是7 h以后,显微下细胞碎片增多,细胞死亡速度加快(图5)。随着游离时间的增加,细胞总数目增多,导致供氧不足,初始的游离细胞活力下降,加上游离过程中的机械碰撞使细胞膜破碎,从而导致总体细胞数目呈现下降趋势。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4水稻叶鞘原生质体游离图a:水稻叶鞘游离过程图Process of rice leaf sheath protoplasts;b:水稻叶鞘原生质体图Observation of protoplasts isolation from leaf sheath
-->Fig. 4Isolation of rice leaf sheath protoplasts
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5酶解时间对原生质体产量的影响
-->Fig. 5Effect of digestion time on the yield of protoplasts
-->
2.3 实时荧光定量PCR分析最佳转化时间
GFP蛋白在蓝色波长范围的光线激发下,发出绿色萤光。将GFP载体转化到原生质体中,28℃,经过14—16 h的暗培养后,吸取5 μL在荧光显微镜下进行检测,可以看到GFP蛋白发出的荧光(图6)。从图中可以看出,GFP载体有较高的转化效率,经过暗培养后,大部分细胞还保持有较完整的形态,较高的生命活力。图中也存在一部分细胞碎片,说明存在一部分的细胞死亡,有一定比例的损失。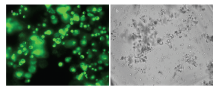 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6水稻叶鞘原生质体GFP转化 a:GFP荧光 GFP filter;b:白光Bright field
-->Fig. 6GFP transformation of rice leaf sheath protoplasts
-->
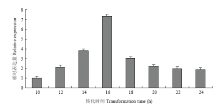
为探索原生质体转化的最佳时间,通过转化GFP质粒,设置不同的转化时间,通过提取原生质体的总RNA,用实时荧光定量技术估测GFP的相对表达量,获得最佳转化时间为14—16 h相对表达量最高的转化时间为16 h,之后逐渐下降(图7)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7不同转化时间GFP相对表达量
-->Fig. 7Relative expression of GFP in different transformation times
-->
2.4 Pik1-H4、Pik2-H4及AvrPik-H4的亚细胞定位
大部分基因产物与特定的细胞器有一定的关联,可通过亚细胞定位来探索该蛋白的功能以及蛋白相互作用的网络。将瞬时表达载体转染到水稻的原生质体中,通过激光共聚焦扫描显微镜63×水镜观察到目标蛋白在水稻细胞内的具体表达部位。由图8可知AvrPik-H4主要定位于细胞膜,Pik1-H4主要定位于内质网,Pik2-H4主要定位于质体。AvrPik-H4蛋白被定位于水稻细胞膜上,说明是一种膜蛋白或者积累于膜上的蛋白,通过某种形式运输到宿主细胞作为激发子触发一系列反应。从定位结果初步推定Pik1-H4可能主要参与AvrPik蛋白的识别反应以及信号传递的作用,Pik2-H4主要起到改变能量的传输方式及调控下游抗病引发过敏性坏死的作用。相比烟叶、洋葱表皮细胞的瞬时转化体系,水稻叶鞘细胞更具有说服力,有正确的蛋白合成系统,能引导目标蛋白的正确折叠。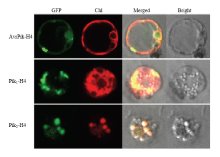 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8AvrPik-H4、Pik1-H4及Pik2-H4亚细胞定位
-->Fig. 8Subcellular localization analysis of AvrPik-H4, Pik1-H4 and Pik2-H4
-->
2.5 Western blot验证
收集转化结束后原生质体,提取总蛋白,进行Western blot验证,结果如图9所示。融合蛋白比目标蛋白分子量增加30 kD左右,用Anti-GFP作为一抗进行孵育,其中泳道1是没有转入质粒的细胞总蛋白作为阴性对照,泳道2转入GFP质粒作为阳性对照,泳道3—5是目的片段与GFP的融合蛋白,与Marker进行对照结果表明正确,为亚细胞定位的准确性提供了有力证据。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9目标蛋白Western blot验证1:阴性对照 Negative control;2:阳性对照 Positive control; 3:Pik1-H4-GFP;4:Pik2-H4-GFP;5:AvrPik-H4-GFP
-->Fig. 9Detected target protein by Western blot
-->
3 讨论
水稻作为单子叶模式植物被广泛地应用于分子功能、遗传进化研究,是探索基因组学和比较基因组学的有效工具[24]。利用水稻转基因植株进行基因功能研究存在周期长、生物安全性问题,而水稻瞬时表达体系能在短时间内实现目标基因的高水平表达,且保留原有的合成、修饰及转运蛋白的途径,更有益于后续接近真实情况抗病相关蛋白的筛选。目前,水稻系统的瞬时表达主要采用原生质体表达系统[25]、农杆菌侵染[26]方法,相对来说原生质体的方法更便捷高效。水稻叶片表面的蜡质层含有10%的硅胶[27],不利于被纤维素酶降解,而水稻幼苗叶鞘的硅胶含量较低[28],适合做原生质体游离的材料。本研究利用1/2 MS培养基25℃种植水稻幼苗,得到了较好的游离效果。相对于土壤栽培,培养基种植能提供更丰富均衡的营养,提供了更高质的游离材料。PEG与二价阳离子共价结合时能介导DNA发生有效沉淀达到转化的目的。有研究表明载体分子量越大转化效率越低,BART等[29]研究表明12 kb质粒转化效率为25%—30%;YANG等[13]研究表明5.9 kb质粒转化效率达到70%左右,3 kb的GFP质粒转化效率达到90%以上;段炼等[30]用蔗糖密度梯度法纯化水稻原生质体,质粒转化浓度为0.7 μg∙μL-1时转化效率达到60%—70%。本研究中,4.7 kb的GFP载体转化效率可达95%以上,融合GFP的目的基因载体大小分别为5、7.7、8.2 kb,GFP空载体与AvrPik-H4-GFP的转化效率相对稍高,但并无太大差别。相对以前的报道,本研究采用离心的方法对细胞进行收集,相对蔗糖密度梯度纯化法简便高效,利用实时荧光定量PCR法得到最佳转化时间为14—16 h,获得了较高的转化效率。Western blot验证结果显示,Pik1-H4-GFP与AvrPik-H4-GFP的表达量最高,说明转化效率与质粒分子大小无显著的线性关系,蛋白的表达量则与蛋白本身的功能性质有关。PEG介导的原生质体转化对DNA属于无选择性吸收,要同时保证质粒的高浓度及高质量才能获得较高的转化效率。Pik-H4位于水稻第11号染色体,由两个相邻的NBS-LRR基因Pik1、Pik2组成,NBS-LRR类是水稻抗稻瘟病基因中最常见的编码结构域[31]。Pik-H4位点存在7个等位基因(Pik、Pikh、Pikm、Pikp、Piks、Pi1、Pike),对稻瘟病菌都具有广谱抗性[32-33]。利用水稻瞬时表达系统对Pik-H4及AvrPik-H4蛋白的成功表达以及亚细胞定位对蛋白的功能研究有非常重要的意义,可为揭示靶蛋白介导的抗性通路提供依据。本研究表明在H4幼苗接种GD0193稻瘟病菌24 h游离的原生质体中转入无毒蛋白AvrPik-H4后,在短时间内大部分水稻细胞聚集成团呈现胶稠透明状发生过敏性坏死,而对照品种中二软占则不会有此现象,说明Pik-H4介导的免疫反应是通过迅速而高效地引起宿主过敏性坏死实现的。该现象为目标基因在水稻叶鞘原生质体中的成功表达提供了有力证据。
瞬时表达系统常用于靶蛋白的亚细胞定位,如农杆菌侵染烟草[34]、洋葱[35]及拟南芥表皮瞬时表达[36]。介于异源表达系统蛋白修饰、转运存在差异可能出现的错定位,同源表达系统的亚细胞定位结果更接近真实情况[37]。ZHAI等[38]利用水稻原生质体表达系统定位Pikh-1、Pikh-2及AvrPik-h均在细胞质和细胞核。靶基因的亚细胞定位对基因功能的研究有重要意义,本研究中将目标蛋白分别与GFP蛋白融合表达,利用水稻叶鞘原生质体瞬时表达系统进行亚细胞定位,观察到Pik1-H4主要定位于内质网,Pik2-H4主要定位于质体,AvrPik-H4主要定位于细胞膜。Pikh是Pik-H4的等位基因,二者定位结果出现差异的原因有两个:(1)CDS碱基序列存在差异。Pikh-1与Pik1-H4的CDS序列存在两个碱基的差异,Pikh-2与Pik2-H4的CDS序列则完全相同,AvrPikh与AvrPik-H4的CDS序列存在一个碱基的差异,可能改变其在细胞内的定位;(2)病原菌入侵时靶蛋白定位发生改变。本研究中的游离材料取自于接种稻瘟病菌24 h后的幼苗,有研究表明一些抗病相关基因会随着病原菌的入侵而改变细胞中的定位,由细胞核流向细胞质,如定位于叶绿体的NRIP1蛋白识别病原菌效应因子后,会从叶绿体流向细胞质及细胞核[39]。有研究表明Avr-Pikh与Pikh-1的CC结构域互作产生相应的信号转导后,Pikh-2使宿主产生相应的抗性[38]。初步推测Pik1-H4主要起到一个无毒蛋白与宿主抗病的衔接作用,识别外源物质入侵及启动防御信号传递给Pik2-H4,能够受到病原物的诱导而表达。Pik2-H4接收到信号以后通过调配代谢物的合成以及物质运输方式启动宿主的防御模式,加厚被侵染细胞的细胞壁或者直接启动自杀机制阻止相邻细胞被侵菌丝侵入。AvrPik在稻瘟病菌孢子的细胞膜上主要起到信号传递的作用,便于被宿主识别。
4 结论
水稻叶鞘原生质体游离的最佳时间为4—6 h,最适转化时间为14—16 h,FAD染色发现得到的细胞具有较高的活力,检测GFP荧光观察到较高的转化效率,通过亚细胞定位观察及Western blot验证目标蛋白的表达,为Pik-H4与无毒蛋白互作机制的研究打下了基础。推测Pik1-H4可能主要参与AvrPik-H4蛋白的识别反应,Pik2-H4主要调控下游抗病反应。(责任编辑 岳梅)
The authors have declared that no competing interests exist.
