0 引言
【研究意义】绿盲蝽(Apolygus lucorum)嗅觉系统在其寻找寄主、交配及趋向行为中发挥重要作用,深入研究其嗅觉系统对设计绿盲蝽选择行为调控剂具有重要指导意义。昆虫气味结合蛋白(odorant binding proteins,OBPs)是一类小分子水溶性蛋白(120—150个氨基酸,大小约为14 kD),在昆虫嗅觉系统中发挥重要作用。通常,昆虫触角中的OBPs与特异性气味物质结合形成复合物后穿过淋巴液将气味物质运输到气味受体(odorant receptors,ORs),最终激活嗅觉受体神经元,将化学信号转变为电信号并引发后续的嗅觉行为反应[1-3]。研究绿盲蝽OBPs的气味配体结合特性对深入解析绿盲蝽嗅觉系统具有重要意义,可以为设计绿盲蝽嗅觉行为调控剂提供新思路。【前人研究进展】当前体外研究昆虫重组OBPs配体结合特征的主要方法是荧光竞争结合试验(fluorescence competitive binding assay)[4],最近微量热涌动(microscale thermophoresis,MST)检测技术被成功应用于分析小分子与蛋白质的结合[5-7],该技术在DNA与蛋白质互作以及昆虫嗅觉受体功能研究等方面被广泛应用[7-8]。笔者团队前期研究发现,气味结合蛋白AlucOBP21主要在绿盲蝽触角中高表达,推测其在绿盲蝽嗅觉行为中发挥重要作用[9]。荧光竞争结合试验是当前普遍采用的研究OBPs配体结合特性的方法,其原理是利用荧光探针具有发射荧光的特性,荧光探针与OBPs混合后荧光值会显著增强,加入气味分子后气味分子将和荧光探针竞争结合OBPs,气味分子和OBPs的结合能力越强,则OBPs/荧光探针复合物的荧光强度值下降的越大,以此计算气味分子和OBPs的解离常数Ki。这种方法简单高效,安全系数高,在研究OBPs功能方面得到了广泛的应用[4,10-12]。但荧光竞争结合试验属于间接测定OBPs与气味分子的结合能力,要求蛋白质必须与荧光探针结合且状态稳定,二者结合后不会影响蛋白质的理化性质、空间构象及动力学等特性。蛋白质与配体分子的结合作用会引起蛋白质理化性质的改变,如分子大小、电荷及溶剂化层,相应地结合前后它在微小温度梯度下的运动也会有发生变化,而MST检测可以量化蛋白质分子在微小温度梯度下的热运动差异,进而分析体系内的蛋白质与小分子的结合现象。MST检测只需在很小的体系内完成,体系可设置为类似于细胞提取物或淋巴液,使之更接近生物体内的原始条件,且不受分子量大小和分子理化性质的影响,理论上其结果可信度更高[5-7,13]。MST技术可用于分析蛋白质与小分子的结合特性,OBPs与配体的结合研究正好也符合该技术应用范围。【本研究切入点】比较荧光竞争结合试验与MST检测两种方法研究绿盲蝽气味结合蛋白AlucOBP21结合特性的差异。【拟解决的关键问题】重组表达绿盲蝽气味结合蛋白AlucOBP21,开展荧光竞争结合试验与MST检测两种方法测定AlucOBP21结合特性的结果比较,探索一种新的高效筛选昆虫OBPs配体化合物的技术方法。1 材料与方法
1.1 供试昆虫
绿盲蝽成虫于2016年采自中国农业科学院廊坊科研中试基地紫花苜蓿地,将绿盲蝽置于塑料保鲜盒(25 cm×12 cm×8 cm)并用新鲜的四季豆饲养,保鲜盒内要放一些弯曲的纸条。养虫室温度26℃,相对湿度65%,光周期16L﹕8D。1.2 AlucOBP21重组表达及纯化
绿盲蝽气味结合蛋白AlucOBP21基因全长序列(GenBank登录号:KT281929)由笔者实验室前期通过绿盲蝽触角转录组测序获得。收集4日龄绿盲蝽雌、雄成虫触角,并置于-80℃保存。触角样品经液氮研磨后采用Trizol(Invitrogen,USA)提取总RNA,按照操作说明书利用SuperScript Ⅲ反转录试剂盒(Invitrogen,USA)合成第一链cDNA。采用特异性克隆引物(表1),以绿盲蝽成虫触角cDNA为模板进行PCR扩增。反应条件:94℃预变性4 min;94℃ 30 s,58℃ 30 s,72℃ 30 s,35个循环;72℃延伸10 min。克隆片段经连接、转化及测序验证,最终获得正确的目标基因序列。设计含有NcoⅠ和XhoⅠ酶切位点的表达引物(表1)进行PCR扩增,反应条件为94℃预变性5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,35个循环;72℃延伸10 min。按操作说明书对目的片段进行双酶切,并通过T4连接酶将目的片段连接至pET-30a(+)表达载体,获得pET32a/AlucOBP21重组质粒后,转化至BL21(DE3)感受态细胞(北京天根)中,并在含有0.1 mg·mL-1氨苄的LB液体培养基中培养,待OD600达到0.6—0.8时加入IPTG至终浓度为1.0 mmol·L-1,随后20℃,150 r/min培养8 h。菌液经超声破碎和和高速离心后,分别取上清和沉淀部分通过12% SDS-PAGE电泳检测,发现目标蛋白主要表达在上清中。随后,利用高亲和Ni-NTA纯化介质对蛋白进行纯化。按照操作说明采用重组肠激酶Recombinant entherokinase切掉His-tag,获得不含标签的AlucOBP21蛋白并溶于pH 7.4的50 mmol·L-1 Tris-HCl备用。Table 1
表1
表1试验中所用引物
Table 1Primers used in this study
| 引物名称Primer name | 序列Sequence | 位置Position (bp) |
|---|---|---|
| AlucOBP21克隆引物-F AlucOBP21 cloning primer-F | 5′-ATCATCCTCATCATGAAGTTCTTC-3′ | -12-+12 |
| AlucOBP21克隆引物-R AlucOBP21 cloning primer-R | 5′-TTTAGAATTCGGGGGTCTTGAC-3′ | 427-448 |
| AlucOBP21表达引物-F AlucOBP21 expression primer-F | 5′-ccatggCAAATGAGAAGAAAGCTAAC-3′ | 61-80 |
| AlucOBP21表达引物-R AlucOBP21 expression primer-R | 5′-ctcgagTTAGAATTCGGGGGTC-3′ | 432-447 |
新窗口打开
1.3 荧光竞争结合试验
采用荧光分光光度计(中国天津港东科技发展股份有限公司,F-380)进行配体荧光竞争结合试验,试验地点为中国农业科学院植物保护研究所,测试时间为2016年8—12月。将荧光探针1-N- phenylnaphthylamine(1-NPN)溶于甲醇(质谱纯级)至终浓度为1.0 mmol·L-1。设激发波长为337 nm,扫描的发射波长范围为370—500 nm。向荧光比色皿中加入AlucOBP21和pH 7.4 Tris-HCl缓冲液使总体积为2.0 mL,蛋白终浓度为2 μmol·L-1。随后依次向比色皿中加8 μL 1-NPN,使1-NPN终浓度由2 μmol·L-1递增至30 μmol·L-1,稳定后分别记录荧光最大值,采用Scatchard方程计算AlucOBP21/1-NPN的解离常数。检测8种盲蝽科性信息素及其类似物、12种植物挥发物及1种绿盲蝽驱避剂组分与重组AlucOBP21的结合能力。4-氧代-反-2-己烯醛由中国农业科学院植物保护研究所新农药创制研究组合成并提供,纯度>90%。其余气味标样购自Sigma公司或东京化成工业株式会社,纯度均>95%(表2)。气味分子标样以1.0 mmol·L-1浓度溶于甲醇。向浓度均为2 μmol·L-1的AlucOBP21和1-NPN的混合液中逐次加入气味标样,使标样的浓度从2 μmol·L-1逐步升至30 μmol·L-1,并记录每次加入气味标样后体系荧光强度的变化。若在此操作过程中混合液的荧光强度降为初始荧光强度的一半,则认为该气味分子能够与AlucOBP21结合。通过计算解离常数Ki值来明确AlucOBP21与气味分子的结合力,计算公式:Ki=[IC50]/(1+[1-NPN]/K1-NPN),其中[IC50]表示荧光强度下降到最强荧光强度50%时体系中气味分子的物质的量浓度,[1-NPN]为体系中未结合的1-NPN的物质的量浓度,K1-NPN为AlucOBP21/ 1-NPN复合物的解离常数[28-29]。
Table 2
表2
表2试验中所用气味化合物
Table 2Odorant samples used in this study
| 气味化合物Odorant chemical | CAS number | 气味化合物Odorant chemical | CAS number | |
|---|---|---|---|---|
| 4-氧代-反-己烯醛[14-15] (e)-4-oxo-2-hexenal | 2492-43-5 | β-蒎烯[20-22]β-pinene | 127-91-3 | |
| 丁酸-反-2-己烯酯[14-15] (e)-2-hexenyl butyrate | 53398-83-7 | 香茅醇[19] Citronellol | 106-22-9 | |
| 丁酸己酯[14,16] Hexyl butyrate | 2639-63-6 | 罗勒烯[19] Ocimene | 13877-91-3 | |
| 丁酸乙酯[15] Ethyl butyrate | 105-54-4 | 乙酸丁酯[19] Butyl acetate | 123-86-4 | |
| 丁酸丁酯[14,17] Eutyl butyrate | 109-21-7 | β-石竹烯[20] β-caryophyllene | 87-44-5 | |
| 丁酸戊酯[14] Pentyl butyrate | 540-18-1 | β-紫罗兰酮[24] β-ionone | 14901-07-6 | |
| 丁酸辛酯[16] Octyl butyrate | 110-39-4 | 芳樟醇[24] Linalool | 78-70-6 | |
| 乙酸正辛酯[17] Acetic acid octyl ester | 112-14-1 | 正己醇[20,25] 1-hexanol | 111-27-3 | |
| 柠檬烯[18] Limonene | 138-86-3 | α-蒎烯[26] (+)-α-pinene | 7785-70-8 | |
| 桉树醇[19] Cineole | 470-82-6 | 二甲基二硫醚[27] Dimethyl disulfide | 624-92-0 | |
| 月桂烯[20-23] Myrcene | 123-35-3 |
新窗口打开
1.4 MST测定
MST测定地点为中国农业科学院农产品加工研究所,测试时间为2016年8—12月。将重组AlucOBP21蛋白浓度稀释到约10 μmol·L-1,用脱盐柱将蛋白质溶液体系置换成MST测定要求的标记缓冲液。取6 μL溶解在DMSO中Monolith NT.115TM Protein Labeling Kit染料、94 μL标记缓冲液与100 μL蛋白质混匀,混合液常温下避光保存30 min,再用分离柱将荧光标记好的蛋白和剩余的荧光染料分离,得到纯净的带有荧光标记的蛋白后置于-20℃避光保存。候选配体标样(表2)溶解在DMSO中制成浓度为100 mmol·L-1的母液,再用50 mmol·L-1 Tris-HCl蛋白缓冲液将母液配制成浓度为500 μmol·L-1的标样于4℃保存待用。MST检测仪器为Monolith NT. Label Free型(Nano temper,德国),参数设定:Led power 60,MST power 40,Fluo before 5,MST on (s) 30 s,Flou after (s) 5,Delay 25。测试前将荧光标记的蛋白质冰上解冻,12 000 r/min,4℃离心后取上清。将配制好的候选配体标样用50 mmol·L-1的Tris-HCl蛋白缓冲液按1﹕2比例稀释成16个梯度,每个梯度体积为10 μL。取10 μL带有荧光标记的蛋白和各梯度标样在PCR管中混匀,冰上静置5 min使配体分子和蛋白充分混合,用MST-NT-Label-FreeTM毛细吸管吸取混合液在MST(Monolith NT.115,NanoTemper)设备上进行检测。MST测试中若配体与目标蛋白发生有效结合,其热涌动会随配体浓度升高发生有规律的变化;若热涌动不随配体浓度升高发生有规律的变化,说明该配体与目标蛋白不结合。MST测试数据用NT-analysis软件进行分析,按照分析软件说明,依据质量作用定律进行Kd拟合。2 结果
2.1 重组表达AlucOBP21蛋白
重组AlucOBP21蛋白在上清和包涵体都能够表达。最终选择上清组分来纯化目标蛋白,利用重组肠激酶在22℃切除His-tag得到无标签的重组AlucOBP21蛋白。在线软件(http://www.bio-soft.net/ sms/prot_mw.html)预测重组AlucOBP21分子量为14.5 kD,通过12% SDS-PAGE电泳结果可看出,目的蛋白条带大小与预测分子量大小一致(图1)。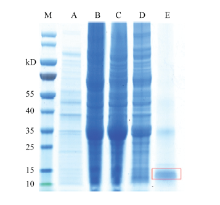 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1AlucOBP21重组蛋白SDS分析M:蛋白标准分子量 Protein molecular weight Marker;A:pET32/ AlucOBP21质粒转化BL21(DE3)菌株未加IPTG诱导 pET/AlucOBP21 without IPTG induction;B:pET32/AlucOBP21质粒转化BL21(DE3)菌株加入IPTG诱导 pET/AlucOBP21 with IPTG induction;C:菌液经IPTG诱导超声破碎后上清 The supernatant of pET32/AlucOBP21 after ultrasonication;D:菌液经IPTG诱导超声破碎后包涵体 The inclusion bodies of pET32/AlucOBP21 after ultrasonication;E:肠激酶切除His-tag后纯化后AlucOBP21蛋白 The AlucOBP21 protein without His-tag purified by HisTrap column
-->Fig. 1SDS-PAGE analysis of recombinant AlucOBP21
-->
2.2 荧光竞争结合检测重组AlucOBP21与配体的结合特征
AlucOBP21重组蛋白与荧光探针1-NPN解离常数为(6.88±0.31)μmol·L-1(图2)。荧光竞争结合试验结果显示,重组AlucOBP21能够与β-紫罗兰酮和β-石竹烯结合,解离常数分别为(13.74±1.93)和(13.24±2.12)μmol·L-1(图3)。重组AlucOBP21不能与盲蝽类性信息素类似物或驱避剂组分有效结合(解离常数均>50 μmol·L-1,未列出)。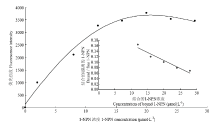 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图21-NPN和AlucOBP21的结合曲线
-->Fig. 2The binding curve of 1-NPN and recombinant AlucOBP21
-->
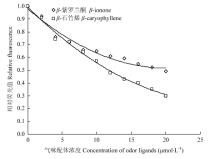 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3两种气味化合物与AlucOBP21竞争结合曲线
-->Fig. 3Competitive binding curves of two odor ligands to recombinant AlucOBP21
-->
2.3 MST检测AlucOBP21与配体的结合特征
MST检测显示(图4),热涌动随配体β-石竹烯、β-紫罗兰酮、β-蒎烯和柠檬烯浓度变化而发生有规律的变化,说明重组AlucOBP21能够与这4种气味化合物有效结合,解离常数分别为(0.20±0.02)、(0.05± 0.01)、(0.70±0.04)和(0.40±0.06)μmol·L-1。包括芳樟醇等其余配体化合物与AlucOBP21的热涌动随配体浓度变化而表现无规律的变化,所以这些气味化合物不能与AlucOBP21发生结合作用。MST检测中有效结合的4个配体化合物包括荧光竞争结合试验证实的β-石竹烯和β-紫罗兰酮,虽然解离常数差异很大,但主要趋势一致。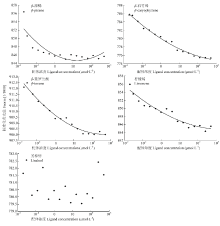 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图45种气味配体与AlucOBP21结合的MST检测
-->Fig. 4MST analysis of five odor ligands with recombinant AlucOBP21
-->
3 讨论
本文采用两种技术手段检测绿盲蝽重组AlucOBP21与候选配体化合物的结合特征。荧光竞争结合试验结果显示,重组AlucOBP21能够与植物挥发物β-石竹烯和β-紫罗兰酮有效结合。MST检测显示,AlucOBP21除了能与β-石竹烯和β-紫罗兰酮有效结合外,还可与β-蒎烯及柠檬烯结合。两种检测方法都发现AlucOBP21的气味结合范围相对较窄,只能够与一些寄主植物萜烯类挥发物结合,推测该蛋白在绿盲蝽寻找、定位寄主植物的行为过程中发挥功能。MST测定的AlucOBP21配体结合范围比采用荧光竞争结合试验所得结果略大,但基本趋势是一致的。荧光竞争结合试验应用的原理为蛋白质和荧光探针结合前后发射光谱波长和荧光强度不同,试验要求荧光探针能与蛋白质稳定结合且不会影响蛋白质的理化性质[4,10-12],这种方法是间接检测OBPs的结合能力,气味分子与OBPs结合需要把荧光探针竞争下来,若存在探针与蛋白质结合能力很强而气味分子与OBPs结合能力较弱时就可能出现假阴性。MST检测在一定程度上提高了配体结合的检测灵敏度,能够直接测定OBPs与气味分子的结合作用,试验体系更接近蛋白质与气味分子结合的原始环境,结果可能更符合预期[5-8]。荧光竞争结合试验发现,AlucOBP21能与两种气味配体β-石竹烯和β-紫罗兰酮结合,而MST检测中AlucOBP21同样能结合β-石竹烯和β-紫罗兰酮,表明两种方法存在一定的一致性。在MST检测中,β-蒎烯和柠檬烯的解离常数远远大于β-石竹烯和β-紫罗兰酮,表明AlucOBP21与β-蒎烯和柠檬烯的结合力显著小于β-石竹烯和β-紫罗兰酮。由于荧光竞争结合试验检测灵敏度低于MST,导致这种结合力比较低的气味配体没有在荧光竞争结合试验中被检测出来。本文中MST检测计算得到的解离常数远小于荧光竞争结合试验对应数值,这可能是由于MST直接检测体系内的分子结合,其结合能力可能更接近真实值。另外,两种检测技术测定原理不同,不同的仪器参数设置也会引起差异,所以计算出的Ki并不适合直接进行数值比较。
综上所述,荧光竞争结合试验和MST在研究昆虫OBPs与配体分子的结合特征方面具有一定的统一性,但MST测得的结合谱更广,可以筛选出结合力较弱的配体化合物。
4 结论
荧光竞争结合试验结果显示,绿盲蝽AlucOBP21能够与β-紫罗兰酮和β-石竹烯结合,解离常数分别为(13.74±1.93)和(13.24±2.12)μmol·L-1。微量热涌动(MST)检测表明,AlucOBP21可与β-石竹烯、β-紫罗兰酮、β-蒎烯、柠檬烯等结合,解离常数分别为(0.20±0.02)、(0.05±0.01)、(0.70±0.04)和(0.40±0.06)μmol·L-1。荧光竞争结合试验和MST在研究昆虫OBPs与配体分子的结合特征方面具有一定的统一性,但MST测得的结合谱更广,可以筛选出结合力较弱的配体化合物。(责任编辑 岳梅)
The authors have declared that no competing interests exist.
