0 引言
【研究意义】肉色是消费者接触肉及肉制品时最直观的印象[1],色泽差的肉给人不卫生、品质差的感觉,因此肉色是影响消费者购买决定最重要的因素之一[2-3]。肌红蛋白(Myoglobin,Mb)是宰后肉中最重要的色素物质[4-6],因此,研究影响肌红蛋白稳定性的因素,能够为提高肉色稳定性提供一定的理论依据。【前人研究进展】在CANTO等[7]的研究中发现肌红蛋白的等电点发生了酸性转移,表明肌红蛋白(PI=6.78)存在翻译后修饰,且发生修饰的肌红蛋白点在肉色不稳定组中含量丰富,因此推测肌红蛋白的这种翻译后修饰会影响肉色稳定性。ZHU等[8]的研究表明PI大于6.4的蛋白质,其等电点的酸性转变预示着该蛋白发生了磷酸化修饰。此外,已有研究证明人和小鼠的肌红蛋白存在磷酸化修饰(www.phosphosite.org),因此,推测肌红蛋白的磷酸化修饰可能会影响肉色稳定性。笔者团队的前期研究表明蛋白质的磷酸化反应负向调控肉色稳定性,且磷酸化可能是通过对糖酵解过程以及肌红蛋白稳定性的调控而影响肉色[9]。【本研究切入点】目前关于蛋白质磷酸化对肉色稳定性影响的相关研究较少,磷酸化对肌红蛋白稳定性影响的研究也较少。【拟解决的关键问题】以纯品骨骼肌肌红蛋白为材料,经连二亚硫酸钠还原得到还原态肌红蛋白。将肌红蛋白与碱性磷酸酶(AP)进行体外孵育(37℃)进而调控肌红蛋白的磷酸化水平,得到磷酸化水平差异的肌红蛋白样品。通过对肌红蛋白氧化还原稳定性的分析,探究肌红蛋白磷酸化对其氧化还原稳定性的影响。通过对肌红蛋白二级结构的研究,明确磷酸化对肌红蛋白二级结构的影响。1 材料与方法
本研究于2016年10月至2017年3月在中国农业科学院农产品加工研究所进行。1.1 试验材料
Pro-Q Diamond染色液、SYPRO Ruby染色液购自美国Invitrogen公司;三羟甲基氨基甲烷(Tris Base)、十二烷基硫酸钠(SDS)、丙烯酰胺(Acrylamide)、甲叉双丙烯酰胺(Methylene diacrylamide)、过硫酸铵(APS)、二硫苏糖醇(DTT)、四甲基乙二胺(TEMED)、连二亚硫酸钠、马骨骼肌肌红蛋白均购自美国Sigma公司;磷酸二氢钠、磷酸氢二钠、异丙醇、乙醇、甲醇、乙酸、乙腈、乙酸钠等均为分析纯,均购自国药基团化学试剂有限公司;15 mL超滤管,截留分子量5 kD,购自美国millipore公司。超纯水机FCR1000-UF-E,青岛富勒姆科技有限公司;磁力搅拌器,天津欧诺仪器仪表有限公司;电子天平ML204/02,上海梅特勒-托利多有限公司;水平脱色摇床TS-2型,海门市其林贝尔仪器制造有限公司;Mettler-Toledo pH计,上海梅特勒-托利多有限公司;雪花制冰机,北京长流科学仪器公司;台式高效冷冻离心机Neofuge 15R,上海力康生物医疗科技控股有限公司;紫外可见光分光光度计,日本Shimadzu公司;ChemiDocTM MP成像系统、电泳设备(Mini-Protein Tetra System),美国Bio-Rad公司;移液枪,德国Eppendorf公司;MJ-Ⅱ霉菌培养箱,上海一恒科技有限公司;圆二色谱仪MOS-450/AF-CD,法国Bio-Logic公司。
1.2 试验方法
1.2.1 样品孵育 用磷酸盐缓冲液(pH 8.0,50 mmol∙L-1)将马骨骼肌肌红蛋白配制成4 mg∙mL-1的溶液,添加连二亚硫酸钠将肌红蛋白还原为还原态肌红蛋白。在3 000×g,4℃超滤离心15 min,重复离心两次以除去连二亚硫酸钠。碱性磷酸酶(AP)用磷酸盐缓冲液稀释后加入孵育体系,孵育体系中肌红蛋白浓度为0.5 mg∙mL-1,碱性磷酸酶用量为25 U/100 μg Mb。试验组为肌红蛋白与碱性磷酸酶的混合液,对照组中为肌红蛋白溶液,每组3个重复。1.2.2 肌红蛋白含量的测定 按照TANG等[10]的方法测定3种肌红蛋白的相对含量。用紫外可见光分光光度计测定样品在503、525、557、和582 nm处的吸光值。3种肌红蛋白相对含量计算公式如下:
[DMb]=-0.543R1+1.594R2+0.552R3-1.329
[MbO2]=0.722R1-1.432R2-1.659R3+2.599
[MetMb]=-0.159R1-0.085R2+1.262R3-0.520
式中,R1=A582/A525,R2=A557/A525,R3=A503/A525。
1.2.3 pH测定 将pH计校正后,直接将探针插入溶液中测定孵育体系的pH。分别在孵育0 min、30 min、2 h、6 h、24 h和48 h时取样测定孵育体系的pH,每个样品重复测定3次。
1.2.4 肌红蛋白磷酸化水平测定 参照文献[11-13]测定肌红蛋白的磷酸化水平。将1体积的肌红蛋白溶液与等体积的2倍上样缓冲液混合(100 mmol∙L-1 Tris-HCl,pH 6.8,40 g∙L-1的SDS,1 g∙L-1的考马斯亮蓝,250 g∙L-1的甘氨酸),在100℃下煮沸5 min。电泳采用12%的分离胶和4%的浓缩胶,每孔上样量为0.3 μg肌红蛋白,每个蛋白样品做3个重复。电泳初始电压为70 V,待溴酚蓝进入分离胶后将电压调至110 V,待溴酚蓝距离底部1 cm左右时关闭电源。
电泳结束后,按照Pro-Q Diamond染液和SYPRO Ruby染液的试剂说明书进行荧光染色,凝胶用固定液(10%乙酸,50%甲醇)固定(2次,每次30 min)后水洗(3次,每次10 min),随后经Pro-Q Diamond染料避光染色(90 min),再经Pro-Q脱色液(20%乙腈,50 mmol∙L-1乙酸钠,pH 4.0)脱色(避光,2次,每次30 min)。脱色后水洗(避光,3次,每次5 min),并采用ChemiDocTMMP凝胶呈像系统对磷酸化蛋白进行图像扫描。磷酸化蛋白图像扫描后用SYPRO Ruby染液进行全蛋白染色(避光,4 h,可过夜),再经Ruby脱色液(7%乙酸,10%乙醇)脱色(避光,每次30 min,2次),随后水洗(避光,3次,每次5 min),并经ChemiDocTMMP凝胶呈像系统进行图像扫描。采用Quantity One软件对Pro-Q染色和Ruby染色后的光密度值进行定量分析。Mb的磷酸化水平用Pro-Q染色后的光密度值(P)与Ruby染色后的光密度值(T)的比值来表示。P/T值是衡量蛋白质磷酸化水平的一种半定量方法[14]。用碱性磷酸酶孵育0 min时的样品,对不同胶上的磷酸化水平进行归一化来消除不同凝胶上电泳及染色的差异。
1.2.5 肌红蛋白二级结构测定 扫描波长范围190—250 nm,扫描波长间隔1 nm,每nm波长测量持续时间为2 s;采用1 mm光径的样品池,每组3个样品,每个样品自动扫描2次。上机时将肌红蛋白溶液稀释为0.1 mg∙mL-1,以磷酸盐缓冲液(pH 8.0,50 mmol∙L-1)为空白。所得数据进行在线二级结构分析(http:// dichroweb.cryst.bbk.ac.uk),选择CDSSTR算法计算二级结构的含量。
1.2.6 数据分析 用IBM SPSS 21.0统计软件进行数据分析。最小显著差异法(Least significant difference)和邓肯多重比较法(Duncan’s multiple range tests)对数据进行差异显著性分析,显著性分析设置在5%的差异显著水平,数据用平均值±标准差的方式表示。
2 结果
2.1 肌红蛋白磷酸化水平
由于孵育体系中只有肌红蛋白,因此在单向电泳中只存在一个肌红蛋白的蛋白条带,所测定的磷酸化水平即为肌红蛋白的磷酸化水平。图1-A为磷酸化染色电泳图,图1-B为总肌红蛋白染色电泳图,电泳图经Quantity One软件进行分析,计算得到肌红蛋白的磷酸化水平(P/T值)。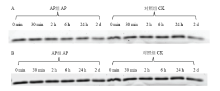 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1磷酸化肌红蛋白和总肌红蛋白染色图(A:磷酸化肌红蛋白染色图;B:总肌红蛋白染色图)
-->Fig. 1Gel images of phosphorylated and total myoglobin by1-DE(A: Image of phosphorylated myoglobin stain with Pro-Diamond; B: Image of total myoglobin stain with SYPRO Ruby)
-->
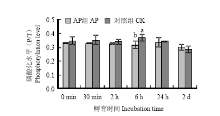
蛋白质在激酶催化下发生磷酸化反应,在磷酸酶催化下发生去磷酸化反应,其中碱性磷酸酶可以催化蛋白发生去磷酸化反应,降低蛋白的磷酸化水平[15]。肌红蛋白磷酸化水平的分析结果如图2所示,在孵育6 h时,两组间肌红蛋白的磷酸化水平出现显著差异(P<0.05),碱性磷酸酶处理组(AP组)肌红蛋白磷酸化水平显著低于对照组(P<0.05),表明碱性磷酸酶催化肌红蛋白发生了去磷酸化反应,降低了肌红蛋白的磷酸化水平。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2AP组和对照组肌红蛋白磷酸化水平分析(不同的字母代表同一时间点两组间差异显著(P<0.05)。下同)
-->Fig. 2Analysis of the phosphorylation level of myoglobin between AP group and control group(Data with different letters at the same time points are significantly different between two groups (P<0.05). The same as below)
-->
2.2 3种肌红蛋白相对含量变化
肌红蛋白由一分子珠蛋白(包含153个氨基酸)和一分子血红素辅基组成[16]。血红素辅基由一个铁离子和四分子吡咯环组成的铁卟啉构成。铁离子共有6个配位键,其中第6个配位键可以与一些小分子物质结合,如氧气、氮气、水分子、一氧化碳等。由于肌红蛋白第6个配位键所结合配体的不同,肌红蛋白存在多种状态,其中以脱氧肌红蛋白(DMb)、氧合肌红蛋白(MbO2)和高铁肌红蛋白(MetMb)为主。在宰后放血充分的肉中,肌红蛋白是最重要的色素物质,且肌红蛋白的绝对含量和3种肌红蛋白的相对含量决定了肉色[6,17]。3种肌红蛋白相对含量的测定结果如图3所示。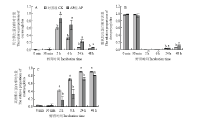 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3肌红蛋白相对含量随时间变化(A:氧合肌红蛋白含量随时间变化;B:脱氧肌红蛋白含量随时间变化;C:高铁肌红蛋白含量随时间变化)
-->Fig. 3Changes of the relative proportions of deoxymyoglobin, oxymyoglobin and metmyoglobin over time(A: Changes of the relative proportions of oxymyoglobin over time; B: Changes of the relative proportions of deoxymyoglobin over time; C: Changes of the relative proportions of metmyoglobin over time)
-->
在孵育0—30 min时,孵育体系中以脱氧肌红蛋白为主,随后脱氧肌红蛋白与氧结合生成氧合肌红蛋白,同时肌红蛋白被氧化生成高铁肌红蛋白。在孵育2 h时,体系中以氧合肌红蛋白和高铁肌红蛋白为主。从2 h起体系中MbO2的含量逐渐降低,MetMb的含量逐渐增加。从孵育2 h起,孵育体系中DMb、MbO2以及MetMb的相对含量在AP组和对照组间差异显著(P<0.05)。其中,对照组中MbO2的含量显著低于AP组(P<0.05),DMb的含量显著低于AP组(P<0.05),而MetMb的含量显著高于AP组(P<0.05)。这表明与对照组相比,AP组中还原态肌红蛋白的含量较高(P<0.05),MetMb的含量较低(P<0.05)。
2.3 孵育体系pH变化
pH是影响肌红蛋白稳定性的重要因素,为明确孵育体系pH是否对肌红蛋白稳定性产生了影响,测定了孵育过程中孵育体系pH的变化,结果表明在整个孵育过程中AP组和对照组间的pH差异不显著(P>0.05)(图4)。这说明添加碱性磷酸酶处理没有导致孵育体系pH的变化。因此推测,在孵育过程中AP组和对照组间肌红蛋白稳定性的差异不是pH造成的。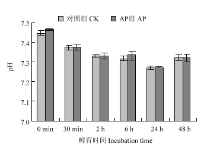 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4孵育体系pH值随时间变化
-->Fig. 4Changes of the pH values in the incubation system over time
-->
2.4 肌红蛋白二级结构变化
肌红蛋白的二级结构主要以α-螺旋为主[18]。AP孵育前后肌红蛋白二级结构的变化如表1所示,肌红蛋白的二级结构主要以α-螺旋为主。在孵育30 min和6 h时,AP组中α-螺旋的含量低于对照组,β-折叠的含量高于对照组。孵育24 h和48 h时,AP组和对照组中肌红蛋白二级结构均以α-螺旋为主,且两组间的螺旋含量无差异。从孵育0—6 h,AP组中肌红蛋白的α-螺旋和β-折叠的含量变化较小,对照组中肌红蛋白的α-螺旋含量增加,β-折叠的含量减少,这表明AP组中肌红蛋白的二级结构稳定性高于对照组,即肌红蛋白磷酸化后影响了其二级结构,且低磷酸化水平肌红蛋白的二级结构稳定性高。Table 1
表1
表1肌红蛋白二级结构变化
Table 1Changes of myoglobin secondary structure
| 时间 Time | ||||||
|---|---|---|---|---|---|---|
| 0 min | 30 min | 6 h | 24 h | 48 h | ||
| α-螺旋 α-helix (%) | AP组 AP | 95.2 | 95 | 95.2 | 100 | 100 |
| 对照组 Control | 95.2 | 96.3 | 98.5 | 100 | 100 | |
| β-折叠 β-Fold (%) | AP组 AP | 4.9 | 5.03 | 4.56 | 0 | 0 |
| 对照组 Control | 4.9 | 3.75 | 1.3 | 0 | 0 | |
新窗口打开
3 讨论
当肉表面以脱氧肌红蛋白为主时,肉呈现紫红色或紫粉色。当肉表面以氧合肌红蛋白为主时,肉呈现鲜红色。当肉表面以高铁肌红蛋白为主时,肉呈现褐色,因此高铁肌红蛋白的生成伴随着肉色的劣变[17,19]。AP组中高铁肌红蛋白的含量显著低于对照,表明AP组中肌红蛋白的自动氧化速率低于对照组,氧化还原稳定性高于对照。另外,AP组中肌红蛋白的磷酸化水平低于对照组。推测低磷酸化水平组肌红蛋白的自动氧化速率低于高磷酸化水平组,即低磷酸化水平肌红蛋白的氧化还原稳定性高于高磷酸化水平肌红蛋白,肌红蛋白的磷酸化可能负向调控肌红蛋白的氧化还原稳定性。宰后pH的下降速率和下降程度是影响肉色最重要的因素之一[20],且肌红蛋白的氧化还原速率受到pH的显著影响。在较低的pH环境下会降低肌红蛋白分子中珠蛋白和血红素辅基结合键的稳定性,进而使得肌红蛋白自动氧化速率升高,氧化还原稳定性降低而易被氧化。GUTZKE等[21]的研究中发现,在不同的物种和温度下肌红蛋白的氧化速率受到pH的显著影响。SHIKAMA等[22]研究了pH(4.8—2.6)对肌红蛋白氧化的影响,结果表明肌红蛋白的氧化反应直接受H+浓度的影响。而在本研究中,AP组和对照间孵育体系的pH无差异,因此可以排除pH对肌红蛋白稳定性的影响,即试验中AP组和对照组间肌红蛋白稳定性的差异不是pH造成的。此外,由于孵育试验是用相同的材料并在相同的环境温度下进行的,因此可以排除其他外在因素对肌红蛋白自动氧化速率的影响,推测AP组和对照组肌红蛋白间稳定性的差异是由于两组间肌红蛋白磷酸化水平的差异引起的。
肌红蛋白是一种单体球蛋白,可以储存氧气并向线粒体传递氧。有研究表明,通过共价或非共价的修饰来调控单体球蛋白的活性是一个较普遍的现象[23],如人的神经球蛋白(单体球蛋白)无论在体内或者体外,都会在缺氧条件下发生磷酸化(共价修饰)修饰进而保护神经细胞。推测肌红蛋白的磷酸化可能与氧气的含量相关,并影响肌红蛋白与氧的结合能力,进而会影响肌红蛋白的存在状态。研究表明,磷酸化会对蛋白质的结构、活性和稳定性产生一定的调控,如丙酮酸激酶在发生磷酸化后会转变成一种酸性稳定异构体,进而在PSE肉中保持较高的活性[24]。糖原磷酸化酶第十四位的丝氨酸可以被磷酸化,引起其结构的改变,并使其激活[25-26]。磷酸果糖激酶磷酸化后与肌动蛋白形成一个复合物,调控磷酸果糖激酶的活性并为细胞提供能量[27-28]。此外,DÍAZ-MORENO等[29]的研究表明KSRP发生磷酸化后,会使其不稳定的KH1区域中不规则的结构伸展,进而改变该蛋白的结构。ZHANG等[30]的研究表明GhPK6在第215和402位的丝氨酸存在磷酸化,其中第215位丝氨酸的磷酸化会抑制该酶的活性,在215位和402位的磷酸化会促进该蛋白的降解。而在本研究中,磷酸化水平差异的肌红蛋白其二级结构稳定性也存在差异。因此,推测可能是AP组和对照组两组间肌红蛋白磷酸化水平的差异,引起了两组间肌红蛋白二级结构的差异,而结构的差异可能导致了两组间肌红蛋白自动氧化速率和氧化还原稳定性的差异。肌红蛋白发生磷酸化或者去磷酸化后,可能会对其二级结构产生一定的调控作用,进而影响肌红蛋白与氧气的结合状态,最终影响肌红蛋白的自动氧化速率和氧化还原稳定性。
4 结论
碱性磷酸酶可以在体外催化肌红蛋白发生去磷酸化反应,进而降低肌红蛋白的磷酸化水平。碱性磷酸酶处理组(去磷酸化处理)中肌红蛋白的自动氧化速率低,氧化还原稳定性高。而外加碱性磷酸酶处理没有改变孵育体系的pH,表明两组间肌红蛋白稳定性的差异不是pH造成的。此外,与对照组相比,肌红蛋白发生去磷酸化后,其二级结构稳定性增强。因此推测,肌红蛋白发生磷酸化修饰后,可能会降低其二级结构的稳定性,并可能使肌红蛋白的自动氧化速率升高,氧化还原稳定性降低,不利于肉色的稳定性,这可能是蛋白质磷酸化负向调控肉色稳定性的原因之一。The authors have declared that no competing interests exist.
