0 引言
【研究意义】大豆属于直根系作物,根系主要由主根和侧根组成。大豆根系是其与外界环境之间进行物质交换的主要器官,与植物营养有着密切的关系,对产量和逆境胁迫有着重要影响[1]。根系是数量性状,大量基因控制着根系生长发育和养分的吸收利用[2-3],外部水分和养分环境对大豆根系生长具有重要的影响[4-6]。氮磷钾对植物的生长发育具有重要作用,任何一种元素的缺乏都会对影响到植物的正常生长发育[7-8]。土壤中氮磷钾元素的缺乏或者不均衡,已经严重影响到作物产量的提高[9-11],通过施肥补充土壤中的氮磷钾养分供应是提高大豆产量的重要措施。但是,过度使用化肥会对农业生态环境带来严重的破坏。因此,研究不同氮磷钾处理大豆苗期主根长和侧根数的QTL定位与上位互作分析对开展大豆养分高效利用和分子标记辅助选择育种具有重要意义。【前人研究进展】目前,国内外****对氮磷钾养分吸收利用和根系性状QTL定位研究主要集中在水稻[12-14]、玉米[15-17]、小麦[18-20]等作物,已经定位出多个根系性状的QTL。以往对大豆根系的研究主要集中在根系形态[21]、生理特性[22]和耐逆性[23-24]等方面,对不同浓度氮磷钾处理根系性状的QTL定位分析研究较少。朱向明等[25]研究了供氮水平对苗期大豆根系吸水特性的影响;ZHANG等[26]以不同磷效率大豆种质组成的自然群体为材料,应用全基因组关联分析,结合大豆基因组信息及低磷胁迫诱导表达,筛选出一个酸性磷酸酶基因(GmACP1);苏辉等[27]利用铁-7555和凤59-15的RIL群体,对相对根系干质量、相对根系磷含量、相对株高和相对叶中磷含量4个性状进行分析,在3和10染色体上共检测到3个与耐低磷有关的QTL,可解释表型变异的4.84%—18.2%;BEEBE等[28]在大田2种磷水平和营养液低磷处理下对根系性状进行了QTL检测,大田2种磷水平下分别检测到8个和6个与磷积累、根长和比根长性状相关的QTL;营养液低磷处理下,检测到12个与根长、主根长、根干重、主根干重和比干重性状相关的QTL;LIANG等[29]进行了幼苗期大豆根系性状的遗传分析与QTL检测研究,共检测到24个与主根长、侧根数、根重、根体积、茎叶重、下胚轴长和下胚轴重相关的QTL,分别位于第2、3、5、6、7、8、9、10、11、12、13、14、18、19和20连锁群上。【本研究切入点】由于根系生长在地下,生长环境比较复杂,截至目前,对于不同浓度氮磷钾处理条件下,大豆主根长和侧根数的QTL定位分析研究较少。【拟解决的关键问题】以栽培大豆晋豆23和山西农家品种灰布支黑豆(ZDD02315)为母本和父本衍生出的447个RIL群体为试验材料,采用WinQTLCart 2.5[30]中复合区间模型分析方法(http://statgen.ncsu.edu/qtlcart/WQTLCart. htm),对不同氮磷钾处理大豆苗期主根长和侧根数进行QTL定位分析,采用QTLNETwork 2.1[31]混合线性模型分析方法,分析QTL间的上位性和环境互作效应,为开展大豆养分高效利用和分子标记辅助选择育种提供依据。1 材料与方法
1.1 供试材料与水培试验
以晋豆23为母本,灰布支黑豆(ZDD02315)为父本所衍生的RIL群体作为供试群体(晋豆23是山西省主栽大豆品种,灰布支黑豆是山西农家品种,2个品种性状差别较大)。参照周蓉等[32]的方法,取亲本及447个家系各30粒种子,用灭菌纸包裹后于2015年5月27日和2016年6月10日分别放置在CK、NPK、1.5NPK各3个环境中进行水培12 d,幼苗长到V2期。根据国家潮土土壤肥力与肥料效益长期监测站(郑州)对不同肥力田块的施肥标准,设置水培试验不同处理的配比(表1),CK模拟种植不施肥(蒸馏水)、NPK模拟大田正常配施氮磷钾肥、1.5NPK模拟高肥田块,这3种环境更加贴近实际大田施肥情况,研究结果更加有利于解决实际生产施肥问题。每组试验设置3次重复,种子萌发和幼苗生长期间置室外环境,环境温度为20—28℃。Table 1
表1
表1水培试验不同处理的配比
Table 1Different material ratios in the hydroponic experiment
| 处理 Treatment | N (尿素Urea, g·L-1) | P (Ca(H2PO4)2, 12%含量Content, g·L-1) | K (KCl, g·L-1) |
|---|---|---|---|
| CK | 0 | 0 | 0 |
| NPK | 0.23 | 0.43 | 0.09 |
| 1.5NPK | 0.345 | 0.645 | 0.135 |
新窗口打开
1.2 根系性状测定和表型数据处理
当幼苗生长至V2期时,每个家系均选取5株生长一致的幼苗,洗净吸干后剪取根系部分,分别于2015年6月8日和2016年6月22日对各环境下幼苗期主根长(main root length,MRL)和侧根数(lateral root number,LRN)进行人工测定。用直尺测量每个单株根系的主根长,对侧根数直接计数并计算5株幼苗试验数据的平均值。利用SPSS 19.0软件进行表型数据分析并计算遗传力h2=V(G)/V(P)。1.3 遗传连锁图谱的构建
采用单粒混传法(single seed multiple descent,SSD)构建作图群体RIL。1998年夏季在山西省以晋豆23为母本,灰布支黑豆(ZDD02315)为父本进行杂交,获得F1籽粒。种植F1,收获一株籽粒产量为732粒的F1单株,1998年10月在海南岛单粒种成732个F2,1999年2月单株收获每个F2形成F3株系。于F3开始,每个世代每个株系随机收获10株上的共20个豆荚,每株2个,共约40粒籽粒,随机选取其中的20粒种成20个株行,形成下一个世代,以此类推至高世代。2004年,王珍[33]以晋豆23×灰布支黑豆(ZDD02315)及其所衍生的F12重组自交系为材料,构建了包含227个SSR标记的大豆遗传连锁图谱。2006年,梁慧珍[34]对图谱进行了重新整合与补充研究,图谱全长达到2 047.6 cM,包括27个连锁群,232个标记位点(该图谱在第9、13和16染色体上,均出现了2个间隙,在12染色体出现了1个间隙,因而形成了27个连锁群)。1.4 QTL定位及上位性互作分析
由于各性状的遗传效应不同,选用不同的统计遗传模型进行研究,能够提高QTL分析的准确性[35]。本研究采用了2种不同的遗传模型来检测主根长和侧根数性状的QTL。利用WinQTLCart 2.5[30]软件中复合区间作图法(CIM)Zmapqtl方法的Model 6,每2 cM对各性状进行全基因组扫描,以确定各性状QTL数目及其在染色体上的位置,通过逐步回归指定解释给定性状最大变异的5个标记作为余因子(co-factor),模拟运算1 000次,选取临界阈值LOD=2.5,检测每个环境下的QTL效应。当LOD≥2.5时,认为QTL存在;如果临近位点间图距<5 cM,就初步认定是同一个QTL。利用QTL Network 2.1[31]软件中的混合线性模型复合区间作图法(MCIM),选取临界阈值P=0.05,检测每个环境下的QTL、加性效应、加性×加性上位互作效应及环境互作效应。当QTL效应P≤0.05时,认为QTL存在。QTL采取MCCOUCH等[36]命名方式。2 结果
2.1 亲本及家系根系性状在RIL群体中的分离及表型分析
观察主根长和侧根数2个性状在分离群体中的分离并进行遗传力(表2)和方差分析(表3),2个亲本2个性状在后代中表现出较大的分离程度,在不同环境中均存在较大差异。RIL群体的最小值和最大值之间差异明显。各性状遗传力h2为41.56%—50.23%,为QTL分析提供了较好的遗传背景。表2中主根长和侧根数变异系数均较大,侧根数变异系数达到0.75、0.74和0.54,说明该性状在幼苗期稳定性较差,可能同时受基因与环境因素的共同影响。方差分析表明,主根长和侧根数性状在基因、环境和基因与环境的互作间均存在极显著差异(表3),说明这2个性状都是复杂的数量性状,受基因和环境的共同影响。分析RIL群体的变异范围,2个性状都有超越双亲的株系出现,说明2个性状遗传基因分布在双亲中,可以通过杂交育种得到超亲分离的株系。2个性状的峰度和偏度均较小,变异连续,呈现出近似正态的连续分布(图1),满足QTL分析要求。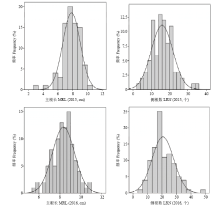 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1群体主根长和侧根数的频率分布图
-->Fig. 1Frequency distribution of main root length (MRL) and lateral root number (LRN) of soybean populations in 2015 and 2016
-->
2.2 大豆根系性状之间的相关分析
对2年6个环境下亲本和RIL根系性状进行相关分析(表4),主根长和侧根数均呈现极显著正相关。说明2个性状之间关联性密切,可能同时受基因与环境因素的共同影响。这种即相互影响又相互制约的关系,为不同环境下表型性状选择提供参考。Table 2
表2
表2RIL的亲本和家系性状描述统计分析
Table 2Phenotypic variation of all traits of RIL and the parents
| 性状 Trait | 环境 Environment | 亲本 Parent | RIL群体 RIL population | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 晋豆23 Jindou23 | 灰布支黑豆 Huibuzhiheidou | 平均值 Mean | 标准差 SD | 变异系数 Variance | 最小值 Min | 最大值 Max | 偏度 Skewness | 峰度 Kurtosis | 遗传力 h2(%) | ||
| 主根长MRL | CK | 17.60 | 10.60 | 11.86 | 1.45 | 0.15 | 8.20 | 15.80 | 0.22 | 0.38 | 49.55 |
| NPK | 16.40 | 9.00 | 10.16 | 2.03 | 0.21 | 5.00 | 16.10 | 0.59 | 0.44 | 50.23 | |
| 1.5NPK | 14.40 | 7.00 | 7.16 | 1.07 | 0.11 | 4.00 | 10.60 | 0.23 | 0.85 | 46.27 | |
| 侧根数LRN | CK | 9.56 | 6.44 | 30.24 | 7.14 | 0.75 | 8.25 | 46.00 | -0.59 | 0.83 | 42.12 |
| NPK | 10.04 | 5.00 | 26.29 | 7.25 | 0.74 | 6.00 | 52.60 | 0.15 | 0.52 | 45.37 | |
| 1.5NPK | 8.36 | 4.00 | 21.28 | 5.19 | 0.54 | 9.00 | 32.40 | -0.08 | -0.51 | 41.56 | |
新窗口打开
Table 3
表3
表3RIL家系主根长和侧根数方差分析
Table 3Variance analysis of MRL and LRN traits of RIL population
| 性状Trait | 变异来源 Source of variation | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 基因Gene | 环境 Environment | 基因×环境Gene × environment | 误差 Error | |||||||
| 均方 MS | F值 F-value | P值 P-value | 均方 MS | F值 F-value | P值 P-value | 均方 MS | F值 F-value | P值 P-value | 均方 MS | |
| 主根长 MRL | 128.378 | 70.029 | <0.0001 | 404.998 | 220.922 | <0.0001 | 93.628 | 51.073 | <0.0001 | 1.833 |
| 侧根数 LRN | 7443.640 | 194.860 | <0.0001 | 1384.963 | 36.256 | <0.0001 | 773.264 | 20.243 | <0.0001 | 38.200 |
新窗口打开
Table 4
表4
表4根系性状之间的相关分析
Table 4Correlation analysis of root traits
| 环境 Environment | 性状 Trait | 主根长 MRL | 侧根数 LRN |
|---|---|---|---|
| CK | 主根长 MRL | 1 | 0.46** |
| 侧根数 LRN | 0.60** | 1 | |
| NPK | 主根长 MRL | 1 | 0.47** |
| 侧根数 LRN | 0.31** | 1 | |
| 1.5NPK | 主根长 MRL | 1 | 0.53** |
| 侧根数 LRN | 0.52** | 1 |
新窗口打开
2.3 主效QTL定位及QE互作效应分析
2种方法对2年6个环境中2个性状共检测到24个主效应QTL,单个性状QTL数分别为9个和15个,分布于第2、3、5、6、7、8、9、10、11、12、13、14、16、17共14条染色体中(图2、表5、表6),单个QTL的贡献率介于8.52%—43.62%。2个QTL能在2种分析方法中同时检测到,9个QTL能在3种环境下同时检测到。但是,没有检测到在所有环境中均能够稳定表达的QTL。2.3.1 主根长性状 共检测到9个QTL,分布在第6、7、8、11、12和14染色体上。解释的表型变异范围为8.52%—43.62%,LOD值为2.50—4.20,位于第11染色体Satt430-Satt359区间的qMRL-b1-1,贡献率为43.62%,解释的表型变异最大。加性效应正值和负值都有表现,加性效应为正值,表明增效基因来自母本晋豆23;加性效应为负值,表明增效基因来自父本灰布支黑豆。第6染色体在2015年NPK、1.5NPK和2016年1.5NPK 3个环境下均检测到主根长QTL,其中,qMRL-c2-2与qMRL-c2-3仅相距1.48 cM,LOD分别为3.16和3.23,表型贡献率分别为29.87%和39.02%,均位于Satt305-Satt291标记区间,推测可能是同一个QTL。2种分析方法均在12染色体上检测到qMRL-h_1-2,加性效应分别为0.067和0.026,MCIM方法检测出加性效应贡献率为3.08%,加性与环境互作贡献率为0.33%。互作效应贡献率小于其自身的加性效应贡献率,说明主根长受基因和环境共同作用,基因比环境的影响更加显著。
Table 5
表5
表5根系性状QTL位置及其参数
Table 5Parameters of QTLs position of root traits
| 性状 Trait | QTL | 染色体 Chr. | 标记区间 Interval | 位置 Position | LOD | 加性效应 Additive | R2 (%) | ||
|---|---|---|---|---|---|---|---|---|---|
| 主根长 MRL | 2015 | CK | qMRL-a2-1 | A2 (8) | BSC-Satt187 | 17.23 | 2.86 | 0.747 | 9.95 |
| qMRL-b1-1 | B1 (11) | Satt430-Satt359 | 134.87 | 2.84 | 1.005 | 43.62 | |||
| NPK | qMRL-c2-1 | C2 (6) | Satt520-Satt305 | 14.91 | 2.50 | -0.325 | 8.52 | ||
| 1.5NPK | qMRL-c2-2 | C2 (6) | Satt305-Satt291 | 52.94 | 3.16 | 1.000 | 29.87 | ||
| qMRL-h_2-1 | H_2 (12) | Satt142-Satt181 | 21.51 | 2.54 | -0.352 | 10.29 | |||
| qMRL-m-1 | M (7) | Satt590-Satt201 | 12.01 | 4.20 | 0.431 | 15.24 | |||
| 2016 | CK | qMRL-b2-1 | B2 (14) | Satt416-Satt474 | 10.54 | 2.51 | 0.428 | 9.37 | |
| qMRL-h_1-2 | H_1 (12) | Satt442-Satt296 | 33.81 | 2.52 | 0.067 | 15.11 | |||
| 1.5NPK | qMRL-c2-3 | C2 (6) | Satt305-Satt291 | 54.42 | 3.23 | 1.004 | 39.02 | ||
| 侧根数 LRN | 2015 | CK | qLRN-d2-2 | D2 (17) | Satt488-Satt461 | 74.54 | 5.02 | 3.378 | 19.60 |
| qLRN-o-1 | O (10) | Satt259-Satt331 | 107.84 | 3.03 | -2.372 | 10.66 | |||
| NPK | qLRN-a1-1 | A1 (5) | Satt382-Satt593 | 53.22 | 4.05 | -2.482 | 21.99 | ||
| qLRN-d2-1 | D2 (17) | Satt543-Satt488 | 72.16 | 2.76 | 2.451 | 11.20 | |||
| qLRN-k_2-1 | K_2 (9) | Satt247-Satt544 | 32.80 | 2.69 | -2.395 | 9.52 | |||
| 1.5NPK | qLRN-a1-2 | A1 (5) | Satt593-Satt454 | 58.77 | 3.96 | -2.192 | 17.15 | ||
| qLRN-m-1 | M (7) | Satt590-Satt201 | 0.01 | 2.52 | 1.599 | 8.83 | |||
| 2016 | CK | qLRN-a1-3 | A1 (5) | Satt593-Satt454 | 63.14 | 2.54 | -1.786 | 11.57 | |
| qLRN-j_2-1 | J_2 (16) | Satt132-Satt456 | 32.53 | 5.48 | 2.616 | 24.60 | |||
| qLRN-m-2 | M (7) | Satt150-Satt567 | 23.27 | 2.50 | -1.902 | 13.18 | |||
| NPK | qLRN-D1b-1 | D1b (2) | Satt350-Satt041 | 4.60 | 6.36 | 3.476 | 21.23 | ||
| qLRN-D1b-2 | D1b (2) | Satt041-Satt546 | 14.84 | 3.22 | 2.791 | 13.41 | |||
| qLRN-d2-3 | D2 (17) | Satt488-Satt461 | 75.15 | 4.98 | 3.920 | 26.37 | |||
| qLRN-n-1 | N (3) | Satt521-GMABABR | 62.67 | 4.04 | 2.751 | 12.80 | |||
| 1.5 NPK | qLRN-f_1-1 | F_1 (13) | Satt269-Satt252 | 18.82 | 2.50 | -1.866 | 9.64 | ||
新窗口打开
Table 6
表6
表6根系性状的QTL及QTL与环境互作
Table 6QTLs and QE interaction of root traits
| 性状 Trait | QTL | 标记区间 Interval | 位置 Position | 加性效应 Additive | 贡献率 H2 (Ai) (%) | 环境互作 贡献率 H2 (AEi) (%) | QTL与环境互作效应 Effects of QTL × environment interactions | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AEi1 | AEi2 | AEi3 | AEi4 | AEi5 | AEi6 | |||||||
| 主根长 MRL | qMRL-h_1-1 | Satt442-Satt296 | 34.0 | 0.026 | 4.18 | 0.33 | -0.0301 | 0.0773 | -0.0028 | -0.0110 | -0.0230 | 0.0029 |
| 侧根数 LRN | qLRN-n-1 | Satt521-GMABABR | 63.0 | 0.021 | 0.87 | 2.25 | 0.0021 | -0.0021 | 0.0041 | -0.0038 | 0.0010 | -0.0021 |
新窗口打开
2.3.2 侧根数性状 共检测到15个QTL,分布在第2、3、5、7、9、10、13、16和17染色体上。解释的表型变异范围为8.83%—26.37%。LOD值为2.50—6.36,母本晋豆23和父本灰布支黑豆均有不同的增效基因。位于17染色体Satt461-Satt301区间的qLRN-d2-3,表型贡献率为26.37%,解释的表型变异最大。第17染色体在2015年CK和NPK、2016年NPK 3个环境下均检测到侧根数QTL,其中,qLRN-d2-2和qLRN-d2-3位置相距0.61 cM,均位于Satt488-Satt461区间,解释的表型变异分别为19.60%和26.37%,推测可能是同一个QTL。第5染色体在2015年NPK和1.5NPK、2016年CK 3个环境下均检测到侧根数QTL,其中qLRN-a1-2和qLRN-a1-3位置相距4.37 cM,均位于Satt593-Satt454区间,解释的表型变异分别为17.15%和11.57%, 推测可能是同一个QTL。2种分析方法均在3染色体上检测到qLRN-n-1,加性效应分别为2.751和0.021,MCIM方法检测出加性贡献率为0.87%,加性与环境互作贡献率为2.25%。
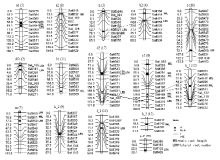 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2检测到的QTL和加性效应QTL在连锁群上的分布以及根系性状上位性QTL间的遗传结构
-->Fig. 2Distribution of main QTLs and additive QTLs on linkage groups and graphic presentation of the genetic architecture between epistatic QTLs for root traits
-->
互作效应贡献率大于其自身的加性效应贡献率,说明侧根数受基因和环境共同作用,环境比基因的影响更加显著。
2.4 上位性互作效应
主根长和侧根数共检测到4对上位性互作QTL(表7)。检测到2对主根长上位性互作QTL,1对发生在主效QTL qMRL-h_1-2和非主效QTL qMRL-c2-5之间,效应值为0.2720,上位效应贡献率2.03%,互作贡献率为1.53%;1对发生在非主效QTL qMRL-h_1-1和非主效QTL qMRL-c2-4之间,效应值为-0.1252,上位互作贡献率为1.95%。检测到2对侧根数上位性互作QTL,1对发生在主效QTL qLRN-n-1和非主效QTL LRN-b2-1之间,1对发生在非主效QTL q LRN-c2-1和非主效QTL qMRL-d2-4之间,上位效应贡献率分别为0.67%和3.15%,互作贡献率分别为2.47%和1.13%,效应值分别为-0.7069和-2.2613,表明该互作为亲本性大于重组型。正向的上位性效应表示两座位间互作基因型与具有正效应的加性基因型方向相同,负向的上位性效应表示两座位间互作基因型与具有正效应的加性基因型方向相反。上位互作贡献率小于(大于)上位效应贡献率,说明上位互作对根系性状遗传的影响小于(大于)上位性的影响。Table 7
表7
表7根系性状加性×加性上位互作效应QTL
Table 7Epistatic effect QTLs of additive × additive of root traits
| 性状 Trait | QTLi | 标记区间 Interval | QTLj | 标记区间 Interval | 上位 效应 AAij | 贡献率 H2 (AAij) (%) | 环境互作 贡献率 H2 (AAEij) (%) | 加性×加性上位互作效应 Epistatic effect QTLs of additive × additive | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AAEij1 | AAEij2 | AAEij3 | AAEij4 | AAEij5 | AAEij6 | ||||||||
| 主根长MRL | qMRL-c2-5 | Satt489-Satt460 | qMRL-h_1-2 | Satt442-Satt296 | 0.2720 | 2.03 | 1.53 | 0.0700 | -0.0397 | 0.3716 | -0.1273 | -0.1058 | -0.1688 |
| qMRL-c2-4 | Satt489-Satt460 | qMRL-h_1-1 | Satt568-Satt442 | -0.1252 | 0.37 | 1.95 | 0.2998 | 0.0494 | -0.4963 | 0.0784 | 0.0677 | 0.0001 | |
| 侧根数LRN | qLRN-b2-1 | Satt020-Satt272 | qLRN-n-1 | Satt521-GMABABR | -0.7069 | 0.67 | 2.47 | -1.6335 | 0.4294 | -1.0465 | 0.2223 | 0.9808 | 1.0417 |
| qLRN-c2-1 | Satt316-Satt371 | qLRN-d2-4 | Satt171-Satt186 | -2.2613 | 3.15 | 1.13 | 0.2269 | 0.3165 | -0.5447 | -0.9372 | 0.9906 | -0.0420 | |
新窗口打开
3 讨论
3.1 主根长和侧根数性状的遗传机制与上位性互作
大豆根系在水分和养分吸收、固定植物以及与根际周围微生物互作等方面具有十分重要的作用。水分和养分环境的改变,对大豆根系生长产生一定程度的影响[37]。本研究中,2年6个环境下,大豆RIL群体中主根长和侧根数的变化趋势均表现出CK>NPK>1.5NPK,可见幼苗期大豆主根长和侧根数对氮磷钾的吸收较少,在农业生产中,施肥时间应该放到苗期以后更加有效,否则不利于根系的生长发育,该研究结果对于合理施肥和“双减”具有重要的现实意义。2年6个环境下,表型分析中2016年数据明显低于2015年。2年间数据有差异的原因是:由于观察水培大豆生长时期,只能通过子叶及以上部分观察,处于V2期大豆虽然地上部分的叶片数一致,但是由于温度、湿度、光照的不同,造成了根系生长的差异,同时遗传上存在明显的互作效应。方差分析结果表明,主根长和侧根数性状在基因、环境和基因与环境的互作间均存在极显著的差异,这2个性状受基因和环境的共同影响。MICM方法分析中,2个性状均检测到存在环境互作效应和上位性互作效应。Network 2.1软件综合考虑了加性、上位性以及与环境互作效应,对研究复杂性状的遗传具有更加重要的意义。同时,对比2个性状RIL群体的变异范围,都有超越双亲的株系出现,说明母本晋豆23和父本灰布支黑豆都具有起到正效作用的等位基因,生产上可以通过杂交育种获得杂种优势。
QTL与环境互作、QTL与QTL上位性互作是作物数量性状遗传的重要组成部分,是作物杂种优势的遗传基础,特别是上位性更适合研究复杂性状的遗传[38]。QTL与环境互作、QTL与QTL上位性互作推进了作物的进化进程,ZHANG等[39]认为上位性比加性QTL更重要。本研究中,上位性贡献率最大为3.15%,加性贡献率最大为3.08%,主根长主效QTL qMRL-h_1-2和非主效QTL qMRL-c2-5之间受到上位效应的影响比加性更显著。
LI等[40]认为QTL上位性互作可分为3个类型,一是2个主效应QTL之间互作(typeⅠ);二是1个主效应QTL与1个“背景”位点之间互作(typeⅡ);三是2个互补位点之间互作(typeⅢ)。本研究检测到的4对互作QTL中,主根长和侧根数各有1对互作QTL qMRL-h_1-2和qMRL-c2-5、qLRN-n-1和QTL LRN-b2-1可视为typeⅡ上位性互作,另外2对可视为type III上位性互作。基因的调控网络与表型性状的遗传作用模式相对应,这3种QTL间的上位性互作模式反映的可能正是QTL所在基因位点间的正向诱导表达或者负向反馈抑制等调控机制[41]。根据本研究检测到的QTL的基因组位置,检索SoyBase数据库中每个QTL附近的功能基因位点后发现,6个QTL中有,标记Satt489、Satt442分别与影响大豆粒长[42]和大豆叶宽[43]的基因位点位于同一区域,Satt020和Satt316分别与影响大豆脂肪[44]和大豆产量[45]的基因位点位于同一区域。除Satt020外,其余3个位点相应的QTL均为上位性互作QTL。因此这些相应的基因位点是否就是相应互作QTL的分子基础?相应的基因位点之间是否存在表达调控机制?而这种调控机制是否就是通过QTL间的上位性互作反映出来的?同时,这些在大豆不同性状中发挥作用的位点又如何影响到主根长和侧根数的差异呢?针对这些疑问,需要进行更深入的研究。
3.2 与前人定位结果的比较
进行QTL定位分析中,建议采用不同的分析方法,优先标定共同发现的QTL[35]。本研究采用2种不同的分析方法共检测到23个主效应QTL,2个QTL能在2种分析方法中同时检测到,分别是主根长QTL qMRL-h_1-2和侧根数QTL qLRN-n-1。参照SoyBase数据库标记信息,这2个QTL均未见报道,全部为新定位出的QTL,需要在今后加以关注并进行进一步研究。本研究中9个QTL能在3种环境下同时检测到,其中第6染色体上主根长在2015年NPK、1.5NPK和2016年1.5NPK 3个环境下均检测到QTL,分别位于Satt520-Satt305和Satt305-Satt291区间。BRENSHA等[46]在第6染色体上Satt357-Satt202和Satt239-Sat_105区间也检测到控住主根长的QTL;周蓉等[32]在第6染色体上Satt281-Sat_153也检测到控住主根长的QTL。由于多种研究采取的研究群体、遗传图谱和分析方法不同,尽管定位在同一条染色体上,但区间不统一,这些区间是否有重叠,需要进一步研究。本研究中第5染色体在2015年NPK和1.5NPK、2016年CK 3个环境下均检测到侧根数QTL,作者在前期研究中也在第5染色体上定位出侧根数QTL[29]。本研究中第17染色体在2015年CK和NPK、2016年NPK 3个环境下均检测到侧根数QTL,以往研究中未见报道。同时也发现,本研究与LIAN等[47-48]把主根长分别定位在第11染色体和第8染色体上、LIANG等[29]把侧根数定位在第2染色体上结果一致。除此之外,本研究中检测到的其他QTL,均未见报道。国内外研究中,因为群体大小和图谱标记密度的不同,QTL定位结果尚不够精细。进一步对大豆主根长和侧根数QTL精细作图,并着重跟踪多环境、多分析方法均能检测到的QTL区域,并进行功能标记开发,发掘控制主根长和侧根数的功能基因,是下一步研究工作的方向。
4 结论
苗期大豆主根长和侧根数对氮磷钾的吸收影响较少,生产中尽可能减少氮磷钾使用量。不同浓度氮磷钾处理苗期主根长和侧根数参数间既有共同的控制基因,也有各自独特的控制基因,多数QTL不能在多个环境下重复检测到,控制其表达的遗传机制较为复杂。加性效应、加性与环境互作和加性×加性上位性互作效应在主根长和侧根数的形成和遗传中发挥着重要作用。主根长和侧根数各有1个QTL能在2种分析方法中同时检测到,Satt442-Satt296和Satt521-GMABABR是共位标记区间。致谢:本研究的连锁图谱和群体材料由海南省热带农业资源开发利用研究所方宣钧研究员和山西省农业科学院经济作物研究所刘学义研究员提供,在此表示感谢。
The authors have declared that no competing interests exist.
