0 引言
【研究意义】植物根系是植物体的吸收器官和代谢器官,它对于外界环境条件反应非常敏感[1]。随着研究手段的不断深入,人们逐步认识到植物根系及其分泌物在作物高产及农业生产中具有十分重要的作用[2-3]。因此,根系分泌物的研究一直是人们关注的热点。【前人研究进展】近年来,根系分泌物的变化在轮作、间作等种植体系中的作用备受关注。黄酮类根系分泌物质作为被根瘤菌感知的初始信号,在豆科作物结瘤过程中起关键作用[4]。关于豆科植物根系分泌黄酮类物质,国内外已经开展了大量研究,这些研究主要集中在单作大豆、苜蓿、豌豆和木豆上,并且在这些豆科作物根系分泌物中先后发现了柑桔素、圣草酚、芹菜素、毛地黄黄酮、槲皮黄酮等黄酮类物质[5-8]。而有关蚕豆根系分泌物中黄酮类分泌物的种类研究不多,最近在蚕豆根系分泌物中也发现了槲皮黄酮和橙皮素等黄酮类物质[9]。但这些黄酮类物质的发现均是在单作条件下的研究结果,间作种植尤其不同施氮水平下对黄酮类物质分泌的影响并不清楚。【本研究切入点】小麦蚕豆间作是云南乃至西南地区重要的间作种植模式,其具有显著的增产[10-12]、控病优势[13],是农民增产增收的重要手段之一[14]。前人大量的研究已经明确了小麦蚕豆间作系统中养分的吸收利用规律[15-16]、病害发生规律[17]、根际微生物的动态变化特征[18],但是不同施氮水平下,间作对小麦蚕豆根系分泌槲皮素和橙皮素的影响尚不清楚。【拟解决的关键问题】本研究以小麦蚕豆间作为研究对象,通过建立高效液相色谱(HPLC)分析技术,结合前人在小麦蚕豆根系分泌物研究的已有结果,系统探讨不同氮水平条件下,不同生育期间作小麦和蚕豆槲皮素和橙皮素的动态变化及累积特征,明确槲皮素和橙皮素在间作系统中的作用,为进一步探明间作增产机制提供依据。1 材料与方法
1.1 供试材料
盆栽试验于2014年10月至2015年5月在云南农业大学植物营养系温室内完成,种植土取自云南农业大学后山红壤,基本理化性质为有机质28.07 g·kg-1,碱解氮68 mg·kg-1,速效磷16 mg·kg-1,速效钾137 mg·kg-1,pH 6.08。试验所用盆钵大小为238 mm×320 mm。土壤磨碎过5 mm筛子,混匀,每盆装土10 kg,装盆时基肥与土混匀。作物供试品种:小麦为云麦42(Tricum aestivum L.cv. Yunmai 42);蚕豆为玉溪大粒豆(Vicia faba L. cv. yuxi bean),种子购于云南省农业科学研究院粮食作物研究所。1.2 试验设计
小麦蚕豆间作试验采用土培模式完成。试验设计为两因素试验,A为种植方式,设小麦蚕豆尼龙分隔(mesh barrier,MB,尼龙网孔径为300目),小麦蚕豆塑料分隔(Polythene Barrier,PB)两种种植方式;B为氮肥施用水平,设低氮(1/2N,即推荐施氮量的一半),推荐施氮(N)和高氮(3/2N,即推荐施氮量的1.5倍)3种氮素供应水平。盆栽试验所用氮肥品种为尿素,正常施肥用量为150 mg·kg-1土;磷肥品种为过磷酸钙,施用量为100 mg·kg-1土;钾肥为硫酸钾,施用量100 mg kg-1土。磷钾肥全部作为基肥一次性施入;氮肥1/2为基肥,1/2为追肥,并于小麦拔节期追施。氮肥追施时仅施用于间作处理的小麦一侧,蚕豆均不施用追肥。试验共计6个处理,每个处理4次重复,采样3次,共计72盆。1.3 幼苗培养与样品收集
种子在发芽前用自来水浮选去除瘪粒,挑选大小、饱满度一致,种皮完整的小麦蚕豆种子,用10%的H2O2浸泡30 min,用去离子水清洗干净;用饱和CaSO4溶液浸润30 cm×20 cm滤纸,将种子(小粒)分布于湿润滤纸上(滤纸卷成筒状),用不透光的黑塑料布遮盖,在20—25℃下放置发芽。发芽后于2014年10月18日进行种植,每盆6株蚕豆、12株小麦,分成两行种植。分别于2014年12月20日,2015年1月24日,2015年3月1日(蚕豆出苗后60、95、131 d)收取根系分泌物(破坏性取样),测定作物生物量,并烘干后称重。根系分泌物收集方法:将植株从试验盆中取出,先用自来水反复冲洗植株根,后用蒸馏水冲洗3次,冲洗后放入5%浓度百里酚溶液中浸泡3 min,取出后放入装有500 mL CaCl2溶液的收集袋中,将袋子放入原生长容器中;根系没入收集液液面开始计时,收集时间为2 h,2 h后将植株取出,在收集液中滴加2—3滴微生物抑制剂,迅速放入-20℃冰箱冷冻、保存待测[19-20]。测定时,从冰箱取出离心管解冻、过膜(0.22 µm)等处理。将植株样品分为根茎叶称鲜重后烘干杀青,烘干后称重。
1.4 样品处理与测定
将收集的根系分泌物解冻后用滤纸过滤,分别用200、100、50 mL乙酸乙酯萃取过滤液3次,3次萃取液混匀后倒入旋转蒸发仪中蒸发浓缩,浓缩液用甲醇冲洗并定容至10 mL备用。将准备好的10 mL样品过0.45 μm 滤膜后放入HPLC中,采用外标法测定槲皮素和橙皮素的含量(标准品购自中国药物研究所,产地为德国)。槲皮素与橙皮素测定所用的色谱条件为色谱柱Synergi 4u Hydro-RP 80A(250×4.6 mm ID),测定流动相:30%—40% 5 min;40%—60% 5 min;60%—90% 15 min;90% 4 min;90%—30% 5 min;30% 3 min。测定条件:流速 0.9 mL·min-1 、柱温30℃、检测波长270 nm,进样量为10 μL,分析时间37 min。在选定的色谱条件下,得到槲皮素(10 μg·mL-1)、橙皮素(10 μg·mL-1)的混合标准品及待测样品的色谱图(图1)。槲皮素与橙皮素的检测限均为0.01 μg·mL-1。
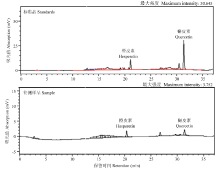 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1槲皮素与橙皮素色谱图
-->Fig. 1Chromatograms of quercetin and hesperetin
-->
1.5 数据处理与分析
采用Microsoft Excel 2003软件对数据进行处理和绘图,采用SPSS 17.0统计分析软件对数据进行差异显著性检验(LSD法,α=0.05)。2 结果
2.1 根系分隔方式对不同氮水平作物生物量和根冠比的影响
由表1可以看出,小麦蚕豆的生物量随施氮量的增加而增加,随生育期的推移增加量逐渐减小。作物生长60 d时,与低氮条件相比,常规施氮和高氮条件下小麦生物量45%—62.5%,蚕豆生物量增加3.2%—18.9%。这主要是由于养分供应充足环境下,作物生长迅速,伴随着作物的生长和成熟,生物量增加缓慢。不同种植方式对作物的生物量也有明显影响。相同氮水平条件下,尼龙分隔的作物生物量高于塑料分隔,这种差异随生长时间变化逐渐不显著。作物生长60 d时,不同施氮量尼龙分隔小麦蚕豆生物量分别比塑料分隔高4.2%—25%、19%—38.6%。这说明根系的不同交互程度对小麦蚕豆生物量有影响。Table 1
表1
表1小麦蚕豆生物量与根冠比
Table 1Biomass and root-shoot ratio of wheat and faba bean
| 作物 Plant | 指标 Index | 氮水平 Nitrogen level | 60 d | 95 d | 131 d | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| MB | PB | 平均 Mean | MB | PB | 平均 Mean | MB | PB | 平均 Mean | |||
| 小麦 Wheat | 生物量 Biomass (g/plant) | 1/2 N | 0.20a | 0.16a | 0.18A | 1.11a | 1.07a | 1.09A | 6.44a | 7.95a | 7.2A |
| N | 0.25b | 0.24b | 0.25B | 1.31b | 1.24b | 1.28B | 8.55b | 8.21b | 8.38B | ||
| 3/2N | 0.29b | 0.26b | 0.28B | 1.32b | 1.14b | 1.23B | 9.02c | 8.58c | 8.8B | ||
| 平均 Mean | 0.25A | 0.22B | 1.25A | 1.15B | 8.0A | 8.25A | |||||
| 根冠比 Root-shoot ratio | 1/2N | 0.47a | 0.51a | 0.49A | 0.42a | 0.42a | 0.42A | 0.39a | 0.59a | 0.49A | |
| N | 0.43a | 0.46a | 0.45A | 0.39ab | 0.41a | 0.40A | 0.40a | 0.34b | 0.37B | ||
| 3/2N | 0.30b | 0.37b | 0.34B | 0.37b | 0.30b | 0.34B | 0.22b | 0.28b | 0.25C | ||
| 平均 Mean | 0.4A | 0.45B | 0.39A | 0.38A | 0.34A | 0.40A | |||||
| 蚕豆 Faba bean | 生物量 Biomass (g/plant) | 1/2N | 0.51a | 0.37a | 0.44A | 1.65a | 1.52a | 1.59A | 6.31a | 7.10a | 6.71A |
| N | 0.58b | 0.46b | 0.52B | 1.96b | 1.57ab | 1.77B | 6.66a | 7.99ab | 7.33B | ||
| 3/2N | 0.59b | 0.49b | 0.54B | 1.83b | 1.63b | 1.73B | 8.26±b | 8.20b | 8.23C | ||
| 平均Mean | 0.56A | 0.44B | 1.81A | 1.57B | 7.08A | 7.76A | |||||
| 根冠比 Root-shoot ratio | 1/2N | 0.43a | 0.42a | 0.43A | 0.45a | 0.45a | 0.45A | 0.39a | 0.28a | 0.34A | |
| N | 0.34b | 0.41a | 0.38B | 0.46a | 0.44a | 0.45A | 0.38a | 0.31a | 035A | ||
| 3/2N | 0.33b | 0.34b | 0.34C | 0.38b | 0.49a | 0.44A | 0.30a | 0.33a | 032B | ||
| 平均 Mean | 0.37A | 0.39A | 0.43A | 0.46A | 0.36A | 0.31A | |||||
新窗口打开
小麦和蚕豆根冠比随施氮量增加而减小,这种差异到作物生长后期逐渐不显著。作物生长60 d时,低氮和常规施氮条件下小麦根冠比分别比高氮提高47.3%和33.8%,蚕豆分别比高氮提高26.9%和11.8%。同一生育期内相同氮水平条件下,与塑料分隔相比,除分蘖期(60 d)尼龙分隔小麦根冠比提高12%外,其他生育期没有明显差异。这说明相比于氮肥施用水平,作物种植方式对根冠比的影响较小。
2.2 根系分隔方式对不同氮水平下小麦分泌槲皮素和橙皮素的影响
表2反映了不同处理小麦槲皮素与橙皮素的含量变化。从表2可以看出,随着生育期的推移,小麦(尼龙和塑料分隔)槲皮素呈现出先增加后减少的趋势。到作物生长95 d时,槲皮素分泌量达到最大值。这主要是由于在小麦旺盛生长期,根系活力最强、生物量最大,根系槲皮素分泌能力最强[21]。伴随着小麦根系的衰老、籽粒的成熟,根系槲皮素分泌量迅速下降。从表2还可以看出,氮肥施用量和根系分隔方式对小麦根系槲皮素的分泌量均有影响。同一生育期内,随着施氮量的增加,小麦根系槲皮素分泌量减少,与常规施氮和高氮相比,低氮条件下,小麦槲皮素分泌量分别增加了13.2%—33.5%和19.4%—67.6%;相同氮水平条件下,与塑料分隔相比,尼龙分隔小麦根系槲皮素分泌量增加15.1%—35.8%。Table 2
表2
表2尼龙分隔和塑料分隔小麦根系槲皮素和橙皮素的分泌量
Table 2Contents of quercetin and hesperetin secreted by nylon and plastic separated root of wheat
| 类别 Type | 氮水平 Nitrogen level | 60 d | 95 d | 131 d | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| MB | PB | 平均 Mean | MB | PB | 平均 Mean | MB | PB | 平均 Mean | ||
| 槲皮素 Quercetin (ng·plant-1·h-1) | 1/2N | 114.6a | 106.4a | 110.5A | 130.3a | 116.3a | 123.3A | 104a | 82.4a | 93.2A |
| N | 102.6b | 86.4b | 94.5B | 112.6b | 105.1b | 108.9B | 84.9b | 54.6b | 69.8B | |
| 3/2N | 96b | 79.2c | 87.6C | 114.4b | 92.2c | 103.3C | 62.8c | 48.3b | 55.6B | |
| 平均 Mean | 104.4A | 90.7A | 119.1A | 104.5A | 83.9B | 61.8B | ||||
| 橙皮素 Hesperetin (ng·plant-1·h-1) | 1/2N | 135.3a | 110.6a | 123A | 119.8a | 105.8a | 112.8A | 108.7a | 85.3a | 97A |
| N | 106.4b | 103.1a | 104.8B | 99.2a | 84b | 91.6B | 71.9b | 60b | 66B | |
| 3/2N | 82.8c | 76.3b | 79.6C | 71.5b | 71.4b | 71.5C | 71.7b | 59.4c | 65.6B | |
| 平均 Mean | 108.2A | 96.7B | 91.8A | 92.1A | 84.1A | 68.2A | ||||
新窗口打开
与小麦根系分泌槲皮素不同,橙皮素的分泌量随生育期逐渐减少。同一生育期内,随施氮量增加,小麦橙皮素分泌量明显减少,与低氮条件相比,常规施氮和高氮小麦橙皮素分泌量分别减少了17.4%—47%和54.5%—74.5%。说明低氮胁迫条件促进了小麦根系橙皮素的分泌。相同氮水平条件下,与塑料分隔相比,小麦尼龙分隔根系分泌橙皮素数量增加,但这种差异在高氮条件下不显著。低氮和常规施氮条件下,尼龙分隔小麦根系分泌橙皮素数量高于塑料分隔13.7%—21%。
2.3 根系分隔方式对不同氮水平下蚕豆分泌槲皮素的影响
由图2可以看出,随施氮量增加,蚕豆根系槲皮素分泌量减少,同一氮水平条件下,蚕豆槲皮素分泌量随生育期的变化先增加后减少。这主要是由于在蚕豆生育前期,根系活力强,分泌槲皮素的能力较强,伴随着蚕豆根系的成熟和衰老,槲皮素的分泌量逐渐减少。与推荐施氮和高氮条件相比,低氮条件下蚕豆根系槲皮素分泌量最高。说明氮胁迫条件下,有利于蚕豆根系槲皮素的分泌。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2尼龙和塑料分隔蚕豆根系槲皮素分泌量
不同字母表示差异性显著(P<0.05)。下同
-->Fig. 2Quercetin secreted by nylon and plastic separated root of faba bean
Different letters mean significance (P<0.05). The same as below
-->
相同氮水平条件下,与根系塑料分隔相比,尼龙分隔蚕豆根系槲皮素的分泌量明显增加。低氮和推荐施氮条件下,尼龙分隔蚕豆根系槲皮素的分泌量分别较塑料分隔提高34.6%和56.6%。说明不同根系作用程度可以改变蚕豆槲皮素的分泌,且在低氮和常规施氮条件下差异显著,这主要是由于尼龙分隔间作体系作物之间存在根系交互作用,低氮和常规施氮条件下,作物之间根系对水分养分激烈竞争,进一步刺激槲皮素等黄酮类物质的分泌。
2.4 根系分隔方式对不同氮水平下蚕豆分泌橙皮素的影响
图3表明,随生长天数增加,蚕豆橙皮素的分泌量逐渐减少。同时,随氮肥施用量的增加,蚕豆根系橙皮素分泌量减少,但常规施氮和高氮之间差异不显著。与常规施氮和高量施氮相比,低氮条件下,蚕豆根系橙皮素分泌量分别增加了23.9%和11.9%,这主要是由于低氮条件下,豆科植物需要增加固氮量,植物自身调节根系分泌大量的黄酮等诱导物质,通过根瘤菌的识别来增加氮素固定。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3尼龙和塑料分隔蚕豆根系橙皮素分泌量
-->Fig. 3Hesperetin secreted by nylon and plastic separated root of faba bean
-->
相同氮水平条件下,间作根系分隔方式不同,蚕豆根系橙皮素分泌量也不同。与塑料分隔相比,低氮和常规氮水平条件下,根系尼龙分隔蚕豆橙皮素分泌量分别增加17.3%和6%,高氮条件下,两种根系分隔方式之间差异不显著。说明根系分隔方式影响蚕豆根系橙皮素的分泌。
3 讨论
与单作相比,豆科和禾本科作物间作往往能较大幅度的提高作物的产量,显示出明显的产量优势[22-23]。有研究表明,禾本科与豆类间作时,土地当量比高达1.4,而这种优势主要是由于非豆科作物的增产造成的,非豆科作物群体密度相对较高,能够截获更多的光能[24]。本研究表明,不同氮水平条件下的小麦蚕豆间作,常规施氮和高氮的蚕豆生物量明显高于低氮;同时,相同氮水平不同根系分隔方式下,蚕豆的生物量表现为尼龙分隔高于塑料分隔。这可能是由于尼龙分隔方式下,水分养分可以透过分隔介质,小麦能够吸收邻近蚕豆的养分,而塑料分隔除地上部交互作用外,根系生长相当于单作,水分养分无法透过分隔介质转运到周围植物根际,不会有地下部养分的竞争和共用,因此,尼龙分隔的作物生物量高于塑料分隔。氮素营养是调控作物生长、群体发育、提高水分利用的重要措施,对作物的根冠关系有重要影响[25]。已有研究表明,随着施氮水平的增加,根冠比降低[26]。王艳哲等[27]研究表明,随着氮肥用量的增加,冬小麦根冠比减小,氮肥水平对根冠比的影响达到显著水平。本研究结果显示,土壤氮肥施用量对小麦根冠比有显著影响,氮肥对根系生长表现为负效应。随着氮肥施用量增加,小麦生物量增加,地下部生物量增加幅度小于地上部,根冠比减小。蚕豆根冠比具有相同趋势,但随着生育期变化,蚕豆根冠比在各氮水平条件下差异不显著,说明当作物生长到一定阶段后,增施氮肥不再明显增加地上部分的生物量。同时说明,氮肥施用量的变化并没有明显影响作物地下部的生长。
已有研究表明,槲皮素是一种具有多种生物活性的黄酮类化合物,具有抗氧化、抗过敏、抗菌、抗病毒[28-29],清除体内自由基、抑制恶性肿瘤生长和转移[30-32]等多方面药理作用。近年来,根际槲皮素的研究也备受关注。最近研究表明,在豆科植物根际中,如果根际微生物是同一类,则随豆科植物根系周围的微生物增多槲皮素浓度也升高[33]。表明槲皮素是固氮根瘤形成初期的重要信号分子[34]。橙皮素也是一类天然黄酮类化合物,研究表明,在短季地区,较低的地温极大地影响豆科植物的固氮作用,进而影响作物的产量[35]。BEGUM等[36]研究发现,在较低地温环境下,豌豆播种时加入橙皮素可以增加豌豆根瘤及豆荚数量。但不同植物根系分泌槲皮素和橙皮素数量不同,即使是同种作物,不同生育期根系分泌量也存在显著差异[37],说明橙皮素也是结瘤固氮的重要信号物质[38]。本研究结果表明,小麦蚕豆根系均分泌槲皮素和橙皮素,不同的是,蚕豆分泌数量高于小麦。小麦槲皮素和橙皮素分泌量随施氮量增加而减小,这可能与小麦根冠比有关,氮肥增加导致地上部生长迅速,生物量累积增加,地下根系增长缓慢,根系分泌物数量减少[39]。与根系塑料分隔相比,尼龙分隔方式下槲皮素和橙皮素分泌量明显增加。这主要是因为尼龙分隔根系水分养分互相流通,根系生长状况可以通过养分质流得到缓解。本研究结果还表明,蚕豆槲皮素与橙皮素数量均随施氮量增加而减小,低氮和常规施氮条件下,蚕豆槲皮素和橙皮素分泌量均为尼龙分隔高于塑料分隔,高氮条件下两种根系分隔之间差异不显著。这一方面是因为槲皮素和橙皮素作为影响豆科作物结瘤的重要黄酮类物质,低氮条件下,由于养分胁迫,蚕豆为固定氮素分泌大量信号物质刺激根系的结瘤作用。另一方面,间作环境下,小麦根系分泌物质的刺激导致蚕豆槲皮素和橙皮素分泌量的增加[40]。
综上所述,从研究方法看,本研究中作物根系分泌物的收集均采用取出植株样品后放入收集液中定时采集,样品采集过程中会存在一定人为的影响因素,故试验结果存在一定误差,但目前的研究尚未有更为精准的根系分泌物收集方法,在今后的根际研究中,应采用更为准确的根系分泌物采样方法进行根际研究。从研究结果来看,氮肥施用水平和作物根系分隔方式能够显著影响小麦蚕豆地上和地下的生长、根冠比的变化,进而影响作物根系槲皮素和橙皮素的分泌,这两种物质的多少又影响豆科结瘤的过程。因此,在农业生产上,如何通过优化施氮和合理种植调控地上和地下生长,使作物维持适中的根冠比,达到既不影响根系对土壤水分养分的有效利用,又能显著控制根系生长,调节根系橙皮素和槲皮素的分泌数量尚需进一步的研究。
4 结论
小麦蚕豆生物量随施氮量增加而增加,根冠比随施氮量增加而减小,根系尼龙分隔小麦蚕豆的生物量和根冠比高于塑料分隔。根系分隔方式和氮肥施用水平均影响小麦蚕豆根系槲皮素和橙皮素的分泌。随施氮量增加,小麦蚕豆槲皮素橙皮素分泌量减少;相同氮水平(尤其低氮和常规施氮)条件下,尼龙分隔小麦蚕豆根系槲皮素和橙皮素分泌量明显高于塑料分隔,高氮条件下差异不显著。
The authors have declared that no competing interests exist.
