0 引言
【研究意义】细胞色素P450s是生物体中一类重要的氧化代谢酶类[1],不仅参与昆虫体内激素的代谢,影响其生长发育,也参与体外包括杀虫剂在内的有毒物质的代谢,使昆虫对其产生耐药性或抗性[2-3]。对棉蚜(Aphis gossypii)CYP6CY3的研究,不仅可以明确其在棉蚜抗药性机制中发挥的作用,还能够为棉蚜的科学防治提供依据。【前人研究进展】棉蚜主要通过取食和传播病毒来危害农作物,在世界范围内造成严重的经济损失[4]。长期以来,棉蚜的防治一直以化学防治为主,由于棉蚜发育历期短,发生量大,加之不合理用药,其抗药性发展速度很快,抗性程度很高,抗性背景复杂[5]。目前,棉蚜已经对有机磷、氨基甲酸酯、拟除虫菊酯、新烟碱类等多种杀虫剂产生抗性[6-8]。已有相关研究证实昆虫对化学杀虫剂的抗性与CYP6家族基因的过量表达有密切关系[8-10]。PENG等[8]利用人工饲喂棉蚜CYP6A2的dsRNA,使棉蚜的CYP6A2表达量显著降低,致使棉蚜在25和50 µg·mL-1螺虫乙酯浓度下死亡率显著高于对照组,说明CYP6A2的沉默能降低棉蚜对螺虫乙酯的抗性;DING等[10]研究发现褐飞虱(Nilaparvata lugens)抗吡虫啉品系的CYP6AY1表达量是敏感品系的17.9倍,通过注射dsRNA干扰抗性品系的CYP6AY1,发现其对吡虫啉敏感性显著增强,说明CYP6AY1参与吡虫啉的代谢。利用RNAi技术干扰解毒基因的表达,从而达到防治害虫的目的是目前研究的一个热点,为害虫防治提供了新思路。【本研究切入点】棉蚜是棉花的主要害虫之一,抗药性的不断发展成为棉蚜科学有效防治的一个难点。石绪根[11]研究发现棉蚜CYP6CY3在抗性品系中的表达量是敏感品系的5.66倍,但其在抗药性中的作用还有待明确。【拟解决的关键问题】通过RT-PCR及3′-RACE技术克隆得到棉蚜的细胞色素P450 CYP6CY3,进行原核表达及多克隆抗体制备,为后续研究CYP6CY3在棉蚜中的时空表达和功能分析,以及在棉蚜抗药性形成中的作用打下基础。1 材料与方法
试验于2015年在新疆大学生物资源与基因工程重点实验室完成。1.1 材料及试剂
试虫棉蚜2010年采自乌鲁木齐市安宁渠棉田,在室内饲养条件:温度为(25±1)℃,相对湿度为50%—60%,光周期为14 L﹕10 D;昆明白小鼠购自新疆医科大学第一附属医院。pET32a质粒为笔者实验室保存;RNA提取试剂
盒TransZol Up Plus RNA Kit购于北京全式金公司;SMARTTM RACE试剂盒购自美国Clontech公司;Taq DNA聚合酶、T4 DNA连接酶、DNA Marker、pMD18-T载体、各种限制性内切核酸酶均为大连TaKaRa公司;蛋白Marker购自Thermo Fisher Scientific公司;小鼠抗His-tag多克隆抗体、辣根过氧化物酶标记的山羊抗小鼠IgG抗体、大肠杆菌Transetta菌株感受态细胞购自北京全式金公司;DAB显色试剂盒购自北京中杉金桥公司;胶回收试剂盒及质粒提取试剂盒均购自OMEGA公司,ELISA板购自广州洁特生物过滤制品有限公司(JET BIOFIL),其余所用的化学试剂均为国产分析纯,试验所用引物合成及序列测序均由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 棉蚜CYP6CY3克隆与序列分析 取大小一致棉蚜约50头,用TRIzol法提取总RNA,1%琼脂糖凝胶电泳检测总RNA的完整性,利用TaKaRa公司的反转录试剂盒PrimeScriptTM 1st Strand cDNA Synthesis Kit反转录合成cDNA第一条链,置于-20℃冰箱保存备用。根据引物设计原则,以棉蚜P450 CYP6CY3的部分序列(GenBank登录号:JQ246416.1)设计PCR引物CYP6CY3-F/R(表1),以反转录的cDNA为模板进行CYP6CY3基因序列的PCR扩增,PCR产物纯化回收后,连接到pMD19-T载体,并转化至大肠杆菌DH5α中,接种到含有Amp的固体LB培养基中培养,扎取单克隆进行扩大培养,继而将菌液PCR鉴定为阳性的菌液送至生工生物工程(上海)股份有限公司进行测序。
基于已克隆得到的CYP6CY3部分cDNA序 列,设计3′-RACE的特异性引物GSP1、GSP2(表1),参照SMARTTM RACE试剂盒说明书进行3′-RACE;将3′-RACE获得的序列与已知序列用DNAMAN软件拼接成完整的开放阅读框(ORF);从ORF两端设计引物(表1),上下游引物分别加酶切位点Hind Ⅲ和Xho I,对拼接的cDNA序列进行克隆验证。
利用ORF finder(http://www.ncbi.nlm.nih.gov/ projects/gorf/)查找序列的ORF,利用DNAMAN6.0软件预测其编码的氨基酸序列,ProtParam(http://web. expasy.org/protparam/)预测蛋白质的理化性质;SignalP 4.1 Server(http://www.cbs.dtu.dk/services/ SignalP/)预测信号肽序列,ProtScale(http://web.expasy. org/ protscale/) 进行疏水性分析。采用软件MEGA 5.0通过以邻接法(neighbor-joining,NJ)构建系统进化树,Bootrap为1 000次。
Table 1
表1
表1引物序列
Table 1Primer sequences
| 引物名称 Primer name | 引物序列 Primer sequences (5′-3′) | 用途 Use |
|---|---|---|
| CYP6CY3-F | ATGATCCGGGATCCGGAAATAATAAAC | cDNA片段克隆 cDNA fragment cloning |
| CYP6CY3-R | TACCACTTGGACGTTTAGCTTTCTCTTC | |
| GSP1 | CGGACAAATTGACAACGCGTTATTG | 3′末端cDNA扩增 3′-end cDNA amplification |
| GSP2 | CTTCGTAAGTATCCTCCACTGGTTGC | |
| CYP6CY3-up | CAAGCTTTTATGATCCGGGATCC | 开放阅读框扩增 ORF amplification |
| CYP6CY3-down | CCCTCGAGTTAATTAATTTTTTTAAATG |
新窗口打开
1.2.2 原核表达质粒pET32a-CYP6CY3的构建与鉴定 将PCR得到的CYP6CY3完整ORF框DNA片段,回收连接至pMD-18T载体,转化大肠杆菌DH5α感受态细胞,挑取单克隆进行PCR及Hind Ⅲ和Xho I双酶切鉴定后,阳性菌液送生工生物工程(上海)股份有限公司测序。用Hind Ⅲ和Xho I将CYP6CY3的序列从重组质粒中切下,纯化、连接到表达载体pET32a上,将连接产物转化DH5α,挑取单克隆进行菌液PCR及质粒酶切鉴定后,选择阳性克隆送上海生工测序。
1.2.3 融合蛋白的诱导表达、鉴定及纯化 将鉴定正确的pET32a-CYP6CY3重组质粒转化大肠杆菌transetta菌株的感受态细胞,进行菌液PCR及质粒酶切鉴定得到阳性克隆。将阳性克隆37℃过夜培养,次日1﹕100接种于新鲜的含有50 µg·mL-1 Amp的LB液体培养基,37℃培养至OD600为0.6—0.8,加入IPTG至终浓度为0.5 mmol·L-1,诱导培养4 h后,离心收集菌体,PBS(pH 8.0)重悬菌体,经超声破碎后离心,取上清和沉淀分别进行SDS-PAGE电泳检测。将分离后的蛋白转印至PVDF膜上,5%的脱脂奶粉封闭4℃过夜,1×TBST洗膜,加入1﹕3 000(v/v)小鼠抗His-tag多克隆抗体,37℃孵育2 h,洗膜,加入1﹕5 000(v/v)辣根过氧化物酶标记的山羊抗小鼠IgG,室温孵育1 h,充分洗涤后用DAB
显色鉴定表达产物。
样品处理后进行12%的SDS-PAGE电泳,0.25 mol·L-1的KCl染色后,切下目的条带,在预冷的研钵研磨15 min,边研磨边加PBS,6块SDS-PAGE切下的胶条约需加1.5—2 mL PBS;4℃,12 000 r/min,离心15 min,上清中含有融合蛋白,利用SDS-PAGE(12%)电泳检测纯化蛋白的大小及纯度。
1.2.4 鼠抗CYP6CY3多克隆抗体的制备 取纯化的CYP6CY3融合蛋白免疫昆明白小鼠,共免疫3次,每次免疫蛋白量50 µg。免疫前采昆明白小鼠血清作为阴性对照。第1次将纯化的蛋白与完全弗氏佐剂等体积混合,超声乳化后皮下多点注射法免疫小鼠;第2、3次免疫使用不完全弗氏佐剂与蛋白充分乳化,每次免疫间隔14 d。最后一次免疫后10 d采血,血样37℃放置0.5 h,4℃放置过夜,5 000 r/min离心15 min所得血清即为抗血清,于-80℃冰箱保存。
1.2.5 ELISA检测鼠抗CYP6CY3抗体效价 以纯化的His-CYP6CY3融合蛋白包被ELISA板,4℃过夜,5%的脱脂奶粉37℃、封闭2 h后,PBST洗涤3次,加入不同稀释比例的鼠抗血清及免疫前的鼠血清做对照,150 µL/孔,37℃、孵育1 h。洗涤3次,加入辣根过氧化物酶标记的山羊抗鼠IgG(1﹕3 000),37℃、孵育1 h。PBST缓冲液洗涤3次,加TMB底物显色10—15 min,各反应孔中加入2 mol·L-1硫酸终止反应。用酶标仪检测A450,免疫前的血清为对照,其A450值为N;免疫后的血清A450值为P,以P/N>2.1判断为阳性。
1.2.6 Western blot及免疫组化检测鼠抗CYP6CY3血清的特异性 CYP6CY3融合蛋白经SDS-PAGE分离后,转印至PVDF膜上,5%的脱脂奶粉封闭4℃过夜,依次用1﹕3 000(v/v)的鼠抗CYP6CY3抗血清,37℃孵育2 h,洗涤,加入1﹕5 000(v/v)的辣根过氧化物酶标记的山羊抗小鼠IgG,室温孵育1 h,充分洗涤后用DAB(中杉金桥公司)显色。
取棉蚜成虫作为免疫组化的材料,按照以下步骤进行:(1)固定:将棉蚜放入4%的多聚甲醛缓冲溶液中,于4℃固定(至少24 h);(2)脱水:经不同浓度的乙醇对组织进行脱水处理;(3)透明;(4)浸蜡:在56℃温箱中将石蜡完全溶入二甲苯,放置1 h,重复两次;(5)包埋;(6)切片:用切片机将组织按照纵切的方式切成2 μm厚度的蜡片,于45℃温水中展开捞起;(7)烤片:将载玻片室温静置1 h,56℃恒温培养箱中烘烤1 h;(8)脱蜡:二甲苯脱蜡3次,每次20 min,分别放入100%、90%、80%、75%的乙醇中各5 min,蒸馏水,PBS洗涤3次,每次5 min;(9)抗原修复:用柠檬酸盐缓冲液浸没组织切片,放入微波炉中加热,温度维持在92℃ 10 min左右,用3% H2O2溶液处理30 min,PBS,蒸馏水分别洗涤3次,每次5 min;(10)抗原封闭:5%的脱脂奶粉,滴加在组织上,37℃孵育2 h;(11)一抗孵育:1﹕100比例稀释一抗后滴加在组织上,4℃孵育过夜,37℃孵育1 h。弃去一抗,PBS,蒸馏水分别洗涤3次,每次5 min;(12)二抗孵育:1﹕1 000稀释二抗,滴加在组织切片上,37℃,3 h。PBS,蒸馏水洗涤3次,每次5 min;(13)DAB显色:将DAB显色剂滴加在组织上,显色3 min后蒸馏水洗去DAB显色液。注意处理之间的显色时间要保持一致;(14)脱水;(15)中性树脂封片;(16)拍照:使用Nikon NIS-Elements D显微镜观察拍照。
2 结果
2.1 棉蚜CYP6CY3目的基因的克隆及序列分析
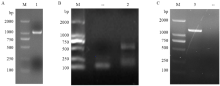
提取总RNA,按照反转录试剂盒说明书反转录得到cDNA,以CYP6CY3-F/R引物扩增棉蚜CYP6CY3的部分序列,1%琼脂糖凝胶检测有一条清晰的条带,与目的片段(1 063 bp)大小一致(图1-A)。将测序结果与NCBI数据库的CYP6CY3序列一致性为99.25%。以GSP1和GSP2 3′-RACE引物扩增CYP6CY3的3′片段,得到大小约为500 bp的序列(图1-B),测序结果用DNAMAN6.0软件进行拼接,得到CYP6CY3完整的ORF。CYP6CY3- up/down引物扩增棉蚜CYP6CY3 cDNA完整ORF(图1-C),并连接至pMD-18T载体测序得到完整ORF框序列。利用ORF Finder对所获得的序列分析表明,棉蚜CYP6CY3 cDNA的ORF大小为1 266 bp,共编码421个氨基酸,预测蛋白分子质量48.8 kD,理论等电点为8.99。核苷酸及推导的氨基酸序列见图2,该基因含有P450基因标志性的F××G×××C×G(358—367)血红素结合位点;位于螺旋K中参与稳定核心结构的E××R(283—286)完全保守序列以及特征序列‘PERF’的P××F×PE/DRT(339-345),螺旋C的保守序列W×××R(45—49),螺旋I中P450氧结合部位的AG××T(225—229)保守序列。SignalP 4.1 Server分析显示该蛋白无信号肽序列(图3-A),ProtScale分析平均疏水性指数为-0.192,属亲水性蛋白(图3-B)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1棉蚜CYP6CY3 扩增
-->Fig. 1Amplification of CYP6CY3 from A. gossypii
A:CYP6CY3部分序列PCR产物 Partial sequence PCR product of CYP6CY3;M:DNA Marker;1:PCR产物 PCR product。B:3′-RACE产物 3′-RACE product;2:第1轮PCR产物稀释100倍作为第2轮的模板扩增得到的PCR产物 PCR product was 100 times diluted and then taken as the template of the later PCR。C:ORF扩增 Amplification of the ORF;3:PCR产物 PCR product;--:阴性对照 Negative control
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2棉蚜CYP6CY3的开放阅读框核苷酸序列及推导的氨基酸序列
-->Fig. 2ORF sequence and the deduced amino acid sequence of CYP6CY3 from A. gossypii
方框内为起始和终止密码子 Inside the box for the start and stop codons;CYP6CY3蛋白保守结构域:W××× R、AG××T、E××R、P××F×PE/DRT和F××G×××C×G用下划线标出 CYP6CY3 conserved motifs including W××× R, AG××T, E××R, P××F×PE/DRT and F××G×××C×G were underlined in bold
-->
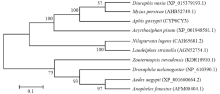
通过NCBI Blastx进行同源序列的比对分析,结果显示,棉蚜CYP6CY3氨基酸序列与豌豆长管蚜(Acyrthosiphon pisum)(XP_001948581.1)氨基酸一致性最高,达到81%,与麦双尾蚜(Diuraphis noxia)(XP_015379193.1)一致性为79%,与桃蚜(Myzus persicae)(AHB52749.1)氨基酸序列一致性76%,4种蚜虫的氨基酸序列都含有位于螺旋K中参与稳定核心结构的E××R完全保守序列及P450基因标志性的F× ×G×××C×G(358—367)血红素结合位点的共有序列。使用MEGA5软件邻接法进行1 000次重复计算后构建系统进化树,由图4可以看出,10种昆虫的P450蛋白聚为两大类,3种蚜虫与褐飞虱及灰飞虱(Laodelphax striatella)聚为一类亲缘关系较近;而内华达古白蚁(Zootermopsis nevadensis)、黑腹果蝇(Drosophila melanogaster)、埃及伊蚊(Aedes aegypti)及催命按蚊(Anopheles funestus)聚为另一大类。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3棉蚜P450 CYP6CY3蛋白的信号肽及亲/疏水性分析
-->Fig. 3Signal peptide and hydrophilic/hydrophobic analyses of P450 CYP6CY3 from A. gossypii
A:信号肽分析 Signal peptide analysis;B:亲/疏水性分析 Hydrophilic/hydrophobic analysis
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4以邻接法构建的10种昆虫P450蛋白系统进化树
-->Fig. 4Phylogenetic analysis of 10 insect P450 proteins by neighbor-joining method
-->
2.2 重组质粒pET32a-CYP6CY3的构建与鉴定
经Hind Ⅲ和Xho I双酶切回收得到的基因片段(图5-A),亚克隆至pET32a载体上,转化DH5α,挑取单菌落进行菌液PCR鉴定,并提质粒进行Hind Ⅲ和Xho I双酶切鉴定,在琼脂糖凝胶上可以看到一条清晰的条带,与目的片段(1 266 bp)的大小一致(图5-B),测序结果正确,表明重组质粒pET32a-CYP6CY3构建成功。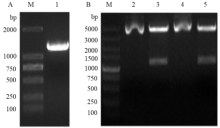 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5CYP6CY3 双酶切回收及重组质粒pET32a-CYP6CY3的鉴定
-->Fig. 5Analysis of double digestion product of CYP6CY3 by agarose gel electrophoresis and identification of recombinant plasmid pET32a-CYP6CY3
A:CYP6CY3双酶切回收产物的琼脂糖凝胶电泳分析 Analysis of double digestion product of CYP6CY3 by agarose gel electrophoresis;M:DL2000 DNA Marker;1:回收产物 Recycled product;B:重组质粒pET32a- CYP6CY3的Hind Ⅲ和Xho I双酶切 The recombinant plasmid pET32a- CYP6CY3 double digestion by Hind Ⅲ and Xho I;M:DL5000 DNA Marker;2、4:重组质粒pET32a-CYP6CY3 The recombinant plasmid pET32a-CYP6CY3;3、5:双酶切产物 Double digestion products
-->
2.3 融合蛋白的诱导表达、鉴定及纯化
重组质粒pET32a-CYP6CY3转化大肠杆菌transetta(DE3)菌株的感受态(全式金),鉴定得到阳性克隆,进行诱导表达后在约66.2 kD处有一条特异性条带(图6-A),与理论大小65.8 kD相符合,其可溶性分析发现其主要存在于沉淀中,为包涵体蛋白。切胶回收的方法纯化得到较纯的融合蛋白(图6-B),可以用于后续的抗体制备。Western blot结果表明在66.2 kD处有一条明显的杂交带出现(图6-C),与预期重组蛋白分子量大小一致,表明重组质粒可以在宿主菌中稳定表达。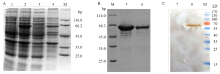 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6融合蛋白的诱导表达、纯化及Western blot鉴定
-->Fig. 6Expression, purification and Western blot detection of the fusion protein
A:融合蛋白的诱导表达 Induced expression product of the fusion protein;M:蛋白Marker Protein Marker;1—4:BL21-His-CYP6CY3诱导前、诱导后、超声后上清、沉淀 BL21-His-CYP6CY3 without IPTG, BL21-His-CYP6CY3 with IPTG, BL21-His-CYP6CY3 supernatant with IPTG, and BL21-His-CYP6CY3 precipitation with IPTG。B:融合蛋白的纯化 Purification of fusion protein;5、6:融合蛋白 Fusion protein。C:融合蛋白的Western blot鉴定 Western blot of fusion protein identification;7、8:诱导前、诱导后 Before induction and after induction
-->
2.4 ELISA检测鼠抗CYP6CY3多克隆抗体效价
融合蛋白His-CYP6CY3免疫3次后,ELISA测定抗血清的效价。从图7可以看到当血清稀释409 600倍时样本光吸收值大于阴性数值的2.1倍,即抗血清的效价大于409 600。说明抗血清滴度达到预期要求,可用于后续试验。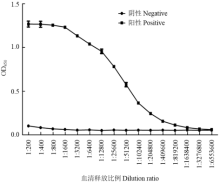 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7ELISA检测鼠抗CYP6CY3血清的效价
-->Fig.7ELISA detection of mouse anti-CYP6CY3 titer
-->
2.5 Western blot及免疫组化检测鼠CYP6CY3血清的特异性
用制备的CYP6CY3多克隆抗体对纯化的融合蛋白作Western blot,结果显示在预期大小的位置呈现特异性的结合条带(图8-A),说明制备的CYP6CY3多克隆抗体具有较好的免疫学活性。用免疫前的小鼠血清作为阴性对照和抗血清,对棉蚜进行免疫组化分析,该血清能和棉蚜组织中的天然CYP6CY3蛋白特异性结合(图8-B),可用于后续研究。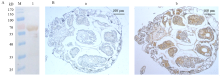 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8多克隆抗体与CYP6CY3特异性结合的检测
-->Fig. 8Detection of polyclonal antibody specificity binding to CYP6CY3
A:多克隆抗体与融合蛋白His-CYP6CY3 Western blot 鉴定 Polyclonal antibody combined with His-CYP6CY3 fusion protein specificity of detection Western blot;M:蛋白Marker Protein Marker;1:融合蛋白Fusion protein。B:免疫组化Immunohistochemistry;a:免疫前血清Pre-immune serum;b:免疫后血清After immunization serum
-->
3 讨论
棉蚜是一种世界性的农业和经济作物害虫[8],能够不断对新的杀虫剂产生抗药性[5-7]。从基因表达调控水平研究害虫抗药性问题对于诠释害虫对杀虫剂产生抗性的机理及科学有效的防治害虫提供参考[12]。细胞色素 P450酶系(P450s)是一类广泛分布于动物和植物等有机体内的血红素蛋白,是一类极其重要的多功能氧化酶[1],参与昆虫对多种化学杀虫剂产生抗性的机制[13-15]。目前已经报道的昆虫P450s基因分属于10 个家族(CYP4、CYP6、CYP9、CYP12、CYP15、CYP18、CYP28、CYP48、CYP49和CYP301-34148),其中CYP4和CYP6家族的P450s基因数量最多,占昆虫P450s基因总数的一半以上,CYP6家族对外源物质存在广谱的抗性被称为昆虫特有的抗性基因[16-18]。CYP6CY3是细胞色素P450 CYP6家族的重要成员之一,已有研究表明其表达量的变化与棉蚜[11]、桃蚜[19]、禾谷缢管蚜[20]等对化学杀虫剂的抗性有关。PUINEAN等[19]从生物化学和基因学的角度研究了新烟碱类杀虫剂的抗性机理,指出桃蚜CYP6CY3的过量表达在抗性中起主要作用,禾谷缢管蚜抗性品系CYP6CY3在吡虫啉处理后3、12 h表达量分别是敏感品系的14、59倍[20],这与石绪根[11]的研究结果一致,进一步说明了该基因在禾谷缢管蚜及棉蚜对吡虫啉产生抗性中具有重要作用。随着分子生物学和DNA重组技术的发展,对于P450的异源表达系统常用的有大肠杆菌表达系统、酵母表达系统、昆虫细胞表达系统以及哺乳动物细胞表达系统[21]。大肠杆菌表达系统是目前最常用的异源蛋白表达系统,具有表达水平高,技术要求低等优点,但其不能够进行翻译后修饰表达出的大部分真核蛋白不具有生物活性[21]。目前已有的报道使用大肠杆菌表达系统表达的昆虫细胞色素P450酶基因有棉铃虫CYP6B7[22]和CYP6B6[23]以及微小按蚊CYP6AA3[24],褐飞虱CYP4C62[25]等基因。笔者研究组前期已经成功在原核表达系统中表达了棉铃虫的CYP6B6蛋白,并制备得到了特异性好效价高的多克隆抗体[12,23]。所以在本研究中通过3′-RACE克隆得到了CYP6CY3 ORF,然后利用原核表达系统诱导并纯化了CYP6CY3融合蛋白。His-CYP6CY3为包涵体蛋白,不具备生物活性,而制备多克隆抗体不需要得到其具有生物活性的蛋白,并且包涵体表达量大,可以纯化得到大量目的蛋白[12]。采用切胶回收的方法纯化包涵体蛋白,该方法不需要反复上柱、洗涤、洗脱等步骤,相较于Ni柱纯化蛋白该方法更加省时,但这种方法只适用于纯化不需要蛋白活性的样品,且操作过程中蛋白易降解。
蛋白免疫法成功制备得到效价高特异性强的多克隆抗体,为后续分析CYP6CY3在棉蚜中的时空表达水平,并通过免疫组化法定位分析该蛋白的组织、细胞及亚细胞分布规律,以及最终解析CYP6CY3的生物学功能打下了基础,下一步计划利用RNAi技术干扰CYP6CY3,使其不表达或表达量下降,从而提高害虫对杀虫剂等的敏感性。
4 结论
克隆得到棉蚜CYP6CY3的开放阅读框(ORF),构建原核表达载体,获得重组质粒pET32a-CYP6CY3,并成功在大肠杆菌Transetta(DE3)中诱导表达,基于切胶回收纯化得到的CYP6CY3蛋白免疫小鼠,制备了高效特异的多克隆抗体,免疫组化显示该抗体具有较好的免疫反应性。The authors have declared that no competing interests exist.
