0 引言
【研究意义】荔枝(Litchi chinensis Sonn.)为无患子科常绿果树,是华南地区的主要特色水果,果肉营养丰富,享有“中华之珍品、岭南果王”的美誉[1]。尽管中国荔枝在产量和品质方面都具有显著优势,但受保鲜和加工技术的限制,产业链的延展和产业规模的增长困难重重,因此,开展精深加工与利用研究、延长其产业链是促进荔枝产业可持续发展的必由之路。中医认为荔枝果肉具有健脾、益肝、养颜功效,现代研究报道荔枝果肉具有抗氧化、抗辐射和护肝等生物活性[2-4]。多酚是一大类重要的非营养素植物活性物质,对于维持人体健康、降低多种慢性疾病的发病风险有重要作用[5]。研究已证实荔枝果肉富含多酚等活性物质[6],前期研究表明荔枝果肉多酚具有明显的抗氧化活性,但采用的是多种酚类物质的混合提取物,其酚类组成颇为复杂,有效的酚类成分尚不明确。探明荔枝果肉中发挥抗氧化作用的有效酚类成分可以为准确揭示荔枝果肉发挥健康效应的物质基础提供依据,对指导荔枝精深加工与利用具有重要的科学意义和经济价值,也为进一步挖掘对人体健康有保护作用的膳食因子,开发功能性食品提供依据。【前人研究进展】目前,国内外对荔枝果皮和果核中酚类物质及抗氧化活性研究已有不少报道,DUAN等[7]和SUN等[8]研究表明荔枝果皮花青素、表儿茶素和原花青素二聚体具有良好消除1,1-二苯基-2-苦基苯肼(1,1-diphenyl- 2-picrylhydrazy,DPPH)自由基,羟基自由基及超氧阴离子自由基的能力;LIU等[9]发现果皮中A型原花青素二聚体和三聚体的抗氧化能力较表儿茶素高,可能与其分子结构中羟基数量有关;ZHOU等[10]发现荔枝果核中高聚原花青素具有铁离子还原能力(ferric reducing ability of plasma,FRAP)和DPPH等抗氧化活性,且较果皮高聚原花青素的活性好。然而,对荔枝可食用部分果肉中酚类物质及其生物活性研究较少。SU等[11]研究发现荔枝果肉多酚提取物具有良好的氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)和细胞抗氧化能力(cellular antioxidant ability,CAA),经HPLC初步鉴定该提取物含有儿茶素、香草酸、咖啡酸、表儿茶素、4-甲基儿茶酚、芦丁等多种酚类化合物。随后,SU等[12]从荔枝果肉中分离纯化并采用电喷雾电离质谱(electrospray ionization mass spectrometry,ESI-MS)、核磁共振(nuclear magnetic resonance,NMR)等手段鉴定出表儿茶素、芦丁和槲皮素-3-O-芸香糖-7-O-α-L-鼠李糖苷3种单体酚,比较其ORAC、CAA抗氧化能力的差异,发现第三种单体酚的活性最好,但并不能完全证明其为最有效的成分。【本研究切入点】近来的研究认为植物活性物质发挥药理活性的往往不是某种单一的化学成分而是一组成分群共同作用的结果[13]。荔枝果肉富含的酚类物质种类繁多,若将荔枝果肉分成不同的酚类成分群,以此来确定其发挥抗氧化作用的有效成分群,这不仅考虑了某些含量较低或单独作用活性较弱的成分对主要活性成分可能具有的协同增效作用,确定出更接近提取物作用效果的有效酚类成分群,而且可以提高工作效率。【拟解决的关键问题】基于以上问题,本研究首先结合高效液相色谱法的原理,采用C18硅胶层析柱分离、纯化得到荔枝果肉的不同酚类成分群,然后采用DPPH、FRAP、ORAC、CAA等多种抗氧化的评价方法来评价比较荔枝果肉不同酚类成分群的抗氧化活性差异,旨在明确荔枝果肉发挥抗氧化作用的主要酚类成分群,为植物活性成分的筛选提供新思路。1 材料与方法
试验于2014年7月至2015年10月在广东省农业科学院蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室内进行。1.1 材料与仪器
1.1.1 试验材料 荔枝品种为‘怀枝’(Litchi chinensis Sonn. cv. Huaizhi),2014年7月采自广东省农业科学院果树研究所种质资源圃。没食子酸(gallic acid)、表儿茶素(epicatechin)、原花青素B2(procyanidin B2)、芦丁(rutin)、槲皮素(quercetin)、DPPH、ABAP(2,2′-偶氮二异丁基脒二盐酸盐)、Trolox(水溶性维E)、DCFH-DA(2′,7′-二氯荧光黄二乙酸盐)、荧光素二钠盐和福林酚试剂均购自Sigma公司;MEM细胞培养基、胎牛血清、HPLC级甲醇、乙酸和乙腈购自Thermo Fisher Scientific公司;FRAP测定试剂盒购自上海碧云天生物技术有限公司;HepG2人肝癌细胞由中国科学院干细胞库提供;其他试剂均为国产分析纯。1.1.2 主要仪器 EYELAN-1100旋转蒸发仪,东京理化器械株式会社;FDU-2110真空冷冻干燥机,东京理化器械株式会社;LC-1260型高效液相色谱仪,Agilent公司;UV-1800型紫外可见分光光度计,日本岛津有限公司;Infinite M200pro酶标仪,Tecan公司;HeraCell 240i CO2培养箱,Thermo Fisher Scientific公司;DMI3000B型倒置荧光显微镜,Leica公司。
1.2 试验方法
1.2.1 荔枝果肉不同酚类成分群的分离制备 荔枝果肉不同酚类成分群的分离制备工艺流程见图1,具体步骤如下所示。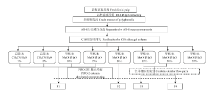 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1荔枝果肉不同酚类成分群的分离制备流程图
-->Fig. 1The preparation of different phenolic compound fractions from litchi pulp
-->
1.2.1.1 荔枝果肉多酚的制备 新鲜荔枝去皮去核后,将果肉浸泡在70%的乙醇溶液中(料液比1﹕3,w/v),转入冰水浴内切式匀浆机均质5 min,离心后收集上清液,置于旋转蒸发仪内45℃减压回收乙醇,残留的水溶液为荔枝果肉多酚粗提液。将粗提液经过AB-8大孔树脂吸附后,蒸馏水洗脱以除去可溶性糖和其他小分子化合物,再用70%乙醇洗脱,收集乙醇洗脱液,于45℃减压浓缩,得到深黄色浓缩液,真空冷冻干燥后即为荔枝果肉多酚提取物(以下简称LPP)。
1.2.1.2 C18硅胶柱分离得到荔枝果肉不同酚类成分群 称取一定量LPP,溶于蒸馏水中(加入少量DMSO助溶),上样于C18硅胶层析柱(15 cm×6.0 cm,40 μm),给予适当的泵压力将流速调整为4 mL·min-1,待样品吸附完成后,依次采用不同浓度的乙腈/水(v/v)和甲醇/水(v/v)进行梯度洗脱,洗脱流速为6 mL·min-1,每6 min收集一流分,并用HPLC检测分析,合并图谱组成相近的流分,再分别经改良的聚苯乙烯填充层析柱(15 cm×6.0 cm,60 μm,以下简称PIPO-2柱)吸附脱水,再用甲醇洗脱,收集甲醇洗脱液,减压回收甲醇,冷冻干燥,最终得到4个组成不同的荔枝果肉酚类成分群,以下简称为F1、F2、F3和F4。LPP及4个成分群的HPLC谱见图2,根据LPP及各成分群的吸收峰出峰时间对比,可见4个成分群的分离效果较好。
1.2.2 荔枝果肉各酚类成分群的单体酚组成及含量HPLC分析 称取适量的各待测样品溶解在甲醇中配制成浓度为2 mg·mL-1的溶液,经0.22 μm滤膜过滤后采用安捷伦1260型HPLC-DAD测定,参照ZHANG等[14]建立的方法。流动相:流动相A为0.4%(v/v)的冰乙酸,流动相B为乙腈,洗脱梯度为0—40 min B 5%—25%,40-—45 min B 25%—35%,45—50 min B 35%—50%,后运行平衡时间5 min;色谱柱为 Zorbax SB-C18反相色谱柱(4.6 mm×100 mm,5 μm,Agilent 公司);柱温为30℃;流速为1.0 mL·min-1;进样体积为20 μL;检测波长为全波长扫描,以280 nm为主要观察波长。样品色谱峰与标准品吸收峰保留时间及全波长扫描图对比定性,峰面积外标法定量。
1.2.3 荔枝果肉各酚类成分群的酚类含量测定
1.2.3.1 总酚含量的测定 采用Folin-Ciocalteu法[15]:以没食子酸溶液为标准品,标准曲线为Y=0.0021X+0.0329,R2=0.9949,其中:X为没食子酸浓度(μg·mL-1),Y为吸光度,检测波长为765 nm。样品中的总酚含量以每g干基中所含没食子酸当量(GAE)表示,单位为mg GAE·g-1 DW。
1.2.3.2 总黄酮含量的测定 采用硝酸铝-亚硝酸钠比色法[15]:以芦丁为标准品,标准曲线为Y=11.6120X+ 0.0086,R2=0.9996,其中:X为芦丁浓度(mg·mL-1),Y为吸光度,检测波长为 510 nm。样品中的总黄酮含量以每g干基中所含芦丁当量(RE)表示,单位为mg RE·g-1 DW。
1.2.3.3 缩合单宁含量的测定 采用香草醛-硫酸法[16]:以儿茶素作为对照,标准曲线为Y=2.0669X- 0.0196,R2=0.9993,其中:X为儿茶素浓度(mg·mL-1),Y为吸光度,检测波长为 500 nm。样品中的缩合单宁含量以每g干基中所含儿茶素当量(CE)表示,单位为mg CE·g-1 DW。
1.2.4 FRAP抗氧化能力测定 参照XU等[17]的方法,按照试剂盒说明测定。配制适量的FRAP工作液,现配现用,配好后37℃孵育待用。96孔板的每个检测孔中加入180 μL FRAP工作液,然后空白检测孔中加入5 μL蒸馏水,标准检测孔内分别加入5 μL各种浓度的FeSO4标准溶液,样品检测孔内加入5 μL待测样品。轻轻混匀,37℃孵育5 min后,采用酶标仪测定A593。根据标准曲线计算出样品的总抗氧化能力(FRAP值),以达到相同吸光度值所需的Fe2+摩尔浓度表示。
1.2.5 DPPH自由基清除率的测定 参照EBRAHIMZADEH等[18]的方法作适当改良。称取4.00 mg DPPH溶解于100 mL无水乙醇中,为DPPH工作液,现配现用。取100 μL不同浓度的各样品溶液,加入900 μL的DPPH工作液,室温避光静置30 min,于517 nm处测定吸光度Ai,同时测定900 μL的DPPH工作液与100 μL无水乙醇溶液的吸光度A1以及900 μL无水乙醇与100 μL样品溶液的吸光度A0。每个样品每个浓度重复3次,取平均值,计算DPPH自由基清除率,同时求得清除率为50%时所需样品浓度,即IC50值。
DPPH自由基清除率=
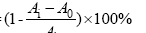
式中,Ai:样品与DPPH工作液反应后的吸光值;A0:样品与无水乙醇反应后的吸光值;A1:无水乙醇与DPPH工作液反应后的吸光值。
1.2.6 ORAC抗氧化能力测定 ORAC的测定采用荧光酶标仪检测法。Trolox标准品及各种待测样品用75 mmol·L-1磷酸缓冲液(pH=7.4)溶解稀释到适当的浓度,反应用黑色96孔板,首先空白孔中加入20 μL磷酸缓冲液,其余孔中分别加入不同浓度的Trolox标准溶液(6.25、12.5、25、50 μmol·L-1)、样品溶液以及17.5 μmol·L-1的没食子酸溶液,将96孔板放入荧光酶标仪中37℃孵育10 min;然后每孔加入200 μL 0.96 μmol·L-1荧光素钠溶液,37℃孵育20 min;之后除F孔外,每孔加入20 μL ABAP溶液(119 mmol·L-1,临用前用缓冲液配制),荧光酶标仪测定每孔的荧光值,测定条件如下:激发波长485 nm,发射波长520 nm,35个循环,每个循环4.5 min。根据Trolox标准曲线计算样品的ORAC值,单位为mmol TE·g-1 DW。
1.2.7 细胞抗氧化能力测定 细胞抗氧化能力(CAA)测定参考WOLFE等[19]的方法。测定原理是细胞经待测样品和本身无荧光的指示剂DCFH-DA混合物预处理,样品中的抗氧化物质结合在细胞膜上或进入细胞内,而DCFH-DA被细胞酯酶分解形成极性更强的还原性二氯荧光素DCFH,然后用ABAP处理细胞,ABAP分散在细胞中并自发分解形成过氧化自由基(ROO+),将DCFH氧化成有荧光的DCF。若存在抗氧化物质,则可消除ROO+,DCF的生成量减少,即荧光强度减弱。具体步骤如下:将处于对数生长期的HepG2细胞悬液种到黑壁透明底96孔细胞培养板中,每孔100 μL,细胞密度约为5×104/孔。板的最外周一圈不种细胞,只加入100 μL PBS。细胞生长24 h后,吸除培养基,用PBS 100 μL/孔清洗各孔一次。然后将100 μL不同浓度的槲皮素溶液或待测样品溶液(用MEM培养基溶解稀释,且含有25 μmol·L-1 DCFH-DA 的荧光素检测液)加入到相应孔中,空白对照孔中加入只含有25 μmol·L-1 DCFH-DA 的荧光素检测液,放入培养箱中继续培养1 h。然后去除各孔中的处理溶液,用多通道移液器迅速向各孔中加入100 μL ABAP溶液(600 μmol·L-1,临用前用PBS配制),空白孔中用PBS代替。迅速将细胞培养板放入荧光酶标仪中开始检测,测定条件为:激发波长485 nm,发射波长520 nm,12个循环,每个循环5 min。绘制工作曲线计算槲皮素和样品的EC50值,以槲皮素EC50与样品EC50的比值为样品的CAA值,单位为μmol QE·g-1 DW。
1.3 数据统计与分析
用SPSS 18.0和Origin 8.0软件进行数据统计分析及作图,图表中所有数据均以Mean±SD表示,荔枝果肉不同酚类成分群的多酚含量及抗氧化能力比较采用单因素方差分析,Tukey检验。统计结果P<0.05认为差异达显著性水平。2 结果
2.1 荔枝果肉各酚类成分群的得率及总酚、总黄酮和缩合单宁含量
由表1可知,F2成分群的得率最高,达到36.10%,其余3个成分群的得率分别为18.71%、16.79%、21.12%。各成分群的总酚、总黄酮和缩合单宁含量分别介于218.86—499.78 mg GAE·g-1 DW、414.94— 1 285.45 mg RE·g-1 DW、83.35—483.43 mg CE·g-1 DW。其中,F2成分群的总酚含量最高,其次是F3、F4,F1最低(P<0.05),且F2对荔枝果肉总多酚含量的贡献率高达50.31%,高于F1、F3和F4这3个成分群的贡献率之和(46.92%),F1的贡献率最低,仅为11.42%,而由于F3在荔枝果肉中占比较少,则其贡献率略低于F4。4个成分群的总黄酮含量及其贡献率的结果与总酚的结果类似。F2的缩合单宁含量显著高于其余3个成分群(P<0.05),对荔枝果肉多酚总含量的贡献率高达72.06%,是F1、F3、F4三者贡献率之和(27.20%)的2.67倍,提示荔枝果肉中部分多酚属于原花青素类,且这些原花青素类化合物主要富集在F2中。因此,F2成分群的得率及总酚、总黄酮和缩合单宁含量均最高。Table 1
表1
表1荔枝果肉不同酚类成分群的得率及酚类含量
Table 1Yield, total phenol, flavonoid and tannin content of different phenolic compound fractions from litchi pulp
| 成分群 Fractions | 得率 Yield (%) | 总酚 Total phenolic (mg GAE·g-1 DW) | 总黄酮 Total flavonoid (mg RE·g-1 DW) | 缩合单宁 Tannin (mg CE·g-1 DW) |
|---|---|---|---|---|
| F1 | 18.71 | 218.86±1.25a(11.42) | 414.94±17.25a(9.07) | 95.76±2.44b(7.40) |
| F2 | 36.10 | 499.78±5.15d(50.31) | 1285.45±32.48d(54.24) | 483.43±3.49d(72.06) |
| F3 | 16.79 | 357.46±5.69c(16.73) | 844.82±10.15c(16.58) | 83.35±3.40a(5.78) |
| F4 | 21.12 | 318.89±4.77b(18.77) | 783.82±5.07b(19.35) | 160.76±1.96c(14.02) |
新窗口打开
2.2 荔枝果肉各酚类成分群的单体酚组成及含量
由图2可知,F1成分群含有5种主要化合物,对应峰号为1—5;F2亦含有5种主要化合物,对应峰号为6—10;F3仅含一种化合物,峰号为11;F4含有4种主要化合物,对应峰号为12—15。HPLC-DAD分析荔枝果肉各酚类成分群的单体酚组成及含量(表2)。结果表明,F1的5种化合物未鉴定出是何种物质,则根据峰面积以没食子酸当量(mg GAE·g-1 DW)分别计算其相对含量,峰3含量最高,峰2次之,其余3个物质含量相近;F2中峰6鉴定为原花青素B2,峰9为表儿茶素,其含量分别为(113.87±3.86)mg·g-1 DW和(19.03±1.35)mg·g-1 DW,前者含量是后者的5.98倍,而其余3个未知化合物的相对含量通过峰面积以表儿茶素当量(mg EE·g-1 DW)分别计算,其中峰6(原花青素B2)和峰10含量远高于其他成分,是F2中最主要的两种物质;F3为槲皮素-3-O-芸香糖-7-O-α-L-鼠李糖苷单体酚,纯度达到90%以上;F4中峰14鉴定为芦丁,含量较低,仅为(32.36±0.45)mg·g-1 DW,其余3个未知化合物则根据峰面积以芦丁当量(mg RE·g-1 DW)分别计算其相对含量,其中峰15的含量最高,是芦丁的3.66倍。可见,各酚类成分群的单体酚组成各有特点。Table 2
表2
表2荔枝果肉各酚类成分群的单体酚组成及含量
Table 2Composition and content of free phenol in different phenolic compound fractions from litchi pulp
| 成分群 Fractions | 峰号 No. | 保留时间 Retention time (min) | 酚类化合物 Phenolic compounds | 相对含量 Relative content (mg·g-1 DW) |
|---|---|---|---|---|
| F1 | 1 | 6.075 | — | 11.67±0.57 |
| 2 | 10.820 | — | 38.58±2.90 | |
| 3 | 12.508 | — | 44.38±3.27 | |
| 4 | 14.206 | — | 16.11±1.48 | |
| 5 | 15.819 | — | 12.87±1.31 | |
| F2 | 6 | 19.910 | 原花青素B2 Procyanidin B2 | 113.87±3.86 |
| 7 | 20.963 | — | 17.16±1.32 | |
| 8 | 21.541 | — | 17.60±1.45 | |
| 9 | 21.935 | (-)-表儿茶素 (-)-Epicatechin | 19.03±1.35 | |
| 10 | 23.706 | — | 131.57±4.73 | |
| F3 | 11 | 25.423 | 槲皮素-3-O-芸香糖-7-O-α-L-鼠李糖苷 Quercetin -3-O-rutinose-7-O-α-L rhamnoside | 914.25±15.82 |
| F4 | 12 | 28.305 | — | 28.38±0.81 |
| 13 | 29.556 | — | 86.22±1.94 | |
| 14 | 30.371 | 芦丁 Rutin | 32.36±0.45 | |
| 15 | 31.638 | — | 118.57±3.73 |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2C18硅胶柱分离荔枝果肉不同酚类成分群的HPLC谱
-->Fig. 2HPLC spectrum of different phenolic compound fractions from litchi pulp by C18 silica gel column
-->
2.3 荔枝果肉各酚类成分群的FRAP抗氧化能力
由图3可知,在试验测定浓度范围内,荔枝果肉4个酚类成分群均具有一定的抗氧化能力。FRAP值越大,抗氧化物质的抗氧化活性越强。随浓度的升高,各样品的抗氧化能力均增强。但是,在同等浓度下,荔枝果肉不同酚类成分群之间的FRAP抗氧化能力有所差异,F2和F3成分群的抗氧化能力显著大于F1和F4(P<0.05)。其中,在低浓度范围内,F2与F3的抗氧化能力差异不大,但当浓度≥0.4 mg·mL-1时,F2的抗氧化能力显著高于F3(P<0.05);随着浓度的逐渐增加,F4的抗氧化能力亦显著高于F1(P<0.05)。因此,整体来看,荔枝果肉4个酚类成分群的FRAP抗氧化能力大小为:F2>F3>F4>F1。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同质量浓度的荔枝果肉各酚类成分群的FRAP抗氧化能力
-->Fig. 3FRAP antioxidant activity of different phenolic compound fractions from litchi pulp in different concentrations
-->
2.4 荔枝果肉各酚类成分群的DPPH自由基清除能力
由表3可知,荔枝果肉各酚类成分群对DPPH自由基均有消除能力,且在一定的浓度范围内呈显著剂量效应关系,当浓度进一步增大时,DPPH自由基清除率达到最大值而趋于平缓。数据显示荔枝果肉各酚类成分群对DPPH自由基最大清除率均约为90%。当质量浓度为30 μg·mL-1时,F2成分群对DPPH·清除率为91.86%,其值在4个成分群中最大,具有良好的DPPH·清除能力;F4对DPPH·清除率为87.95%,接近最大值;而F3和F1的清除率仅分别为72.26%、55.09%。当质量浓度增加到60 μg·mL-1时,F3和F1才逐渐达到最大清除率。此时选择半抑制率浓度IC50可以更客观地反映4个酚类成分群的抗氧化能力大小,IC50值越小,表明样品抗氧化能力越强。经Probit回归分析求得各成分群清除DPPH·的IC50值分别为27.00、9.76、19.41、16.25 μg·mL-1,四者之间具有显著性差异(P<0.05),其中F2的IC50值最小,F1的IC50值最大,后者约为前者的2.77倍。因此,在低于30 μg·mL-1质量浓度下,4个成分群的DPPH·清除率能力大小顺序为F2>F4>F3>F1。Table 3
表3
表3不同质量浓度的荔枝果肉各酚类成分群对DPPH·的清除作用
Table 3Scavenging capacities for DPPH· of different phenolic compound fractions from litchi pulp in different concentrations
| 浓度 Concentration (μg·mL-1) | DPPH清除率 DPPH· scavenging rate (%) | |||
|---|---|---|---|---|
| F1 | F2 | F3 | F4 | |
| 5 | 9.80±0.15 | 25.14±2.82 | 15.44±2.63 | 20.04±0.83 |
| 10 | 23.83±2.71 | 50.51±0.79 | 28.55±0.67 | 32.91±1.65 |
| 20 | 41.74±0.89 | 89.92±1.22 | 48.96±1.13 | 61.11±1.45 |
| 30 | 55.09±1.25 | 91.86±0.58 | 72.26±0.57 | 87.95±1.31 |
| 40 | 69.76±2.30 | 92.25±0.19 | 79.22±0.71 | 90.10±0.68 |
| 50 | 81.61±3.13 | 92.75±0.23 | 85.10±0.66 | 89.47±1.18 |
| 60 | 90.08±0.31 | 92.80±0.95 | 89.69±0.66 | 91.34±0.59 |
| 80 | 89.81±1.94 | 92.78±1.34 | 89.95±2.16 | 92.47±0.59 |
| IC50 | 27.00±0.11d | 9.76±0.29a | 19.41±0.18c | 16.25±0.23b |
新窗口打开
2.5 荔枝果肉各酚类成分群的ORAC抗氧化能力
由图4可知,各酚类成分群表现出的ORAC值差异显著(P<0.05),介于(3.61±0.22)—(8.36±0.45)mmol TE·g-1 DW。其中F2成分群的ORAC值最大,较F3的ORAC值((5.88±0.34)mmol TE·g-1 DW)高约20%,是F4((4.84±0.24)mmol TE·g-1 DW)的1.59倍,是F1 ORAC值的1.95倍。因此,4个成分群中,F2的ORAC抗氧化能力最强,其次是F3和F4,F1的活性最弱。另外,F2对荔枝果肉总多酚的ORAC值(5.04±0.23 mmol TE·g-1 DW)的百分比贡献率高达50.42%;F1的贡献率最小,仅为13.40%;F3和F4的贡献率相近,分别为19.59%和18.61%。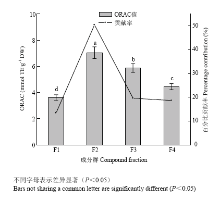 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4荔枝果肉各酚类成分群的ORAC值和百分比贡献率 比较
-->Fig. 4ORAC value and percentage contribution of different phenolic compound fractions from litchi pulp
-->
2.6 荔枝果肉各酚类成分群的细胞抗氧化能力(CAA)
细胞抗氧化能力(CAA)可以从细胞水平上反映抗氧化物质的吸收、代谢和分布情况,是一种能有效预测植物化学物质在生物系统中抗氧化活性的评价方法。该方法与传统的化学分析方法相比更具有生物相关性;与动物试验和临床研究相比更经济、快捷[20]。由图5可知,4个酚类成分群的EC50值介于(30.00±2.74)—(130.96±15.73)μg·mL-1。其中F2成分群的EC50值最小,其次是F3((80.30±4.31)μg·mL-1)和F4((115.60±1.15)μg·mL-1),F1具有最大的EC50值。CAA抗氧化能力结果显示,F1和F4的CAA值相近,差异不显著,分别为(43.90±5.43)μmol QE·g-1 DW和(47.52±0.47)μmol QE·g-1 DW,且两者的CAA值最低;其次是F3,其值为(68.55±3.78)μmol QE·g-1 DW,较F4的CAA值高约44%;F2的CAA值为(190.71±16.57)μmol QE·g-1 DW,显著高于其他3个成分群(P<0.05),是F3 CAA值的2.78倍,是F1、F4的约4倍。比较各成分群的EC50值和CAA值,可以看出两者呈负相关,EC50值越小,则表示CAA值越大,即细胞抗氧化活性越强。因此,荔枝果肉4个酚类成分群的细胞抗氧化活性的大小为F2>F3>F4、F1。此外,荔枝果肉多酚总提取物的EC50和CAA值分别为(64.56±3.87)μg·mL-1和(81.08±4.29)μmol QE·g-1 DW,F2的CAA值对荔枝果肉总多酚的CAA值的贡献率达到84.91%,其余3个成分群的贡献率均约为10%。可见,F2是荔枝果肉多酚细胞抗氧化活性的最主要成分群。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5荔枝果肉各酚类成分群的EC50值和CAA值及其CAA的百分比贡献率
-->Fig. 5EC50 and CAA values and their percentage contribution of different phenolic compound fractions from litchi pulp
-->
3 讨论
3.1 荔枝果肉单体酚组成的分离与鉴定
目前关于荔枝果肉多酚的分离纯化的研究较少。苏东晓等[21]采用大孔树脂吸附法对荔枝果肉多酚进行分离纯化,提高了荔枝果肉多酚的纯度,而该方法大多是用来去除粗提物中多糖和部分蛋白质杂质,却无法对物质组分进行有效分离。张粹兰等[22]采用5种不同极性的溶剂分部萃取荔枝果肉多酚以达到不同酚类物质的分离,但某些物质在不同极性溶剂中都有一定溶解,造成不同萃取级分间物质组分交叉重复。研究表明,硅胶柱层析法可以实现物质高纯度、高效的分离,已广泛用于天然产物的分离纯化。WANG等[23]为了分离得到荔枝果核单体酚,利用硅胶层析柱将荔枝果核多酚提取物进行分离,得到8个成分群。JIANG等[24]亦为鉴定荔枝果皮单体酚组成,利用硅胶层析柱将荔枝果皮多酚提取物进行分离,得到10个成分群。因此,本研究选用C18硅胶柱层析分离技术将荔枝果肉中的不同酚类物质进行分离,采用极性从大到小的流动相梯度洗脱,荔枝果肉各酚类物质依次流出,分段收集,得到4个组成基本无重叠的成分群,避免了简单常用的溶剂分步萃取法造成物质组分交叉重复的现象[25]。研究报道,钟慧臻等[26]通过LC-ESI-MS手段检测到荔枝果肉中可能含有表儿茶素、原花青素B2、原花青素三聚体、原花青素二聚体、槲皮素-芸香糖-鼠李糖苷、芦丁及其同分异构体、异鼠李素-3-O-芸香糖苷等多种单体酚。LÜ等[27]亦采用相同手段从荔枝果肉中检测到13种单体酚,可能为原花青素B2、表儿茶素、A型原花青素三聚体、B型原花青素三聚体、槲皮素-芸香糖-鼠李糖苷、芦丁异构体、山奈酚-芸香糖-鼠李糖苷、异鼠李素-芸香糖-鼠李糖苷、芦丁、B型原花青素二聚体、原花青素A2、山奈酚-芸香糖苷和异鼠李素-芸香糖苷。然而,这些研究均未从荔枝果肉中分离纯化出单体酚组分,也未通过紫外、红外、质谱和核磁等手段进行确证。本研究从荔枝果肉分离纯化出3种单体酚组分,经ESI-MS、1H-NMR、13C-NMR和HMBC谱鉴定为表儿茶素、槲皮素-3-O-芸香糖-7-O-α-L-鼠李糖苷和芦丁,分别存在于成分群F2、F3和F4中,但仍然有一些主要的单体酚未确证其化学结构。基于前人研究结果,推测荔枝果肉可能还含有A型或B型原花青素三聚体、山奈酚-芸香糖-鼠李糖苷、异鼠李素-芸香糖-鼠李糖苷、异鼠李素-芸香糖苷等单体酚。另外,根据各酚类物质保留时间特征分析发现,酚酸类化合物的出峰时间较早,原花青素三聚体的出峰时间仅次于表儿茶素,山奈酚-3-O-芸香糖苷和异鼠李素-3-O-芸香糖苷等黄酮苷出峰时间则更晚[28]。鉴于此,荔枝果肉分离得到的4个酚类成分群中,F1所含物质的出峰时间最早,可能是一些酚酸类化合物;F2中除原花青素B2和表儿茶素外,可能还含有原花青素三聚体;F4中物质的出峰时间最晚,可能是山奈酚-芸香糖-鼠李糖苷、异鼠李素-芸香糖-鼠李糖苷、异鼠李素-芸香糖等黄酮苷类物质。然而,这些化合物的结构特征未通过核磁等手段完全确证,有待进一步探究。另外,F2作为荔枝果肉多酚最主要的活性组分,进一步弄清楚其所含原花青素种类、分子量和聚合度等将能提高其利用价值。
3.2 荔枝果肉抗氧化活性与其酚类物质的关系
FRAP和DPPH是体外评价活性物质抗氧化能力的常见方法,操作简便;ORAC是目前国际上常用的一种评价食品抗氧化能力的方法,较一般的自由基清除法更准确灵敏[29];CAA是一种生物评价方法,较化学抗氧化方法具有一定的优越性。选用这四种抗氧化活性评价方法可全面反映荔枝果肉4个酚类成分群的抗氧化活性差异。在4种抗氧化体系中,F2成分群均呈现良好的抗氧化能力,但相较之下,其CAA抗氧化能力更为显著;而F4的CAA抗氧化能力弱于它在另外3个抗氧化体系中的表现,可能是因为F4所含的芦丁等黄酮苷类物质溶解性差而不易被细胞吸收,无法发挥细胞内抗氧化作用[30]。可见,不同的抗氧化体系可明显地影响酚类等活性物质的抗氧化活性大小。荔枝果肉4个酚类成分群在各评价体系中的抗氧化能力有所差异,综合来看,4个成分群的抗氧化活性大小为F2>F3>F4>F1。从酚类含量来看,各成分群中总酚和总黄酮含量大小也为F2>F3>F4>F1。可见,抗氧化能力与总酚含量正相关,这与SUN等[31]的结论基本一致。从酚类成分来看,F2主要为原花青素类,据报道,该类化合物是一种天然的自由基清除剂和抗氧化剂,因此其抗氧化活性最强。F3是槲皮素-3-O-芸香糖-7-O-α-L-鼠李糖苷单体酚。SU等[12]采用ORAC和CAA的方法研究比较该单体酚与表儿茶素、芦丁及槲皮素的抗氧化活性大小,发现槲皮素-3-O-芸香糖-7-O-α-L-鼠李糖苷的ORAC值最大,CAA活性弱于槲皮素,但明显强于表儿茶素和芦丁,且数据显示其CAA值比被广泛研究报道的咖啡酸、儿茶素和阿魏酸等单体酚的CAA值都高。可见,F3具有良好的抗氧化活性。然而,F3的DPPH·消除能力弱于F4,这可能与两个成分群所含物质种类不同有关。有研究发现在DPPH抗氧化体系中,原花青素二聚体相比没食子酸、表儿茶素、槲皮素等常见酚类物质,因其含有更多的活性羟基而具有更强的自由基消除能力[32]。F4的缩合单宁含量较F3高,可能含有某些原花青素类物质,如原花青素A2、B型原花青素二聚体等,而F3仅含一种黄酮醇单体酚,因此所含成分的不同可能是F4的DPPH自由基消除能力强于F3的原因。这说明物质的抗氧化活性大小既与物质的组成有关,也与抗氧化体系有关[33]。因此,在比较多种活性物质的抗氧化活性大小时,应结合物质的组成特点选择最佳的抗氧化评价方法。
4 结论
本研究采用C18硅胶柱将荔枝果肉多酚提取物分离后得到了4个不同的酚类成分群,分析比较各酚类成分群的总酚、总黄酮和缩合单宁含量及抗氧化活性差异。结果表明,F2成分群的得率最高,总酚、总黄酮和缩合单宁含量最高,其对荔枝果肉总多酚含量的贡献率也最大;在4种抗氧化体系中,F2成分群的抗氧化能力均显著高于其他3个成分群,尤其是其CAA抗氧化能力,对荔枝果肉总多酚的CAA贡献率高达84.91%,而ORAC值的贡献率也达到50.42%,均高于其他3个成分群对荔枝果肉抗氧化能力的贡献率之和。因此,F2所含的成分如原花青素B2、表儿茶素、原花青素三聚体等可能是荔枝果肉抗氧化活性的最主要酚类物质。(责任编辑 赵伶俐)
The authors have declared that no competing interests exist.
