0 引言
【研究意义】库尔勒香梨(Pyrus sinkiangensis Yu)属于新疆梨系统句句梨类型中选育的芽变品种[1],在新疆巴音郭楞蒙古自治州和阿克苏地区集中栽培约6.9×104 hm2,正常年份总产量约7.0×105 t。新疆梨有3个主要品种类型——句句梨、乃西普特和阿木特,以香梨等句句梨类型品种与白梨(Pyrus bretschneideri Rehd.)的亲缘关系较近[2-3],香梨属于果糖与葡萄糖含量高、糖酸比高的类型[4-5],生理成熟时果皮依然呈绿色,跃变后熟转为黄色[6],兼具西洋梨(Pyrus communis Linn.)的部分品质特征。成熟果实表皮绿色、肉质细脆、甜度高,是库尔勒香梨区别于其他品种的典型品质特征。目前,糖分低、含酸量高[7]的青顶果、粗皮果类等外果比例增加和“抢青”采收,导致商品率下降和商品果采后耐贮性下降,是困扰库尔勒香梨产业增值的原因之一。研究香梨果实发育成熟过程中基本的糖积累动态和糖代谢机理,对确定库尔勒香梨商品果的适贮采收时间和品质评价标准,确定等外果品质劣变与调控的途径,研究相关应用技术具有重要意义。【前人研究进展】糖分作为果实基本的品质构成物质,在糖代谢调控淀粉、蔗糖、己糖、糖醇等物质转化与合成的机制,以及糖代谢关键酶的动力学特性、基因克隆与功能鉴定方面,已有较为广泛和深入的研究[8-20]。近年来已在作物与果实上发现,糖酵解、三羧酸循环、电子传递链调控淀粉、可溶性糖、有机酸、氨基酸等重要的初生代谢以及黄酮与色素等物质的次生代谢,对不同发育时期的代谢产物在不同细胞分区积累的时序和水平具有重要的作用[21-23]。【本研究切入点】库尔勒香梨果实的成熟品质以糖分构成为主,但果实的结构存在明显的分化,有关果实不同部位品质分化的时期、代谢互作调控的差异、等外果的果皮与果肉组织发育异常及品质劣质化等机理的研究未见报道。【拟解决的关键问题】本研究通过分析库尔勒香梨果实发育成熟过程糖代谢与呼吸代谢的响应协调关系,以明确不同糖组分变化与积累的时序和果实的部位间差异;了解运转糖和贮备糖动态平衡的生理意义;探索不同途径的呼吸代谢对不同糖组分转化、合成利用的作用,糖分品质不同部位异质化的大致代谢机理及调控关键位点,为库尔勒香梨果实品质调控和等外果发育品质的改善提供理论依据。1 材料与方法
试验于2013—2015年在新疆农业科学院农产品贮藏加工研究所进行。1.1 试验材料
果实取样地点为新疆巴音郭楞蒙古自治州轮台县国家果树资源圃的3.5 hm2香梨果园(84.22°67′ E、41.78°36′ N)。香梨树龄15年,株行距4 m×6 m,园内无任何间作,树形均为三主枝中干型,授粉树为鸭梨,无人工疏花疏果;果园土质为壤土,壤土层深度约100—120 cm;120 cm以下土层为黏土和砂石层。梨树生长季内共沟灌浇水6次,包括3月中,4月底,5月、6月、7月及8月的中旬各浇水1次。6月中旬追肥一次,沟施氮肥约0.80 kg/株、磷钾肥(磷酸二铵﹕硫酸钾=2.5﹕1)约1.6 kg/株;10月底前施入羊粪厩肥约50 kg/株。于2013年6月15日至9月25日(花后60—150 d),在园内选取树势与负载量(年均单产30 kg/棵)相对一致、集中在同一小区的香梨树35株,每10 d摘取样果一次,共取样10次。每次清晨采收样果,采收时选择着生于树冠中部的外层结果枝果实。选留无损伤、无虫斑、带有完好果柄的果实约15 kg,苯板箱加冰袋包装后公路运输。12 h内运至实验室,当天完成鲜样检测分析;剩余样品切分后液氮速冻,-80℃保存备用。1.2 试验方法
1.2.1 试验设计 将各次取样果实剖分出果皮、果肉和果心3个部位材料,通过糖组分(蔗糖、山梨醇、葡萄糖、淀粉)、不同途径(EMP糖酵解、PPP磷酸戊糖途径、TCAC三羧酸循环、CP细胞色素途径、AP交替途径)呼吸速率的测定,确定果实发育成熟过程中3个部位糖分构成特征和呼吸途径的强弱差异。选择香梨果实单糖和多糖代谢的路径节点关键酶,包括蔗糖代谢(SPS蔗糖磷酸合酶、SuSy蔗糖合酶的合成方向与分解方向、AI酸性转化酶、NI中性转化酶)、山梨醇代谢(NAD-SDH、NADP-SDH山梨醇脱氢酶、SO山梨醇氧化酶)、淀粉代谢(AGPase腺苷二磷酸葡萄糖焦磷酸化酶、UGPase尿苷二磷酸葡萄糖焦磷酸化酶、α-淀粉酶、β-淀粉酶)共12种代谢酶,测定发育成熟过程中酶活性;选择呼吸与电子传递链的代谢路径节点关键酶,包括糖酵解(GPI磷酸己糖异构酶、PK丙酮酸激酶)、磷酸戊糖途径(G-6-PDH葡萄糖-6-磷酸脱氢酶和6-PGDH 6-磷酸葡萄糖酸脱氢酶的联酶)、三羧酸循环(Sdh琥珀酸脱氢酶、PDC丙酮酸脱氢酶、NAD-MDH苹果酸脱氢酶、NADP-ME苹果酸酶)、细胞色素电子传递链(COX细胞色素氧化酶)、交替电子传递链(AOX交替氧化酶)共9种代谢酶,测定发育成熟过程中酶活性。通过分阶聚类分析,探明果实发育成熟过程中糖代谢与呼吸代谢21种酶活性峰值出现时间与代谢节点的二向聚类关系;结合代谢酶活性与糖组分含量的主成分分析结果,确定果实发育成熟过程不同部位糖和呼吸的代谢响应特征。1.2.2 测定方法 单果、果皮、果肉、心室的质量及比例,单果与心室的纵横经,每次测定约40个果实。香梨果肉、心室和果皮的蔗糖、葡萄糖、果糖、山梨醇、淀粉的含量的液相色谱测定方法和甜度计算方法,参考姚改芳[4]的方法,重复3次。参考史青纯[24]的方法,使用氧电极测定和计算样果果肉、心室和果皮的总呼吸和不同途径的呼吸速率,每次测定重复5次。糖代谢12种酶的活性测定重复3次,提取和测定方法包括:SPS、SuSy、AI、NI、SO、SDH酶提取方法参考许让伟[18]和赵智中[25]的方法,略作修改;AI活性测定参考魏建梅[20]的方法,略作修改;NI、SuSy-s(合成方向)和SuSy-c(分解方向)酶活性测定参考许让伟[18]和HAYATA[26]的方法,略作修改;SO、NAD-SDH、NADP-SDH活性测定参考YAMAGUCHI[27]的方法;AGPase和UGPase酶提取与活性测定使用试剂盒(上海江莱生物科技公司);淀粉酶液提取、活性测定及计算(总酶、α-淀粉酶、β-淀粉酶)参考张迟[28]的方法 。呼吸代谢9种酶活性测定重复3次,提取和测定方法包括:GPI、PK、G-6-PDH和6-PGDH联酶、Sdh、PDC、COX和AOX酶液提取参考史青纯[24]与何亚辉[29]的方法,略作修改;GPI活性测定参考BROWN[30]和韩蓓[31]的方法修改;PK活性测定使用试剂盒(南京建成生物科技公司,A076-1型);G-6-PDH和6-PGDH联酶活性测定参考BROWN[30]的方法;Sdh活性测定参考史青纯[24]的方法,略作修改;PDC活性测定参考何亚辉[29]的方法(DCPIP法),略作修改;NAD-MDH和NADP-ME活性测定参考HIRAI[32]和WEDDING[33]的方法,略作修改;COX活性测定参考史青纯[24]、田美华[34]和陈京京等[35]的方法,略作修改;AOX活性测定参考VANLERBERGHE[36-37]、胡文海[38]和JARMUSZKIEWICZA[39]的方法调整,以氧电极法测得耗氧速率表示AOX活性。糖组分与淀粉含量、糖代谢酶活性和呼吸代谢酶活性每批次测定使用的样果量不同,其中花后60—70 d样果的测定用量为400—600个果;花后80—90 d样果的测定用量为160—260个果;花后100—150 d样果的测定用量为80—100个果。果肉材料选用果实赤道线部位约2.0 cm3的去皮组织;心室材料选用去除种子、心室隔膜内的组织;果皮材料剔除红晕着色部位。
1.2.3 试验仪器 质量测定使用电子天平(赛多利斯,ALC-2100型),单果与心室的纵横经测定使用游标卡尺测量(杭州力创,150D型)。果皮剥取使用削皮机(RS,NC-3447型),去皮厚度0.5—1.0 mm。液相色谱条件包括高效液相色谱仪(安捷伦,1260型),钙离子交换柱(安捷伦 Hi-Plex Ca 8.0 μm,7.7 mm×300 mm);超声波脱气和0.45 μm膜过滤的纯水(18 MΩ·cm)为流动相,流速0.60 mL·min-1,20 μL进样量,80℃柱温,示差检测器(G1362A RID)设置0.05 AUFS灵敏度。呼吸速率测定使用Clark 液相氧电极仪(Hansatech,Oxygtherm型)。酶提取和活性测定过程,材料液氮研磨(IKA,T18型)再冰浴匀浆(IKA,T10型主机、10 G型刀头);梯度离心使用低温高速离心机(Eppendorf,Centrifuge2510R型)和(Hettich Mikko22R型);分光光度计使用岛津UV2600型。超低温冰箱(海尔,DW-86L490型)-80℃保存样品。
1.3 数据统计
使用Sigma Plot 13.0软件制图,回归方程的拟合使用分类回归方法。分阶聚类前,使用SPSS 20.0软件的描述性检验工具Z-Score对21种酶活性的测定数值处理为标准化数值,再转换为TDMS格式文件,导入MeV Version 4.9.0软件(软件来源www.tm4.org);以分阶聚类(Hierarchical Clustering)方法制作HCL Tree热图,自动建立分阶聚类树,分析糖代谢和呼吸代谢的关联时间和关联节点。使用SPSS 20.0软件的降维分析方法(最优尺度)工具进行主成分分析(PCA),选择香梨果心、果肉和果皮的质量为标示变量,21种酶活性为分析变量,5种糖组分为补充变量;对标示变量、分析变量和补充变量回归后获得载荷图和双标图;根据载荷系数分析香梨果实发育成熟过程不同部位的质量、糖分构成和代谢酶的关系。以上述HCL和PCA计算结果为依据划分果实不同部位的发育成熟阶段,依据KEGG(Kyoto Encyclopedia of Genes and Genomes,http:// www.genome.jp/kegg/)公布的碳水化合物代谢路径(Central carbohydrate metabolism:EC00500,M00001,M00009,M00010,M00011),结合YAMAKI等[9]对果实山梨醇和蔗糖运转与代谢的研究总结,补充山梨醇代谢节点;参考BIAIS等[40]的代谢分析和构图方法,构建果实发育成熟过程糖代谢和呼吸代谢的关联路径;以HCL聚类分组的结果,讨论果实不同部位代谢酶之间的时序关联。2 结果
2.1 成熟过程中质量和果径的变化
花后60—150 d库尔勒香梨的单果质量、果肉质量、果皮质量和果心质量增加4.26—5.67倍(图1-A、B)。果肉质量、果皮质量和心室质量约占单果质量70.85%—81.74%、12.25%—16.12%和6.91%—11.37%(图1-C)。花后60—110 d是果肉、心室和果皮的速生期,质量增长速率分别为13.32、1.26和2.19 g/(10 d)。发育至成熟,果实的纵径和横径分别增加70.72%和85.68%,心室纵径和横径分别增加46.11%和78.52%(图1-D、E)。花后60—90 d心室的纵径和横径增长最快,平均每10 d增长1.25—2.05 mm;花后60—110 d果实的纵径和横径增长最快,平均每10 d增长4.18—4.91 mm。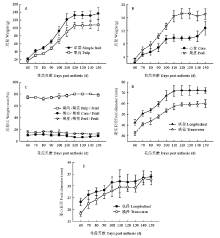 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1库尔勒香梨果实发育与成熟过程不同部位质量和果径变化A:单果和果肉质量;B;心室与果皮质量;C:果肉、果皮、心室占单果质量的比例;D:单果纵横经;E:心室纵横经
-->Fig. 1Different parts weights and diameters of Korla pear throughout the fruit development and ripeningA: Weight of single fruit and pulp. B: Weight of core and peel. C: Weight ratios of pulp, core and peel account for single fruit. D: Longitudinal and transverse diameters of single fruit. E: Longitudinal and transverse diameters of core
-->
2.2 成熟过程中不同部位糖分含量和比例变化
2.2.1 果心糖分含量和比例变化 图2-A和图3-A显示,库尔勒香梨果实发育成熟过程,果心的果糖、葡萄糖、山梨醇含量持续积累升高,其中山梨醇含量在花后90 d达到峰值21.15 mg·g-1 FW;果糖与葡萄糖含量于花后120—130 d达到峰值,分别为64.78 mg·g-1 FW和33.63 mg·g-1 FW。蔗糖含量相对最低,为2.60—6.03 mg·g-1 FW,发育成熟过程中未见明显变化。淀粉含量为10.32—11.85 mg·g-1 FW,未见明显变化。果糖和葡萄糖是果心的主要糖组分,至果实成熟分别占果心4种可溶性糖分的42.63%—54.67%和22.31%— 30.85%。山梨醇占果心可溶性糖分的比例由28.05%线性降至10.22%。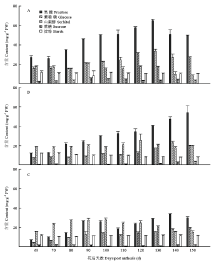 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2库尔勒香梨果实发育成熟过程果心、果肉和果皮糖分含量的变化A:果心糖分含量;B:果肉糖分含量;C:果皮糖分含量
-->Fig. 2Sugar contents of core, pulp and peel in Korla pear throughout the fruit development and ripeningA: Sugar contents of core; B: Sugar contents of pulp; C: Sugar contents of peel
-->
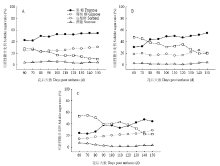 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3库尔勒香梨果实发育成熟过程果心、果肉和果皮可溶性糖分比例的变化A:果心可溶性糖分比例;B:果肉可溶性糖分比例;C:果皮可溶性糖分比例
-->Fig. 3Soluble sugar ratios of core, pulp and peel in Korla pear throughout the fruit development and ripeningA: Soluble sugar ratios of core; B: Soluble sugar ratios of pulp; C: Soluble sugar ratios of peel
-->
2.2.2 果肉糖分含量和比例变化 图2-B和图3-B显示,库尔勒香梨花后80—150 d,果肉的可溶性糖分以果糖含量相对最高,果实成熟时最高,达54.24 mg·g-1 FW。山梨醇和葡萄糖的含量分别在花后120 d、140 d升至峰值25.81、23.25 mg·g-1 FW,蔗糖在花后150 d含量最高,约4.28 mg·g-1 FW。淀粉含量在花后120—150 d快速降至8.36—8.77 mg·g-1 FW。香梨花后80 d之后,果糖占果肉可溶性糖分的比例逐渐增至54.88%,相对最高;而山梨醇的比例呈线性下降,最低至27.75%;葡萄糖和蔗糖的比例未见明显变化。
2.2.3 果皮糖分含量和比例变化 图2-C和图3-C显示,库尔勒香梨花后120 d以前,果皮的可溶性糖分以山梨醇含量相对最高,花后100 d达到峰值27.85 mg·g-1 FW;花后120 d后,以果糖含量相对最高,花后140 d达到峰值33.79 mg·g-1 FW。果皮的葡萄糖含量至花后150 d增至最高,约19.65 mg·g-1 FW。果实发育至成熟,果皮的淀粉含量约10.59—12.09 mg·g-1 FW,蔗糖含量约1.03—2.79 mg·g-1 FW,均未出现明显变化。花后120 d之前,山梨醇占果皮4种可溶性糖分的比例相对最大,约38.57%—55.07%。此后山梨醇比例持续下降,果糖比例增至36.99%—47.81%,果皮可溶性糖分以果糖为主。
2.2.4 质量与糖组分含量及甜度的关系 表1显示,花后60—150 d,果肉、果心和果皮的质量增长量均与果糖和葡萄糖的积累以及甜度的增加存在极显著的正相关(Sig<0.01),香梨果实发育是各个部位质量与果糖、葡萄糖和甜度同步提高的过程。果肉与果心的质量均与淀粉含量的变化显著负相关(Sig<0.01),说明两个部位的质量增长伴有明显的淀粉降解。
Table 1
表1
表1库尔勒香梨果实发育成熟过程不同部位质量与糖分及甜度的相关性
Table 1Correlations between weight, sugar contents and sweetness of core, pulp and peel in Korla pear throughout the fruit development and ripening
| 质量 Weight | 果糖含量 Frouctose content | 葡萄糖含量 Glucose content | 山梨醇含量 Sorbitol content | 蔗糖含量 Sucrose content | 淀粉含量 Starch content | 甜度 Sweetness |
|---|---|---|---|---|---|---|
| 果肉 Pulp | 0.912** | 0.820** | 0.315 | 0.521* | -0.888** | 0.899** |
| 0.000 | 0.000 | 0.090 | 0.003 | 0.000 | 0.000 | |
| 果心 Core | 0.749** | 0.770** | -0.625** | 0.397* | -0.393* | 0.734** |
| 0.000 | 0.000 | 0.000 | 0.030 | 0.032 | 0.000 | |
| 果皮 Peel | 0.848** | 0.896** | -0.173 | -0.381* | 0.456* | 0.846** |
| 0.000 | 0.000 | 0.361 | 0.038 | 0.011 | 0.000 |
新窗口打开
2.3 成熟过程中不同部位的不同途径呼吸速率变化
2.3.1 果心不同途径呼吸速率变化 库尔勒香梨花后80 d之前,果心总呼吸速率持续降低约53.06%(图4-A);花后80 d之后总呼吸速率回升,在花后100 d达到峰值131.43 nmol(O2)·mg-1·min-1。果心EMP呼吸速率与总呼吸速率变化趋于平行,在花后100 d同步回升,达到峰值76.38 nmol(O2)·mg-1·min-1。果心的PPP、TCAC、CP和AP呼吸速率从花后60 d均持续减弱,均未出现呼吸峰;CP和AP呼吸速率在花后140—150 d回升,与果心总呼吸在果实成熟末期变化相近。果实发育成熟过程,果心总呼吸与各途径呼吸速率的分类回归结果显示(表2),EMP途径呼吸对总呼吸的贡献最大,是果心的呼吸主途径(Beta=1.270,Sig=0.00)。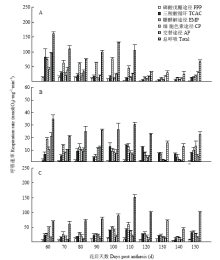 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4库尔勒香梨果实发育成熟过程果心、果肉、果皮不同途径呼吸速率的差异A:果心主路径与电子传递链的呼吸速率;B:果肉主路径与电子传递链的呼吸速率;C:果皮主路径与电子传递链的呼吸速率
-->Fig. 4Difference of respiration rate from different respiratory pathways between core, pulp and peel in Korla pear throughout the fruit development and ripeningA: Respiration rates of main pathways and electron transport chains of core; B: Respiration rates of main pathways and electron transport chains of pulp; C: Respiration rates of main pathways and electron transport chains of peel
-->
Table 2
表2
表2库尔勒香梨果实发育成熟过程不同部位总呼吸与EMP、TCAC、PPP、AP、CP途径呼吸速率分类回归结果
Table 2Category regressions between total respiration rate and respiration rates corresponding to EMP, TCAC, PPP, AP, CP of core, pulp and peel of Korla pear
| 呼吸途径 Respiratory pathways | 果心总呼吸 Total respiration of core | 果肉总呼吸 Total respiration of pulp | 果皮总呼吸 Total respiration of peel | |||
|---|---|---|---|---|---|---|
| 标准系数Coefficient | Sig. | 标准系数Coefficient | Sig. | 标准系数Coefficient | Sig. | |
| 磷酸戊糖途径 PPP | -0.374 | 0.026 | -0.123 | 0.168 | -0.331 | 0.050 |
| 三羧酸循环 TCAC | -0.146 | 0.364 | 0.337 | 0.002 | 0.557 | 0.000 |
| 糖酵解 EMP | 1.270 | 0.000 | 0.790 | 0.000 | 0.741 | 0.000 |
| 细胞色素途径 CP | 0.080 | 0.433 | 0.132 | 0.052 | -0.204 | 0.180 |
| 交替途径 AP | 0.221 | 0.207 | -0.027 | 0.881 | 0.020 | 0.892 |
| 模型优度 R2 | 0.904 | 0.834 | 0.954 | |||
新窗口打开
2.3.2 果肉不同途径呼吸速率变化 香梨果肉的总呼吸与EMP呼吸速率均在花后90 d快速回升(图4-B),与TCAC同在花后110 d出现呼吸峰;总呼吸、EMP和TCAC的呼吸速率峰值分别为30.36、12.83、14.15 nmol(O2)·mg-1·min-1。PPP呼吸速率相对最低、未见明显变化。CP和AP呼吸速率平缓下降,至花后140 d回升。果肉的总呼吸与各途径呼吸速率分类回归结果显示(表2),果肉的EMP途径(Beta=0.790,Sig=0.000)和TCAC途径(Beta=0.337,Sig=0.002)呼吸均对总呼吸具有显著的贡献,果实发育过程两个途径轮换构成果肉呼吸的主途径;轮动切换时间大致为花后90 d左右,TCAC呼吸强度略高于EMP。
2.3.3 果皮不同途径呼吸速率变化 果皮的总呼吸速率与EMP、TCAC、CP、PPP变化趋于平行(图4-C),均在香梨花后110 d同步出现呼吸峰,峰值分别为151.01、59.48、42.76、38.81、14.30 nmol(O2)·mg-1·min-1。果皮AP呼吸速率相对较低,未见明显变化。果皮的总呼吸与各途径呼吸速率分类回归结果显示(表2),EMP途径(Beta=0.741,Sig=0.000)和TCAC途径(Beta=0.557,Sig=0.000)呼吸同时对总呼吸具有显著的贡献,为果实发育成熟过程果皮呼吸的主途径。
2.4 成熟过程中不同部位的糖代谢酶活性变化
2.4.1 蔗糖代谢酶活性变化 香梨果实发育成熟过程,果心与果肉AI活性变化趋于平行,花后60—100 d活性下降较为明显。花后100—150 d果皮AI活性逐渐增强。果实AI活性以果心相对最高,约72.44— 143.70 μmol·g-1·min-1,比果肉和果皮AI活性平均高约1.71倍和6.90倍(图5-A)。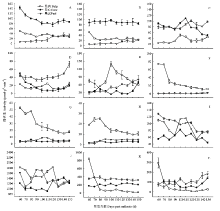 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5库尔勒香梨果实发育成熟过程果心、果肉、果皮的糖代谢酶活性变化A:蔗糖酸性转化酶活性;B:蔗糖中性转化酶活性;C:蔗糖磷酸合酶活性;D:蔗糖合酶(合成方向)活性;E:蔗糖合酶(分解方向)活性;F:山梨醇氧化酶活性;G:NAD-山梨醇脱氢酶活性;H:NADP-山梨醇脱氢酶活性;I:腺苷二磷酸葡萄糖焦磷酸化酶活性;J:尿苷二磷酸葡萄糖焦磷酸化酶;K:α-淀粉酶活性;L:β-淀粉酶活性
-->Fig. 5Enzyme activities of sugar metabolism of core, pulp and peel in Korla pear throughout the fruit development and ripeningA: Acid invertase activity; B: Neutral invertase activity; C: SPS activity; D: SuSy-c activity; E: SuSy-s activity; F: SOX activity; G: NAD-SDH activity; H: NADP-SDH activity; I: AGPase activity; J: UGPase activity; K: α-Am activity; L: β-Am activity
-->
香梨果实NI活性以果心相对最高、约84.98—97.16 μmol·g-1·min-1,比果肉和果皮平均偏高约2.25和6.74倍(图5-B),但未见果心NI活性出现明显变化。花后60—80 d果肉NI活性明显减弱,此后再无明显变化;果皮NI活性仅在花后110—150 d略有升高。香梨发育成熟过程果心、果肉和果皮的NI活性变化均不明显。
花后100—120 d果肉、果心和果皮SPS活性先后出现峰值51.28、109.70、101.70 μmol·g-1·min-1(图5-C);果实趋于成熟,果心SPS活性呈线性下降。香梨果实SPS活性以果肉相对最低,比果肉和果皮平均低约54.20%—59.17%。
花后120 d之前,果心SuSy-c活性呈指数下降;花后120 d之后,果皮SuSy-c活性呈指数升高;果肉SuSy-c活性在花后110 d出现峰值,约24.61 μmol·g-1·min-1(图5-D)。香梨果实SuSy-c活性以果皮相对最高,比果心和果肉平均高约1.51倍和1.62倍。
果肉SuSy-s活性在花后100 d升至峰值140.09 μmol·g-1·min-1(图5-E);此后至果实成熟活性呈线性下降。果心SuSy-s仅在花后150 d活性升高,此前并无明显变化。果皮SuSy-s活性在花后80—110 d活性偏低,约33.91—51.40 μmol·g-1·min-1。香梨果实SuSy-s活性以果肉相对最高,比果心和果皮平均高26.06%— 108.82%。
2.4.2 山梨醇代谢酶活性变化 果实各个部位的SO、NAD-SDH、NADP-SDH活性均以果肉相对最高,平均约29.57、29.20、15.75 μmol·g-1·min-1,比果心和果皮的SO活性平均高26.11倍和20.70倍;比果心和果皮的NAD-SDH活性平均高6.30和4.99倍;比果心和果皮的NADP-SDH活性平均高5.37和3.04倍。果实发育成熟过程,果肉的山梨醇代谢3种酶活性均呈指数下降、变化幅度相对最大(图5-F、G、H)。果心和果皮的SO、NAD-SDH、NADP-SDH活性较弱、未见明显变化。
2.4.3 淀粉代谢酶活性变化 果实发育成熟过程中,果皮AGPase活性由128.03 μmol·g-1·min-1线性降至74.66 μmol·g-1·min-1(图5-I);果心和果肉AGPase活性在花后100—110 d出现峰值81.95 μmol·g-1·min-1和116.02 μmol·g-1·min-1,但果实AGPase活性均值以果心相对最低。
果皮、果肉和果心UGPase分别在花后90 d、120 d、140 d出现活性峰值,约1 730.93、1 828.68、1 426.27 μmol·g-1·min-1(图5-J);果实UGPase活性以果心相对最低,比果肉和果皮平均低16.25%—23.59%。
果肉的α-淀粉酶和β-淀粉酶的活性呈指数降低,约827.64 μmol·g-1·min-1和267.62 μmol·g-1·min-1,变化幅度相对最大(图5-K、L)。果心和果皮α-淀粉酶活性的均值相对较高,分别为204.83 μmol·g-1·min-1和345.42 μmol·g-1·min-1,但发育成熟过程未见明显变化。花后130—150 d果皮和果心β-淀粉酶活性平行升至最高;花后90 d之后,果实β-淀粉酶活性始终以果皮相对最高。
2.5 成熟过程中呼吸代谢酶活性变化
2.5.1 磷酸戊糖途径代谢酶活性变化 果皮G-6-PDH与6-PGDH联酶的活性从花后70 d由峰值295.90 μmol·g-1·min-1呈线性降低,下降幅度约89.65%(图6-A)。果心的联酶活性在花后100 d升至峰值166.80 μmol·g-1·min-1,果肉的联酶活性平缓升高,在成熟末期达到最高,约113.58 μmol·g-1·min-1。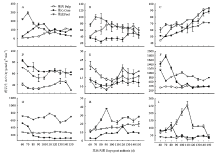 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6库尔勒香梨果实发育成熟过程果心、果肉和果皮呼吸代谢的酶活性变化A:葡萄糖-6-磷酸脱氢酶与6-磷酸葡萄糖脱氢酶联酶;B:丙酮酸激酶;C:磷酸己糖异构酶;D:丙酮酸脱氢酶;E:琥珀酸脱氢酶;F:NAD-苹果酸脱氢酶;G:NADP-苹果酸酶;H:细胞色素氧化酶;I:交替氧化酶
-->Fig. 6Enzyme activities of respiratory metabolism of core, pulp and peel in Korla pear throughout the fruit development and ripeningA: Glucose-6-phosphate dehydrogenase and 6-phosphogluconic dehydrogenase (G-6-PDH+6-PGDH); B: Pyruvate kinase (PK); C: Glucose phosphate isomerase (GPI); D: Pyruvate dehydrogenase complex (PDC); E: Succinate dehydrogenase (Sdh); F: NAD-dependent malate dehydrogenase (NAD-MDH); G: NADP-dependent malic enzyme (NADP-ME); H: Cytochrome oxidase (COX); I: Alternative oxidase (AOX)
-->
2.5.2 糖酵解代谢酶活性变化 果皮PK活性从花后70 d由峰值99.90 μmol·g-1·min-1呈线性降低,下降幅度约56.84%(图6-B)。果肉PK在花后100 d活性升至峰值79.41 μmol·g-1·min-1;果心PK活性仅从花后120 d之后略有上升,此前未见明显变化。果实发育成熟过程以果心PK活性相对最低,比果肉和果皮平均低41.37%—45.29%。
果肉和果心GPI活性均呈线性升高,至花后150 d升至最高,分别约88.36 μmol·g-1·min-1和93.53 μmol·g-1·min-1(图6-C)。果皮GPI活性为60.36—71.61 μmol·g-1·min-1,未见明显变化;香梨花后110—150 d果实GPI活性以果肉相对最高,果皮最低。
2.5.3 三羧酸循环代谢酶活性变化 果心PDC活性从花后60 d约82.94 μmol·g-1·min-1呈指数平缓下降(图6-D),果皮和果肉PDC活性均在花后130 d达到峰值、约65.59 μmol·g-1·min-1和46.85 μmol·g-1·min-1。发育成熟过程果实PDC活性以果肉相对最低、比果心和果肉平均偏低61.02%—78.53%。
果皮和果肉Sdh活性分别在花后90 d、100 d降至最低,均在花后120 d回升至峰值,分别为15.90 μmol·g-1·min-1和20.54 μmol g-1 min-1(图6-E)。果心Sdh活性约10.90—14.02 μmol·g-1·min-1,未见明显变化。发育成熟过程果实Sdh活性以果肉相对最高,比果皮和果心平均高40.18%—42.36%。
果心NAD-MDH活性从花后70 d由峰值1 770.42 μmol·g-1·min-1呈指数快速衰减(图6-F),果皮NAD-MDH活性在花后100 d出现峰值1 027.50 μmol·g-1·min-1,果肉NAD-MDH活性均值约366.87 μmol·g-1·min-1,未见明显变化。发育成熟过程果实NAD-MDH活性以果肉相对最低,比果心和果皮平均低50.46%和56.51%。果皮NADP-ME活性在花后110 d升至峰值786.67 μmol·g-1·min-1(图6-G),果心NADP-ME活性从花后60 d呈指数下降至115.83 μmol·g-1·min-1。果肉NADP-ME活性为249.44—281.11 μmol·g-1·min-1,未见明显变化。发育成熟过程果实NADP-ME活性以果皮相对最高,比果肉和果心活性平均高约1.18倍和5.14倍。
2.5.4 电子传递链代谢酶活性变化 果皮COX活性在花后90 d升至峰值37.95 μmol·g-1·min-1(图6-H),果肉COX活性呈线性升高,最高至19.88 μmol·g-1·min-1,果心COX活性为2.58—10.33 μmol·g-1·min-1,仅在花后120 d略有升高。发育成熟过程果实COX活性以果皮相对最高,比果肉和果心平均高约50.16%和2.27倍。
果肉AOX活性在花后110 d升至峰值255.10 nmol·(O2)mg-1·min-1,果心AOX活性在花后80 d出现峰值119.88 nmol·(O2)mg-1·min-1,果皮AOX活性为22.43—51.02 nmol·(O2)mg-1·min-1,未见明显变化(图6-I)。发育成熟过程中果实AOX活性以果肉相对最高,比果心和果皮平均高约1.14倍和2.27倍。
2.6 成熟过程中糖代谢和呼吸代谢的响应关系
2.6.1 果心糖代谢和呼吸代谢的响应关系 分阶聚类分析结果显示,果心发育成熟过程被分为2个阶段。第一个阶段为花后60—80 d,可归为果心发育初期,以果心TCAC与山梨醇、蔗糖的代谢的增强和响应关联为主(图7-A,绿色条码),聚类酶包括:TCAC反应的启动节点PDC、苹果酸代谢NADP-ME与NAD-MDH、TCAC与电子传递的联结位点Sdh、交替呼吸电子传递AOX;将蔗糖和蔗糖-6磷酸分解为果糖、葡萄糖、6磷酸-葡萄糖、ADP-葡萄糖的AI和SuSy-c,均在该阶段出现活性峰值。第二个阶段为花后90—150 d。其中,花后90—110 d的聚类分支属于果心质量增加最快的时期,可归为果心速生期,基本以糖代谢为主。聚类代谢酶包括:调控蔗糖-6磷酸合成与分解的SPS和NI,以及催化蔗糖/淀粉代谢、合成ADP-葡萄糖及高水平磷酸的AGPase均出现活性峰值、被聚为一个分支(图7-A,黄绿色条码);氧化山梨醇为葡萄糖的SO、水解淀粉转化为单糖的β-amylase,与G-6-PDH/6-PGDH联酶的聚类分支(图7-A,黄色条码),与花后120—150 d的聚类分组关联。花后120—150 d的聚类分支可归为果心的成熟阶段,以EMP、淀粉、山梨醇的代谢响应为主,聚类代谢酶包括:转化山梨醇、促进果糖和葡萄糖积累的SDH;催化淀粉水解为单糖的α-amylase、催化磷酸-葡萄糖转化为蔗糖合成底物的UGPase,可逆转化葡萄糖-6磷酸和果糖-6磷酸的GPI,提供TCAC反应底物丙酮酸,同时转化ADP为ATP的PK,以及参与ATP合成的细胞色素电子传递链COX,均在该阶段活性增强、出现峰值(图7-A,红色条码)。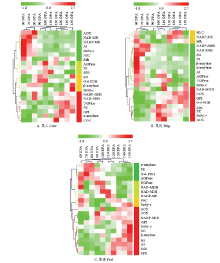 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7库尔勒香梨果实发育成熟过程糖与呼吸代谢酶的分阶聚类A:果心糖和呼吸代谢21种酶的分阶聚类热图;B:果肉糖和呼吸代谢21种酶的分阶聚类热图;C:果皮糖和呼吸代谢21种酶的分阶聚类热图图中代谢酶聚类分组的绿色、黄色、红色条码,表示各个聚类分组所处果实发育成熟的不同时段AGPase:腺苷二磷酸葡萄糖焦磷酸化酶;AOX:交替氧化酶;COX:细胞色素氧化酶;G-6-PDH:葡萄糖-6-磷酸脱氢酶与6-PGDH(6-磷酸葡萄糖酸脱氢酶)联酶;GPI:磷酸己糖异构酶;AI:酸性转化酶;NI:中性转化酶;NAD-MDH:苹果酸脱氢酶;NADP-ME:NADP型苹果酸酶;SDH:山梨醇脱氢酶(NAD型和NADP型);PDC:丙酮酸脱氢酶;PK:丙酮酸激酶;Sdh:琥珀酸脱氢酶;SO:山梨醇氧化酶;SPS:蔗糖磷酸合酶;SuSy:蔗糖合酶(SuSy-c:分解方向,SuSy-s:合成方向);UGPase:尿苷二磷酸葡萄糖焦磷酸化酶;α-amylase:α-淀粉酶;β-amylase:β-淀粉酶。下同 The same as below
-->Fig. 7Hierarchical clustering analysis of 21 enzyme activities profiles of sugar metabolism and respiratory metabolism of Korla pear throughout the fruit development and ripeningA: Hierarchical clustering profile performed on 21 enzyme activities of core; B: Hierarchical clustering profile performed on 21 enzyme activities of pulp; C: Hierarchical clustering profile performed on 21 enzyme activities of peelGreen, yellow and red codes of different enzymes clusters correspond to the grouping at different stages throughout development and ripening
-->
根据果心糖分含量和代谢酶活性的主成分分析结果,发育成熟过程果心糖代谢与呼吸代谢的动态关联被分成2个维度,对分析变量和补充变量的方差解释为51.10%(图8-A-1)。随着果心质量增加、组织发育成熟,果心糖分的主成分转变顺序为:淀粉→蔗糖→山梨醇→葡萄糖→果糖;主成分的载荷维度(0.0—1.0)与果心质量7.0—12.0 g(质量标示变量系数-2.0—2.0)的维度基本对称(图8-A-2)。代谢酶中以GPI、SO、NADP-SDH、UGPase的载荷系数相对较高(0.817、0.714、0.681、0.672),并与蔗糖含量变化的关联度较高;而果心含量最高的糖分——葡萄糖和果糖的含量,与COX、PK和α-amylase的活性关联度相对较高。
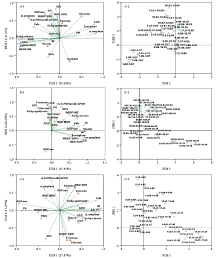 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8库尔勒香梨果实发育成熟过程糖分与21种代谢酶活性的主成分分析A:果心糖分与代谢酶的载荷图(A-1)及果心质量标示图(A-2);B:果肉糖分与代谢酶的载荷图(B-1)及果肉质量标示图(B-2);C:果皮糖分与代谢酶的载荷图(C-1)及果皮质量标示图(C-2)Fructose:果糖;Glucose:葡萄糖;Sorbitol:山梨醇;Starch:淀粉;Sucrose:蔗糖
-->Fig. 8Principal component analysises of combined set of 5 sugars content with 21 metabolic enzyme activities Korla pear throughout the fruit development and ripeningA: Loading plot (A-1) of sugars content with enzyme activities and weight labelled plot (A-2) of core; B: Loading plot (B-1) of sugars content with enzyme activities and weight labelled plot (B-2) of pulp; C: Loading plot (C-1) of sugars content with enzyme activities and weight labelled plot (C-2) of peel
-->
2.6.2 果肉糖代谢和呼吸代谢的响应关系 分阶聚类将果肉发育成熟过程分为2个阶段。第一个阶段为花后60—80 d,可归为果肉的发育初期,以山梨醇、蔗糖、淀粉代谢的增强与响应关联为主;山梨醇代谢酶SO、SDH(NADP型和NAD型),蔗糖代谢酶AI、NI、SuSy-c,蔗糖/淀粉代谢酶α-amylase、β-amylase、AGPase、UGPase,共11种活性较强的糖代谢酶被聚为一组(图7-B,绿色条码);有7种酶的活性出现峰值。该阶段的糖代谢特点为:催化山梨醇和蔗糖两种运转糖转化为单糖的反应较为活跃,淀粉降解的代谢强度相对最高。第二个阶段为花后90—150 d,其中花后90—110 d的聚类分支属于果肉质量快速增加的时期,可归为果肉速生期,以TCAC(图7-B,黄色条码)代谢为主(PDC、NADP-ME、Sdh)。花后120—150 d的聚类分支可归为果肉成熟阶段,以EMP和蔗糖代谢关联为主(图7-B,红色条码),EMP调控ATP合成的节点PK,逸失多余电子、减少ATP合成的AOX均在该阶段出现活性峰值;调控磷酸化蔗糖与单糖转化的SPS,平衡蔗糖与单糖动态消长的SuSy-s与SuSy-c,促进淀粉水解产物向蔗糖转化的AGPase和UGPase,同步出现酶活性的增强。
主成分分析结果显示,香梨果实发育成熟过程果肉糖代谢与呼吸代谢的动态关联被分成2个维度,对分析变量和补充变量的方差解释为63.93%(图8-B-1)。对照果肉的质量标示图(图8-B-2),发育成熟过程果肉糖分的主成分转变顺序为:淀粉→山梨醇→蔗糖、葡萄糖、果糖。其中,果肉质量缓慢增长的过程(维度2载荷系数-4.0—0.0),淀粉和山梨醇代谢关联性较高,与分阶聚类分析结果一致。果肉质量50.0—100.0 g快速增长过程(质量标示维度2载荷系数0.0—6.0)以山梨醇积累为主;果肉质量大于100.0 g后,以蔗糖、葡萄糖和果糖积累为主;SPS(0.822)、SuSy-s(0.775),与EMP代谢GPI(0.807)、调控ATP合成的PK(0.730)与COX(0.874),以及PPP呼吸支路G-6-PDH/6-GPDH联酶(0.936)的载荷系数和关联度较高。
2.6.3 果皮糖代谢和呼吸代谢的响应关系 分阶聚类将果皮发育成熟过程分为2个阶段。第一阶段为花后60—120 d(图7-C,绿色、黄绿和黄色条码),可归为果皮的发育期,支路呼吸途径PPP的G-6-PDH/ 6-GPDH联酶,呼吸主路径EMP的产能节点PK及TCAC启动节点PDC,淀粉降解、转化ADP-葡萄糖以及合成蔗糖的α-amylase、AGPase、SuSy-s存在较高活性的响应关联;TCAC苹果酸代谢NAD-MDH与NAD-ME,与山梨醇转化果糖SDH(NAD型与NADP型)、淀粉水解转化UDP-葡萄糖UGPase,均在该阶段出现酶活性峰值。第二个阶段为花后130—150 d,可归为果皮的成熟期。该阶段SO、SuSy-c、NI、β-amylase糖代谢在同步出现酶活性峰值的响应;蔗糖代谢AI与SPS、TCAC与电子传递联结节点Sdh,两个电子传递链关键酶AOX和COX,均具有较强活性、被关联聚类(图7-C,红色条码)。
主成分分析结果显示,果实发育成熟过程果皮糖代谢与呼吸代谢的动态关联被分成2个维度,对分析变量和补充变量的方差解释为55.54%(图8-C-1)。对照果皮质量标示图(图8-C-2),发育成熟过程果皮糖分的主成分转变顺序为:山梨醇、蔗糖→淀粉→葡萄糖、果糖。其中,果皮质量10.0—17.0 g(维度1系数0.0—6.0)快速增长的时期,果皮糖分以山梨醇和蔗糖两个运转糖为主要组分;糖代谢AI、NI、NAD-SDH、SuSy-s,与呼吸代谢Sdh、AOX的活性关联度较高,以Sdh(0.825)、NI(0.948)和AI(0.923)的载荷系数最高。果皮质量增至17.0—22.0 g的时期,糖分以淀粉、葡萄糖和果糖为主要组分;呼吸代谢中仅有COX与糖代谢SO、β-amylase、SPS、SuSy-c的活性关联度较高;以SO(0.823)和β-amylase(0.894)的载荷系数相对最高。
3 讨论
香梨果实发育和成熟过程中,果心、果肉和果皮的山梨醇含量都较为丰富,比蔗糖含量高6.0%— 48.0%,叶片合成并运至果实的糖分,尤其在发育前期可能以山梨醇为主。山梨醇代谢转化的产物之一果糖可直接参与EMP;其转化的葡萄糖由EMP关键酶GPI调控、选择性的参与EMP或PPP[31,41]。图9显示,果肉、果心和果皮的GPI代谢热点均出现于成熟期,表示成熟期各部位GPI活性的升高有利于引导更多的6磷酸-葡萄糖转化为6磷酸-果糖进入EMP,以减少果糖的消耗而留存和积累。山梨醇代谢和蔗糖转化可能是香梨果实的糖代谢基本途径,作为代谢产物的调节枢纽与呼吸代谢关联。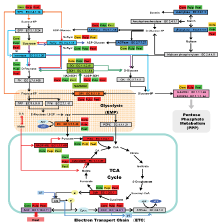 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9库尔勒香梨果实发育成熟过程果心、果肉和果皮糖代谢与呼吸代谢的关联差异(1)果心、果肉和果皮的代谢酶不同颜色条码与
-->Fig. 9Simplified drawing of sugar metabolism and respiratory metabolism responding difference between core, pulp and peel of Korla pear throughout the fruit development and ripening(1) The color codes of core, pulp and peel representing developing early or late correspond to the hierarchical clustering analysis (
-->
果实各部位的蔗糖比例虽然比山梨醇明显偏低,但发育成熟过程依然具有关键的作用。一方面,蔗糖可能是果实发育前期淀粉合成与积累的来源[42-46]。蔗糖运转、卸载至果实[9]、被SuSy-c分解为ADP-葡萄糖后[18,20],再由淀粉合成酶或分支酶转化为支链淀粉和淀粉[47-49];其次,蔗糖作为代谢调控的信号[8,50],可能在SuSy合成和分解过程起到转换和反馈调节UDP-葡萄糖或ADP-葡萄糖的转化率的作用,从而调控蔗糖/淀粉代谢转化方向和强度。因此,香梨果实的糖代谢没有蔗糖的明显积累,可能与低含量的蔗糖仅作为单糖/多糖代谢之间的路径连接信号作用有关。SuSy两个代谢转化方向的产物和底物均存在果糖,作为香梨果实中含量最为丰富的糖组分,果糖含量的高低可能直接影响SuSy的转化方向和活性强弱。跃变型果实成熟过程中,多发生组织淀粉水解、转化[51-54]为单糖被用于呼吸代谢。代谢路径(图9)显示,淀粉降解代谢趋于3个方向[55]:(1)淀粉由α-amylase水解为糊精。(2)淀粉由淀粉磷酸化酶分解为1磷酸-葡萄糖后,通过UGPase转化为UDP-葡萄糖,或通过SuSy-s与果糖合成蔗糖;或通过SPS与6-磷酸果糖合成6磷酸-蔗糖。(3)淀粉通过β-amylase外切为麦芽糖,麦芽糖磷酸化酶水解麦芽糖为葡萄糖和磷酸-葡萄糖[56]。UGPase和AGPase作为淀粉代谢与蔗糖代谢路径连接的节点[13]转化磷酸-葡萄糖为UDP-葡萄糖或ADP-葡萄糖[19],香梨果实中2个酶活性同时或前后交替升高,与淀粉含量的同步下降有关;而果实各部位的磷酸-葡萄糖被合成蔗糖或6磷酸-蔗糖,葡萄糖被转化为6-磷酸葡萄糖后,由GPI和G-6-PDH竞争性的选择进入EMP或PPP,同样在马铃薯低温糖化过程被发现[57]。香梨花后100 d果实趋于成熟,果心和果肉的蔗糖转化为单糖的积累过程,与蔗糖积累同时存在;依靠淀粉水解产物转化和蔗糖不断分解,葡萄糖和果糖积累明显、甜度升高;通过GPI促进糖分流向EMP底物转化,由PDC、Sdh、COX保持TCAC代谢通路的流程,NAD-MDH与NADP-ME通过有机酸回填和产物平衡,调控TCAC物质合成与电子传递的代谢速度;PPP代谢增强表示该阶段在糖分富集和GPI异构反应负荷过高条件下,可能通过呼吸支路代谢增强、主动分流糖代谢供应过量的6磷酸-葡萄糖。因此,代谢强度较高的EMP或PPP与蔗糖/淀粉代谢关联,是促进果心和果肉糖代谢、单糖持续积累的有利条件。
SPS合成6-磷酸蔗糖的过程必须以6磷酸-果糖为底物,相关功能鉴定的研究结果说明果糖含量的高低与磷酸蔗糖合成的启动和持续有关[10]。香梨果实的果糖聚寡同时受蔗糖和山梨醇代谢的多个位点调控,例如果肉和果皮的AI、NI、SO和SDH在同一时期形成关联热点。SO属于束缚型调控酶,以SDH催化山梨醇生成果糖的能力较强,对果糖积累的贡献可能相对更高[58]。果心SPS在花后60—110 d较为活跃,果肉和果皮活性从花后100 d升高,说明磷酸蔗糖的合成是果心发育期和速生期的重要事件;此时的果心果糖含量明显高于果肉和果皮,已达到果实内源多聚糖代谢的条件。果肉和果皮SPS启动时,果肉的果糖和果皮的山梨醇含量均大于30 mg·g-1;此时果肉和果皮的呼吸代谢同步升高,加快内源聚糖的转化以维持代谢通路。蔗糖转化酶的催化反应仅发生在酸性或中性环境[59],有机酸在TCAC过程合成并运至胞质,为转化酶提供了酸性环境;TCAC生成的质子在线粒体内被“质子泵”用于合成ATP,而SDH在催化山梨醇转化为果糖或葡萄糖时亦释放质子,有利于TCAC保持代谢强度、持续合成有机酸。香梨花后90 d出现果肉和EMP转换构成呼吸主路径,与番茄相关研究结果一致;BIAIS等[40]认为TCAC代谢增强提高ATP合成,是果实发育细胞分裂的必要条件,此后细胞膨大的速生过程需要EMP参与完成。
花后120—150 d,果心、果肉和果皮COX,以及果肉和果皮的AOX活性升高,与GPI和Sdh(果肉和果皮)形成关联热点。CP高强度的电子传递推动能量合成与AP放热耗能过程[60-61]同时存在,必然导致底物的消耗过量。交替呼吸途径虽然表现为“无效”的散热和能量损失过程,但交替途径参与果实跃变成熟的调控[62-65]。该阶段山梨醇含量下降明显,表示代谢底物可能来源于山梨醇,代谢消耗大于运转供给造成山梨醇含量下降;而果肉NADP- ME活性升高,表示通过有机酸回填反应补充代谢底物的亏缺。
综上所述,香梨果实发育成熟过程:(1)花后60—80 d的果心发育期,果心的糖代谢以蔗糖代谢为主,与TCAC的苹果酸代谢、Sdh、交替电子传递形成代谢的关联热点;花后90—150 d的果心速生期与成熟期,糖代谢以淀粉和山梨醇代谢为主,以蔗糖代谢作为多糖和单糖转化的连接路径,与EMP、PPP和细胞色素途径形成关联热点。(2)花后60—80 d果肉发育初期基本以糖代谢为主,淀粉酶、蔗糖转化酶和山梨醇酶为代谢热点,未见呼吸代谢热点的明显关联;花后90—150 d果肉速生期和成熟期以呼吸代谢为主,EMP、TCAC、CP、AP相关酶与SPS、SuSy-s形成关联热点。(3)花后60—120 d的果皮发育期,淀粉酶、NAD-SDH与PK、苹果酸代谢酶和PPP呼吸形成代谢热点;花后120—150 d果皮成熟期的糖代谢以蔗糖代谢和山梨醇代谢(SO和NADP-SDH)为主,与GPI、Sdh、AOX、COX形成关联热点。从本试验结果来看,香梨果实发育成熟的过程存在果实3个部位糖代谢和呼吸代谢的异质化,果心成熟相对较早,当果肉果糖和葡萄糖含量升至峰值之前,果心已达到生理成熟,果糖和葡萄糖停止积累,以呼吸代谢消耗单糖为主要生理过程;果皮成熟相对最晚。因此,适宜在果心糖分达到峰值的时期采收香梨,即新疆巴州主产区的9月上旬。
花后130 d之前香梨果实的果皮存在强度较高的PPP代谢和苹果酸代谢,表示果皮的部分糖代谢产物用于次生代谢,有机酸大量TCAC代谢被消耗。香梨等外果在发育期果皮增厚,近果皮组织石细胞比例和有机酸含量偏高,可能与苹果酸代谢异常,有机酸未被大量消耗,TCAC与EMP代谢减弱,果皮组织糖代谢产物集中流向木质素代谢有关。库尔勒香梨作为梨属植物中与西洋梨(Pyrus communis Linn.)存在亲缘关系的品种[2,66],具有后熟跃变过程果皮色泽转黄和皮层油脂增厚特性[67],可能与果皮成熟后期高强度电子传递的产能与放热代谢带动TCAC,以完成氨基酸、脂肪酸及香气呈味组分的转化合成[68]有关。从呼吸跃变的强弱差异来看,香梨属于内(果心)、外(果皮)强,中心(果肉)弱的“夹心”模式,与厚皮甜瓜呼吸代谢“内强外弱”的渐变模式有所不同[69]。呼吸代谢较强的部位,均存在与外界环境交换气体的通道,以维持高强度的有氧呼吸[70],香梨果皮可直接与环境交换气体,而果心存在的中空腔体与花萼的萼孔相通,具有与环境气体交换的结构条件;其心室隔膜又能有效的避免种籽与空气接触,有利于维持种籽成熟后的休眠状态,从而满足不同组织休眠或代谢活跃的需要。
4 结论
4.1 香梨花后60—80 d的果心发育期,蔗糖、三羧酸循环、交替途径的代谢酶关联,促进蔗糖转化为单糖,用于放热耗能的呼吸代谢;花后90—150 d果心速生期和成熟期,果心质量增至7.0 g以上,淀粉/蔗糖、山梨醇、糖酵解、磷酸戊糖途径、细胞色素途径的代谢酶关联,以糖酵解为呼吸主路径,促进果糖、葡萄糖积累比例升高,与质量和甜度的增长显著相关。4.2 香梨花后60—80 d的果肉发育期,淀粉/蔗糖与山梨醇代谢酶关联,促进淀粉、山梨醇和蔗糖转化为单糖,果糖含量快速升高;花后90—150 d果肉速生期和成熟期,果肉的糖酵解、三羧酸循环、交替途径、细胞色素途径、淀粉/蔗糖的代谢酶关联;糖酵解和三羧酸循环在花后约90 d切换,相继成为呼吸主路径;果肉质量增至50.0—100.0 g,以淀粉降解和山梨醇积累为主;质量增至100.0 g以上则以果糖、葡萄糖和蔗糖积累,均与质量和甜度的增长显著相关。
4.3 香梨花后60—120 d的果皮发育期,淀粉、山梨醇、磷酸戊糖途径、糖酵解、三羧酸循环的代谢酶关联,以糖酵解和三羧酸循环共同构成呼吸主路径,山梨醇积累和蔗糖转化较快。花后130—150 d果皮成熟期,果皮质量增至17.0 g以上,蔗糖、山梨醇、糖酵解、三羧酸循环、交替途径、细胞色素途径的代谢酶关联,促进山梨醇转化和果糖、葡萄糖的积累。
4.4 香梨果实以糖分积累构成典型的内在品质,存在果实成熟时糖分构成与甜度的部位异质,是发育与成熟不同阶段糖代谢与呼吸代谢不同动态响应累积的结果。磷酸已糖异构酶与细胞色素氧化酶是果实3个部位成熟期呼吸代谢与糖代谢的交联节点。
The authors have declared that no competing interests exist.
