 ,1, 仲伶俐1, 秦琳1, 黄世群1, 李曦1, 郑幸果1, 雷欣宇1, 雷绍荣1, 郭灵安1, 冯俊彦
,1, 仲伶俐1, 秦琳1, 黄世群1, 李曦1, 郑幸果1, 雷欣宇1, 雷绍荣1, 郭灵安1, 冯俊彦 ,2,*
,2,*Effects of Different Drying Methods on Functional Components and Antioxidant Activity in Sweet Potato Leaves
ZHAO Shan ,1, ZHONG LingLi1, QIN Lin1, HUANG ShiQun1, LI Xi1, ZHENG XingGuo1, LEI XinYu1, LEI ShaoRong1, GUO LingAn1, FENG JunYan
,1, ZHONG LingLi1, QIN Lin1, HUANG ShiQun1, LI Xi1, ZHENG XingGuo1, LEI XinYu1, LEI ShaoRong1, GUO LingAn1, FENG JunYan ,2,*
,2,*通讯作者:
责任编辑: 林鉴非
收稿日期:2021-02-25接受日期:2021-05-14
| 基金资助: |
Received:2021-02-25Accepted:2021-05-14
作者简介 About authors
联系方式:赵珊,Tel:028-84504142;E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1655KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
赵珊, 仲伶俐, 秦琳, 黄世群, 李曦, 郑幸果, 雷欣宇, 雷绍荣, 郭灵安, 冯俊彦. 不同干燥方式对甘薯叶功能成分及抗氧化活性的影响. 中国农业科学, 2021, 54(21): 4650-4663 doi:10.3864/j.issn.0578-1752.2021.21.014
ZHAO Shan, ZHONG LingLi, QIN Lin, HUANG ShiQun, LI Xi, ZHENG XingGuo, LEI XinYu, LEI ShaoRong, GUO LingAn, FENG JunYan.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】甘薯(Ipomoea batatas Lam.)又名红薯、番薯,属旋花科番薯属一年生草本植物[1],世界第七大粮食作物,也是我国重要的粮食、饲料、工业原料和生物质能源作物[2]。甘薯地上部分包括叶、叶柄和茎,可以在一年中多次采收,产量远高于其他叶类蔬菜[3]。甘薯茎叶还富含多种生物活性成分,如多糖、黄酮、多酚以及多种维生素,具有调节免疫、抗肿瘤、降血糖、降血脂、抗衰老、抗疲劳、抗菌、抗辐射等生理保健功效[4,5,6,7]。近年来,茎叶的食用和加工逐渐成为甘薯产业化研究的热点。多酚类物质是甘薯叶中最重要的功能性成分之一,主要包括绿原酸及其衍生物 [8,9,10]。由于新鲜甘薯叶片采摘后保鲜时间短,易萎蔫、腐烂。干燥是延长甘薯叶片保存时间的最佳方法,也是深加工及产品开发的必需环节,如甘薯叶青汁粉、甘薯叶饮料、甘薯叶保健醋等[11]产品都是在干燥叶片的基础上开发而来。这些产品不但满足了消费者对营养和保健的需求,也进一步促进了甘薯产业的发展。但是,研究表明[12,13,14]干燥会对叶片固有营养物质,特别是生物活性化合物造成损害。因此,研究不同干燥方式对甘薯叶片功能成分的影响,建立最佳的干燥方式,对提高甘薯叶片加工工艺具有重要意义。【前人研究进展】目前,果蔬的干燥方式主要有日晒、热风干燥、真空冷冻干燥等。日晒投入低,但加工时间长,易受天气、温度等气候环境因素的影响,干燥质量不稳定。热风干燥是一种成本低、易于控制且应用广泛的干燥方法[15],但热风干燥往往会破坏活性成分,降低含量[16,17]。真空冷冻干燥技术能够较好地保存和保留新鲜样品的外观、味道、营养成分、颜色、风味、质地和生物活性等,但该方式设备投资高,干燥时间长且能耗大[18,19]。蒸汽热烫结合热风干燥是近几年发展起来的干燥新技术,据报道在保存食品营养价值方面效果更好,被认为是一种获得高质量干燥产品的潜在方法[20,21,22]。司金金[23]、宋振[24]等比较了不同干燥方式对总酚、黄酮、蛋白质、总糖等成分的影响。JENG等[25]比较了30℃鼓风干燥、70℃和100℃热风干燥以及真空冷冻干燥下甘薯叶片中咖啡酰奎宁酸的含量,发现高温干燥会影响甘薯叶中咖啡酰奎宁酸的含量,真空冷冻干燥叶片的含量显著高于其他几种,其次是30℃鼓风干燥。【本研究切入点】最好的干燥方式应该是既可简便、快速除去材料中的水分,又尽可能减少材料中有效活性成分或目标成分的损失。目前,关于甘薯叶片干燥方式的报道还较少,不同干燥方式对甘薯叶功能成分及抗氧化活性的影响也缺乏全面和深入的研究。【拟解决的关键问题】本研究采用蒸干结合热风干燥、真空冷冻干燥和3种热风干燥的方式对甘薯叶进行干燥,比较不同干燥方式对甘薯叶片中功能成分、抗氧化活性及色泽等品质性状的影响,探求一种高效、低成本,且最大限度保留甘薯叶片活性成分的干燥方式,为叶用甘薯加工及产业发展提供理论和技术支撑。1 材料与方法
1.1 试验材料
本研究选用甘薯品种为‘台农71’和‘胜南’,由四川省农业科学院生物技术核技术研究所提供。‘台农71’:半直立株型,叶心形、绿色;‘胜南’:半直立株型,叶心形、绿色。材料种植于四川省农业科学院生物技术核技术研究所试验基地。2019年4月播种育苗,同年6月剪苗栽插,8月采集甘薯叶片进行试验。1.2 仪器与试剂
ACQUITY UPLC I-Class/Xevo TQ-XS超高效液相色谱-串联三重四级杆质谱仪(美国Waters公司);1290 Infinity II超高效液相色谱仪(美国Agilent公司);Gamma 2-16 LSC plus真空冷冻干燥机(德国Martin christ公司);Varioskan Flash多功能酶标仪(美国Thermo fisher公司);UV2550紫外分光光度计(日本岛津公司);Cary Eclipse荧光分光光度仪(美国Varian公司);CR-400色差仪(柯尼卡美能达公司);SFG-02B电热鼓风干燥箱(黄石市恒丰医疗器械公司);SHA-CA恒温水浴振荡器(常州荣华仪器制造有限公司);D3204R高速离心机(北京大龙兴创实验仪器有限公司);KQ5200DE超声波清洗机(昆明市超声仪器有限公司)。标准品(纯度均大于97%):咖啡酸、L-抗坏血酸、β-胡萝卜素购自美国Sigma-Aldrich公司,3-CQA、维生素D3、α-生育酚、维生素B1和维生素B2购自德国Dr. Ehrenstorfer公司,4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA购自武汉天植生物技术有限公司,1-CQA、1,3-diCQA和1,5-diCQA购自成都普瑞法科技开发有限公司,芦丁购自日本和光纯药公司;福林酚试剂购自国药集团化学试剂有限公司;1,1-二苯基-2-苦肼基自由基(1,1-Diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2′-Azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)、过硫酸钾(分析纯)、乙腈(色谱纯)、甲醇(色谱纯)、无水乙醇(色谱纯)、甲酸(色谱纯)、0.22 μm微孔过滤膜等购自上海安谱科技股份有限公司;碳酸钠、乙酸钠、铁氰化钾、偏磷酸、硼酸、丙酮、石油醚、氢氧化钠、盐酸、乙酸等分析纯试剂均购自广东西陇化工股份有限公司。
1.3 试验方法
1.3.1 甘薯叶粉的制备 取新鲜叶片冲洗干净泥沙,晾干水分后随机均分为5份,根据文献[25]并结合预试验结果,分别采用不同的干燥方式干燥至水分低于10%。将干燥后的叶片粉碎过60目筛,贮存于-20℃备用。蒸干结合热风干燥(steam drying combined with hot air drying,SD+HAD):将叶片平铺于蒸板上,水沸后将叶片放入蒸锅,并盖上锅盖蒸5 min,打开锅盖继续蒸,使甘薯叶片中水分去除80%以上,然后将甘薯叶片转移至电热鼓风干燥箱,50℃继续干燥2 h。
真空冷冻干燥(vacuum freeze drying,VFD):将叶片放入-80℃超低温冰箱冷冻过夜,之后将冷冻的叶片移至真空冷冻干燥箱,连续干燥48 h。
热风干燥(hot air drying,HAD):将叶片放至电热鼓风干燥箱干燥,分别设定温度为60℃,干燥时间为4 h;温度为50℃,干燥时间为8 h;温度为40℃,干燥时间为32 h。
1.3.2 总酚和总黄酮的测定 甘薯叶醇提取物的制备参照ZHENG[26]的方法并改进:精确称取样品0.2 g,加入70 mL 70%甲醇水溶液,于60℃超声浸提30 min,定容至100 mL,离心后过0.22 μm微孔过滤膜,避光保存待测定游离酚酸、总酚和总黄酮。
总酚含量的测定参照文献[27]以绿原酸为标准品,采用福林酚法测定上述醇提取物中总多酚含量,结果以干基样品中绿原酸当量(mg CAE·g-1 DW)表示。测定重复3次。
总黄酮含量的测定参照文献[28]以芦丁为标准品,采用三氯化铝比色法测定上述醇提取物中总黄酮含量,结果以干基样品中芦丁当量(mg RE·g-1 DW)表示。测定重复3次。
1.3.3 甘薯叶游离酚酸的UPLC-MS/MS分析 将1.3.2甘薯叶醇提取物稀释20倍进行UPLC-MS/MS分析,参照文献[29]进行测定,结果以干基(mg·g-1 DW)表示,重复3次。具体条件和操作如下。
1.3.3.1 色谱条件 色谱柱:Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 µm);柱温:35℃;样品室温度10℃;进样量:2.0 μL;流动相A:0.01%甲酸水溶液,过0.2 μm水相微孔过滤膜;流动相B:乙腈;流速:0.3 mL·min-1;梯度洗脱程序:0—0.5 min,5% B;0.5—3 min,5%—10% B;3—9 min,10%—15% B;9—12 min,15%—20% B;12—12.5 min,20% B;12.5—14 min,20%—50% B;14—14.5 min,50%—90% B;14.5—15 min,90% B;15—15.5 min,90%—5% B;然后运行2.5 min。
1.3.3.2 质谱条件 离子源:电喷雾电离源(electrospray ionization,ESI);扫描方式:负离子模式;监测模式:多重反应监测模式(multiple response monitoring,MRM);毛细管电压3.0 kV;离子源温度:150℃;脱溶剂气温度:500℃;脱溶剂气流量:1 000 L·h-1;碰撞气流速:0.15 mL·min-1;锥孔气流速:150 L·h-1。
1.3.3.3 标准溶液的配制 分别称取10种酚酸标准品各10 mg,用甲醇溶解并定容至10 mL,贮存于-20℃棕色玻璃瓶中。酚酸混合标准工作液采用梯度稀释法现配现用。
1.3.4 β-胡萝卜素、维生素和叶绿素的测定 β-胡萝卜素含量的测定参照食品安全国家标准GB 5009.83— 2016,以β-胡萝卜素为标准品,采用高效液相色谱法测定,结果以干基样品中β-胡萝卜素量(mg·kg-1 DW)表示。重复3次。
维生素D和维生素E含量的测定分别参照食品安全国家标准GB 5009.82—2016中第四法和第一法,分别以维生素D3和α-生育酚为标准品,采用高效液相色谱法测定,结果以干基样品中维生素D3和α-生育酚量(mg·kg-1 DW)表示。重复3次。
抗坏血酸含量的测定参照食品安全国家标准GB 5009.86—2016第二法,以L(+)-抗坏血酸为标准品,采用荧光分光光度法测定,结果以干基样品中L(+)-抗坏血酸总量(mg/100 g DW)表示。重复3次。
维生素B1、B2含量的测定分别参照食品安全国家标准GB 5009.84—2016和GB 5009.85—2016,分别以维生素B1和B2为标准品,采用高效液相色谱法测定,结果以干基样品中维生素B1和B2量(mg·kg-1 DW)表示。重复3次。
叶绿素含量的测定参照农业标准NY/T 3082— 2017,采用分光光度法,以叶绿素总量(mg·g-1 DW)表示。重复3次。
1.3.5 抗氧化活性分析 DPPH清除能力的测定:使用DPPH法测量甘薯叶醇提取物的自由基清除能力。参照文献[30]并稍作修改,将50 μL提取物添加到3 mL 60 μmol·L-1 DPPH(溶于80%甲醇)中。将混合物混合并在室温下于黑暗中保持30 min。在酶标仪517 nm下测量反应溶液的吸光度。以甲醇(80%)为空白溶液作为对照。所有试验重复3次。使用以下公式计算DPPH自由基清除率:
DPPH自由基清除率(%)=(A0-Ai)/A0×100
其中A0为对照品的吸光度,Ai为样品的吸光度。
ABTS+清除能力的测定:参照文献[31]并稍作修改,取7.4 mmol·L-1ABTS储备液和2.6 mmol·L-1过硫酸钾溶液以体积比1:1混匀,室温避光静置12 h后,用pH 7.4磷酸盐缓冲液稀释至734 nm处吸光度0.7±0.02,作为ABTS+工作液。取50 μL甘薯叶醇提取物样品至3 mL ABTS+工作液中,混匀后反应6 min,在酶标仪734 nm波长下测定吸光度。以pH 7.4磷酸盐缓冲液为空白溶液作为对照。所有试验重复3次。使用以下公式计算ABTS+自由基清除率:
ABTS+自由基清除率(%)=(A0-Ai)/A0×100
其中A0为对照品的吸光度,Ai为样品的吸光度。
1.3.6 色值的测定 将甘薯叶粉末平铺于色差仪的粉末测试盒中,读取色值,记录L*、a*、b*值,L*表示亮度,a*和b*分别表示红(+a*)/绿(-a*)和黄(+b*)/蓝(-b*),重复3次。
1.4 数据处理
采用完全随机设计,每个样品3次重复。使用SPSS 22.0软件分析统计数据。用方差分析评估各组间的统计差异,然后进行LSD检验,不同字母表示差异显著(P<0.05)。2 结果
2.1 UPLC-MS/MS测定甘薯叶片游离酚酸方法的建立与优化
结合之前的研究结果[29],通过进一步优化液相条件和质谱方法,10种酚酸化合物得到了较好的峰形和分离度。在负离子模式下,分别对10种酚酸化合物进行扫描,确定特征离子对,进一步优化毛细管电压、锥孔电压、碰撞能量、驻留时间等参数,使分子离子与特征碎片离子产生的离子对强度达到最大,确定丰度较高的两个子离子作为定性离子,并选择其中丰度最高的作为定量离子,具体质谱参数见表1。采用优化好的液相方法和质谱方法对酚酸标准品进行分析,10种酚酸的离子色谱图如图1所示。各酚酸在10—1 000 μg·L-1浓度范围线性良好,相关系数(r2)≥0.999,可以满足定量分析的要求。Table 1
表1
表1目标化合物的质谱分析参数
Table 1
| 酚酸 Phenolic acid | 保留时间 Retention time (min) | 质荷比Mass-to-charge ratio (m/z) | 锥孔电压 Cone voltage (V) | 碰撞能量 Collision energy (eV) | |
|---|---|---|---|---|---|
| 母离子 Parent ion | 子离子 Daughter ion | ||||
| 1-咖啡酰奎宁酸 1-CQA | 2.99 | 353.10 | 191.03*, 84.92 | 16 | 20, 42 |
| 新绿原酸 5-CQA | 3.77 | 352.95 | 190.96*, 178.93 | 30 | 20, 18 |
| 绿原酸 3-CQA | 5.15 | 352.92 | 190.98*, 84.92 | 20 | 16, 42 |
| 隐绿原酸 4-CQA | 5.51 | 352.95 | 172.95*, 178.93 | 14 | 16, 16 |
| 咖啡酸 Caffeic acid | 6.38 | 178.91 | 134.92*, 78.88 | 24 | 14, 24 |
| 1,3-双咖啡酰奎宁酸 1,3-diCQA | 7.19 | 515.16 | 353.11*, 179.00 | 12 | 18, 32 |
| 异绿原酸B 3,4-diCQA | 12.87 | 515.02 | 172.95*, 353.04 | 8 | 26, 20 |
| 1,5-双咖啡酰奎宁酸 1,5-diCQA | 12.89 | 515.16 | 191.03*, 353.11 | 10 | 30, 16 |
| 异绿原酸A 3,5-diCQA | 13.26 | 514.96 | 353.04*, 190.97 | 32 | 18, 32 |
| 异绿原酸C 4,5-diCQA | 13.96 | 514.96 | 353.04*, 172.95 | 4 | 18, 30 |
新窗口打开|下载CSV
图1
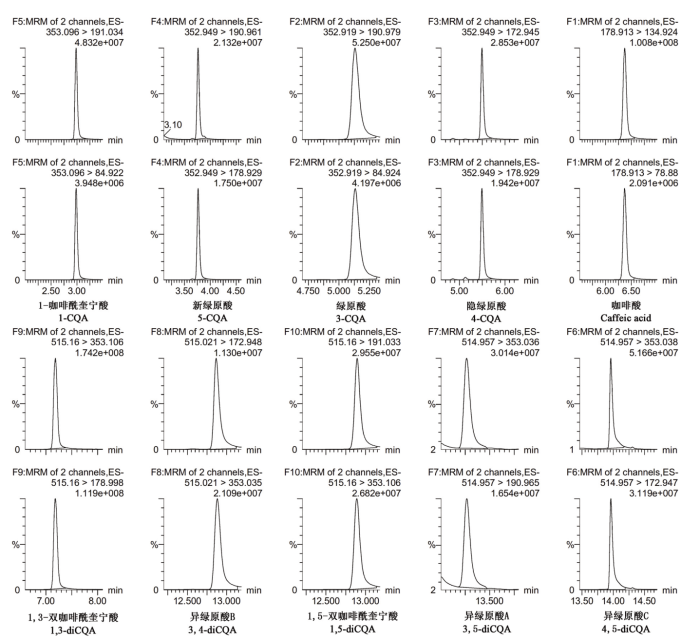 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图110种酚酸的离子色谱图
Fig. 1The ion chromatograms of 10 kinds of phenolic acids
2.2 干燥方式对甘薯叶片功能成分含量及色值的影响
2.2.1 游离酚酸含量 甘薯叶中游离酚酸的组成为新绿原酸、绿原酸、隐绿原酸、咖啡酸、异绿原酸A、异绿原酸B和异绿原酸C。不同干燥方式下甘薯叶中游离酚酸含量见表2,两个材料在不同干燥方式下游离酚酸总量差异显著(P<0.05),‘胜南’中游离酚酸含量低于‘台农71’。在‘台农71’叶片中,游离酚酸总量最高的干燥方式是真空冷冻干燥(38.4 mg·g-1 DW),其含量分别是蒸干结合热风干燥、40℃热风干燥、50℃热风干燥、60℃热风干燥的1.3倍、2.6倍、3.7倍和25.6倍。‘胜南’中游离酚酸总量最高的干燥方式是蒸干结合热风干燥(17.9 mg·g-1 DW),其含量分别是真空冷冻干燥、40℃热风干燥、50℃热风干燥、60℃热风干燥条件下的1.3倍、3.6倍、6.9倍、19.9倍。Table 2
表2
表2不同干燥方式下甘薯叶中酚酸的含量
Table 2
| 材料 Material | 干燥方式 Drying method | 酚酸 Phenolic acid (mg·g-1 DW) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 新绿原酸 5-CQA | 绿原酸 3-CQA | 隐绿原酸 4-CQA | 咖啡酸 CA | 异绿原酸B 3,4-diCQA | 异绿原酸A 3,5-diCQA | 异绿原酸C 4,5-diCQA | 总量 Total | ||
| 台农71 Tainong 71 | 蒸干结合热风干燥 SD+HAD | 3.45±0.12b | 4.37±0.20b | 2.15±0.10a | 0.04±0.01b | 6.05±0.32b | 9.31±0.49b | 4.38±0.32a | 29.8±1.5b |
| 真空冷冻干燥 VFD | 3.87±0.08a | 4.86±0.15a | 2.09±0.06a | 2.70±0.22a | 7.50±0.25a | 15.82±0.82a | 1.51±0.05c | 38.4±1.6a | |
| 60℃热风干燥 60℃ HAD | 0.17±0.01e | 0.22±0.03e | 0.08±0.01d | 0.01±0.00b | 0.26±0.04e | 0.59±0.07d | 0.13±0.01d | 1.5±0.2e | |
| 50℃热风干燥 50℃ HAD | 0.55±0.02d | 1.13±0.08d | 0.30±0.01c | 0.03±0.00b | 2.01±0.13d | 4.97±0.35c | 1.36±0.10c | 10.3±0.6d | |
| 40℃热风干燥 40℃ HAD | 1.02±0.05c | 1.53±0.05c | 0.56±0.02b | 0.04±0.01b | 4.00±0.20c | 5.64±0.49c | 2.10±0.20b | 14.9±1.0c | |
| 胜南 Shengnan | 蒸干结合热风干燥 SD+HAD | 1.67±0.03a | 2.57±0.05b | 1.11±0.02a | 0.07±0.01b | 4.58±0.15a | 3.86±0.12b | 4.10±0.05a | 17.9±0.3a |
| 真空冷冻干燥 VFD | 1.25±0.02b | 3.23±0.01a | 0.57±0.00b | 0.41±0.01a | 2.30±0.10b | 4.50±0.18a | 1.26±0.02b | 13.5±0.3b | |
| 60℃热风干燥 60℃ HAD | 0.09±0.01e | 0.15±0.01e | 0.04±0.00e | 0.01±0.00c | 0.16±0.01e | 0.30±0.01e | 0.16±0.01e | 0.9±0.0e | |
| 50℃热风干燥 50℃ HAD | 0.14±0.00d | 0.33±0.01d | 0.08±0.00d | 0.01±0.00c | 0.52±0.01d | 0.92±0.01d | 0.57±0.01d | 2.6±0.0d | |
| 40℃热风干燥 40℃ HAD | 0.39±0.01c | 0.86±0.01c | 0.19±0.00c | 0.01±0.00c | 1.17±0.04c | 1.50±0.09c | 0.87±0.04c | 5.0±0.2c | |
新窗口打开|下载CSV
单个酚酸的测定结果显示,在‘台农71’叶片中,真空冷冻干燥方式下的新绿原酸(3.87 mg·g-1 DW)、绿原酸(4.86 mg·g-1 DW)、异绿原酸B(7.50 mg·g-1 DW)、异绿原酸A(15.82 mg·g-1 DW)含量最高;异绿原酸C在蒸干结合热风干燥下的(4.38 mg·g-1 DW)含量最高;隐绿原酸在真空冷冻干燥(2.09 mg·g-1 DW)和蒸干结合热风干燥(2.15 mg·g-1 DW)中含量相对较高且二者间没有显著差异(P>0.05);咖啡酸在真空冷冻干燥下(2.70 mg·g-1 DW)含量最高,显著高于其他4种干燥方式(0.01—0.04 mg·g-1 DW)(P<0.05)。在‘胜南’中,真空冷冻干燥条件下的绿原酸(3.23 mg·g-1 DW)和异绿原酸A(4.50 mg·g-1 DW)含量最高;蒸干结合热风干燥条件下的新绿原酸(1.67 mg·g-1 DW)、隐绿原酸(1.11 mg·g-1 DW)、异绿原酸B(4.58 mg·g-1 DW)和异绿原酸C(4.10 mg·g-1 DW)含量最高;咖啡酸在真空冷冻干燥下(0.41 mg·g-1 DW)含量最高,显著高于其他4种干燥方式(P<0.05)。
2.2.2 总酚、总黄酮含量 不同干燥方式下总酚含量差异显著(P<0.05),总黄酮在50℃和40℃热风干燥的‘台农71’叶片中差异不显著(P>0.05),其余差异显著(P<0.05),其中真空冷冻干燥和蒸干结合热风干燥的含量明显高于3种热风干燥。不同温度下的热风干燥,其总酚和总黄酮含量高低顺序为40℃>50℃>60℃(图2)。
图2
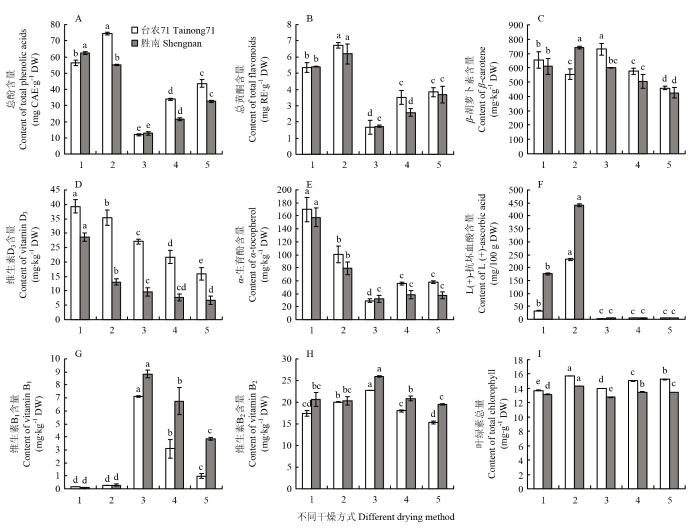 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同干燥方式对甘薯叶功能成分含量的影响
不同小写字母表示差异显著(P<0.05)。下同
Fig. 2Effects of different drying methods on the content of functional components in sweet potato leaves
The different lowercase letters mean a significant difference (P<0.05). The same as below
真空冷冻干燥下,两个材料的总酚(64.8 mg CAE·g-1 DW)和总黄酮(6.5 mg RE·g-1 DW)含量最高,总酚分别是蒸干结合热风干燥、40℃热风干燥、50℃热风干燥、60℃热风干燥的1.1倍、1.7倍、2.3倍、5.3倍;总黄酮分别是它们的1.2倍、1.7倍、2.1倍和3.8倍。
2.2.3 脂溶性维生素含量 β-胡萝卜素在‘台农71’中的含量范围为457.9—729.8 mg·kg-1 DW,含量最高的是60℃热风干燥;在‘胜南’中含量范围是425.6—740.6 mg·kg-1 DW,含量最高的是真空冷冻干燥。维生素D3在两个材料中的含量高低情况基本一致,具体为蒸干结合热风干燥>真空冷冻干燥>60℃热风干燥>50℃热风干燥>40℃热风干燥,‘台农71’和‘胜南’中的含量范围分别为16.0—39.3和6.7—28.6 mg·kg-1 DW。α-生育酚在蒸干结合热风干燥中含量最高(157.5—169.8 mg·kg-1 DW),其次是真空冷冻干燥(79.0—100.6 mg·kg-1 DW),3种热风干燥含量较低(图2)。
2.2.4 水溶性维生素含量 抗坏血酸在真空冷冻干燥方式下含量最高,‘台农71’和‘胜南’中含量分别为175.3和441.1 mg/100 g DW,其次是蒸干结合热风干燥(32.4和175.3 mg/100 g DW),3种热风干燥下,抗坏血酸被严重破坏,仅为3.4—5.7 mg/100 g DW。维生素B1在热风干燥下含量较高,且高低情况为60℃>50℃>40℃,在‘台农71’中的含量为1.0—7.1 mg·kg-1 DW,‘胜南’中的含量为3.9—8.8 mg·kg-1 DW;维生素B1在真空冷冻干燥和蒸干结合热风干燥中含量都较低,且没有显著性差异(P>0.05)。维生素B2在两个材料中含量最高的都是60℃热风干燥(图2)。
2.2.5 叶绿素含量和色值结果 由图2-I可知,不同干燥方式下甘薯叶中叶绿素总量差异显著(P<0.05),‘台农71’和‘胜南’都是真空冷冻干燥下含量最高。‘台农71’在蒸干结合热风干燥下(13.7 mg·g-1 DW)含量最低,‘胜南’在60℃热风干燥下(12.8 mg·g-1 DW)含量最低。
不同干燥方式对甘薯叶色值的影响见表3。L*值差异相对较小,不同干燥方式下‘台农71’的a*和b*有显著性差异(P<0.05),其绿色深浅程度为40℃热风干燥>真空冷冻干燥>50℃热风干燥>蒸干结合热风干燥>60℃热风干燥,黄色深浅程度为真空冷冻干燥>40℃热风干燥>50℃热风干燥>60℃热风干燥>蒸干结合热风干燥。在‘胜南’中,蒸干结合热风干燥和60℃热风干燥的a*值之间差异不显著(P>0.05),40℃和60℃热风干燥的b*值差异不显著(P>0.05),其余方式差异显著(P<0.05),绿色的深浅程度为真空冷冻干燥>40℃热风干燥>50℃热风干燥>60℃热风干燥/蒸干结合热风干燥,黄色深浅程度为真空冷冻干燥>40℃/60℃热风干燥>50℃热风干燥>蒸干结合热风干燥。
Table 3
表3
表3不同干燥方式对甘薯叶色值的影响
Table 3
| 材料 Material | 干燥方式 Drying method | 亮度 Lightness (L*) | 红绿值Redness/greenness (a*) | 黄蓝值Yellowness/blueness (b*) |
|---|---|---|---|---|
| 台农71 Tainong 71 | 蒸干结合热风干燥 SD+HAD | 56.68±0.68b | -4.41±0.05d | 4.86±0.05e |
| 真空冷冻干燥 VFD | 57.07±0.05b | -6.37±0.05b | 12.62±0.06a | |
| 60℃热风干燥 60℃HAD | 57.95±0.28a | -3.47±0.08e | 6.03±0.12d | |
| 50℃热风干燥 50℃HAD | 55.79±0.14c | -6.11±0.04c | 10.17±0.08c | |
| 40℃热风干燥 40℃HAD | 55.71±0.10c | -7.02±0.01a | 11.74±0.02b | |
| 胜南 Shengnan | 蒸干结合热风干燥 SD+HAD | 55.04±0.16b | -4.02±0.05d | 5.02±0.04d |
| 真空冷冻干燥 VFD | 56.32±0.53a | -7.93±0.27a | 12.41±0.47a | |
| 60℃热风干燥 60℃HAD | 53.13±0.12c | -4.06±0.04d | 8.72±0.12b | |
| 50℃热风干燥 50℃HAD | 53.37±0.14c | -4.87±0.05c | 8.13±0.09c | |
| 40℃热风干燥 40℃HAD | 53.10±0.17c | -6.15±0.07b | 9.11±0.11b |
新窗口打开|下载CSV
2.3 功能成分相关性和主成分分析
整体上看,总酚、总黄酮、总绿原酸、维生素D3、α-生育酚、维生素B1之间的相关性较强。其中,总酚与总黄酮、总绿原酸极显著相关;总酚与维生素D3、α-生育酚、L(+)-抗坏血酸呈极显著正相关(P<0.01);而维生素B1与总酚、总黄酮、总绿原酸、维生素D3、α-生育酚、L(+)-抗坏血酸呈极显著负相关(P<0.01);β-胡萝卜素仅与L(+)-抗坏血酸呈极显著正相关(P<0.01),与维生素D3呈显著正相关(P<0.05),与其他成分相关性不显著(表4)。Table 4
表4
表4甘薯叶功能成分间的相关性分析
Table 4
| 相关性 Correlation | 总黄酮 Total flavonoids | 总绿原酸 Total caffeoylquinic acids | β-胡萝卜素 β-carotene | 维生素D3 Vitamin D3 | α-生育酚 α-tocopherol | L(+)-抗坏血酸 L(+)-ascorbic acid | 维生素B1 Vitamin B1 | 维生素B2 Vitamin B2 |
|---|---|---|---|---|---|---|---|---|
| 总酚 Total phenolic acids | 0.961** | 0.905** | 0.034 | 0.574** | 0.775** | 0.640** | -0.928** | -0.485** |
| 总黄酮 Total flavonoids | 0.842** | 0.125 | 0.477** | 0.704** | 0.741** | -0.900** | -0.433* | |
| 总绿原酸 Total caffeoylquinic acids | 0.055 | 0.766** | 0.773** | 0.402* | -0.809** | -0.476** | ||
| β-胡萝卜素 β-carotene | 0.387* | 0.250 | 0.453** | -0.033 | 0.331 | |||
| 维生素D3 Vitamin D3 | 0.733** | 0.129 | -0.517** | -0.243 | ||||
| α-生育酚 α-tocopherol | 0.342 | -0.742** | -0.328 | |||||
| L(+)-抗坏血酸 L(+)-ascorbic acid | -0.560** | 0.024 | ||||||
| 维生素B1 Vitamin B1 | 0.697** |
新窗口打开|下载CSV
将总酚、总黄酮、β-胡萝卜素、维生素D3、α-生育酚、L(+)-抗坏血酸、维生素B1和维生素B2这8项指标用于甘薯功能成分的主成分分析(表5),前3个主成分累计方差贡献率达到90.936%,可以代表原始数据的大部分信息。由表5可知,第一主成分包含信息量的57.746%,主要代表总酚、总黄酮、维生素D3、α-生育酚和L(+)-抗坏血酸;第二主成分包含信息量的20.053%,主要代表β-胡萝卜素和维生素B2;第三主成分包含信息量的13.137%,主要代表维生素D3和α-生育酚。结合含量结果,推测同一类中的各成分在干燥过程中含量的变化趋势较为相似。
Table 5
表5
表5甘薯叶中8项功能成分的主成分分析
Table 5
| 指标 Index | PC1 | PC2 | PC3 |
|---|---|---|---|
| 总酚 Total phenolic acids | 0.967 | -0.093 | -0.120 |
| 总黄酮 Total flavonoids | 0.946 | 0.001 | -0.255 |
| β-胡萝卜素 β-carotene | 0.212 | 0.879 | 0.175 |
| 维生素D3 Vitamin D3 | 0.666 | 0.191 | 0.666 |
| α-生育酚 α-tocopherol | 0.844 | 0.078 | 0.353 |
| L(+)-抗坏血酸 L(+)-ascorbic acid | 0.639 | 0.467 | -0.598 |
| 维生素B1 Vitamin B1 | -0.953 | 0.225 | 0.088 |
| 维生素B2 Vitamin B2 | -0.524 | 0.715 | -0.084 |
| 特征值 Characteristic value | 4.620 | 1.604 | 1.051 |
| 方差贡献率 Variance contribution rate (%) | 57.746 | 20.053 | 13.137 |
| 累计方差贡献率 Cumulative variance contribution rate (%) | 57.746 | 77.799 | 90.936 |
新窗口打开|下载CSV
2.4 干燥方式对甘薯叶醇提取物抗氧化活力的影响
2.4.1 不同干燥方式下甘薯叶醇提取物的抗氧化活力 5种干燥方式下的DPPH自由基清除率差异显著(P<0.05),‘台农71’在真空冷冻干燥(73.3%)方式下最高,分别是蒸干结合热风干燥、40℃热风干燥、50℃热风干燥、60℃热风干燥的1.1倍、1.7倍、2.1倍、7.2倍。‘胜南’在蒸干结合热风干燥(61.3%)方式下最高,分别是真空冷冻干燥、40℃热风干燥、50℃热风干燥、60℃热风干燥的1.1倍、2.1倍、3.2倍、8.3倍。比较ABTS+自由基清除率,发现‘台农71’在真空冷冻干燥(40.7%)方式下清除率最高,其次是蒸干结合热风干燥(34.7%),40℃热风干燥(31.0%)和50℃热风干燥(30.5%)差异不显著(P>0.05),60℃热风干燥(18.6%)最低。‘胜南’在蒸干结合热风干燥(34.5%)和真空冷冻干燥(34.1%)下清除率较高,且二者之间差异不显著(P>0.05),其次依次为40℃热风干燥(27.8%)、50℃热风干燥(26.1%)、60℃热风干燥(16.8%)(图3)。图3
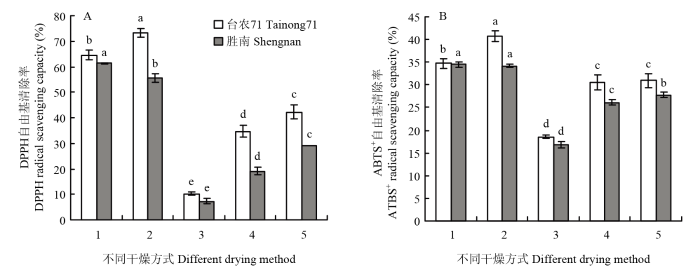 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3干燥方式对甘薯叶醇提取物抗氧化能力的影响
Fig. 3Effects of drying methods on antioxidant capacity of methanol extracts from sweet potato leaves
2.4.2 抗氧化能力与功能成分间的相关性分析 甘薯叶DPPH和ABTS+自由基清除率与总酚、总黄酮、绿原酸类化合物总量以及各个酚酸含量之间都存在极显著相关性(P<0.01),特别是与总酚、总黄酮、绿原酸类化合物总量、绿原酸和异绿原酸B的相关性较强,与总酚的相关性最强,相关系数范围为0.553—0.989(表6)。
Table 6
表6
表6干燥的甘薯叶抗氧化能力与总酚、总黄酮及绿原酸类化合物含量间的相关性分析
Table 6
| 相关性 Correlation | 总酚 Total phenolic acids | 总黄酮 Total flavonoids | 总绿原酸 Total caffeoylquinic acids | 新绿原酸 5-CQA | 绿原酸 3-CQA | 隐绿原酸 4-CQA | 咖啡酸 CA | 异绿原酸A 3,5-diCQA | 异绿原酸B 3,4-diCQA | 异绿原酸C 4,5-diCQA |
|---|---|---|---|---|---|---|---|---|---|---|
| DPPH | 0.989** | 0.957** | 0.925** | 0.883** | 0.948** | 0.873** | 0.553** | 0.829** | 0.921** | 0.745** |
| ABTS+ | 0.954** | 0.931** | 0.865** | 0.797** | 0.869** | 0.774** | 0.577** | 0.818** | 0.861** | 0.635** |
新窗口打开|下载CSV
3 讨论
3.1 甘薯叶游离酚酸的组成及开发价值
甘薯叶中游离酚酸主要为绿原酸及其衍生物,这与前人的研究[8,32]一致。本研究除分析鉴定了9种绿原酸类物质和咖啡酸外,还采用笔者前期研究使用的方法[29]分析鉴定了甘薯叶中的其他游离酚酸,包括没食子酸、2,3,4-三羟基苯甲酸、水杨酸、3,5-二羟基苯甲酸、原儿茶酸、龙胆酸、焦儿茶酸、对羟基苯甲酸、香草酸、丁香酸、4-香豆酸、阿魏酸、3-羟基肉桂酸、芥子酸、异阿魏酸、2-羟基肉桂酸和反式肉桂酸,但这17种酚酸的游离态在甘薯叶中未检出(结果未列出)。研究发现[33,34,35]绿色甘薯叶片的黄酮组成有槲皮素和山奈酚及相应的黄酮苷等,但其黄酮类成分含量远低于酚酸,本研究结果与之一致。广泛存在绿原酸类物质的天然植物主要有杜仲、金银花、咖啡豆、菊花等,杜仲中绿原酸类物质含量高达5%,金银花为1.5%—5%,绿咖啡豆为6%—7.5%,甜叶菊为1.7%—7.2%[36]。本研究采用真空冷冻干燥或蒸干结合热风干燥后的甘薯叶片中绿原酸及衍生物含量为13.1—35.7 mg·g-1 DW,较高的绿原酸类物质含量可能是甘薯叶具有保健功能的原因之一。与其他富含绿原酸的植物相比,甘薯叶具有栽培简单、生长周期短、产量高、成本低、绿原酸含量高等特点,这些特性也使甘薯叶在功能保健方面具有极大的开发价值。3.2 不同干燥方式影响甘薯叶中的功能成分
多酚、黄酮、维生素等功能成分在干燥过程中会受到光照、温度、氧分压、水分活度等因素的影响,发生氧化、集合或分解等反应,导致功能成分含量发生变化[20,25,37-40]。真空冷冻干燥和蒸干结合热风干燥下的总酚、总黄酮、抗坏血酸、新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A和异绿原酸C含量都明显高于热风干燥。推测真空冷冻干燥是在低温、低氧分压条件下,氧化酶活性低,因此,类似多酚、黄酮、抗坏血酸等易发生酶促氧化和热敏感成分在该干燥条件下有较好地保留。蒸干结合热风干燥下多酚、黄酮等成分含量高可能是在高温蒸汽条件下使氧化酶迅速失活,且在较短时间内水分迅速蒸发,保持了较低的水分活度,这些使易发生酶促氧化反应的成分得到较好地保留。胡皓等[41]测定了生咖啡豆和不同烘焙条件下的6种绿原酸及衍生物含量,发现生咖啡豆中绿原酸及衍生物总量最高,随着烘焙温度和时间的增加,绿原酸总量逐渐降低。在热风干燥中,总酚、总黄酮、绿原酸及衍生物随着温度升高,含量逐渐降低,表明这些成分都是热敏感成分,在干燥方式和条件的选择时,温度需要重点考虑。在一定温度范围内,随着干燥温度的升高,氧化酶的活性增强,加速活性成分的氧化反应,但温度升高,干燥时间相应缩短,氧化反应时间减少,对于β-胡萝卜素、维生素D3、维生素E等成分而言,可能是不同的干燥温度和时间共同决定了最终成分的含量差异。抗坏血酸的酶促氧化反应十分迅速,它可能只有在低温低氧分压条件才能部分保存,而不同干燥方式对维生素B2的影响较小。另外,不同干燥方式下甘薯叶的颜色有一定差异,低温对叶绿素的破坏较少,同时甘薯叶色值更偏绿和偏黄。综上,真空冷冻干燥更有利于甘薯叶中多酚、黄酮等功能活性成分的保留,其次是蒸干结合热风干燥,但两者在成本投入上有较大的差异,真空冷冻干燥设备投入大且能耗高,而蒸干结合热风干燥成本低、耗时短,在生产上更具有实用性。本研究选用的两个材料各功能成分间有一定的差异,如‘胜南’的绿原酸及衍生物含量明显低于‘台农71’,因此,功能成分的含量还取决于品种、基因等因素。3.3 酚类物质含量影响甘薯叶的抗氧化能力
DPPH和ABTS+的自由基清除率与总酚、总黄酮以及绿原酸类化合物含量存在极显著相关性(P<0.01)。总酚和总黄酮为甘薯叶中主要的功能成分,其中由绿原酸及其衍生物组成的酚类物质占主导。多酚化合物含有多个酚羟基,有很强的还原性,其结构特性是这类化合物具有抗氧化活性的主要原因,它们主要通过直接清除自由基或与金属离子相互作用来实现抗氧化[42]。傅玉凡等[43]研究了不同叶菜型甘薯茎尖绿原酸含量及清除DPPH能力,发现DPPH清除能力与绿原酸含量具有显著或极显著正相关。李晓英等[38]比较了不同干燥方式对蓝莓叶中酚类物质含量及抗氧化活性的影响,结果显示绿原酸、总酚和总黄酮含量均与抗氧化活性存在极显著相关性。综上,多酚类化合物的含量对甘薯叶抗氧化能力有很大的影响,而不同干燥方式影响了甘薯叶中功能成分的含量,特别是酚类物质,因此,干燥方式也决定了其抗氧化性能。4 结论
采用蒸干结合热风干燥、真空冷冻干燥、60℃/50℃/40℃热风干燥5种方式对甘薯叶进行处理,不同干燥方式显著影响甘薯叶中功能成分的含量及抗氧化能力。真空冷冻干燥和蒸干结合热风干燥较好地保留了多酚、黄酮、维生素D3、α-生育酚、抗坏血酸等功能成分的含量及较高的抗氧化活性。在热风干燥下,多酚和黄酮类物质为热敏感型成分,随着温度的升高,含量逐渐降低。相比真空冷冻干燥,蒸干结合热风干燥具有成本较低和干燥时间更短的优势,是实际生产应用中保留多酚和黄酮类物质的优选干燥方式。(责任编辑 赵伶俐)
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/S0378-4290(03)00018-2URL [本文引用: 1]
DOI:10.1111/nure.2010.68.issue-10URL [本文引用: 1]
DOI:10.1021/jf502328dURL [本文引用: 1]
DOI:10.1111/j.1365-2621.2006.tb08912.xURL [本文引用: 1]
DOI:10.1111/jfds.2003.68.issue-1URL [本文引用: 1]
DOI:10.1021/jf020120lURL [本文引用: 2]
DOI:10.1016/j.jfca.2010.03.025URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
DOI:10.3390/horticulturae7010010URL [本文引用: 1]
DOI:10.1021/acs.jafc.8b05993URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.foodchem.2004.09.020URL [本文引用: 1]
DOI:10.1016/j.foodchem.2008.07.090URL [本文引用: 1]
DOI:10.1080/07373937.2019.1599905URL [本文引用: 1]
DOI:10.3390/molecules21060729URL [本文引用: 2]
[本文引用: 1]
DOI:10.1186/s43014-020-00022-0URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1590/fst.29217URL [本文引用: 1]
DOI:10.1590/fst.29217URL [本文引用: 1]
DOI:10.1016/j.jfda.2014.07.002URL [本文引用: 3]
DOI:10.1016/j.foodchem.2007.05.053URL [本文引用: 1]
DOI:10.1016/j.fbio.2016.04.004URL [本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
DOI:10.1016/j.foodchem.2008.08.008URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1080/09168451.2015.1025032URL [本文引用: 1]
DOI:10.1002/(SICI)1097-0010(200004)80:5<>1.0.CO;2-QURL [本文引用: 1]
DOI:10.1016/j.foodchem.2013.05.009URL [本文引用: 1]
DOI:10.1016/j.foodchem.2006.10.077URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.foodchem.2009.01.040URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
