 ,, 任涛, 陆志峰
,, 任涛, 陆志峰 ,, 鲁剑巍华中农业大学资源与环境学院/华中农业大学微量元素研究中心,武汉 430070
,, 鲁剑巍华中农业大学资源与环境学院/华中农业大学微量元素研究中心,武汉 430070Effects of Different Magnesium Supplies on the Growth and Physiological Characteristics of Oilseed Rape in Seeding Stage
WANG KunJiao ,, REN Tao, LU ZhiFeng
,, REN Tao, LU ZhiFeng ,, LU JianWeiCollege of Resources and Environment, Huazhong Agricultural University/Microelement Research Center, Huazhong Agricultural University, Wuhan 430070
,, LU JianWeiCollege of Resources and Environment, Huazhong Agricultural University/Microelement Research Center, Huazhong Agricultural University, Wuhan 430070通讯作者:
责任编辑: 杨鑫浩
收稿日期:2020-10-12接受日期:2020-11-30
| 基金资助: |
Received:2020-10-12Accepted:2020-11-30
作者简介 About authors
王鲲娇,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (774KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
王鲲娇, 任涛, 陆志峰, 鲁剑巍. 不同镁供应浓度对油菜苗期生长和生理特性的影响[J]. 中国农业科学, 2021, 54(15): 3198-3206 doi:10.3864/j.issn.0578-1752.2021.15.005
WANG KunJiao, REN Tao, LU ZhiFeng, LU JianWei.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】长期以来,为追求集约化农业的高生产力,过量施用氮、磷肥而忽视钙、镁、硫等中微量元素肥料的现象非常普遍。随着高产优质品种以及高强度轮作模式的推广,作物从土壤中带走大量的养分,土壤中养分得不到及时补充,长期处于潜在匮乏的状态。镁缺乏逐渐成为我国农业生产中作物产量的潜在限制因子,合理施用镁肥能明显提高作物的产量、改善品质、提升抗逆境胁迫能力[1,2]。我国是世界油料消耗大国,但我国食用油的自给率不足40%,且呈现连年下降的趋势[3,4]。油菜作为我国当前最重要的油料作物之一,菜籽油占国产油料作物产油量的60%左右,因此扩大油菜的种植面积和提高油菜的单产对于保证我国食用油安全具有重大意义[5,6]。长江流域冬油菜典型种植区油菜的产量占全国总产量的85%以上,该区域耕层土壤有效镁平均含量为225.7 mg·kg-1,其中潜在缺镁和缺镁的土壤比例超过50%,缺镁已成为限制我国油菜产量潜力发挥的重要因子[7,8,9]。【前人研究进展】油菜作为需镁量较大的作物,每季平均从土壤中吸收60 kg·hm-2 MgO,每生产100 kg油菜籽平均需2 kg MgO[10]。油菜在苗期积累21 kg·hm-2 MgO,其中73%分布在叶片中[11],充足的镁对于维持叶片较高的光合速率、促进碳水化合物的快速转移及生育后期生殖器官的形态建成等非常关键[12]。土壤中镁与其他阳离子的相互作用直接影响作物对镁的吸收,土壤交换性K/Mg比值大于1.4[13]或Ca/Mg比值大于7[14]时作物容易出现缺镁症状。高钾地力下,施用镁肥不仅有助于提高油菜的产量,而且对于提高油菜籽的品质也有一定作用[8,15]。【本研究切入点】镁属于移动性较强的元素,单个叶片的缺镁响应特征不足以明确镁素在油菜生长中的作用,因此镁在不同叶位间的转移特性以及由此对叶片生理特性的影响便显得尤为重要。目前的研究多集中于其他养分离子对镁吸收的影响[8,13-15],镁如何影响钾和钙等养分离子的平衡尚未明确。【拟解决的关键问题】本研究通过水培试验分析了不同镁供应浓度下油菜苗期生长和叶片生理特性的变化,重点分析镁营养调控油菜叶片钾和钙的吸收、各叶位叶片同化物的合成和分配等规律,旨在明确镁对油菜的营养调控功能及镁、钾和钙离子的协同配合,为油菜生产上镁肥的合理施用、大量元素与中微量元素的协同增效提供必要的理论基础。1 材料与方法
1.1 试验设计
试验在华中农业大学资源与环境学院光照培养室内进行,培养环境设置为:日照/黑暗时长14 h/10 h、光照强度300 μmol·m-2·s-1、温度22℃、湿度60%—75%。供试油菜品种为华油杂9号,选取大小一致的种子,使用1%的NaClO浸泡10 min,用超纯水将种子表面冲洗干净后,在4℃环境下用超纯水浸泡24 h。将浸泡过后的种子均匀播种到塑料育苗盘内,加入适量超纯水,浸润种子。育苗一周后,将长势一致(油菜两片子叶展开,第一片新叶刚刚抽出)的幼苗定植至盛有不同镁浓度营养液的黑色塑料方盘中(436 mm×290 mm×75 mm),每方盘盛营养液7 L,定植24株幼苗,营养液每3 d更换一次,各方盘位置每天更换,定植12 d后每方盘间苗至4株幼苗。试验设置12个镁(MgCl2)供应浓度:0.01、0.02、0.04、0.06、0.08、0.10、0.30、0.50、0.80、1.00、1.50、2.00 mmol·L-1。每个处理4次重复,除镁以外其余元素的营养液浓度如下:NH4NO3 3 mmol·L-1,Na2HPO4·12H2O 0.28 mmol·L-1,NaH2PO4·2H2O 0.64 mmol·L-1,K2SO4 1 mmol·L-1,CaCl2 3.24 mmol·L-1,H2BO3 46 μmol·L-1,MnCl2·4H2O 9 μmol·L-1,CuSO4·5H2O 0.3 μmol·L-1,ZnSO4·7H2O 0.8 μmol·L-1,Na2MoO4·2H2O 0.1 μmol·L-1,EDTA-Fe 50 μmol·L-1。
1.2 测试项目及方法
1.2.1 生物量及养分含量 在处理后30 d(0.01、0.02、1.50、2.0 mmol·L-1处理四叶一心,其余处理五叶一心),选取各处理长势均一的植株,测定下列指标:(1)根系与地上部生物量和地上部钾、钙、镁浓度。将各处理根系和地上部分别用超纯水清洗干净后于110℃杀青15 min,在75℃下烘干至恒重,称重测得地上部与根的生物量(BMshoot与BMroot)。用研钵将地上部干样粉碎后,准确称取磨细过筛(0.5 mm,40目筛)的植物样品0.4000—0.5000 g,采用体积比4﹕1 HNO3-HClO4联合消煮,测定各处理地上部镁浓度(Mgc)及0.01、1.00、2.00 mmol·L-1处理地上部钾和钙浓度(Kc、Cac),其中镁与钙采用原子吸收分光光度计法测定,钾采用火焰光度计法测定[16]。
(2)新老叶片镁浓度。不同镁处理叶片数不同,0.01、0.02、1.50、2.0 mmol·L-1处理均有5片叶,0.04、0.06、0.08、0.10、0.30、0.50、0.80、1.00 mmol·L-1处理则有6片叶。取各处理由下至上第1—2片叶代表老叶(OL),0.01、0.02、1.50与2.00 mmol·L-1处理第3—5片叶,与0.04、0.06、0.08、0.10、0.30、0.50、0.80与1.00 mmol·L-1处理第3—6片叶代表新叶(NL),测定各处理老叶与新叶的镁浓度(Mgc),并计算镁转移系数T(T=Mgc(NL)/Mgc(OL))。
1.2.2 形态生理指标 在处理后40—45 d选取0.10 mmol·L-1(六叶一心)与1.00 mmol·L-1(七叶一心)长势均一的植株(图1),测定下列指标:
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1镁供应浓度对油菜苗期叶片生长的影响
Fig. 1Effects of different magnesium supplies on leaf growth of oilseed rape during seedlings stage
(1)气体交换与叶绿素荧光参数。使用配备荧光叶室的便携式光合测定仪Li-6400XT(LI-COR,USA)同步测定0.10与1.00 mmol·L-1处理下层叶片(从下往上第3片叶)与上层叶片(从下往上第5片叶)的气体交换与叶绿素荧光参数。设置叶室内CO2浓度400 μmol·mol-1,叶片温度25℃,空气相对湿度60%,气体流速500 mol·s-1。将叶片暗适应30 min后,测得初始荧光(F0)和最大荧光(Fm)。再将样品置于饱和光强下(1 200 μmol·m-2·s-1)活化0.5 h,待仪器稳定后记录净光合速率(A)、气孔导度(gs)、胞间CO2浓度(Ci)、稳态荧光(Fs)、光适应下最大荧光(Fm’)与最小荧光(F0’)等参数。计算实际光化学量子效率(ΦPSII)=(Fm’-Fs)/ Fm’与表观光合电子传递速率(ETR)=ΦPSII×PFFD ×α×β,其中PFFD是光量子通量密度,α表示叶片吸光系数(取值0.85),β是叶片吸收的光子中分配到PSII的比例(取值0.5)。
(2)二氧化碳响应曲线。保持光强、温度和湿度条件不变,用CO2注入系统控制CO2浓度为400、300、200、150、100、80、50、400、600、800、1 000、1 200、1 500和1 800 μmol·mol-1,测得各CO2浓度下的净光合速率(A)和胞间CO2浓度(Ci)。根据FARQUHAR等[17]的生化模型,计算25℃下叶片Rubisco最大羧化效率(Vcmax)和最大电子传递速率(Jmax)。
(3)根系指标及叶片面积、生物量与镁含量。采集0.10与1.00 mmol·L-1处理所有叶位的叶片,置于黑色背景板上,以25 cm2白色纸板做参照,拍照后利用 Image-pro plus 6.0软件计算油菜叶面积(LA)。随后用超纯水清洗叶片,擦干后于110℃杀青15 min,在75℃下烘干至恒重,测定叶片生物量(BMleaf)和镁浓度(Mgc)。叶片比叶重(LMA)为干物质量与叶片面积的比值。同时采集完整根系,用吸水纸吸去残余的水分后利用根系分析仪(EPSON PERFECTION V700)获取根部图片,用 WinRHIZO 根系分析软件(Pro 2012b)测量根长(Root length)、根尖数(Root tips)与根平均直径(Root avgdiam)。
(4)叶片蔗糖与淀粉含量。采集0.10与1.00 mmol·L-1处理所有叶位的新鲜叶片,擦净表面污物,剪碎混匀,称取0.1000—0.3000 g于刻度试管中,采用蒽酮比色法测定蔗糖浓度(Sugarc)和淀粉浓度(Starchc)[18]。
(5)叶绿素含量与Rubisco酶活性。采集0.10与1.00 mmol·L-1处理的下层叶片(从下往上第3片叶)与上层叶片(从下往上第5片叶),擦净组织表面污物,剪碎混匀后称取0.2000 g,用95%乙醇提取测定油菜叶片叶绿素a(Chl a)与叶绿素b(Chl b)含量[18];Rubisco酶活性(Rubisco activity)的测定采用紫外分光光度法,称取0.1000 g叶片,使用Rubisco 活性检测试剂盒(Cat#BC0440,上海索莱宝生物科技有限公司,中国)测定。
1.3 数据处理
使用SPSS 18.0(SPSS,Chicago,IL,U.S.A.)进行方差分析(ANOVA)。使用Duncan的多范围检验进行均值比较,当P<0.05时差异达显着性水平。采用Origin Pro 8.5软件(Origin Lab Corporation,Northampton,MA,U.S.A.)作图和回归拟合。2 结果
2.1 不同镁供应强度对油菜苗期地上部生物量和镁浓度的影响
镁营养显著影响油菜生长和干物质分配。随着镁用量的增加,单株生物量呈现先增加后降低的趋势,但是地上部与根生物量达到峰值时的镁用量不同,当供镁用量在1.0 mmol·L-1时,地上部生物量最大,过量的镁浓度(>1.0 mmol·L-1)会抑制油菜生长(图2)。在镁用量为0.3 mmol·L-1时,油菜根生物量最大,随着镁用量继续增加,根系生物量下降。根冠比随镁用量的增加呈现先增加后减小的趋势,当镁用量为0.3 mmol·L-1时根冠比最大。随着地上部镁浓度的增加,新老叶镁浓度逐渐增加,但在地上部镁浓度增加至0.45%后老叶镁浓度增加幅度大于新叶。这主要是因为在地上部镁浓度较低时,老叶往新叶中转移的镁更多,镁转移系数大于1;而当地上部镁浓度较高时,转移系数快速降低并小于1。地上部镁浓度越大,油菜生物量越大,但过高的镁浓度会抑制油菜的生长。以相对生物量大于95%为标准,得到油菜苗期适宜的地上部镁浓度范围为0.39%—0.67%,油菜镁缺乏与过量的范围分别是<0.39%与>0.67%。图2
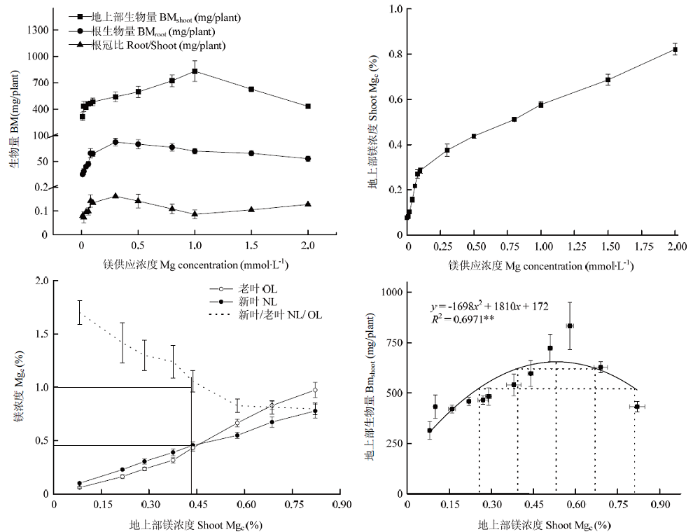 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同镁供应强度对油菜苗期地上部生物量和镁含量的影响
**表示拟合方程P值小于0.01,方程有效性在99%以上
Fig. 2Effects of different Mg supplies on shoot and root biomass and Mg concentration of oilseed rape during seedling stage
** indicates that the P value of the fitting equation is less than 0.01, and the validity of the equation is more than 99%
2.2 镁营养丰缺对油菜苗期地上部钾与钙养分吸收的影响
以上文地上部镁营养临界值的划分为依据,分析不同地上部镁营养对钾与钙浓度的影响(表1)可知,与适宜镁营养状态相比(1.00 mmol·L-1),镁缺乏(0.01 mmol·L-1)时地上部钙浓度显著增加,镁过量(2.00 mmol·L-1)时地上部钙浓度显著降低,新叶与老叶中镁离子与钙离子的拮抗作用表现不同,新叶钙浓度在镁缺乏时显著增加,老叶钙浓度在镁过量时显著降低。不同镁营养状态下地上部钾浓度无显著差异,新叶钾浓度在镁缺乏时显著增加,镁过量时新叶与老叶的钾浓度都显著降低。Table 1
表1
表1不同地上部镁营养对油菜苗期地上部钾与钙浓度的影响
Table 1
| 植株部位 Each part of the plant | 镁缺乏 Mg lack | 镁适宜 Mg optimum | 镁过量 Mg excess | |
|---|---|---|---|---|
| 地上部 Shoot | 镁浓度 Mgc (%) | 0.08±0.01c | 0.58±0.01b | 0.82±0.03a |
| 钙浓度 Cac (%) | 3.38±0.49a | 2.94±0.47b | 2.63±0.53c | |
| 钾浓度 Kc (%) | 4.61±0.80a | 5.48±0.99a | 5.00±0.77a | |
| 新叶 NL | 镁浓度 Mgc (%) | 0.10±0.01c | 0.55±0.03b | 0.78±0.07a |
| 钙浓度 Cac (%) | 3.14±0.16a | 2.52±0.08b | 2.51±0.05b | |
| 钾浓度 Kc (%) | 5.56±0.28a | 5.08±0.04b | 4.47±0.24c | |
| 老叶 OL | 镁浓度 Mgc (%) | 0.06±0.01c | 0.66±0.04b | 0.97±0.07a |
| 钙浓度 Cac (%) | 3.44±0.17b | 5.04±0.16a | 3.33±0.02b | |
| 钾浓度 Kc (%) | 4.32±0.25c | 7.74±0.28a | 6.22±0.36b | |
新窗口打开|下载CSV
2.3 镁营养丰缺对油菜苗期生长及其光合作用的影响
2.3.1 镁对油菜苗期根系与叶片生长的影响 缺镁显著抑制油菜根系与叶片的生长(表2),根生物量、根平均直径、根长、根尖数分别减小了66.7%、25.6%、21.8%与33.9%,叶片生物量与叶面积则分别减小了31.1%与40.1%。Table 2
表2
表2镁对油菜苗期根系与地上部表型特征的影响
Table 2
| 表型特征 Phenotype | 镁缺乏 Mg lack 0.10 | 镁适宜 Mg optimum 1.00 |
|---|---|---|
| 根生物量 BMroot (g/plant) | 0.11±0.01b | 0.33±0.05a |
| 根平均直径 Root avgdiam (mm) | 0.58±0.04b | 0.78±0.10a |
| 根长 Root length (cm) | 877±121b | 1121±169a |
| 根尖数 Root tips | 627±92b | 948±177a |
| 叶面积 LA (cm2) | 504±7b | 842±12a |
| 地上部生物量 BMshoot (g/plant) | 1.51±0.05b | 2.19±0.07a |
新窗口打开|下载CSV
2.3.2 镁对油菜苗期不同叶位叶片生长的影响 镁缺乏显著降低油菜各叶位叶片的生物量与叶面积,但不同叶位叶片比叶重对镁素供应的响应不完全相同,与正常供镁处理相比,缺镁显著增加了老叶的比叶重,但不影响上层叶片的比叶重(表3)。在叶片镁浓度与碳水化合物浓度上,缺镁植株各叶位叶片的镁浓度显著减少,但叶片淀粉含量显著增加。缺镁油菜植株下层叶片蔗糖累积,而上层叶片的蔗糖浓度则较低。综上表明镁营养调控油菜苗期碳水化合物从下层老叶向上层新叶的转运,镁营养缺乏时下层老叶积累更多的糖类物质,进而导致下层叶片比叶重的增加。
Table 3
表3
表3镁对油菜苗期各叶位叶片表型特征的影响
Table 3
| 供镁浓度 Magnesium supplies concentration (mmol·L-1) | 表型 Phenotype | 叶位Leaf position | ||||||
|---|---|---|---|---|---|---|---|---|
| 1 (下lower) | 2 | 3 | 4 | 5 | 6 | 7 (上upper) | ||
| 缺乏Lack 0.10 | 镁浓度 Mgc (%) | 0.13±0.01* | 0.16±0.01* | 0.16±0.01* | 0.24±0.01* | 0.28±0.02* | 0.33±0.04* | — |
| 叶面积 LA (cm2) | 51±5* | 87±3* | 91±4* | 104±4* | 104±5* | 66±5* | — | |
| 叶片生物量 BMleaf (g DW/plant) | 0.26±0.03 | 0.28±0.01* | 0.30±0.02* | 0.29±0.02* | 0.25±0.02* | 0.14±0.01* | — | |
| 比叶重 LMA (mg·cm-2) | 2.8±0.4* | 2.9±0.3* | 3.2±0.3* | 2.8±0.1 | 2.7±0.1 | 3.9±0.3 | — | |
| 淀粉浓度 Starchc (%) | 4.1±0.2* | 7.9±0.3* | 8.2±0.1* | 5.3±0.2* | 4.7±0.2* | 3.3±0.0* | — | |
| 蔗糖浓度 Sugarc (%) | 6.1±0.3* | 5.1±0.3* | 4.7±0.1* | 3.2±0.1* | 2.4±0.1* | 3.3±0.1* | — | |
| 适宜Optimum 1.00 | 镁浓度 Mgc (%) | 1.30±0.03 | 1.35±0.05 | 1.27±0.09 | 0.98±0.03 | 1.08±0.04 | 1.07±0.04 | 0.93±0.03 |
| 叶面积 LA (cm2) | 113±12 | 155±4 | 160±4 | 139±5 | 126±4 | 93±4 | 56±2 | |
| 叶片生物量 BMleaf (g DW/plant) | 0.27±0.01 | 0.32±0.01 | 0.38±0.01 | 0.42±0.03 | 0.33±0.02 | 0.30±0.02 | 0.17±0.02 | |
| 比叶重 LMA (mg·cm-2) | 1.5±0.2 | 1.9±0.1 | 2.1±0.2 | 3.1±0.3 | 3.0±0.2 | 3.5±0.1 | 4.9±0.3 | |
| 淀粉浓度 Starchc (%) | 1.5±0.0 | 2.2±0.1 | 1.9±0.0 | 2.5±0.1 | 2.7±0.1 | 3.0±0.1 | 2.1±0.1 | |
| 蔗糖浓度 Sugarc (%) | 3.3±0.1 | 1.8±0.2 | 3.2±0.0 | 7.4±0.1 | 4.5±0.1 | 6.4±0.1 | 11.5±0.6 | |
新窗口打开|下载CSV
2.3.3 镁对油菜苗期叶片生理生化指标的影响 缺镁显著降低油菜叶片净光合速率(A)(表4),上层叶片与下层叶片净光合速率分别降低了25.6%与59.0%。缺镁叶片(尤其是下层叶片)气孔导度(gs)、叶绿素含量(Chl a+b)、表观光合电子传递速率(ETR)、实际光化学量子效率(ΦPSII)、Rubisco酶活性(Rubisco activity)、最大羧化效率(Vcmax)与最大电子传递速率(Jmax)等生理指标均受到不同程度的抑制。
Table 4
表4
表4镁对油菜苗期叶片生理生化指标的影响
Table 4
| 生理生化指标 Physiological and biochemical indexes | 上层叶片 Upper leaf | 下层叶片 Lower leaf | ||
|---|---|---|---|---|
| 镁缺乏 Mg lack | 镁适宜Mg optimum | 镁缺乏 Mg lack | 镁适宜Mg optimum | |
| 净光合速率 A (μmol·m-2·s-1) | 12.2±1.3b | 16.4±1.4a | 6.8±1.1b | 16.6±1.8a |
| 气孔导度 gs | 0.14±0.02a | 0.13±0.02a | 0.08±0.03b | 0.17±0.02a |
| 胞间CO2浓度 Ci | 246±8a | 189±12b | 285±11a | 248±8b |
| 叶绿素a含量 Chl a (mg·g-1 FW) | 0.10±0.01b | 0.76±0.06a | 0.09±0.01b | 0.49±0.04a |
| 叶绿素b含量 Chl b (mg·g-1 FW) | 0.10±0.01b | 0.36±0.03a | 0.07±0.01b | 0.18±0.02a |
| 叶绿素含量 Chl a+b (mg·g-1 FW) | 0.20±0.01b | 1.12±0.08a | 0.16±0.02b | 0.67±0.05a |
| 实际光化学量子效率 ΦPSII | 0.24±0.02b | 0.29±0.02a | 0.17±0.02b | 0.24±0.02a |
| 表观光合电子传递速率 ETR | 122±9b | 147±9a | 85±9b | 123±12a |
| Rubisco酶活性 Rubisco activity (U·g-1 FW) | 228±10b | 908±23a | 99±6b | 298±5a |
| 最大羧化效率 Vcmax | 19.66±2.84b | 33.03±1.38a | 16.20±2.37b | 35.76±2.33a |
| 最大电子传递速率 Jmax | 18.27±2.72b | 41.45±0.96a | 16.01±2.20b | 38.84±3.43a |
新窗口打开|下载CSV
3 讨论
3.1 油菜临界镁浓度及缺镁症状
镁是植物体内移动性较强的元素,因此缺镁症状通常先出现在老叶上[19]。本研究结果表明不同镁缺乏程度油菜新老叶中镁的转移和分配差异显著。在轻微缺镁时,新叶镁含量小于老叶,随着镁缺乏程度的加重,新叶镁含量大于老叶。在本研究条件下,油菜缺镁的临界浓度为0.4%,地上部镁含量小于0.4%时,老叶中镁含量开始小于新叶镁含量,这与刘晓伟等[11]在田间观测的结果一致。一般认为植物叶片中镁含量低于0.2%时可能出现缺镁[20],本研究发现当叶片镁含量低于0.2%时,叶片开始出现明显的脉间失绿症状,但在叶片镁含量低于0.4%时,老叶中镁已开始向新叶转移,这表明新叶与老叶间的镁含量差异可以更早地为作物镁含量丰缺诊断提供依据。根冠比增加通常是植物适应胁迫环境的重要途径,镁对植物地上和地下干物质分配的影响结论不一[21,22,23,24,25],这可能与缺镁处理的时间以及镁缺乏的程度有关[26]。本研究结果表明,油菜缺镁对根系生长的调控受镁缺乏程度的影响;在镁轻微缺乏时,根冠比增加,有助于增强根系对镁的吸收,但随着镁缺乏程度的加重,地上部同化物运输受阻,根冠比显著降低[27]。3.2 缺镁胁迫对光合作用的影响
蔗糖运输受阻是植株响应缺镁胁迫的早期生理反应[27],本研究结果表明,缺镁显著降低老叶中糖类物质的转移,导致叶绿体内淀粉粒的累积,并可能影响叶绿体的结构和稳定性,也可能通过反馈调节作用抑制叶片的光合作用[28]。随着缺镁胁迫程度的加深,叶片的光合速率受到影响,具体表现在:(1)光合面积降低,缺镁油菜叶面积比正常供镁处理减少了17.5%—54.9%;(2)净光合速率下降,镁供应不足显著减少了油菜叶片的净光合速率(降幅25.6%—59.0%),且净光合速率的降低与气孔导度、电子传递速率和Rubisco酶活性的下降有关。目前关于缺镁影响叶片净光合速率的主导因素尚无明确定论,但其中镁在Rubisco酶活化及叶绿素合成上的功能可能是决定叶片光合能力的两个关键因子[29]。镁作为叶绿素的中心原子[30],在叶片光能吸收上有重要作用。本研究结果证实无论是新叶还是老叶,缺镁显著降低叶片的叶绿素a和叶绿素b含量,进而降低PSII天线色素吸收的光能用于光合电子传递的比例。缺镁胁迫叶片PSII实际光化学效率(ΦPSII)与表观光合电子传递效率(ETR)均显著降低,表明缺镁叶片对光能的吸收、传递和利用效率均较低,这与前人研究相符[31,32]。相对而言,缺镁对叶绿素a的影响较大,这主要是因为叶片在镁缺乏时,脱镁叶绿素酶催化叶绿素a的降解从而实现叶绿素镁的释放与再利用,而叶绿素b则必需先转化为叶绿素a才能被降解[33]。3.3 镁过量对钾与钙离子吸收的影响
除影响糖类运输和光合作用外,镁离子还能够调节根系对其他阳离子的吸收以及细胞内的离子平衡[34]。在本研究中,镁与钾、钙间存在拮抗作用,叶片高镁浓度显著抑制钾、钙的吸收,这与前人研究结果相符[35,36,37,38]。镁离子影响其他阳离子吸收可能是由于植物木质部导管壁上带负电荷的阴离子基团对阳离子的吸附。阳离子中价数越高,静电引力越大,吸附就越牢固。提高镁离子浓度可以减少被导管壁吸附的镁离子的相对数量,增加镁离子向地上部的运输效率,但是镁离子供应浓度过高也可能会通过与其他阳离子竞争离子通道或因维持电中性需要而引起镁与钾、钙离子间的拮抗作用[39,40]。因此,在油菜生产上,镁肥的施用需兼顾土壤中钾、钙等其他阳离子的含量,注重镁对油菜的营养调控及镁与钾、钙的协同配合,实现大量元素与中微量元素的协同增效。4 结论
随着镁供应量的增加,油菜地上部镁含量增加,油菜生物量及根冠比呈现先增加后减小的趋势。油菜苗期生长的适宜地上部镁含量范围为0.4%—0.7%。缺镁降低油菜各叶位叶片的镁含量,促进老叶中的镁往新叶转移;镁不足时各叶位叶片淀粉含量增加,下层叶片蔗糖含量增加,同化物的运输受阻。
缺镁时油菜光合面积减小,叶绿素含量与Rubisco活性下降,电子传递速率和CO2羧化速率降低,抑制叶片光合作用。
镁过量破坏油菜叶片的离子平衡,镁浓度过高显著抑制新叶与老叶的钾与钙的吸收,在油菜生产上镁肥的施用需注意避免高浓度镁离子与钾离子、钙离子之间的拮抗作用。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1007/s11104-012-1555-2URL [本文引用: 1]
DOI:10.1071/CP15104URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.1007/s11104-013-1781-2URL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/BF00386231URL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/jxb/47.Special_Issue.1255URL [本文引用: 1]
DOI:10.1111/ppl.2008.133.issue-4URL [本文引用: 1]
DOI:10.1007/s11738-015-2044-zURL [本文引用: 1]
DOI:10.1016/j.tplants.2006.10.007URL [本文引用: 1]
DOI:10.1111/nph.2010.187.issue-1URL [本文引用: 1]
DOI:10.3389/fpls.2019.00766URL [本文引用: 1]
DOI:10.1007/s11104-013-1589-0URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/ppl.2018.163.issue-3URL [本文引用: 1]
DOI:10.1104/pp.65.2.350URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.jplph.2018.01.010URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1080/01904168509363366URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1104/pp.110.168047URL [本文引用: 1]
DOI:10.1071/FP03201URL [本文引用: 1]
