 ,中国农业科学院郑州果树研究所,郑州450009
,中国农业科学院郑州果树研究所,郑州450009Prokaryotic Expression of dsRNA of Zucchini yellow mosaic virus and Its Control Efficacy on ZYMV
XIE KunLun, LIU LiMing, LIU Mei, PENG Bin, WU HuiJie, GU QinSheng ,Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009
,Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009通讯作者:
责任编辑: 岳梅
收稿日期:2019-09-9接受日期:2019-11-4网络出版日期:2020-04-16
| 基金资助: |
Received:2019-09-9Accepted:2019-11-4Online:2020-04-16
作者简介 About authors
解昆仑,E-mail: xiekunlun1994@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (3016KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
解昆仑, 刘莉铭, 刘美, 彭斌, 吴会杰, 古勤生. 小西葫芦黄花叶病毒dsRNA的原核表达及其对ZYMV的防治效果[J]. 中国农业科学, 2020, 53(8): 1583-1593 doi:10.3864/j.issn.0578-1752.2020.08.008
XIE KunLun, LIU LiMing, LIU Mei, PENG Bin, WU HuiJie, GU QinSheng.
0 引言
【研究意义】西瓜(Citrullus lanatus)属于葫芦科作物,是我国重要的夏季水果。我国是西瓜最大生产国和消费国,但是每年由于病毒病的发生会造成西瓜大面积的减产甚至绝收[1],其中小西葫芦黄花叶病毒(Zucchini yellow mosaic virus,ZYMV)是分布最广、在我国危害较普遍的病毒[2],属于马铃薯Y病毒属(Potyvirus),通过机械、蚜虫、种子等途径传播[3],目前尚缺乏有效的防治方法。因此,探寻防治该病毒病的有效方法具有重要意义。【前人研究进展】RNA干扰(RNA interference,RNAi)是一种在生物进化过程中高度保守的、由双链RNA(double-stranded RNA,dsRNA)产生的小干扰RNA(small interfering RNA,siRNA)诱导信使RNA(messenger RNA,mRNA)高效特异性降解的现象,是生物本身一种天然的防御机制,能够有效地抵御外来核酸的侵扰。自2003年TENLLADO等[4]利用体外喷施dsRNA的方法防治病毒病以来,一种新的利用dsRNA防治病害的方法得以出现。2016年,KOCH等将其命名为喷施诱导的基因沉默(spray-induced gene silencing,SIGS)[5]。该方法在防治昆虫[6,7]、真菌[5,8]、病毒[9,10,11]等植物病虫害上已有广泛研究。2017年,MITTER等[9]利用纳米材料LDH(layered double hydroxide)包裹裸露的dsRNA,使喷施的dsRNA能够稳定的在叶片表面存在近一个月,在此期间植株能够有效地抵抗病毒病的侵染;2018年,KALDIS等[11]利用体外转录的方法用试剂盒在体外生产了ZYMV的HC-Pro和CP片段的dsRNA,随后将其和病毒汁液混合后摩擦接种,发现ZYMV HC-Pro片段的dsRNA在西瓜、黄瓜和南瓜上的防治效果分别为50%、82%和18%,而ZYMV CP片段的dsRNA防治效果分别为43%、70%和16%。【本研究切入点】虽然外部利用体外转录生产的dsRNA防治ZYMV已有报道,但是体外转录生产dsRNA的成本高,目前应用于实际生产有很大的限制,而利用生产成本较低的原核表达体系生产dsRNA用来防治ZYMV尚无研究,本研究探索利用原核表达的方法生产dsRNA,摸索其生产条件并评价防治效果。【拟解决的关键问题】构建一个能够表达dsRNA的原核表达体系,探明不同片段dsRNA、不同的施用时间对病毒病的预防和治疗效果,为该方法的实际应用打下基础。1 材料与方法
试验于2018—2019年在中国农业科学院郑州果树研究所完成。1.1 试验材料
西瓜品种‘红和平’种子购于浙江浙农种业有限公司。西瓜植株的培养条件为温度(26±2)℃,光周期L﹕D=16 h﹕8 h。ZYMV毒源、ZYMV侵染性克隆及pCAMBIA3301质粒均由本实验室保存。RNAⅢ酶缺陷型大肠杆菌HT115菌株及含有双T7启动子的RNAi沉默载体L4440[12]均购自北京庄盟国际生物基因科技有限公司。PCR扩增用的Mix购自北京擎科新业生物技术有限公司,胶回收试剂盒为Axygen公司生产,所用内切酶SacI和HindⅢ均为NEB公司产品,同源重组试剂盒为近岸科技有限公司生产(NovoRec® plus One step PCR Cloning Kit),DNase I、RNase A、IPTG、Tris-HCl以及EDTA均为索莱宝生产,DAS-ELISA所用的检测ZYMV的试剂盒为Agdia公司生产,PBS、PBST等试剂均为实验室自行配制。1.2 试验方法
1.2.1 目的片段的选取与扩增 首先以ZYMV侵染性克隆为基础,根据其全长序列(登录号:MN296124),对ZYMV不同基因片段分别进行BLAST比对分析。针对不同片段分别选取BLAST出来的19条序列,利用软件DNAMAN 8对这20条序列进行多序列比对分析其保守性,从中选出保守性相对较高的5个片段,它们分别属于ZYMV的3′UTR、6K2、HC-Pro、NIb、P3区域,这些片段大小约200—350 bp。190 bp GUS片段从pCAMBIA3301 载体扩增。利用Primer5.0软件,根据ZYMV病毒序列以及载体L4440上的SacI和HindⅢ这两个酶切位点,分别设计ZYMV的3′UTR、6K2、HC-Pro、NIb、P3片段和GUS片段的特异性引物(表1),以ZYMV侵染性克隆的质粒和pCAMBIA3301质粒为模板分别扩增这6个片段。
Table 1
表1
表1本研究所用引物
Table 1
| 引物名称Primer name | 引物序列 Primer sequence (5′ to 3′) | 片段大小Fragment size (bp) |
|---|---|---|
| 3′UTR-F | GTCGACGGTATCGATAAGCTTTAAAGGGTAGGTCGCCTAC | 215 |
| 3′UTR-R | ATCATCGATGAATTCGAGCTCAGGCTTGCAAACGGAGTCTA | |
| 6K2-F | GTCGACGGTATCGATAAGCTTGTAAGCAAGAGGTCAGCAAC | 284 |
| 6K2-R | ATCATCGATGAATTCGAGCTC TCCTCTCTTCGTGTAAGCCT | |
| HC-F | GTCGACGGTATCGATAAGCTT TACGTAGTGCGAAACTTTCC | 338 |
| HC-R | ATCATCGATGAATTCGAGCTCGTTGAGATAGCAATAACCTTCC | |
| NIb-F | GTCGACGGTATCGATAAGCTT GTTGGTCAAGAGATGCTTGA | 287 |
| NIb-R | ATCATCGATGAATTCGAGCTC GAGGATGACATGTTATCAAG | |
| P3-F | GTCGACGGTATCGATAAGCTT ATCACGACCCGAGTACATG | 220 |
| P3-R | ATCATCGATGAATTCGAGCTC CTTCTCTTGTCGCTGCTATCAT | |
| GUS-F | GTCGACGGTATCGATAAGCTT GTAAATTTCTAGTTTTTCTCC | 190 |
| GUS-R | ATCATCGATGAATTCGAGCTC CTGTAACTATCATCATCATC | |
| L4440 | AGCGAGTCAGTGAGCGAG | |
| M13-F20 | TGTAAAACGACGGCCAGT |
新窗口打开|下载CSV
1.2.2 同源重组构建原核表达载体 利用同源重组的方法构建原核表达载体,首先PCR反应扩增得到ZYMV的5个目的片段和GUS的目的片段,PCR反应程序:94℃预变性3 min,然后按照94℃ 2 min,58℃ 30 s,72℃ 30 s,进行30次循环反应,最后于72℃延伸5 min。通过1%琼脂糖凝胶电泳分离目的片段的PCR产物,并用胶回收试剂盒(Axygen)纯化回收目的DNA片段。同时利用SacI和HindⅢ对载体双酶切,得到线性化的载体,然后利用同源重组试剂盒(NovoRec Plus PCR一步定向克隆试剂盒)进行同源重组,将同源重组产物转化HT115感受态(笔者实验室制备),利用L4440载体通用引物M13-F20/ L4440,PCR扩增确定阳性克隆后,将菌液送至上海生工生物工程有限公司测序,利用Clustalx比对,将测序结果正确的菌液-80℃保存备用。
1.2.3 原核表达体系的建立与优化 将成功导入质粒的菌液,以1﹕100的比例加入含有氨苄青霉素(Amp)和四环素(Tet)抗性的LB液体培养基中,37℃ 200 r/mim摇床过夜培养。第2天将菌液以1﹕100重新稀释培养,37℃摇床220 r/min培养3 h,分光光度计测菌液OD值,达到0.5时加入IPTG诱导,参考已报道的4—8 mmol·L-1浓度的IPTG[13],选取4和8 mmol·L-1分别诱导,以不加IPTG作为对照,诱导4 h后利用Trizol抽提细菌总RNA,将dsRNA提取出来。利用1.5%琼脂糖凝胶电泳,观察不同浓度诱导相同时间其dsRNA表达量。同样地,利用8 mmol·L-1 IPTG分别诱导4、5、6、7 h,提取dsRNA后电泳,观察表达量。
1.2.4 dsRNA的消化验证 将Trizol提取的dsRNA,用DNase I和RNase A消化,DNase I可以特异性的消化双链DNA和单链DNA,RNase A在高盐浓度下可以特异性的消化单链RNA,通过消化验证证实经诱导得到了dsRNA。
1.2.5 dsRNA喷施液的制作 在摸索最佳的诱导条件后,取2 mL菌液提取RNA,紫外分光光度计测定RNA的浓度,DNase I和RNase A消化后再次测量核酸浓度,并以此浓度作为dsRNA的生产浓度。
将诱导后的菌液8 000 r/min离心5 min,收集菌体,以1﹕1的比例加入相应体积的TE缓冲液,然后利用超声波细胞破碎仪对细胞进行破碎,将大肠杆菌体内的dsRNA释放出来,在对破碎时间进行筛选的过程中,根据实验室已有条件,在超声波细胞破碎仪3ø档位下,分别设置破碎时间为10、15、20、25 min,筛选出相对合适的破碎时间,制作成可喷施的dsRNA液体。
1.2.6 dsRNA的喷施 设置7个处理,分别喷施ZYMV的3′UTR、6K2、HC-Pro、P3、NIb 5个片段,以GUS片段和TE缓冲液作为对照,每个处理20株西瓜苗,重复3次。喷施dsRNA 1 d后即接种ZYMV,接种7 d后利用DAS-ELISA检测病毒,14、21 d时分别调查统计发病率,根据植株的发病情况统计,当植株呈现出花叶、畸形、皱缩、黄化等某一症状时即认为其发病。筛选出防治效果最好的片段,用于后续试验。
将筛选出来的防治效果最好的片段、GUS以及TE缓冲液3个处理进行预防和治疗试验。预防试验:在喷施dsRNA或TE缓冲液后 3、5、7 d分别接种ZYMV,21 d后调查统计发病率。治疗试验:先接种ZYMV,接种后1、3、5、7 d喷施dsRNA或TE缓冲液,接种21 d后调查统计发病率。每个处理10株,对照处理6株,每处理重复3次。
1.2.7 利用DAS-ELISA检测病毒 DAS-ELISA又叫双抗体夹心酶联免疫吸附法,是病毒检测中比较常用的方法,其具有操作简单、快速、灵敏度高、特异性好等优点。所用的酶联检测试剂盒购自美国Agdia公司。阳性对照样品为中国农业科学院郑州果树研究所西瓜甜瓜病虫害防控实验室保存的接种ZYMV毒源的西瓜植株。
在接种ZYMV 7 d后分别取样品,按1 g﹕10 mL的比例用提取缓冲液研磨样品。然后离心取上清,即为待检样品。检测步骤参考试剂盒说明书进行,以健康的西瓜叶片作为阴性对照,感病的叶片为阳性对照,缓冲液为空白对照。
利用酶标仪对反应后的吸光值进行检测,测出各个孔的吸光值,利用公式计算相应的I/S值, I/S值≥3时即认为其是阳性。计算公式:I/S=(样品吸光值-缓冲液对照吸光值)/阴性对照的吸光值。
2 结果
2.1 载体的构建
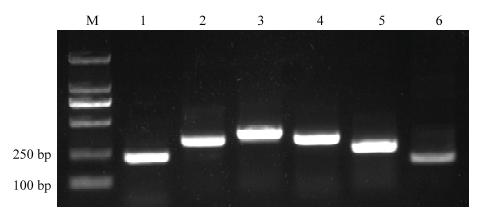
利用ZYMV侵染性克隆和pCAMBIA3301质粒为模板扩增ZYMV的5个片段和GUS片段,获得的PCR产物电泳检测,得到长度约为215、284、338、287、220、190 bp的目的条带,与预期大小一致(图1)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1ZYMV的3′UTR、6K2、HC-Pro、NIb、P3和GUS片段的PCR扩增
M: DL2000; 1: ZYMV-3′UTR (215 bp); 2: ZYMV-6K2 (284 bp); 3: ZYMV-HC-Pro (338 bp); 4: ZYMV-NIb (287 bp); 5: ZYMV-P3 (220 bp); 6: GUS (190 bp)
Fig. 13′UTR, 6K2, HC-Pro, NIb, P3 of ZYMV and GUS products by PCR
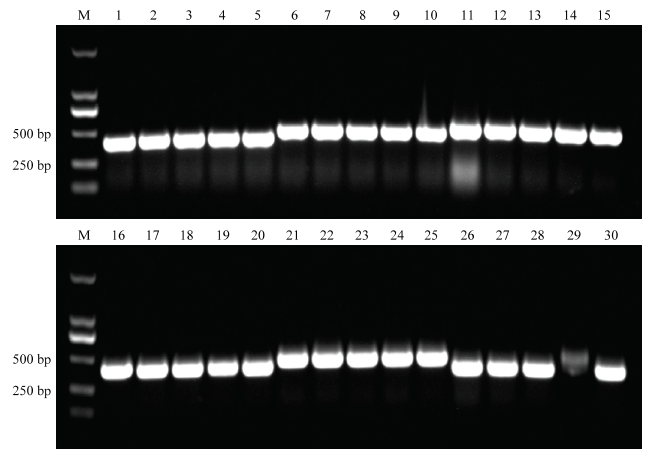
将扩增的片段和经双酶切处理的L4440载体利用同源重组的方法进行连接,随后转入HT115菌株的感受态中。经菌液PCR检测显示各克隆均为阳性,由于通用引物会扩增载体上的106 bp的片段,因此扩增的片段长为目的片段的长度加上106 bp(图2)。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2菌液PCR检测
M: DL2000; 1-5: 3′UTR (215 bp); 6-10: 6K2 (284 bp); 11-15: HC-Pro (338 bp); 16-20: P3 (220 bp); 21-25: NIb (287 bp); 26-30: GUS (190 bp)
Fig. 2Fragments amplified by PCR from bacterial culture
2.2 dsRNA诱导表达条件的优化
以ZYMV的HC-Pro片段的dsRNA作为研究对象,筛选合适的IPTG诱导浓度和诱导时间。因为L4440载体的两个T7启动子之间还有79 bp的序列,因此诱导得到的dsRNA的长度应为HC-Pro片段长度338 bp加上79 bp,即为417 bp,同时有研究指出dsRNA在电泳时迁移速度要低于dsDNA[11],因此目的片段在利用DL2000作为Mark时,在电泳图上要略大于标准值。结果发现当IPTG的诱导浓度为8 mmol·L-1时,诱导4 h后,dsRNA的表达量要比4 mmol·L-1时多,当IPTG浓度为0时,dsRNA表达量为0(图3)。当IPTG浓度为8 mmol·L-1时,随着诱导时间的增加,dsRNA的表达量持续增加,诱导7 h后,表达量相对较高(图4)。图3
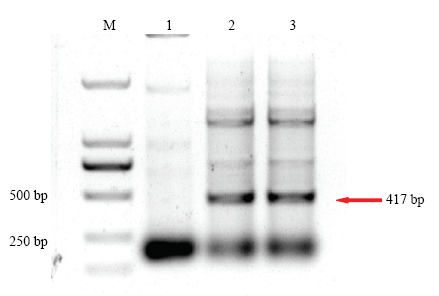 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同浓度IPTG诱导4 h后HC-Pro dsRNA的表达量
M:DL2000;1—3:IPTG浓度分别为0、4、8 mmol·L-1 The concentration of IPTG is 0, 4, 8 mmol·L-1, respectively
Fig. 3The amount of HC-Pro’s dsRNA expression after 4 hours of induction with different concentrations of IPTG
图4
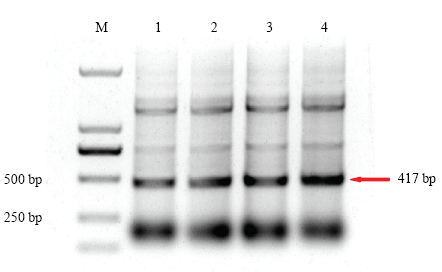 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4IPTG浓度为8 mmol·L-1时诱导不同时间后HC-Pro dsRNA表达量
M:DL2000;1—4:诱导时间分别为4、5、6、7 h The induced time is 4, 5, 6, 7 h, respectively
Fig. 4The amount of HC-Pro’s dsRNA expression induced with different times at 8 mmol·L-1 of IPTG
同样以ZYMV HC-Pro片段的dsRNA为研究对象,在IPTG浓度为8 mmol·L-1诱导7 h的条件下,利用超声波细胞破碎仪3ø的档位,60%输出功率,分别破碎10、15、20、25 min,随后将破碎后的液体利用琼脂糖凝胶电泳直接分离溶液中的dsRNA,可以发现在超声波破碎15 min后,即可有效释放dsRNA(图5)。
图5
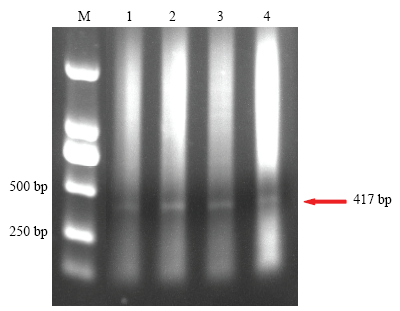 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5超声波破碎不同时间后dsRNA的释放量
M:DL2000;1—4:破碎时间分别为10、15、20、25 min The disruption time is 10, 15, 20, 25 min, respectively
Fig. 5The amount of dsRNA released by ultrasonic disruption with different times
2.3 利用DNase I和RNase A消化验证dsRNA
为验证提取的总RNA中是否含有dsRNA,利用DNase I和RNase A消化验证,首先利用DNase I对总RNA进行消化反应,以加入RNase-Free H2O作为对照,随后将经DNase I消化后的反应产物中加入RNase A,在1 mol·L-1的NaCl溶液中,以RNase-Free H2O作为对照,进行消化验证反应,结果表明当提取到的总RNA被DNase I和RNase A消化过后,在目的条带处仍存在清晰的条带,证明成功诱导表达了dsRNA(图6)。图6
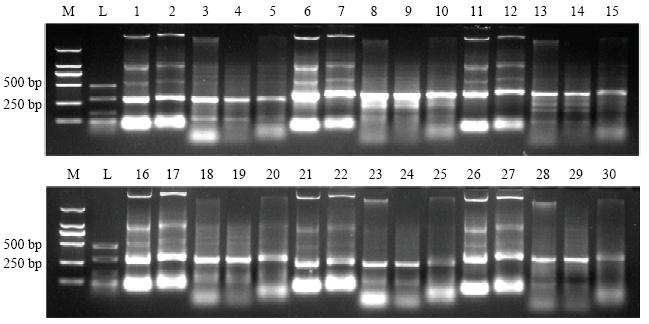 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6dsRNA的消化验证
M:DL2000;L:dsRNA Ladder;1:ZYMV 3′UTR的dsRNA dsRNA of ZYMV 3′UTR;2:ZYMV 3′UTR片段加水反应30 min后 ZYMV 3′UTR fragment reacted with water for 30 min;3:ZYMV的3′UTR片段被DNase I消化后 ZYMV 3′UTR fragment was digested by DNase I;4:ZYMV的3′UTR片段被DNase I消化30 min后,加水反应30 min ZYMV 3′UTR fragment was digested by DNase I for 30 min, then reacted with water for 30 min;5:ZYMV的3′UTR片段被RNase I消化后 ZYMV 3′UTR fragment was digested by RNase I;6—10:6K2片段的验证情况,条件如上 6K2 fragment verification, conditions as above;11—15:HC-Pro片段的验证情况,条件如上 HC-Pro fragment verification, conditions as above;16—20:P3片段的验证情况,条件如上 P3 fragment verification, conditions as above;21—25:NIb片段的验证情况,条件如上NIb fragment verification, conditions as above;26—30:GUS片段的验证情况,条件如上GUS fragment verification, conditions as above
Fig. 6Digestion verification of dsRNA
在总RNA被DNase I和RNase A消化过后,利用分光光度计测量核酸浓度,并以此作为诱导的dsRNA浓度,其量约占细菌总RNA的40%,随后以1﹕1的比例加入TE缓冲液,本试验中对叶片施用的量大致为4 μg·cm-2。
2.4 喷施dsRNA 1 d后接种ZYMV的预防效果
喷施ZYMV相关基因片段的dsRNA 1 d后摩擦接种ZYMV,结果发现处理组在接种ZYMV 7 d后无明显症状,14、21 d后植株仅有部分表现出症状;而喷施了TE缓冲液以及GUS片段dsRNA的对照组在接种病毒7 d后系统叶即产生了轻微花叶症状,14 d后整体植株呈现矮缩现象,叶片呈现花叶黄化、畸形症状,21 d后整株呈现严重的矮缩、花叶黄化现象,部分植株已经死亡(图7)。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7喷施dsRNA 1 d后接种ZYMV的预防效果
Fig. 7The prevention efficacy of inoculated ZYMV 1 d after spraying dsRNA
接种ZYMV 7 d后,每个处理随机采集3个样品进行混样,随后利用DAS-ELISA对ZYMV进行检测,结果发现喷施了TE缓冲液以及GUS dsRNA的对照组已经非常接近呈现阳性,而喷施了ZYMV的dsRNA的处理组均未检测到病毒(图8)。
图8
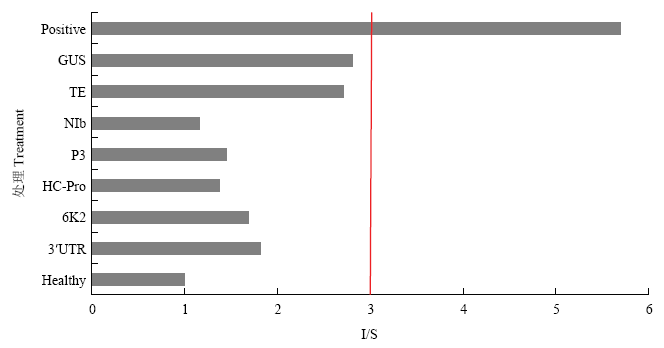 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8接种ZYMV 7 d后DAS-ELISA检测
当I/S值≥3时认为样品为阳性
Fig. 8DAS-ELISA detection after 7 days of ZYMV inoculation
When the I/S value ≥3, the sample is considered positive
接种ZYMV 21 d后统计发病率,发现喷施了TE缓冲液及GUS的dsRNA对照组植株发病率均为100%,喷施ZYMV的3′UTR、6K2、HC-Pro、P3、NIb 5个片段dsRNA的处理组的平均发病率分别为10%、15%、5%、10%、20%(图9)。结果表明喷施过dsRNA的处理组很好地抵御了ZYMV的侵染,其中HC-Pro片段的防治效果最佳。
图9
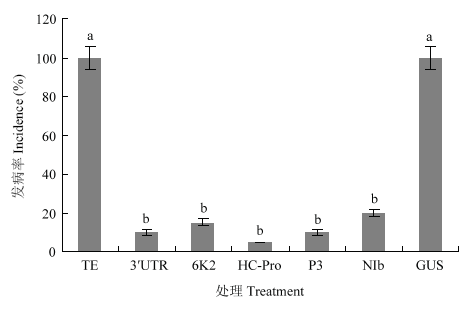 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9喷施dsRNA 1 d后接种ZYMV发病率(21 d)
利用邓肯氏多重极差测验法对发病率进行方差分析(SPSS软件),不同小写字母表示差异显著(α=0.05)Analysis of variance (SPSS software) of incidence using Duncan’s multiple range test, different lowercase letters indicate significant difference (α=0.05)。下同The same as below
Fig. 9Disease incidence of inoculation ZYMV (at 21 d) after spraying dsRNA for 1 day
2.5 基于HC-Pro基因片段的dsRNA预防和治疗ZYMV效果评价
为了进一步了解dsRNA抗病毒的预防时效及其治疗效果,选取防治效果最好的HC-Pro片段作为研究对象。在预防试验中,发病率统计结果显示喷施dsRNA 3 d后接种病毒,处理组发病率为16%,而对照组发病率分别为94%和78%;喷施dsRNA 5 d后接种病毒,处理组发病率为63%,而对照组发病率均为100%;喷施dsRNA 7 d后接种病毒,处理组发病率为63%,对照组发病率分别为72%和61%,已无显著差异(图10)。治疗试验的统计结果发现处理组和对照组之间的发病率无显著差异(图11)。图10
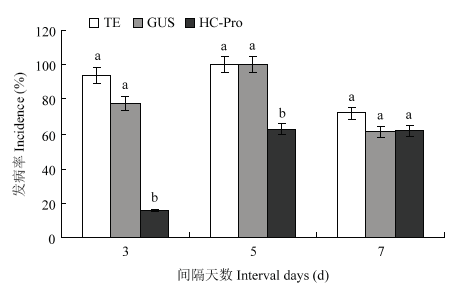 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图10喷施dsRNA后间隔不同天数接种ZYMV的发病率(21 d)
Fig. 10Disease incidence of inoculation ZYMV (at 21 d) when the virus was inoculated at different intervals after spraying dsRNA
图11
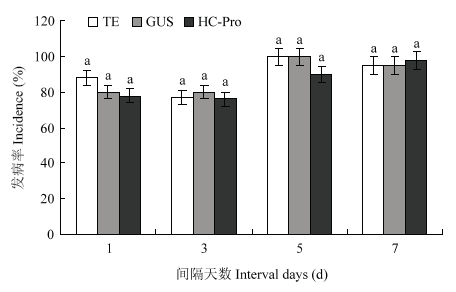 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图11接种ZYMV后间隔不同天数喷施dsRNA的发病率(21 d)
Fig. 11Disease incidence of inoculation ZYMV (at 21 d) when dsRNA was sprayed at different intervals after inoculation of ZYMV
3 讨论
植物可以利用自身的RNAi机制来抵御外来病毒的侵染,而引起植物RNAi反应的主要诱导因子就是dsRNA[14,15],自植物被证实能够吸收外源dsRNA且其能在植物体内系统性移动以来[16],利用外源喷施dsRNA防治病害的方法已经成为研究的热点[11,17-18]。目前利用该方法防治病毒病已在多种作物上尝试[19,20],但外源喷施原核表达生产的dsRNA用来防治ZYMV尚未有报道。基于此,本研究探索了原核表达体系的构件条件、不同片段的防治效果差异以及防治效果持续时间等问题。有关dsRNA长度和结构的选取,已有很多的讨论和证实[21,22,23,24],理论上讲,当dsRNA与其同源的序列长度能达到30 bp左右即可产生与其同源的siRNA,用来干扰该基因的表达[25],同时有研究指出,当dsRNA的长度介于200—500 bp时,其沉默效率是比较高的[26],基于此,本试验中涉及到的dsRNA的长度均位于200—350 bp;dsRNA可以设计成不同的结构,当dsRNA为发卡结构时,其沉默效率和稳定性要比普通的dsRNA强[27],但是构建成功后不稳定,不宜长时间保存,本研究前期利用延长dsRNA茎作为环的方法,构建了发卡结构的dsRNA,但是发现其生产dsRNA的效率低下,因此选择了简单高效的普通dsRNA方法应用于本试验。
该方法中,目的基因的选取是非常重要的,由于RNAi的特异性和病毒遗传物质的特性,在长期的相互作用和进化过程中,病毒自身产生了很多可以编码抑制植物体内RNAi效应的基因,称为RNAi沉默抑制子,研究表明马铃薯Y病毒属中的HC-Pro基因是一种RNAi沉默抑制子,可以通过阻止siRNA的积累来抵御植物的RNAi效应[25]。对比试验结果也可以发现,当沉默HC-Pro片段时其预防效果可高达95%,而沉默其他区域时预防效果相对较低,因此以后应用此方法时,可先分析病毒不同基因的功能,选取病毒的RNAi沉默抑制子进行沉默,可达到最佳的防治效果。dsRNA虽然较RNA稳定,但是其在自然界中裸露的情况下还是非常容易被降解的,因此其在叶片表面持续的时间长短是一个关键问题,本试验结果也表明,喷施裸露的dsRNA 7 d左右,基本上失去预防作用。考虑其原因应该是当植物叶片吸收外源的dsRNA后,利用自身体内的酶将dsRNA降解为siRNA,1 d后接种病毒,在病毒进入植物体内之后,siRNA即可以和病毒的基因组特异性结合而将其降解,降解之后又会产生新的siRNA,即RNAi的二级放大效应[28],所以这时防治效果就比较好。当进入植物的dsRNA被植物体内的酶降解成siRNA后,如后续长时间没有病毒的入侵,siRNA就会在植物体内被慢慢降解而使其失去抵抗病毒的能力。本试验结果表明,预喷施dsRNA 5 d后接种病毒,发病率存在显著差异,而预喷施7 d后接种病毒就无明显差异,笔者认为这除了与dsRNA的降解有关,还与植株的生长有关,西瓜苗在长出两片子叶后,其在25℃恒温恒湿的条件下生长速度很快,植株2 d的生长就会有很大的区别。MITTER等研究发现,当利用纳米材料包裹dsRNA后,dsRNA的降解速率会大幅度下降[9],同时由于纳米材料的缓释效果,研究表明无论是在室温还是4℃放置一段时间后,dsRNA的总量不仅没有下降,还有小幅上升[18],随着纳米材料生产的扩大与普及应用,有可能广泛应用于该领域。从另一方面来说,在田间实际生产中,农作物病害的流行有一定的规律性,在掌握病害的流行规律之后,可于病害易发期之前通过连续喷施,帮助植株度过病害易发期,从而保证应用效果。
本研究发现,当先接种病毒再喷施dsRNA时,仅能起到延迟发病的效果,推测原因可能与病毒以及dsRNA进入植物的顺序有关,在病毒先进入植物之后,会进行大量的复制增殖,而后dsRNA进入植物时,在植物体内形成的siRNA仅抑制了部分病毒的复制增殖,不能完全抑制住病毒的侵染,因此治疗效果不佳,后期发病之后,其症状与对照组没有明显差别。
目前,尚未有很好的方法防治植物病毒病,但是其在生产上造成的危害又非常严重,利用原核表达的方法生产dsRNA,外源喷施dsRNA防治病毒病是一种非常有潜力的方法,解决限制其发展的生产、包裹、存储等问题是目前最紧要的任务,如何真正的将该方法应用到实际生产中来,还需要进一步深入研究。
4 结论
通过设计、扩增、生产ZYMV不同区域的dsRNA,建立了能够稳定表达和生产dsRNA的原核表达体系,明确了稳定生产dsRNA的条件;通过喷施试验发现,不同区域的dsRNA片段均对病毒有很好的预防效果,其中HC-Pro片段的防效最好,能达到95%;但是dsRNA不能长时间在植株表面稳定存在,在喷施7 d后,就会丧失预防效果;外源喷施dsRNA的治疗效果不明显,仅能推迟发病。利用原核表达生产dsRNA,外源喷施的方法防治病毒病是一种很有潜力的方法,探究延长dsRNA在植物表面存在的时间、合适的施用时间以及规模化生产的方法是未来研究的主要方向。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 4]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
