 ,, 邹剑秋
,, 邹剑秋 ,辽宁省农业科学院高粱研究所,沈阳110161
,辽宁省农业科学院高粱研究所,沈阳110161Comparative Transcriptome Analysis of Different Salt Tolerance Sorghum (Sorghum bicolor L. Moench) Under Salt Stress
ZHANG Fei, WANG YanQiu, ZHU Kai, ZHANG ZhiPeng, ZHU ZhenXing, LU Feng ,, ZOU JianQiu
,, ZOU JianQiu ,Sorghum Institute, Liaoning Academy of Agricultural Sciences, Shenyang 110161
,Sorghum Institute, Liaoning Academy of Agricultural Sciences, Shenyang 110161通讯作者:
责任编辑: 李莉
收稿日期:2019-06-14接受日期:2019-08-12网络出版日期:2019-11-16
| 基金资助: |
Received:2019-06-14Accepted:2019-08-12Online:2019-11-16
作者简介 About authors
张飞,Tel:024-31029903;E-mail:zhangfei19821121@163.com

摘要
关键词:
Abstract
Keywords:
PDF (2192KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
张飞, 王艳秋, 朱凯, 张志鹏, 朱振兴, 卢峰, 邹剑秋. 不同耐盐性高粱在盐逆境下的比较转录组分析[J]. 中国农业科学, 2019, 52(22): 4002-4015 doi:10.3864/j.issn.0578-1752.2019.22.006
ZHANG Fei, WANG YanQiu, ZHU Kai, ZHANG ZhiPeng, ZHU ZhenXing, LU Feng, ZOU JianQiu.
0 引言
【研究意义】土壤盐渍化是一个全球性的资源和环境问题,严重制约着作物的生产。中国盐渍化土壤面积约为3 600万hm2,占全国可利用土地的4.88%[1],且盐渍化土壤面积呈逐年上升趋势,越来越多的土地由于盐渍化程度过高而无法利用,造成土地资源的荒废[2]。因此,如何利用盐渍化土地进行作物栽培及生产已成为农业发展的重要需求[3,4]。高粱是公认的耐盐性较强的作物,发掘高粱耐盐基因,研究高粱耐盐的代谢途径,挖掘高粱耐盐潜力对促进盐渍土地高粱生产及盐渍土地资源的开发利用都尤为重要。【前人研究进展】前人研究表明,土壤盐渍化对作物具有多重危害,盐胁迫会引起作物生理代谢紊乱,如光合效率下降、呼吸作用加剧、蛋白质合成受阻、有毒物质积累及加速衰老和死亡等[4]。在作物耐盐基因及分子机制研究方面,****们开展了大量研究。曾有研究表明植物的耐盐性涉及多个基因,由多种机制协调作用[5]。也有报道指出盐胁迫应答相关的基因涉及离子转运、细胞防御、生理代谢及细胞生长等诸多方面,这些基因以不同方式协同作用抵御盐渍逆境,如编码与光合作用相关的基因、渗透调节基因、自由基清除酶基因和液泡区域化酶基因等[6]。随着生物技术的发展和耐盐机理研究的不断深入,LIU等[7]发现盐胁迫下从水稻中分离的2个水通道蛋白基rMip1和rTip1在根部的表达增强;此外,一些与渗透调节相关的基因也被发现与耐盐相关,如与果聚糖、脯氨酸、糖醇、甘氨酸等生物合成相关的基因Lea、SOS1[8];也有研究表明Zn/Cu SOD是定位于叶绿体中的超氧化物歧化酶,转Zn/Cu SOD基因烟草在氧化胁迫下较对照植株耐盐性有所增强[9]。另外,近年来,众多****针对植物耐盐代谢机制开展了大量研究,其中,以生理机制研究为主,主要包括植物对盐胁迫的感应及信号传导、Na+运输、盐胁迫下的解毒途径等几个方面[10]。【本研究切入点】尽管在其他作物耐盐基因挖掘及耐受性分子机制方面取得了一定的研究进展,但对高粱耐盐性的研究仍停留在形态和生理研究水平上,在高粱耐盐基因挖掘和代谢途径等方面研究较少。【拟解决的关键问题】本研究以筛选出的对盐胁迫反应极端的2个典型高粱品种为材料,通过转录组研究分析高粱耐盐基因表达及基因调控路径和网络,以挖掘高粱耐盐潜力,为耐盐品种培育和盐碱地高效利用提供技术参考。1 材料与方法
1.1 试验设计
试验以筛选出的对盐胁迫反应极为典型的2个材料八叶齐(极耐盐型)和PL212(极盐敏感型)为试验材料。于2017年在辽宁省农业科学院(沈阳)人工气候室进行,昼/夜温度为25℃/18℃,湿度为48%,黑暗12 h/光照12 h,光照强度为1 085 μmol·(m2·s1)-1。试验采取盆栽方式,塑料盆大小为:直径20 cm,盆深18 cm,每盆装0.8 kg过筛细沙,其中细沙先用清水洗干净,再用双蒸水清洗干净并晾干。采用称重法对土壤水分进行检测,待细沙含水量为20%时开始播种,每盆6穴,每穴2株,待出苗后每盆定苗2株。1.2 用于转录组测序样品的处理
播种后20 d(5叶期),分别用蒸馏水漫灌(对照,CK)和180 mmol·L-1的NaCl盐溶液漫灌模拟盐胁迫对八叶齐(极耐盐型)和PL212(极盐敏感型)进行处理,处理时间48 h。以下分别简称为八叶齐对照(CK- tolerant)、八叶齐盐处理(CK-sensitive)、八叶齐盐处理(salt-tolerant)和PL212盐敏感(salt-sensitive)。之后提取处理和对照幼叶样品的RNA。RNA提取及质量检测:采用Trizol(Invitroge)试剂提取叶片总RNA[11],并用DNaseⅠ(TaKaRa)去除DNA。利用1.2%琼脂糖凝胶电泳进行RNA条带初步分析;利用NanoDrop(ThermoFisher)检测浓度等参数;利用Agilent 2100 Bioanalyzer(Agilent)检测RNA样品的完整度。完整度RIN≥7.0,且挑选浓度等指标合格者进行高通量测序。
1.3 Illumina测序
转录组测序委托生物科技有限公司完成。简要流程如下:样品提取总RNA后,利用带有Oligo (dT)的磁珠富集mRNA,其后将mRNA打断成短片段,再以片段后的mRNA为模板,合成cDNA第一链,继而合成cDNA第二链,纯化并经末端修复、加碱基A,加测序接头,再经琼脂糖凝胶电泳回收目的大小片段,并进行PCR扩增,从而完成整个文库制备工作,构建好的文库上机进行测序。1.4 测序数据生物信息学分析
测序数据进行生物信息学处理,首先进行测序原始数据的处理得到去除接头等序列的clean data。而后将这些数据进行参考基因组比对,将序列定位到高粱基因组上,过滤掉不能定位到基因组上序列,然后基于这些序列进行测序质量的评估和基因表达量等分析。1.5 差异基因筛选及验证
1.5.1 基因表达定量 首先使用Htseq软件提取基因的read数目,利用Reads Per RPKMKilo bases per Million reads方法计算基因表达量。其公式为:$RPKM=\frac{Total\ exon\ reads}{Mapped\ reads\ (millons)*exon\ length}\qquad$
其中,Total exon reads/mapps (millions)为所有read数中有百分之多少map到这个基因,除以基因长度,就可以获得基因单位长度有百分之多少的Total mapped read有表达。转录组测序中的基因表达水平用RPKM值表示。
1.5.2 差异表达基因筛选 通过比较不同样本间的数据从而筛选出差异表达基因,后续分析中的差异基因表达模式聚类分析,使用DESeq进行差异基因分析。在差异表达基因检测过程中,将Fold Change≥2且FDR<0.01作为筛选标准。差异倍数(fold change)表示两样品(组)间表达量的比值。错误发现率(false discovery rate,FDR)是通过对差异显著性P值(P-value)进行校正得到的。采用了公认的Benjamini- Hochberg校正方法对原有假设检验得到的显著性P值(P-value)进行校正,并最终采用FDR作为差异表达基因筛选的关键指标。
1.5.3 差异表达基因功能注释和富集分析 基因注释的数据库包括:non-redundant(Nr)、nucleotide(Nt)、Swiss-Prot、the Kyoto Encyclopedia of Genes and Genomes(KEGG)、the Cluster of Orthologous Groups(COG)和GO数据库[12]。
1.5.4 基因验证 选取试验中检测到的8个差异表达基因进行qRT-PCR分析,20 d 苗龄对盐敏感及耐盐品种植株进行盐胁迫处理48 h,每个生物学重复挑选3株长势一致植株混样进行地上部分总RNA提取。qRT-PCR采用3次生物学重复,3次技术重复。选取EXCEL 2007软件进行统计分析,采用Student T测验进行两两检测差异性,对测序结果进行验证。总RNA提取如1.2所示,利用试剂盒PrimeScript RT reagent Kit(大连宝生物)合成cDNA。采用Primer 3.0软件设计定量引物,产物长度片段在100—300 bp。定量PCR试验采用罗氏定量PCR仪器LightCycler? 480II(Roche),使用SYBR Premix EX Taq试剂(大连宝生物)。
2 结果
2.1 测序数据的质量分析
通过对耐盐材料对照(CK-tolerant)、盐敏感材料对照(CK-sensitive)、耐盐材料盐处理(Salt-tolerant)和盐敏感材料盐处理(Salt-sensitive)4个样本的录数据信息分析(表1)。过滤后4个样品的read平均长度变化幅度为147.41—147.64 bp,基因长度分布规律一致,过滤后总碱基数量258.2亿,占原始总碱基数量96.8%,且在4个样品间的变幅为61.35—64.89亿,较为均匀。另外,4个样品测得数据过滤后GC含量在52.18%—53.28%,CycleQ20值均超过95%,CycleQ30值也在90%左右。4个样品中,过滤后碱基中N的数量平均为4.37。测得的数据准确度较高,数据质量很好,利于后期数据的分析。Table 1
表1
表1测序数据质量统计
Table 1
| 样品 Sample | 序列长度 Length (bp) | Bases (Billion) | Q20比例 Q20 percentage (%) | Q30比例 Q30 percentage (%) | G和C占总碱基数量百分比 GC(%) |
|---|---|---|---|---|---|
| CK-耐盐 CK-tolerant | 147.45 | 64.89 | 96.09 | 90.20 | 52.18 |
| CK-盐敏感 CK-sensitive | 147.57 | 61.35 | 95.85 | 89.74 | 53.44 |
| Salt-耐盐 Salt-tolerant | 147.64 | 61.72 | 95.85 | 89.73 | 52.38 |
| Salt-盐敏感 Salt-sensitive | 147.41 | 61.95 | 95.93 | 89.89 | 53.28 |
新窗口打开|下载CSV
2.2 基因表达数量及比例分析
分别统计了耐盐和盐敏感材料在盐胁迫和对照条件下不同RPKM值基因的数量以及基因的表达比例(表2)。共获取83 265个基因,采用RPKM方法标准化对测序深度作了归一化,并对基因长度也作了归一化,对不同长度的基因在不同测序深度下得到的基因表达水平进行了估计。其中RPKM值大于0.1阈值基因数量达到了89.7%。在单个基因的表达方面,RPKM值大于0.1阈值的基因表达比例为92.4%,表达水平较高。另外,4个样品测得基因的长度分布规律一致,基因数目和单个所占比例均符合测序标准,有利于对基因表达进行深度分析。Table 2
表2
表2不同表达水平区间的基因数量及比例统计
Table 2
| 项目 Item | 样品 Sample | RPKM值RPKM value | |||||
|---|---|---|---|---|---|---|---|
| 0—0.1 | 0.1—1 | 1—3 | 3—15 | 15—60 | >60 | ||
| 基因数量 Number of genes | CK-耐盐CK-tolerant | 2125 | 6815 | 4570 | 8046 | 4345 | 1371 |
| CK-盐敏感CK-sensitive | 2392 | 6985 | 4621 | 9605 | 3890 | 1377 | |
| Salt-耐盐Salt-tolerant | 2075 | 6687 | 4537 | 8024 | 4436 | 1364 | |
| Salt-盐敏感Salt-sensitive | 2258 | 6864 | 4625 | 7811 | 3927 | 1281 | |
| 基因表达比例 Gene expression ratio (%) | CK-耐盐CK-tolerant | 7.79 | 24.98 | 16.75 | 29.49 | 15.96 | 5.03 |
| CK-盐敏感CK-sensitive | 8.90 | 26.00 | 17.20 | 28.30 | 14.48 | 5.03 | |
| Salt-耐盐Salt-tolerant | 7.65 | 24.65 | 16.73 | 29.58 | 16.36 | 5.03 | |
| Salt-盐敏感Salt-sensitive | 8.44 | 25.64 | 17.28 | 29.18 | 14.67 | 4.79 | |
新窗口打开|下载CSV
2.3 差异表达基因的筛选
将参试的4个样品定位到的差异表达基因进行筛选,对DESeq检测的结果按照差异显著性标准(差异基因表达变化2倍以上且FDR<0.01)进行筛选,统计基因显著性差异表达情况(图1)。在4个样品间共检测到1 338个差异表达基因,包括819个上调基因和519个下调基因(表3)。耐盐品种在盐胁迫下共有184个差异表达基因,包括122个上调基因和62个下调基因;而盐敏感品种盐处理下仅检测到121个差异表达基因,盐胁迫下差异基因数量耐盐品种远多于盐敏感品种。通过维恩图(图2)分析,发现只在耐盐品种中检测到的差异基因为159个,而仅在盐敏感品种中检测到的差异基因68个,说明盐胁迫造成了2个材料的基因表达变化。图1
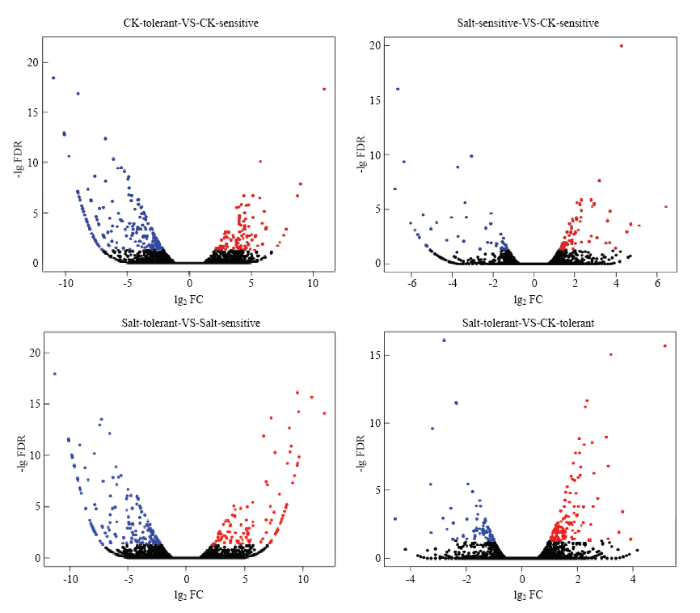 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1差异基因火山图
Fig. 1Volcano map of differential gene
Table 3
表3
表3盐胁迫下4个高粱样品间的差异表达基因
Table 3
| 样品比较 Sample-VS-Sample | 上调基因 Up-regulated genes | 下调基因 Down-regulated genes |
|---|---|---|
| CK-耐盐VS CK-盐敏感 CK-tolerant VS CK-sensitive | 346 | 134 |
| Salt-耐盐VS Salt-盐敏感 Salt-tolerant VS Salt-sensitive | 353 | 200 |
| Salt-耐盐VS CK-耐盐 Salt-tolerant VS CK-tolerant | 62 | 122 |
| Salt-盐敏感VS CK-盐敏感 Salt-sensitive VS CK-sensitive | 58 | 63 |
新窗口打开|下载CSV
图2
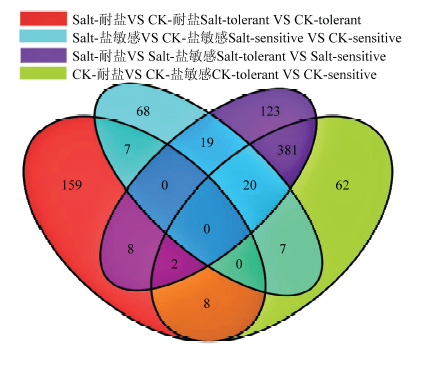 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2盐处理和对照(CK)下高粱品种差异基因表达维恩图
Fig. 2Venn diagram of differential gene expression of sorghum cultivars under salt treatment and control
2.4 耐盐相关差异表达基因的功能分析
盐胁迫条件下,高粱的耐盐性强弱很大程度上取决于耐盐材料的差异基因表达,故以4个样品间共检测到的1 338个差异表达基因的聚类分析结果为基础,对应答盐渍胁迫逆境的耐盐材料特有的159个差异表达基因进行功能注释(图3),通过差异性检验和与高粱苗期耐盐代谢基因功能的综合分析,筛选出4类基因在耐盐应答中起着关键作用,分别为5个Fe离子氧合酶超家族蛋白、4个富含半胱氨酸的类受体激酶(RLK)、3个谷胱甘肽转移酶和3个重金属运输/解毒超家族蛋白。另外,基因功能注释发现钾转运蛋白、过氧化物酶超家族蛋白也发生了相应变化。涉及具体基因信息详见表4。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3与盐胁迫相关的高粱差异表达基因注释
Fig. 3Sorghum differentially expressed genes associated with salt stress
Table 4
表4
表4高粱耐盐相关基因及功能描述
Table 4
| 基因ID Gene_ID | log2FC | KOG | KEGG/ec | Best-hit-Arabi-name | Arabi-symbol | 功能描述 Arabi-decline |
|---|---|---|---|---|---|---|
| Sobic.001G314300.v3.1 | 2.29 | KOG0143 | 1.14.11.9 | AT5G24530.1 | DMR6 | 铁离子转运蛋白 Fe ion transport protein |
| Sobic.006G190000.v3.1 | 1.91 | KOG0143 | 1.14.11.9 | AT5G24530.1 | DMR6 | 铁离子转运蛋白 Fe ion transport protein |
| Sobic.001G526900.v3.1 | 1.40 | KOG0143 | 1.14.11.9 | AT5G24530.1 | DMR6 | 铁离子转运蛋白 Fe ion transport protein |
| Sobic.001G166401.v3.1 | 1.27 | KOG0143 | AT3G19000.1 | 铁离子转运蛋白 Fe ion transport protein | ||
| Sobic.009G044400.v3.1 | 1.19 | KOG0143 | 1.14.17.4 | AT1G77330.1 | 铁离子转运蛋白 Fe ion transport protein | |
| Sobic.001G215900.v3.1 | 1.29 | KOG1187 | 2.7.11.1 | AT1G70520.1 | CRK2 | 富含半胱氨酸的蛋白激酶 Cysteine-rich protein kinase |
| Sobic.002G327700.v3.1 | 1.18 | KOG1187 | 2.7.11.1 | AT4G23310.1 | CRK23 | 富含半胱氨酸的蛋白激酶 Cysteine-rich protein kinase |
| Sobic.002G327800.v3.1 | 1.23 | KOG1187 | 2.7.11.1 | AT4G05200.1 | CRK25 | 富含半胱氨酸的蛋白激酶 Cysteine-rich protein kinase |
| Sobic.008G099300.v3.1 | 1.72 | 2.7.11.1 | AT4G00970.1 | CRK41 | 富含半胱氨酸的蛋白激酶 Cysteine-rich protein kinase | |
| Sobic.003G164800.v3.1 | 1.33 | KOG0867 | 2.5.1.18 | AT3G62760.1 | ATGSTF13 | 谷胱甘肽S-转移酶家族蛋白 Glutathione S-transferase family protein |
| Sobic.001G318900.v3.1 | 2.12 | KOG0406 | 2.5.1.18 | AT1G10360.1 | ATGSTU18,GST29, GSTU18 | 谷胱甘肽S-转移酶TAU 18 Glutathione S-transferase TAU 18 |
| Sobic.001G318200.v3.1 | 2.02 | KOG0406 | 2.5.1.18 | AT1G10360.1 | ATGSTU18,GST29,GSTU18 | 谷胱甘肽S-转移酶TAU 18 Glutathione S-transferase TAU 18 |
| Sobic.006G113800.v3.1 | 2.24 | AT5G48290.1 | 重金属运输/解毒超家族蛋白 Heavy metal transport/detoxification superfamily protein | |||
| Sobic.006G114200.v3.1 | 1.93 | AT5G48290.1 | 重金属运输/解毒超家族蛋白 Heavy metal transport/detoxification superfamily protein | |||
| Sobic.006G257700.v3.1 | 1.53 | KOG1603 | AT1G01490.1 | 重金属运输/解毒超家族蛋白 Heavy metal transport/detoxification superfamily protein | ||
| Sobic.002G220600.v3.1 | 1.09 | AT2G30070.1 | ATKT1,ATKT1P,ATKUP1,KT1,KUP1 | 钾转运蛋白 Potassium transport protein | ||
| Sobic.002G416600.v3.1 | 1.97 | 1.11.1.7 | 过氧化物酶超家族蛋白 Peroxidase superfamily protein |
新窗口打开|下载CSV
2.5 盐胁迫相关基因的GO分析
对4个样品的差异表达基因进行GO分析,发现耐盐和盐敏感材料在遭受盐逆境和对照条件下的生物过程、细胞组分和分子功能3个方面存在较大差异(图4)。GO分析结果显示,在15 418个基因中获得4 528个GO注释条目(表5)。在分子功能方面,结合和催化活性基因数量耐盐材料明显高于盐敏感材料。在生物过程方面代谢过程、细胞过程等方面耐盐材料明显高于盐敏感材料。另外,值得注意的是耐盐材料的较盐敏感材料增加了多生物过程和定位这两个参数,这也进一步说明了耐盐材料其耐盐性较强可能与这两个过程相关。图4
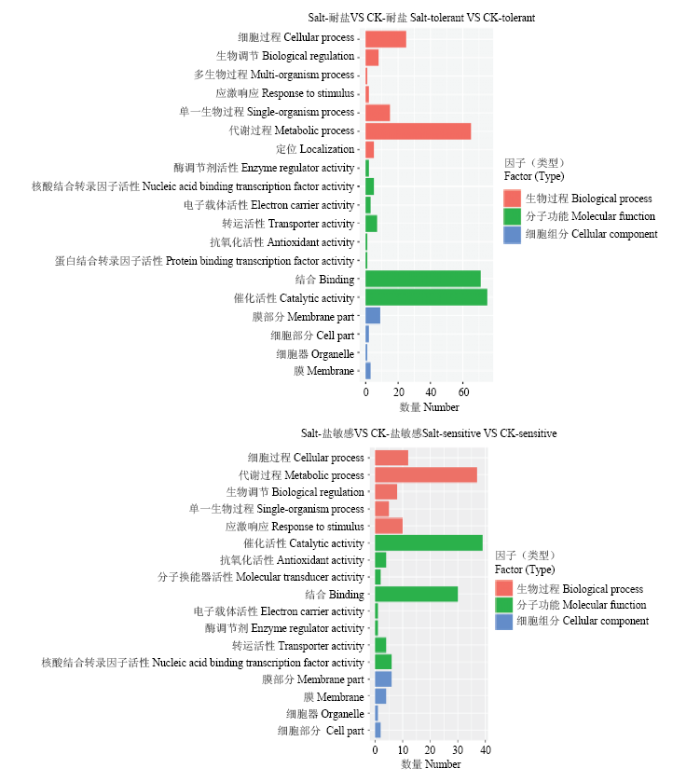 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4高粱耐盐基因GO分析柱状图
Fig. 4Histogram of sorghum salt tolerance gene GO analysis
Table 5
表5
表5高粱耐盐基因分布及注释到基因
Table 5
| 基因本体 Gene ontology term | 集群频率 (出现集群/总集群数量) Cluster frequency(Appears number/total number) | 基因组使用频率 Genome frequency of use | 修正P值 Corrected P-value | 注释到基因集群 Annotated gene cluster |
|---|---|---|---|---|
| 膜 Membrane | 12 /14 85.7% | 1862/15418, 12.1% | 5.37e-09 | Sobic.004G073400.v3.1, Sobic.002G329600.v3.1, Sobic.007G210500.v3.1, Sobic.004G182300.v3.1, Sobic.006G003700.v3.1, Sobic.002G339100.v3.1, Sobic.002G367700.v3.1, Sobic.005G037300.v3.1, Sobic.002G220600.v3.1, Sobic.006G021900.v3.1, Sobic.002G201900.v3.1, Sobic.010G146100.v3.1 |
| 膜部分 Membrane part | 9/14 64.3% | 1043 /15418 6.8% | 3.37e-07 | Sobic.002G201900.v3.1, Sobic.006G021900.v3.1, Sobic.005G037300.v3.1, Sobic.004G182300.v3.1, Sobic.007G210500.v3.1, Sobic.002G329600.v3.1, Sobic.004G073400.v3.1, Sobic.002G339100.v3.1, Sobic.006G003700.v3.1 |
| 膜整体 Integral to membrane | 8 /14 57.1% | 829 /15418 5.4% | 1.21e-06 | Sobic.004G182300.v3.1, Sobic.004G073400.v3.1, Sobic.007G210500.v3.1, Sobic.002G339100.v3.1, Sobic.006G003700.v3.1, Sobic.006G021900.v3.1, Sobic.002G201900.v3.1, Sobic.005G037300.v3.1 |
| 膜固有 Intrinsic to membrane | 8 /14 57.1% | 841 /15418 5.5% | 1.35e-06 | Sobic.002G201900.v3.1, Sobic.006G021900.v3.1, Sobic.005G037300.v3.1, Sobic.004G182300.v3.1, Sobic.007G210500.v3.1, Sobic.004G073400.v3.1, Sobic.002G339100.v3.1, Sobic.006G003700.v3.1 |
新窗口打开|下载CSV
2.6 差异基因KEGG富集及代谢途径分析
通过差异基因KEGG分析,发现耐盐和盐敏感材料在对照和盐渍胁迫条件下各生理代谢途径差异基因数量差别很大(图5)。值得注意的是,在耐盐材料中,盐胁迫下显著富集了细胞色素P450、谷胱甘肽代谢等有关抗氧化逆境的代谢途径。另外耐盐材料在蔗糖代谢、光合作用、倍半萜类化合物和三萜类化合物的生物合成等16个代谢途径都有显著富集。而盐敏感材料主要集中在一些代谢途径如苯丙烷类生物合成、苯丙氨酸代谢、类黄酮生物合成3个途径中差异基因较多,其他路径基因数量很少。表明盐胁迫下抗氧化代谢途径、光合调控途径和糖代谢途径等可能增加植物抗氧化和调节渗透能力,也可能是耐盐品种具有较强耐盐调节适应的重要原因。图5
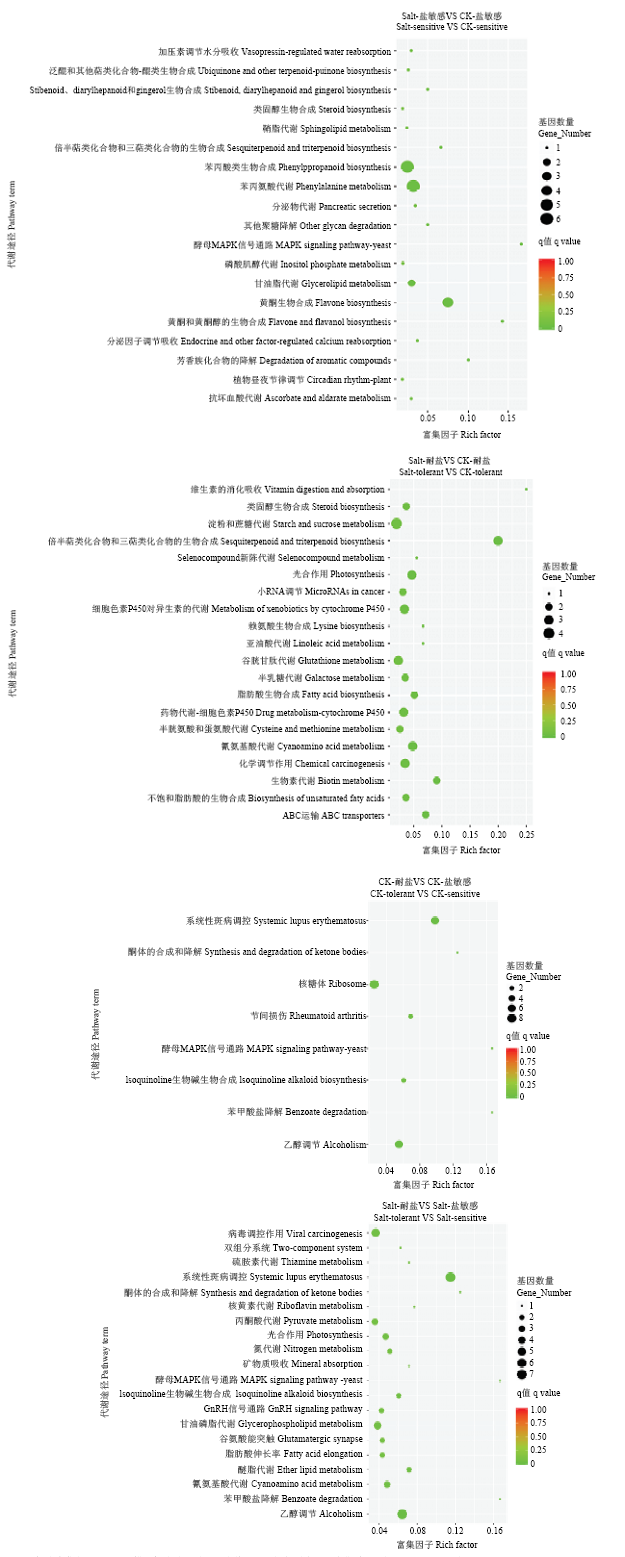 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5差异基因KEGG富集散点图
纵坐标为富集的GO term,横坐标为该差异基因个数。不同颜色用来区分生物过程、细胞组分和分子功能
Fig. 5KEGG enrichment scatter plot of differential gene
The ordinate is the enriched GO term, and the abscissa is the number of the differential genes. Different colors are used to distinguish biological processes, cellular components, and molecular functions
2.7 应用qRT-PCR对测序结果的验证
为确认测序结果的准确性,随机选取试验中检测到的8个差异表达基因进行qRT-PCR分析,以盐敏感对材料对照(CK-sensitive)RPKM值为1作基准进行比较。通过转录组测序结果和qRT-PCR分析结果比较表明赖氨酸组氨酸转运蛋白(Sobic.007G025900)、而氧化应激蛋白(Sobic.004G279700)、钾转运蛋白(Sobic. 002G220600)、糖转运蛋白(Sobic.002G201900)、液泡铁转运蛋白(Sobic.002G194600)、果胶甲酯酶抑制剂超家族蛋白(Sobic.001G323801)、磷酸盐应答家族蛋白(Sobic.004G229200)、果胶乙酰酯酶家族蛋白(Sobic.003G384700)8个基因的RPKM值与转录组分析数据差异均不显著,且变化趋势基本一致,表明qRT- PCR分析结果与测序结果吻合,转录组测序结果准确。图6
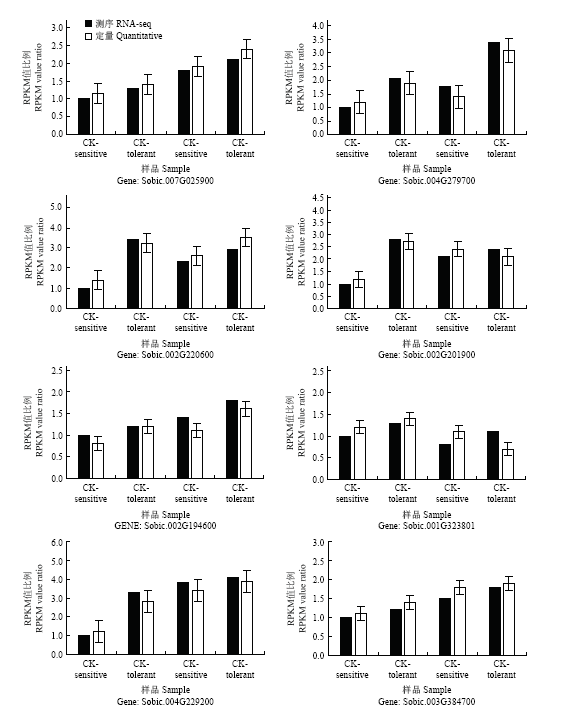 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6部分基因的qRT-PCR验证
**,P<0.01;*,P<0.05。因差异均不显著,故图中未作标注
Fig. 6qRT-PCR validation of partially selected gene expression
** indicate P < 0.01, *indicate P < 0.05. The difference is not significant, so it is not marked in the figure
3 讨论
3.1 耐盐涉及基因
高粱耐盐是一个极其复杂的过程,耐盐调节涉及许多相关基因的调控。本研究以极耐盐和盐极敏感的2个极端高粱品种为材料,通过转录组测到与耐盐相关的差异基因涉及植物细胞氧化应激、离子转运蛋白运输、渗透调节物质转运等多个逆境生理调节关键环节。本研究与盐逆境下甜瓜[13]、紫花苜蓿[14]、棉花[15]和番茄[16]等的调控基因表达与渗透调节、离子转运途径相关的结果相类似,也与岳小红等[17]对野大麦应答盐渍胁迫研究发现的候选基因的表达模式与脯氨酸等渗透调节物质密切相关的结果相吻合。3.2 耐盐基因表达
本研究发现在盐应答时5个Fe离子氧合酶超家族蛋白、4个富含半胱氨酸的类受体激酶、3个谷胱甘肽转移酶和3个重金属运输/解毒超家族蛋白相关基因表现出上调和下调,另外,钾转运蛋白、过氧化物酶超家族蛋白也发生了相应变化。分析可能是由于在盐渍逆境下,高粱幼苗代谢受阻,Fe离子氧合酶超家族蛋白变化活跃,盐敏感材料超氧自由基活动加剧,盐逆境下抗氧化系统失调,导致铁离子转运紊乱;富含半胱氨酸的类受体激酶的变化表明在盐胁迫下蛋白质在接受和感知信号中受影响,并影响信号传递。此研究结果与HERNANDEZ等[18]研究并提出的盐渍条件下甘蓝抗氧化系统变化活跃的结论基本一致,同时XU等[19]对盐渍胁迫下水稻渗透调节系统的研究也得出类似的结果。另外,本研究还发现在遭遇盐渍胁迫时,重金属等可与细胞生物大分子重要成分发生共价结合,对机体造成损害。谷胱甘肽S-转移酶可与其结合后,可防止发生此种共价结合,起到解毒作用。重金属运输/解毒超家族蛋白相关基因的变化也进一步解释了这个论断。综合分析这几类基因主要集中在抗氧化系统、渗透调节和离子化转运生理过程,同时盐渍环境下重金属毒害相关基因变化活跃,有可能是在成盐害的重要原因,但耐盐调控与重金属运输和解毒机制紧密相关方面前人尚未见报道。3.3 耐盐表达基因功能
盐胁迫下耐盐和盐敏感材料在遭受盐逆境时的生物过程、细胞组分和分子功能3个方面均存在较大差异。GO分析发现生物过程中代谢过程、细胞过程耐盐材料明显高于盐敏感材料,耐盐材料的生理过程中较盐敏感材料增加了多生物过程和定位这两个过程。此类研究在盐逆境下陆地棉[20]、紫花苜蓿[21]、棉花[22]和番茄[23]上也曾对进行过报道,另外WAMBUA等[24]和NETONDO等[25]对盐渍条件下高粱的生理表现分析结果与本研究结论也基本一致。本研究中还发现在分子功能方面,结合和催化活性差异表达基因数量较多,同时多生物过程和定位这两个过程与耐盐调控这关系密切。本研究结果与前人指出的植物分子功能及基因表达是造成耐盐性差异的主要原因的结论相吻合[26,27]。3.4 耐盐基因代谢途径
盐胁迫下,耐盐和盐敏感高粱代谢通路有所不同。本研究KEGG分析结果显示耐盐和盐敏感材料在对照和盐渍胁迫条件下在苯丙烷类生物合成、苯丙氨酸代谢、类黄酮生物合成3个途径中差异基因较多,可能是造成两个材料盐耐盐性差异的重要原因。目前,苯丙氨酸和类黄酮生物合成途径与耐盐性相关已有研究得出类似结论[17],但关于类黄酮生物合成途径在耐盐调节中尚未见报道,是否是高粱耐盐特有代谢途径还有待于进一步研究。同时,本研究结果与白子彧等[28]研究的非生物胁迫下Na+的运输通道和路径与苯丙氨酸代谢密切相关的结论相吻合,同时,也有报道指出Na+/H+转运蛋白对Na+的运输途径存在影响,且其在不同作物和生育时期存在差异[29,30,31]。此外,有****指出Na+运输途径不同将造成光合系统发生变化,影响光合物质生产[13]。4 结论
高粱耐盐调控过程较为复杂,耐盐调控基因涉及生物过程、细胞组分和分子功能3个方面,其中多生物过程和定位这两个过程对高粱的耐盐调节起着关键作用;重金属运输和解毒相关基因在盐胁迫时变化活跃,可能与耐盐调节相关;在生理代谢途径方面,盐敏感材料苯丙烷类生物合成、苯丙氨酸代谢、类黄酮生物合成3个途径过量表达很可能是造成盐害的重要原因。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
